1,8-萘啶基荧光分子探针在氯胺酮娱乐性滥用神经机制研究及成瘾程度诊断中的应用的制作方法
本发明属于生物医药领域,具体涉及1,8-萘啶基荧光分子探针在氯胺酮娱乐性滥用神经机制研究及成瘾程度诊断中的应用。
背景技术:
在我国,滥用冰毒,氯胺酮,摇头丸等新型毒品人数不断增多,云南由于受境外传统毒品与新型毒品渗透的不断加剧,禁毒、戒毒工作面临着新的课题和困难,美沙酮维持疗法并不能同时适用于传统和新型毒品的戒毒工作。为维护社会安定团结,开发快速、高效的治疗方法使新型毒品滥用者尽快脱毒迫在眉睫,而毒品滥用的神经机制研究将为戒毒工作奠定基础。
作为新型毒品之一的氯胺酮(ketamine),为非竞争性的n-甲基-d-天门冬氨酸(nmda)受体拮抗剂,是临床常用的麻醉药,治疗剂量下氯胺酮可产生致幻作用甚至类精神分裂样症状等不良反应。由于氯胺酮的麻醉和致幻作用,滥用者并不能意识到自身机体的损害及攻击性行为,且无法摆脱精神依赖。因此,氯胺酮作为“娱乐性滥用”新型毒品与酒精性饮料共同滥用,出现在夜总会、舞厅、以及强奸案现场,且多为青壮年。虽然氯胺酮一直为管制药物,但它迅速在美国、中国、澳大利亚等许多国家被滥用的现状不容忽视。
随着氯胺酮滥用趋势日益增长,它的神经机制越来越备受研究者们的关注。众所周知,nmda受体在介导神经突触可塑性及调节记忆功能中起到非常重要的作用。氯胺酮作为非竞争性nmda受体拮抗剂,在急性剂量下,损伤记忆、意识、及认知功能。香港中文大学davidt.yew教授课题组的研究表明,长期氯胺酮滥用sd大鼠脑部前额叶皮质脑区内γ-羟基丁酸受体中γ5亚单元的蛋白水平和mrna水平上调,从而导致sd大鼠的学习和记忆行为减退。氯胺酮对认知功能也有影响,它不但可致老年鼠认知功能减退,也可通过对海马神经元thr231位点tau蛋白过度磷酸化,致幼年鼠短暂认知功能减退。类似的研究也表明,啮齿类动物和猴子在长期氯胺酮给药条件下,大脑中也出现tau蛋白过磷酸化。tau蛋白过度磷酸化后,失去与微管结合的能力,聚集并形成神经纤维缠结(neurofibrillarytangles,nft),最后导致神经元退行性变以及丢失。蛋白激酶/蛋白磷酸酯酶磷酸化系统失衡,导致tau蛋白异常、过度磷酸化。其磷酸化水平受蛋白激酶如糖原合成激酶3β(glycogensynthasekinase3β,gsk-3β)和蛋白磷酸酯酶如蛋白磷酸酯酶2a(proteinphosphatase2a,pp2a)的调节。蛋白激酶活性的增强或蛋白磷酸酯酶活性的减弱均可使tau蛋白出现过度磷酸化。
氯胺酮通过对gsk-3β磷酸化水平的调节(即自身活性的调节)加重aβ25-35所诱导的pc12细胞tau蛋白过度磷酸化,而gsk-3β在n端ser9位点的磷酸化是受pi3k/akt分子通路调节的,且该过程无法脱离β-淀粉样蛋白的沉积而独立存在β-淀粉样蛋白(aβ)的沉积和tau蛋白过度磷酸化之间是有密切的联系,许多实验已证明aβ可直接引起tau蛋白过度磷酸化。
若能借鉴ad患者早期诊断中所应用的分子成像技术来研究氯胺酮娱乐性滥用的神经机制及诊断不同滥用时间下的成瘾程度,那么,抑制β-淀粉样蛋白沉积将可作为戒毒治疗的靶点,这将为氯胺酮戒断治疗开辟新的切入点。
分子成像技术对患者创伤小,且敏感性高,为ad患者的早期诊断和治疗提供有力依据。主要有磁共振成像(mri)、正电子发射断层成像(pet)、单光子发射计算机断层现象(spect)和近红外荧光成像(nirf)。mri只有在患者发生脑组织萎缩时才能检测得到,而此时患者脑组织的病理学改变早已发生,且费用昂贵,不易推广;pet和spect属于放射性影像学,因其对患者有放射性危险,且半衰期适宜的放射性元素有限,操作时间受半衰期限制,其临床应用终将被近红外荧光成像技术替代。
荧光探针标记aβ原理,aβ(1-42)的氨基酸序列为:daefrhdsgyevhhqklvffaedvgsnkgaiiglmvggvvia,其中包括疏水性氨基酸(g,a,f,v,l,i,m)、带负电的氨基酸(d,e)、带正电的氨基酸(k)和极性氨基酸(y,h,q,n,s)。aβ(1-42)的氨基酸序列中klvff为主要核心片段,分子探针主要与核心片段中的疏水性片段lvff通过化学键相互作用结合,而探针中的亲水性基团则与亲水性的hhqk片段相互作用。探针与aβ斑块结合后荧光特性发生显著改变(荧光强度、荧光寿命、发射波长和量子产率),通过对荧光检测,获得被测靶蛋白定性、定量及定位信息。
迄今为止,已报道许多关于检测aβ斑块的荧光探针,这些探针均有共同的结构特点,即由3个结构片段形成的高共轭分子,包括:接受电子基团,简称受体,如二氰亚甲基;供给电子基团,简称供体,如对二甲氨基苯基;连接基团,也称连接桥,一般为共轭π电子链。共有以下几类:苯乙烯基类衍生物、噁嗪类衍生物(aoi987)、噻吩类衍生物(niad)、姜黄素类衍生物(cranad)、硼二吡咯亚甲基类衍生物(bodipy)、4,6(1h,5h)-嘧啶二酮类衍生物(thk-265)、氨基萘-2-氰基丙烯酸酯类衍生物(anca)、共轭π电子链类(danirs)。有的脑血屏障穿透性不好,有的标记aβ斑块特异性不好,各有优缺点。
1,8-萘啶基团具有较好的生物活性受药物分子设计合成科技工作者的追捧,广泛应用于抗肿瘤,抗抑郁等药物,但尚未见有报道以1,8-萘啶为母体的荧光探针标记aβ斑块。
技术实现要素:
本发明的目的之一是提供一种化合物,其结构式如式i所示:
上述式i中,r1、r2独立地选自-cf3和-cn;
r3为下述任一基团:-n(cnh2n+1)2,-ocnh2n+1,-coocnh2n+1,
上述式i所示化合物具体可为:
上述式i所示化合物是按照包括下述步骤的方法制备得到的:
1)在惰性气体保护下,在磷酸中,使得2,6-二氨基吡啶与式ii所示化合物进行回流反应,得到式111所示化合物;
上述式ii、式iii中,r1、r2的定义同式i中r1、r2的定义;
2)在碱性条件下,使得式iii所示化合物与式iv所示化合物进行回流反应,得到式v所示化合物;
上述式iv,式v中,r1、r2、r3的定义同式i中r1、r2、r3的定义;
3)在有机胺作用下,使得式v所示化合物与bf3.et2o反应,得到式i所示化合物。
上述方法步骤1)中,2,6-二氨基吡啶与式ii所示化合物的摩尔比可为1:1-2,具体可为1:1。
所述反应在搅拌下进行,所述反应的时间为8-24小时,具体可为24小时。
上述方法步骤2)中,所述反应在无水有机溶剂中进行,所述无水有机溶剂具体可为无水thf;
所述碱具体可为nah。
所述式iii所示化合物与式iv所示化合物的摩尔比为1:1-2,具体可为1:1。
所述反应在搅拌下进行,所述反应的时间为8-24小时,具体可为24小时。
上述方法步骤3)中,所述有机胺具体可为三乙胺。
式v所示化合物与所述有机胺的摩尔比为1:15-20,具体可为0.8:15;
式v所示化合物与bf3.et2o的摩尔比为1:10-20,具体可为1:10。
所述反应在无水chcl3中进行。
所述反应的温度为室温,时间为12-24小时,具体可为24小时。
本发明的另一目的是提供上述式i所示化合物的应用。
本发明所提供的式i所示化合物的应用是式i所示化合物作为荧光探针在淀粉样蛋白标记中的应用。
所述淀粉样蛋白为aβ42,aβ40。
上述式i所示化合物在制备下述产品中的应用也属于本发明的保护范围:
1)判断是否有氯胺酮滥用的产品;
2)研究氯胺酮娱乐性滥用神经机制的产品;
3)诊断氯胺酮成瘾程度的产品。
其中,所述氯胺酮娱乐性滥用是指氯胺酮乙醇同时合用。
本发明的又一目的是提供一种判断是否有氯胺酮滥用的产品、研究氯胺酮娱乐性滥用神经机制的产品或诊断氯胺酮成瘾程度的产品,其包括上述式i所示化合物。
本发明还提供一种检测生物体是否存在氯胺酮滥用的方法,用式i所示化合物作为荧光探针检测生物体中淀粉样蛋白的量和/或量的动态变化,若淀粉样蛋白的量显著增加,则待测生物体存在氯胺酮滥用。
本发明首次合成了含有生物活性的1,8-萘啶基为母体化合物的bodipy类荧光探针分子,应用于标记β-淀粉样蛋白。可用于判断是否有氯胺酮滥用、研究氯胺酮娱乐性滥用神经机制和诊断氯胺酮成瘾程度。
现有毒品成瘾机制的研究方法大多是在处死动物模型后完成,仅有为数不多报道采用mri技术研究活体毒品成瘾动物模型,mri只有在患者发生脑组织萎缩时才能检测得到,而此时患者脑组织的病理学改变早已发生,且费用昂贵,不易推广。利用荧光成像技术研究活体毒品成瘾机制国内外尚未见报道,且对于氯胺酮娱乐性滥用的已有报道中尚未出现对于神经机制的研究,本发明可实现对氯胺酮娱乐性滥用活体的神经机制推断,治疗靶点寻找,成瘾程度诊断的可视化研究。
附图说明
图1为本发明中c3化合物的合成路线图。
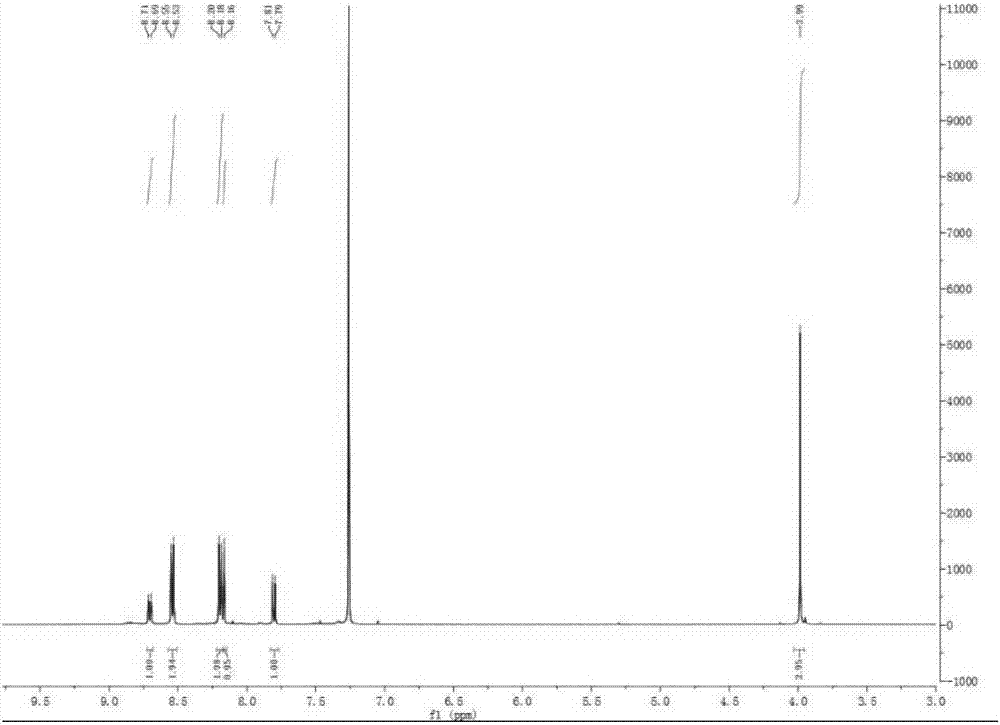
图2为c3化合物的氢谱图。
图3为c3化合物的x轴椭球模型图。
图4为一个月不同氯胺酮给药剂量对大鼠前额叶皮质区aβ表达的影响。
图5为三个月不同氯胺酮给药模式对大鼠纹状体区aβ表达的影响。
图6为c3、c3+bsa、c3+aβ42和c3+aβ40的荧光发射光谱图。
具体实施方式
下面通过具体实施例对本发明进行说明,但本发明并不局限于此。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所用的试剂、材料等,如无特殊说明,均可从商业途径得到。
实施例1、c3化合物的制备
按照图2所示的合成路线图制备c3化合物。
步骤1:
2-氨基-5,7-三氟甲基-1,8-萘啶的合成(化合物1):2,6-二氨基吡啶(市售,分析纯,10.9g,0.1mol)与六氟乙酰丙酮(市售,分析纯,10.0g,0.1mol),100ml磷酸,氮气保护,搅拌回流24小时。冷却反应液,在冰浴条件下,用氨水调至中性。于5℃冷藏过夜后抽滤,用冷水洗涤滤饼,干燥得到粗产品。粗产品用无水乙醇重结晶得到浅黄色固体粉末。yield:17.3g(61.3%)。
步骤2:
化合物3的合成:化合物1(2.81g,0.01mol)和化合物2(0.01mol)室温下溶于100ml无水thf溶液中,加入nah(60w%,0.8g)。混合物回流搅拌24h。冷却至室温,旋干溶剂,残渣用饱和氯化铵溶液洗涤,过滤,固体干燥后硅胶柱层析纯化。(洗脱剂ch2cl2/meoh100:1)yield:1.4g(32%)。
步骤3:
化合物c3的合成:化合物3(0.35g,0.8mmol)溶于70ml无水chcl3,加入三乙胺(2ml,15mmol)逐滴加入bf3.et2o(2ml,8mmol)室温下搅拌24h。反应完成后,混合物用ch2cl2稀释,有机相用水洗涤后无水na2so4干燥,过滤。旋干溶剂,粗产品用硅胶柱层析纯化(石油醚/ch2cl2,100:1)yield:0.24g(62%)。
氢谱图见图2所示。
1hnmr(500mhz,cdcl3)δ(ppm)8.70(d,napy-h,j=9.3hz,1h),8.54(d,ar-h,j=8.4hz,2h),8.19(d,ar-h,j=8.4hz,2h),8.16(s,napy-h,1h),7.80(d,napy-h,j=9.3hz,1h),3.99(s,ch3,3h).
图3为x轴椭球模型图。
由此可知,合成的化合物确实为c3化合物。
实施例2、c3化合物在氯胺酮娱乐性滥用神经机制研究及成瘾程度诊断中的应用
氯胺酮滥用sd大鼠模型:
1、给药时间为1个月的sd大鼠进行了一种给药模式,两种不同剂量的研究:
模型一:选取健康昆明sd大鼠(雄性,6个月)9只,以(30mg/kg)剂量腹腔注射氯胺酮给药,用于生化检测。每周测量体重并调节给药量。
模型二:选取健康昆明sd大鼠(雄性,6个月)9只,以(60mg/kg)剂量腹腔注射氯胺酮给药,用于生化检测。每周测量体重并调节给药量。
空白对照组(c组):选取健康昆明sd大鼠(雄性,6个月)9只,分别与给药组同时生理盐水灌胃(0.9%,w/v)3个月,用于生化检测。
2、给药时间为3个月的sd大鼠进行了同一给药剂量,两种不同给药模式的研究:
模型一:氯胺酮滥用sd大鼠模型(k组):选取健康昆明sd大鼠(雄性,6个月)9只,分别以(30mg/kg)腹腔注射氯胺酮给药,用于生化检测。每周测量体重并调节给药量。
模型二:氯胺酮乙醇同时合用sd大鼠模型即氯胺酮娱乐性滥用模型(ke组):选取健康昆明sd大鼠(雄性,6个月)9只,随机分为两批,分别以(30mg/kg)腹腔注射氯胺酮合用乙醇(20%的乙醇水溶液,2ml/kg)灌胃,用于生化检测。每周测量体重并调节给药量。
乙醇对照组(e组):选取健康昆明sd大鼠(雄性,6个月)9只,随机分为两批,分别乙醇(20%的乙醇水溶液,2ml/kg)灌胃,用于生化检测。每周测量体重并调节给药量。
空白对照组(c组):选取健康昆明sd大鼠(雄性,6个月)9只,分别与给药组同时生理盐水灌胃(0.9%,w/v),用于生化检测。
免疫组化实验检测大鼠脑组织中的aβ:
大鼠在给药后,乙醚麻醉处死,生理盐水灌注,快速断头取脑,完整取出大鼠大脑,并放入体积分数为10%的中性甲醛溶液中固定过夜。将固定后的大鼠大脑从视交叉处向后切成约3mm厚的薄片,经梯度酒精脱水、二甲苯透明、浸蜡、石蜡包埋后,将脑片放于振动显微切片机上进行冠状切片,约5μm厚,裱褙于多聚赖氨酸处理好的载玻片上,置于50℃的烤箱中烘烤24h。取大鼠大脑切片,经脱蜡处理后,按照sp免疫组化试剂盒说明书进行染色:切片经pbs缓冲液(0.01mol/l,ph7.4)冲洗后,置于柠檬酸盐(0.01mol/l)中微波修复20min以暴露抗原,再放入体积分数为3%的h2o2中15min以灭活内源性过氧化物酶,经正常山羊血清封闭液封闭20min后加入兔抗鼠aβ42多克隆抗体(1:500稀释),4℃过夜。第二天于37℃复温1h后加入生物素标记的羊抗兔igg,37℃孵育30min后加入生物素标记的链霉亲和素,37℃孵育30min,最后用dab显色,苏木素染液复染,中性树脂封片,光学显微镜下观察。aβ42阳性细胞为胞质内有棕黄色颗粒出现。
一个月氯胺酮滥用大鼠试验结果:
不同剂量氯胺酮给药下,大鼠脑前额叶皮质区均出现aβ阳性表达,通过ipp进行半定量计算,图4为一个月不同氯胺酮给药剂量对大鼠前额叶皮质区aβ表达的影响,给药组大鼠脑前额叶皮质区阳性表达均比生理组呈显著性增多。
表1不同氯胺酮给药剂量对大鼠前额叶皮质区aβ表达的影响
大鼠腹腔注射氯胺酮(30mg/kg,60mg/kg)单独给药30天后,大鼠处死后快速断头取脑,根据鼠脑立体定位图谱,分离前额叶皮质脑区。采用免疫组化技术检测大鼠脑前额叶皮质区aβ表达。通过ipp进行半定量计算,生理组iod值和平均光密度density(mean)值分别为:2916.74、0.1796;ketamine30mg/kg给药大鼠的表达为:10325.8、0.2386;ketamine60mg/kg平行给药大鼠,表达为:12873.5、0.3422和11178.4、0.3315。相比于生理组,给药大鼠aβ表达呈显著性增多,且与给药剂量呈一定的相关性。
三个月氯胺酮滥用大鼠试验结果:
同一给药剂量不同氯胺酮给药模式下,大鼠脑纹状体区均出现aβ阳性表达,通过ipp进行半定量计算,图5为三个月不同氯胺酮给药模式对大鼠前额叶皮质区aβ表达的影响,给药组大鼠脑纹状体区阳性表达均比生理组呈显著性增多。
表2不同氯胺酮给药模式对大鼠前额叶皮质区aβ表达的影响
大鼠腹腔氯胺酮(30mg/kg)不同给药模式3个月后,大鼠处死后快速断头取脑,根据鼠脑立体定位图谱,分离前额叶皮质采用免疫组化技术检测大鼠脑纹状体脑区aβ表达。通过ipp进行半定量计算,生理组iod值和平均光密度density(mean)值分别为:17969.592、0.1689;ketamine30mg/kg给药大鼠的表达为:24208.855、0.3208;ketamine+ethanol给药大鼠,表达为:32186.43、0.3283;ethanol给药大鼠,表达为:20646.91、0.2887。相比于生理组,给药大鼠aβ表达呈显著性增多,且氯胺酮与乙醇联合给药的大鼠脑区相关表达更多,表明氯胺酮娱乐性滥用模式下氯胺酮和乙醇产生了协同效应。
由此证实一个月大鼠氯胺酮娱乐性滥用模型中,大鼠脑中前额叶皮质脑区有aβ阳性表达;三个月大鼠氯胺酮娱乐性滥用模型中,大鼠脑纹状体脑区有aβ阳性表达。
化合物c3用于淀粉样蛋白aβ42,aβ40的荧光标记:
1、淀粉样蛋白aβ42,aβ40聚合物的制备:人淀粉样蛋白淀粉样蛋白aβ42(as-20276,hplc纯化,anaspecco.),aβ40(as-24236,hplc纯化,anaspecco.)均1mg溶于4mlpbs缓冲溶液(ph=7.4),蛋白浓度为0.25mg/ml,持续轻缓摇动,于37℃下孵育42h,加入pbs缓冲溶液稀释为0.2mg/ml;
2、化合物c3乙醇溶液(1μmol,光谱纯)300μl,加入aβ42聚合物或者aβ40聚合物或者bsa(牛血清蛋白,0.2mg/ml,pbs缓冲溶液)300μl,再加入pbs缓冲溶液2400μl,溶液总体积为3000μl,蛋白总量为60μg,配制比例为化合物c3:蛋白1:1,混合物于室温下孵育30min;
3、孵育后荧光检测,荧光仪f-4600flspectrophotometer,exwl:350nm。
图6为c3、c3+bsa、c3+aβ42和c3+aβ40的荧光发射光谱图。
由图6可知:化合物c3最大发射波长为431nm,发射强度为361,与aβ42结合后,发射波长431nm处发射强度增强为561,荧光探针与aβ42标记后荧光强度增强155%;与aβ40结合后,发射波长431nm处发射强度增强为560,荧光探针与aβ40标记后荧光强度增强155%。bsa为牛血清蛋白,作为蛋白对照样,评价荧光探针化合物是否对aβ有特异性。从实验结果中可知,化合物c3与bsa结合后发射波长431nm处发射强度仅发生略微改变,为408,相比c3,荧光强度增强113%。由此可见,化合物c3能特异性结合aβ42和aβ40,可作为标记aβ的荧光探针化合物。
- 还没有人留言评论。精彩留言会获得点赞!