核酸敏化稀土发光传感器检测三聚氰胺的方法与流程
基于稀土敏化发光的核酸适体荧光传感器检测三聚氰胺,属于分析化学技术领域。
背景技术:
三聚氰胺(1,3,5-三嗪-2,4,6-三胺,c3h6n6)是一种无臭、味微苦的白色结晶、微溶于水,由尿素聚合而得,主要用于合成三聚氰胺树脂以及制备漂白剂、除草剂。因其含氮量高达66%,而被不法商家违规地添加到牛奶中,引发了一系列食品安全问题。因在人体中代谢缓慢易蓄积,摄入超过安全限量的三聚氰胺将引起肾结石甚至肾功能衰竭。
现阶段有关三聚氰胺的定性和定量分析方法主要是高效液相色谱法、气相色谱质谱联用法、液相色谱质谱联用法。这些方法虽然精准度高,但是设备昂贵、操作复杂,且样品前处理费时费力、成本高、劳动量大。因此,为了更有效快捷地检测三聚氰胺,建立新型的快检技术实现对三聚氰胺的定性和定量分析意义重大。
tb3+作为一种重要的稀土元素,拥有着良好的光学性能,可以在光学传感器的构建中起到信号探针的作用,其对单链dna尤其是环处鸟嘌呤含量高(g-rich)的颈环结构dna具有敏感性,可以在g-richdna的激发下产生明显的荧光发射峰;核酸适配体是一种短链dna或rna序列,可以特异性地识别目标物,并与之高亲和性地结合,因此作为生物传感器中的识别探针而得以广泛应用;因此,利用核酸适配体作为识别探针,结合稀土元素的发光特性,构建光学传感器检测食品中有毒有害物质的研究具有科学性和可行性。
技术实现要素:
本发明的目的是建立基于稀土敏化发光的核酸适体荧光传感体系简便、快速、准确、灵敏地检测三聚氰胺残留量。
技术问题:基于稀土敏化发光的核酸适体荧光传感器检测三聚氰胺基于以下原理:
三聚氰胺适配体的互补链经过设计,可以构成颈环结构,环状部位为gggggg碱基序列,可以显著提高铽离子(tb3+)的荧光,而双链结构对tb3+荧光的激发作用十分微弱;三聚氰胺适配体为27个连续的t碱基序列,3’端被cccccc序列修饰,可以与互补链形成双螺旋并破坏其颈环结构,降低体系中tb3+荧光强度;因此,当被测体系中不含三聚氰胺时,适配体与互补链结合,形成双螺旋打开颈环结构,此时加入tb3+体系荧光微弱,而当三聚氰胺存在时,适配体与三聚氰胺识别并结合,释放互补链,游离的互补链将显著激发tb3+的荧光。通过测定三聚氰胺加入前后体系荧光强度的变化,可以实现对三聚氰胺的定性和定量检测。
本发明的技术方案:
包括以下步骤:构建适配体和互补链杂交的核酸分子开关;基于稀土敏化发光的核酸适体荧光传感器检测三聚氰胺的可行性分析;建立基于稀土敏化发光的核酸适体荧光传感器检测三聚氰胺;分析所建立的核酸适体传感器检测三聚氰胺的选择性;运用所建立的核酸适体传感器测定加标牛奶样品中的三聚氰胺。
(1)构建适配体和互补链杂交的核酸分子开关
用ph7.7的tris-hcl缓冲液将三聚氰胺适配体和互补链配制成浓度为10μm的工作液,将75μl三聚氰胺适配体工作液和50μl的互补链工作液加入到1.5ml的离心管中涡旋混合,然后95℃水浴条件下加热10min解除自身螺旋,最后冷却至室温并用tris-hcl缓冲液稀释10倍,作为双链核酸配体工作液放入4℃冰箱中过夜保存以备使用。
(2)基于稀土敏化发光的核酸适体荧光传感器检测三聚氰胺的可行性分析
取五个1.5ml的离心管,编号为a、b、c、d、e,分别进行如下操作:a管中加入50μl100μmtb3+和50μl1μm的互补链反应5min后,用tris-hcl缓冲液补齐500μl体系;b管中加入50μl100μmtb3+和125μl双链核酸配体工作液反应10min后,用tris-hcl缓冲液补齐500μl体系;c管加入50μl100μmtb3+和125μl双链核酸配体工作液反应10min后,再加入50μl1μg/ml的三聚氰胺溶液,反应15min后用tris-hcl缓冲液补齐500μl体系;d管加入50μl100μmtb3+和50μl互补链溶液反应10min后,再加入50μl1μg/ml的三聚氰胺溶液反应15min后用tris-hcl缓冲液补齐500μl体系;e管中加入50μl100μmtb3+和75μl1μm的适配体,反应10min后,用tris-hcl缓冲液补齐500μl体系;最后用荧光分光光度计分别测定a、b、c、d、e体系的荧光光谱图,激发波长为290nm,激发和发射狭缝宽度分别为10nm和5nm。
(3)建立基于稀土敏化发光的核酸适体荧光传感器检测三聚氰胺
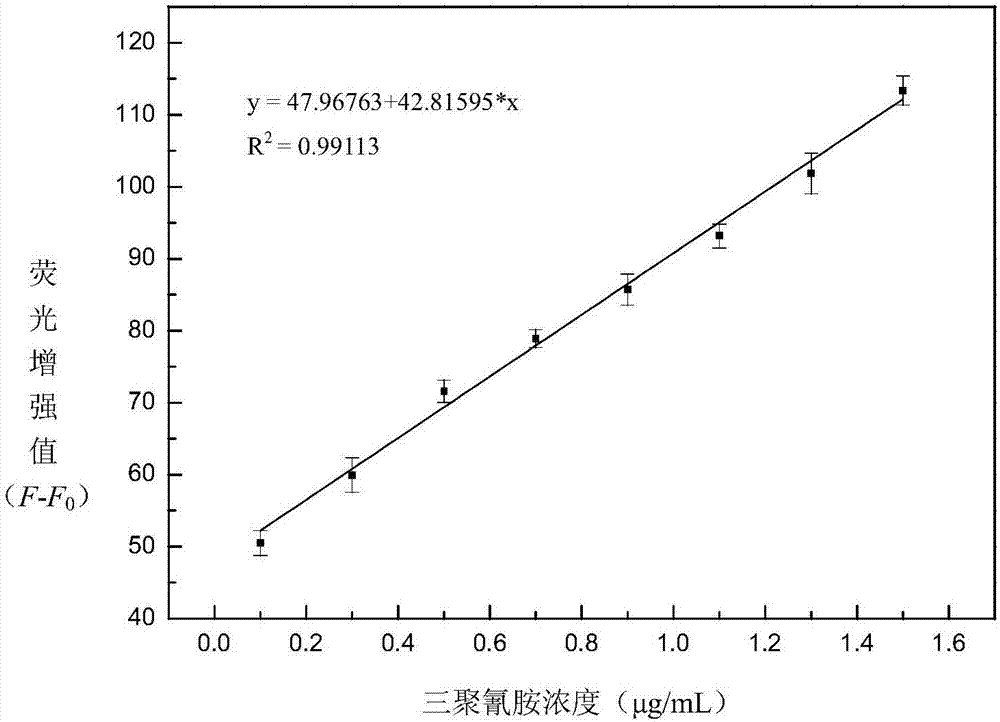
将125μl双链核酸配体工作液和50μl不同浓度的三聚氰胺溶液分别加入到1.5ml离心管中,涡旋混合15min,再加入50μl浓度为100μm的tb3+溶液,涡旋混合10min,最后用tris-hcl缓冲液补齐500μl体系测定荧光光谱,得到荧光峰值f,空白对照实验用等量的二重蒸馏水代替三聚氰胺溶液,按照相同步骤测定荧光光谱,得到荧光峰值f0。根据荧光增强值(f-f0)与三聚氰胺的浓度之间的线性关系建立标准曲线,水溶液中三聚氰胺的检出限为0.057μg/ml,线性范围为0.1μg/ml-1.5μg/ml。
(4)分析所建立的核酸适体传感器检测三聚氰胺的选择性
选择五种与三聚氰胺结构相似的物质进行对照试验,分别为尿素、双氰胺、环丙氨嗪、三聚氰酸和尿酸。分别配制1μg/ml的尿素、双氰胺、环丙氨嗪、三聚氰酸、尿酸和三聚氰胺溶液,按照步骤(3)中方法进行检测,用荧光分光光度计分别记录六种被测物加入与否体系545nm处的荧光峰值(f和f0),并计算6种物质引起的荧光提升率(f-f0)/f0。
(5)运用所建立的核酸适体传感器测定加标牛奶样品中的三聚氰胺
首先,将加入不同浓度三聚氰胺的牛奶样品进行前处理,吸取4ml牛奶样品、6ml三重蒸馏水、2ml10%的三氯乙酸和2ml氯仿加入到15ml的离心管中,涡旋混合1min后在20℃的条件下超声15min;然后将上述溶液在13000转/分钟的条件下离心10min,吸取上清液转移至另一个15ml的离心管中,再以10000转/分钟的转速离心10min,收集上清液进行测定。根据荧光增强值(f-f0)与三聚氰胺浓度之间的线性关系的关系建立工作曲线,线性范围为0.1μg/ml-2.5μg/ml;最后用本方法检测牛奶基质中浓度分别为0.60、1.20、1.80μg/ml的三聚氰胺,根据工作曲线计算本方法的回收率。
本发明的有益效果:
本发明建立了一种对三聚氰胺有高选择性,同时又简单、快速、灵敏的分析检测方法,具有良好的实用价值,对小分子有害物快速检测技术的开发提供了参考。
附图说明
图1原理可行性分析实验中不同体系下tb3+的荧光光谱图;三聚氰胺,1μg/ml;核酸适配体,0.15μm;互补链,0.1μm;tb3+,10μm.
图2三聚氰胺加入后体系中tb3+的荧光增强值(f-f0)与三聚氰胺浓度之间的线性标准曲线(空白对照组荧光峰值记为f0,样品组荧光峰值记为f);三聚氰胺0.1,0.3,0.5,0.7,0.9,1.1,1.3,1.5μg/ml;核酸适配体,0.15μm;互补链,0.1μm;tb3+,10μm.
图3三聚氰胺及其类似物分别加入后,体系的荧光增强率(f-f0)/f0(空白对照组荧光值记为f0,样品组记为f);a三聚氰胺、b双氰胺、c环丙氨嗪、d三聚氰酸、e尿酸、f尿素,浓度均为1.0μg/ml.
图4牛奶样品上清液加入后,tb3+的荧光增强值与在牛奶基质中三聚氰胺浓度之间的线性工作曲线;三聚氰胺浓度分别为0.1,0.5,1.0,1.5,2.0,2.5μg/ml;核酸适配体,0.15μm;互补链,0.1μm;tb3+,10μm.
具体实施方式
(1)构建适配体和互补链杂交的核酸分子开关
材料/试剂:三聚氰胺核酸适配体、互补链均购买于生工生物工程股份有限公司(中国上海)。
方法:将购买的核酸适配体及互补链在-4℃、2500转/分钟条件下离心5min,配制ph7.7的tris-hcl缓冲液将三聚氰胺适配体和互补链稀释成浓度为10μm的工作液;取75μl三聚氰胺适配体工作液和50μl的互补链工作液加入到1.5ml的离心管中在涡旋混合器上充分振荡混合,然后放入95℃水浴锅中加热解旋10min,室温条件下冷却30min以上,并用tris-hcl缓冲液稀释10倍,放入4℃冰箱中过夜保存以备使用。
结果:核酸适配体与互补链充分杂交,形成双链结构。
(2)缓冲溶液ph、互补链和三聚氰胺适配体的浓度比、体系反应时间等实验条件对于研究tb3+光学性能和核酸适体荧光传感器检测三聚氰胺的性能有着重要影响,因此需要对上述实验条件进行优化。
材料/试剂:三聚氰胺(melamine)购买自阿拉丁试剂公司;tbcl3购自西格玛试剂公司;三聚氰胺核酸适配体、互补链均购买于生工生物工程股份有限公司(中国上海)。
方法:将125μl双链dna配体工作液和50μl1μg/ml的三聚氰胺溶液加入到1.5ml离心管中,涡旋混合15min,再加入50μl浓度为100μm的tb3+溶液,涡旋混合10min,最后分别用不同ph(7.1、7.3、7.5、7.7、7.9、8.1)tris-hcl缓冲液补齐500μl体系测定荧光光谱,得到荧光峰值f,空白对照实验用等量的二重蒸馏水代替三聚氰胺溶液,按照相同步骤测定荧光光谱,得到荧光峰值f0。得到不同ph环境下加入等量三聚氰胺前后的荧光强度提升率。
结果:结果表明,该荧光适配体传感器在ph为7.7的环境中可以获得最佳的荧光提升率。
方法:将50μl10μm的互补链工作液分别加入到25、50、75、100、125μl10μm三聚氰胺适配体工作液中,涡旋混合后,95℃水浴加热5min后冷却至室温,稀释10倍使用,此时适配体与互补链浓度比分别为0.5:1、1:1、1.5:1、2:1、2.5:1。分别使用上述适配体-互补链杂交工作液检测1μg/ml的三聚氰胺,计算不同比例下体系的荧光提升率。
结果:结果表明,适配体与互补链最佳浓度比例为1:1.5。
方法:首先将50μl浓度为10μg/ml的三聚氰胺溶液加入到125μl双链核酸配体工作液中,分别涡旋混合不同时间(1、3、5、10、20、30、40、50min),再加入50μl浓度为100μm的tb3+溶液,涡旋混合10min。最后用tris-hcl缓冲液补齐500μl体系检测荧光光谱。
结果:结果表明,随着三聚氰胺和双链dna反应时间的延长,体系荧光信号也在不断增加,15min后荧光强度趋于平稳,因此三聚氰胺和dna的充分反应的时间为15min。
方法:50μl浓度为10μg/ml的三聚氰胺和125μl双链核酸配体工作液涡旋反应15min后,再加入50μl浓度为100μm的tb3+溶液,分别涡旋混合不同时间(1、3、5、7、9、15、25、35、45min)后检测荧光光谱。
结果:tb3+与体系中的dna在10min后配位完全,体系荧光达到稳定。
(3)建立基于稀土敏化发光的核酸适体荧光传感器检测三聚氰胺
材料/试剂:三聚氰胺(melamine)购买自阿拉丁试剂公司;tbcl3购自西格玛试剂公司;三聚氰胺核酸适配体、互补链均购买于生工生物工程股份有限公司(中国上海)。
将125μl双链核酸配体工作液和50μl不同浓度的三聚氰胺溶液(终浓度分别为:0.1,0.3,0.5,0.7,0.9,1.1,1.3,1.5μg/ml)分别加入到1.5ml离心管中,涡旋混合15min,再加入50μl浓度为100μm的tb3+溶液,涡旋混合10min,最后用tris-hcl缓冲液补齐500μl体系,用光分光光度计测定体系中tb3+光谱,得到荧光峰值f;空白对照实验用等量的二重蒸馏水代替三聚氰胺溶液,按照相同步骤测定荧光光谱,得到荧光峰值f0。
结果:根据(f-f0)与三聚氰胺浓度之间的关系建立标准曲线,水溶液中三聚氰胺的检出限为0.057μg/ml,线性范围为0.1μg/ml-1.5μg/ml。
(4)方法的选择性测定
材料/试剂:三聚氰胺、三聚氰酸、环丙氨嗪、双氰胺购买自阿拉丁试剂公司;尿酸、双氰酸胺购自西格玛试剂公司;tbcl3购自西格玛试剂公司;三聚氰胺核酸适配体、互补链均购买于生工生物工程股份有限公司(中国上海)。
方法:选择五种与三聚氰胺结构相似的物质进行对照试验,分别配制1μg/ml的尿素、双氰胺、环丙氨嗪、三聚氰酸、尿酸和三聚氰胺溶液,各取50μl分别与125μl双链dna配体工作液加入到1.5ml离心管中,涡旋混合15min,再加入50μl浓度为100μm的tb3+溶液,涡旋混合10min,最后用tris-hcl缓冲液补齐500μl体系,用光分光光度计测定体系中tb3+光谱,得到荧光峰值f;空白对照实验用等量的二重蒸馏水代替三聚氰胺溶液,按照相同步骤测定荧光光谱,得到荧光峰值f0,并计算6种物质引起的荧光提升率(f-f0)/f0。
结果:结果显示加入三聚氰胺的体系中荧光增强率显著高于其他五种干扰物质,即该基于稀土敏化发光的核酸适配体荧光传感器对于三聚氰胺的检测具有良好的选择性。
(5)实际样品检测:选择牛奶作为实际样品进行检测
材料/试剂:三聚氰胺购买自阿拉丁试剂公司;tbcl3购自西格玛试剂公司;三聚氰胺核酸适配体、互补链均购买于生工生物工程股份有限公司(中国上海);牛奶购买于当地农场。
方法:首先,将加入不同浓度三聚氰胺的牛奶样品进行前处理,吸取4ml牛奶样品、6ml三重蒸馏水、2ml10%的三氯乙酸和2ml氯仿加入到15ml的离心管中,涡旋混合1min后在20℃的条件下超声15min;然后将上述溶液在13000转/分钟的条件下离心10min,吸取上清液转移至另一个15ml的离心管中,再以10000转/分钟的转速离心10min,收集上清液进行测定(三聚氰胺终浓度分别为:0.1,0.5,1.0,1.5,2.0,2.5μg/ml)。根据f-f0与三聚氰胺浓度之间的线性关系的关系建立工作曲线,线性范围为0.1μg/ml-2.5μg/ml;最后用本方法检测牛奶基质中浓度分别为0.60、1.20、1.80μg/ml的三聚氰胺,根据工作曲线计算本方法的回收率。
结果:根据f-f0与牛奶样品中三聚氰胺浓度之间的关系建立工作曲线,线性范围为0.1μg/ml-2.5μg/ml;检测加标牛奶样品中三聚氰胺的回收率如表1所示,回收率范围为94.47-103.84%。
表1基于稀土敏化发光的核酸适体荧光法测定牛奶样品中三聚氰胺的加标回收率
序列表
<110>吉林大学
<120>核酸敏化稀土发光传感器检测三聚氰胺的方法
<160>2
<170>siposequencelisting1.0
<210>1
<211>35
<212>dna
<213>人工序列(artificialsequence)
<400>1
ttggggggaaaaaaaaaaaaaaaaaaaaaaaaaaa35
<210>2
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>2
tttttttttttttttttttttttttttcccccc33
- 还没有人留言评论。精彩留言会获得点赞!