一种益生菌微胶囊及其制备方法与流程
本发明属于益生菌制品制备技术领域,具体涉及一种益生菌微胶囊及其制备方法。
背景技术:
益生菌是一类对宿主有益的活性微生物,是定植于人体肠道、生殖系统内,能产生确切健康功效从而改善宿主微生态平衡、发挥有益作用的活性有益微生物的总称。常见的益生菌有长双歧杆菌、嗜酸乳杆菌、鼠李糖乳杆菌和乳双歧杆菌。它们都是人和动物肠道内重要的益生菌,具有调节肠道菌群平衡、提供营养、降低胆固醇和抗癌等特性。然而它们专性厌氧,对氧气、pH、温度、湿度等外界不良环境极为敏感,在生产、贮存和运输过程中很难保持活性;而且干菌粉经口服食用时,无法耐受低pH值的胃酸、胆盐等环境,难以保证有大量的存活菌到达肠道而定殖于肠粘膜上。
技术实现要素:
本发明的目的是提供一种益生菌微胶囊及其制备方法,解决了液体益生菌制剂中活菌含量大幅度下降及不耐胃酸的问题,较好的延长了益生菌制剂的保藏期。
本发明所采用的技术方案为:
一种益生菌微胶囊的制备方法,其特征在于:
由以下步骤实现:
步骤一:在37℃的温度条件下,将益生菌粉在液体培养基中厌氧培养24小时,离心收集菌体,用0.85%的生理盐水洗涤制备菌悬液;
步骤二:在78℃的温度条件下,制备保护剂,每100mL保护剂填加有30g菊粉、0.1g沙棘粉,其余为蒸馏水;
步骤三:将经过灭菌处理的保护剂常温下冷却,将保护剂与菌悬液按3:1的体积比混合均匀,静置30min,在-20℃的温度条件下预冻2小时,然后在-50℃、真空度为50-100毫托的真空冷冻干燥箱中干燥48小时,制备得到冻干菌粉;
步骤四:向质量分数为1.5-2.5%的海藻酸钠溶液中加入0.1 g冻干菌粉,冻干菌粉与海藻酸钠的质量比为1:(2-4),混合均匀后得到菌胶混合液;
步骤五:将菌胶混合液逐滴加入到0.15%的吐温-80的大豆油中,菌胶混合液与大豆油的体积比为1:6,乳化并快速加入到摩尔浓度为0.1mol/L的氯化钙溶液中,静置40min;
步骤六:离心收集微胶囊,用质量分数为0.85%的蒸馏水洗涤,并将制备好的微囊置于真空冷冻干燥箱中干燥。
步骤一中,益生菌粉包括长双歧杆菌、嗜酸乳杆菌、鼠李糖乳杆菌和乳双歧杆菌中的一种或多种。
步骤二中,菊粉是以菊芋为原料,通过纯物理方法提取的水溶性膳食纤维和益生元。
步骤五中,乳化的搅拌速度为200-400rpm/min,乳化时间为10-20min,氯化钙溶液的加入速度为25ml/s。
步骤六中,离心收集微胶囊的条件为500g,10min,4℃;
步骤六中,真空冷冻干燥的条件为-20℃预冻2 h,然后在-50℃、真空度为50-100 mtorr的真空冷冻干燥箱中干燥12 h。
如所述的一种益生菌微胶囊的制备方法制得的益生菌微胶囊。
本发明具有以下优点:
本发明的益生菌微胶囊具有耐胃酸性、耐胆盐性和肠溶性的优点,菌体的存活率高,制备方法简单,实用性强,便于工业化生产;菊粉作为一种低聚果糖,不仅可以证实能够提高益生菌的存活率,而且它还是一种水溶性膳食纤维和益生元,可以为肠道菌群提供营养物质,促进肠道菌群增殖,促进肠蠕动;微胶囊的贮藏稳定性良好,解决了益生菌制剂保藏期短的问题。
附图说明
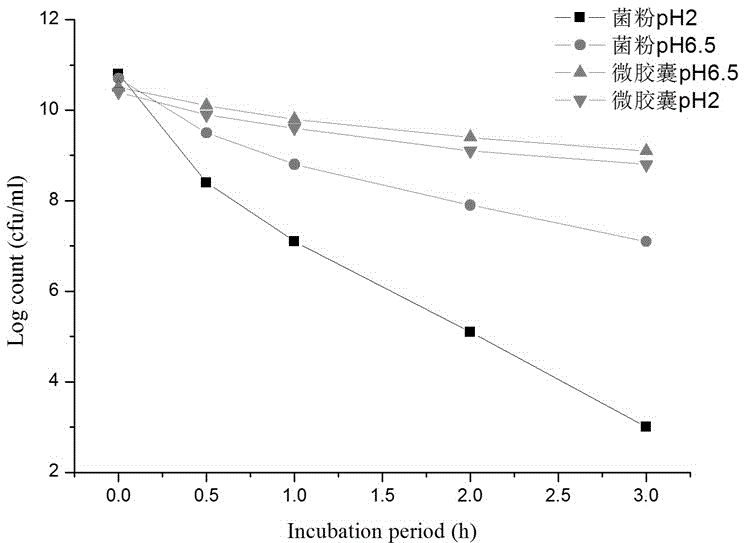
图1为益生菌微胶囊人工胃液的耐受性测试结果。
图2为菌粉和微胶囊人工胆盐的耐受性测试结果。
图3为益生菌微胶囊人工肠液的耐受性测试结果。
具体实施方式
下面结合具体实施方式对本发明进行详细的说明。
本发明涉及的一种益生菌微胶囊的制备方法,由以下步骤实现:
步骤一:在37℃的温度条件下,将益生菌粉在液体培养基中厌氧培养24小时,离心收集菌体,用0.85%的生理盐水洗涤制备菌悬液;
步骤二:在78℃的温度条件下,制备保护剂,每100mL保护剂填加有30g菊粉、0.1g沙棘粉,其余为蒸馏水;
步骤三:将经过灭菌处理的保护剂常温下冷却,将保护剂与菌悬液按3:1的体积比混合均匀,静置30min,在-20℃的温度条件下预冻2小时,然后在-50℃、真空度为50-100毫托的真空冷冻干燥箱中干燥48小时,制备得到冻干菌粉;
步骤四:向质量分数为1.5-2.5%的海藻酸钠溶液中加入0.1 g冻干菌粉,冻干菌粉与海藻酸钠的质量比为1:(2-4),混合均匀后得到菌胶混合液;
步骤五:将菌胶混合液逐滴加入到0.15%的吐温-80的大豆油中,菌胶混合液与大豆油的体积比为1:6,乳化并快速加入到摩尔浓度为0.1mol/L的氯化钙溶液中,静置40min;
步骤六:离心收集微胶囊,用质量分数为0.85%的蒸馏水洗涤,并将制备好的微囊置于真空冷冻干燥箱中干燥。
步骤一中,益生菌粉包括长双歧杆菌、嗜酸乳杆菌、鼠李糖乳杆菌和乳双歧杆菌中的一种或多种。
步骤二中,菊粉是以菊芋为原料,通过纯物理方法提取的水溶性膳食纤维和益生元。
步骤五中,乳化的搅拌速度为200-400rpm/min,乳化时间为10-20min,氯化钙溶液的加入速度为25ml/s。
步骤六中,离心收集微胶囊的条件为500g,10min,4℃;
步骤六中,真空冷冻干燥的条件为-20℃预冻2 h,然后在-50℃、真空度为50-100 mtorr的真空冷冻干燥箱中干燥12 h。
在上述条件下,粒径分布在150-650μm的微胶囊的百分含量为81.2%,且平均粒径为512.38μm。通过扫描电镜观察,微胶囊的形态基本呈球形,表面结构均匀完整,无破损、孔洞和裂缝现象。
实施例1:
步骤一:在37℃的温度条件下,将益生菌粉在液体培养基中厌氧培养24小时,离心收集菌体,用0.85%的生理盐水洗涤制备菌悬液;
步骤二:在78℃的温度条件下,制备保护剂,每100mL保护剂填加有30g菊粉、0.1g沙棘粉,其余为蒸馏水;
步骤三:将经过灭菌处理的保护剂常温下冷却,将保护剂与菌悬液按3:1的体积比混合均匀,静置30min,在-20℃的温度条件下预冻2小时,然后在-50℃、真空度为50毫托的真空冷冻干燥箱中干燥48小时,制备得到冻干菌粉;
步骤四:向质量分数为1.5%的海藻酸钠溶液中加入0.1 g冻干菌粉,冻干菌粉与海藻酸钠的质量比为1:2,混合均匀后得到菌胶混合液;
步骤五:将菌胶混合液逐滴加入到0.15%的吐温-80的大豆油中,菌胶混合液与大豆油的体积比为1:6,乳化并快速加入到摩尔浓度为0.1mol/L的氯化钙溶液中,静置40min;
步骤六:离心收集微胶囊,用质量分数为0.85%的蒸馏水洗涤,并将制备好的微囊置于真空冷冻干燥箱中干燥。
步骤一中,益生菌粉包括等量的长双歧杆菌、嗜酸乳杆菌、鼠李糖乳杆菌。
步骤二中,菊粉是以菊芋为原料,通过纯物理方法提取的水溶性膳食纤维和益生元。
步骤五中,乳化的搅拌速度为200rpm/min,乳化时间为10min,氯化钙溶液的加入速度为25ml/s。
步骤六中,离心收集微胶囊的条件为500g,10min,4℃;
步骤六中,真空冷冻干燥的条件为-20℃预冻2 h,然后在-50℃、真空度为50 mtorr的真空冷冻干燥箱中干燥12 h。
实施例2:
步骤一:在37℃的温度条件下,将益生菌粉在液体培养基中厌氧培养24小时,离心收集菌体,用0.85%的生理盐水洗涤制备菌悬液;
步骤二:在78℃的温度条件下,制备保护剂,每100mL保护剂填加有30g菊粉、0.1g沙棘粉,其余为蒸馏水;
步骤三:将经过灭菌处理的保护剂常温下冷却,将保护剂与菌悬液按3:1的体积比混合均匀,静置30min,在-20℃的温度条件下预冻2小时,然后在-50℃、真空度为80毫托的真空冷冻干燥箱中干燥48小时,制备得到冻干菌粉;
步骤四:向质量分数为2%的海藻酸钠溶液中加入0.1 g冻干菌粉,冻干菌粉与海藻酸钠的质量比为1:3,混合均匀后得到菌胶混合液;
步骤五:将菌胶混合液逐滴加入到0.15%的吐温-80的大豆油中,菌胶混合液与大豆油的体积比为1:6,乳化并快速加入到摩尔浓度为0.1mol/L的氯化钙溶液中,静置40min;
步骤六:离心收集微胶囊,用质量分数为0.85%的蒸馏水洗涤,并将制备好的微囊置于真空冷冻干燥箱中干燥。
步骤一中,益生菌粉包括等量的嗜酸乳杆菌、鼠李糖乳杆菌和乳双歧杆菌。
步骤二中,菊粉是以菊芋为原料,通过纯物理方法提取的水溶性膳食纤维和益生元。
步骤五中,乳化的搅拌速度为300rpm/min,乳化时间为15min,氯化钙溶液的加入速度为25ml/s。
步骤六中,离心收集微胶囊的条件为500g,10min,4℃;
步骤六中,真空冷冻干燥的条件为-20℃预冻2 h,然后在-50℃、真空度为80 mtorr的真空冷冻干燥箱中干燥12 h。
实施例3:
步骤一:在37℃的温度条件下,将益生菌粉在液体培养基中厌氧培养24小时,离心收集菌体,用0.85%的生理盐水洗涤制备菌悬液;
步骤二:在78℃的温度条件下,制备保护剂,每100mL保护剂填加有30g菊粉、0.1g沙棘粉,其余为蒸馏水;
步骤三:将经过灭菌处理的保护剂常温下冷却,将保护剂与菌悬液按3:1的体积比混合均匀,静置30min,在-20℃的温度条件下预冻2小时,然后在-50℃、真空度为100毫托的真空冷冻干燥箱中干燥48小时,制备得到冻干菌粉;
步骤四:向质量分数为2.5%的海藻酸钠溶液中加入0.1 g冻干菌粉,冻干菌粉与海藻酸钠的质量比为1:4,混合均匀后得到菌胶混合液;
步骤五:将菌胶混合液逐滴加入到0.15%的吐温-80的大豆油中,菌胶混合液与大豆油的体积比为1:6,乳化并快速加入到摩尔浓度为0.1mol/L的氯化钙溶液中,静置40min;
步骤六:离心收集微胶囊,用质量分数为0.85%的蒸馏水洗涤,并将制备好的微囊置于真空冷冻干燥箱中干燥。
步骤一中,益生菌粉包括等量的长双歧杆菌、鼠李糖乳杆菌和乳双歧杆菌。
步骤二中,菊粉是以菊芋为原料,通过纯物理方法提取的水溶性膳食纤维和益生元。
步骤五中,乳化的搅拌速度为400rpm/min,乳化时间为20min,氯化钙溶液的加入速度为25ml/s。
步骤六中,离心收集微胶囊的条件为500g,10min,4℃;
步骤六中,真空冷冻干燥的条件为-20℃预冻2 h,然后在-50℃、真空度为100 mtorr的真空冷冻干燥箱中干燥12 h。
以下为益生菌微胶囊的功能特性实验:
1、耐胃酸性
将1 g微胶囊置于9 mL的人工胃液(pH 2.0)中,37℃厌氧处理,分别于0、0.5、1、2、3 h后收集微囊,并进行活菌计数,分析微囊对人工胃液的耐受情况,同时以未经包埋的冻干菌粉进行对照。实验结果表明,菌粉和微胶囊在pH 6.5的条件下处理3 h后,活菌含量基本保持不变。然而,当处于人工胃液中时,活菌含量逐渐降低,而且随着处理时间的延长,菌粉中的活菌数要比微胶囊下降的多。分析其原因可能是:菌粉中的益生菌由于未被包埋,使得菌体直接暴露于胃液环境中,遭受胃酸的破坏而死亡;海藻酸钠微胶囊在胃液中很难溶解,可以减少具体的释放量,达到保护细胞的目的。之所以开始时间段内,活菌含量有所下降,是由于少量没有被包裹完全的微囊发生渗漏或者微囊表面附着有游离菌体的缘故。由此可见,制得的益生菌微胶囊在人工胃液中性质较稳定,可以较好的保护菌体免受胃酸的伤害,可以以较高的活性状态到达肠道顺利定殖。
2、耐胆盐性
分别配制质量分数为0%、1%和2%的胆盐溶液模拟人工胆盐,将1 g微胶囊置于9 mL不同浓度的胆盐溶液中,37℃厌氧处理3 h和12 h后收集微囊,并进行活菌计数,分析微囊对人工胆盐的耐受情况,同时以未经包埋的冻干菌粉进行对照。实验结果表明,当胆盐浓度为1%时,处理12 h后,微胶囊中的活菌数明显高于菌粉的活菌数,其结论与2%的胆盐条件相同。可见,益生菌经微囊化后,可以提高菌体对高浓度胆盐的耐受程度,可以保护菌体免遭胆盐环境的破坏。
3、肠溶性
将1 g微胶囊置于9 mL的人工肠液(pH 6.8)中,37℃厌氧处理,崩解破碎后稀释,并进行活菌计数,分析微囊在人工肠液中的肠溶情况。实验结果表明,微胶囊在人工肠液中处理15 min后开始迅速释放菌体,30 min后基本保持不变,释放率可达83%,而且经人工观察,30 min后已无固体颗粒存在,可断定该微囊在人工肠液中已基本崩解完全,该法制得的微胶囊具有较好的肠溶性,能够使益生菌从海藻酸钠体系中释放出来,从而发挥益生功能。
本发明的内容不限于实施例所列举,本领域普通技术人员通过阅读本发明说明书而对本发明技术方案采取的任何等效的变换,均为本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!