选择素及ICAM/VCAM肽配体偶联物的制作方法
本申请要求2014年5月12日提交的美国申请61/992,056号的权益,该申请的内容通过引用整体并入本申请中。
关于联邦资助的研究或开发的声明
本发明是在政府支持下完成的,由美国国立卫生研究院资助,资助号T32DK101001。政府在本发明中具有某些权利。
背景技术:
本部分介绍了可以有助于更好理解本发明的各个方面。相应地,这些陈述应从这个角度理解,而不应被理解为承认什么是或不是现有技术。
内膜增生是由血管损伤和疾病造成的。在受损的血管中,血小板结合至暴露在血管内的胶原上并在其上转变为激活状态。激活的血小板支持血栓形成,释放炎症细胞因子并从血液募集单核细胞进入血管组织。然后,单核细胞分泌各种因子,包括刺激平滑肌细胞(SMC)迁移进入内膜层以及刺激细胞外基质分泌(ECM)的细胞因子,从而导致内膜增生。类似于暴露的胶原,功能失调的内皮(由于尿毒症及其他代谢障碍而存在于所有糖尿病患者中)支持血小板结合和激活。此外,功能失调并受损的内皮支持白细胞从血液迁移进入血管壁。功能失调的内皮还丧失了细胞-细胞连接,由于细胞间存在间隙变得易渗漏,并且可能暴露出这些间隙中的底层胶原而与血小板结合。因此,操作所致的机械性血管损伤导致上皮细胞(EC)损失,进而暴露出胶原,而功能失调并受损的EC支持了内膜增生。
糖萼(覆盖内皮的阴离子糖胺聚糖层)的缺失是功能失调的内皮和炎症的的标志。糖萼的缺失暴露出细胞表面受体(包括ICAM 和VCAM),这些受体在慢性炎症和EC功能失调时表达。糖萼缺失还暴露出受体P-选择素和E-选择素,它们在损伤和炎症时短暂表达于细胞表面上,而在功能失调的内皮中长期表达(糖尿病患者的情形即是如此)。选择素促进白细胞在 EC上滚动,这是单核细胞和中性粒细胞迁移进入血管壁的第一步。滚动之后,白细胞更加牢固地结合至ICAM 和 VCAM。它们随后迁移进入它们释放细胞因子的组织中,并且刺激SMC迁移进入内膜及ECM的合成。最终的结果是内膜增生,从而阻止向外重塑(outward remodeling),并可促进长期血栓生成。
白细胞迁移通过内皮还可导致组织和器官浸润,败血症中的情形即是如此。这样大的浸润可以导致器官衰竭,甚至多系统器官衰竭。
概述
本发明通过用被偶联至糖胺聚糖(GAG)(例如硫酸皮肤素)的肽配体靶定暴露于血流的内皮选择素和/或ICAM/VCAM受体而解决了受损的/功能失调的内皮的问题。相应地,在一个实施方式中,本发明提供了一种肽偶联物,其包含糖胺聚糖及约1至约50个肽配体,其中所述肽配体结合至选择素、ICAM 和/或 VCAM受体。所述肽偶联物在本文中也称为EC-SEAL偶联物。在某些实施方式中,所述EC-SEAL偶联物进一步包含结合至糖胺聚糖的烷基尾部。
在一些方面,所述糖胺聚糖为葡聚糖、软骨素、硫酸软骨素、皮肤素、硫酸皮肤素、硫酸乙酰肝素、肝素、角蛋白、硫酸角质素或透明质酸。在一些方面,所述肽通过接头被共价结合至糖胺聚糖。在一些方面,所述接头为N-[β-马来酰亚胺基丙酸]酰肼(BMPH)、3-(2-吡啶基二硫代)丙酰肼(PDPH)或肽GSG。在一些方面,所述EC-SEAL偶联物包含约3至约50个、或5至约40个肽配体。在一些方面,所述肽配体包含选自以下序列的氨基酸序列:i) IELLQAR (SEQ ID NO: 1)、IELLQARGSC (SEQ ID NO: 2)、IDLMQAR (SEQ ID NO: 3)、IDLMQARGSC (SEQ ID NO: 4)、QITWAQLWNMMK (SEQ ID NO: 5)、QITWAQLWNMMKGSC (SEQ ID NO: 6)、NAFKILVVITFGEK (SEQ ID NO: 7)、NAFKILVVITFGEKGSC (SEQ ID NO: 8)、ITDGEA (SEQ ID NO: 9)、 ITDGEAGSC (SEQ ID NO: 10)、DGEATD (SEQ ID NO: 11)、或DGEATDGSC (SEQ ID NO: 12);或ii) 包含与i)的氨基酸序列有至少约80%序列同一性的序列且能够结合至选择素、ICAM和/或 VCAM的肽。
在一些方面,所述EC-SEAL偶联物被施用以在靠近功能失调的内皮处获得20 μM至1000 μM的血药浓度。在一些方面,所述EC-SEAL偶联物被施用以在接近功能失调的内皮处获得100 μM至400 μM的血药浓度。
在一些方面,所述EC-SEAL偶联物包含约5个至约40个能够结合至选择素的肽配体。在一些方面,所述EC-SEAL偶联物包含约5个至约40个能结合至ICAM和/或VCAM的肽配体。在某些方面,所述EC-SEAL偶联物包含约5个至约20个能结合至选择素的肽配体和约5个至约20个能够结合至ICAM和/或VCAM的肽配体。在一些方面,所述EC-SEAL偶联物包含硫酸皮肤素或硫酸软骨素以及约3个至约25个肽配体,其中所述肽配体结合至选择素、ICAM和/或VCAM。在一些方面,所述EC-SEAL偶联物包含硫酸皮肤素和约10、15、20或30个肽配体,其中所述肽配体结合至选择素、ICAM 和/或 VCAM。在一些方面,所述EC-SEAL偶联物包含硫酸皮肤素和约10个能结合至选择素肽的配体和约10个能够连接至ICAM和/或VCAM的肽配体。
本发明的一个方面为EC-SEAL 偶联物,其包括肽配体、糖胺聚糖和任选的烷基尾部。相应地,这样的EC-SEAL偶联物的结构可为下式:
(R)m-GAG-(P)n
其中:
R为直链或支链C2-25烷基链;
GAG为糖胺聚糖;
每一个P独立地为约3至50个氨基酸的肽,其包含一个或多个选择素-结合单元、ICAM-结合单元和/或VCAM-结合单元;
n为1-50的整数;并且
m为0、1、2或 3。
所述GAG可为任何糖胺聚糖,如藻酸盐、琼脂糖、葡聚糖、软骨素、皮肤素、硫酸皮肤素、肝素、硫酸乙酰肝素、角蛋白、透明质酸或它们的组合。
这样的EC-SEAL偶联物可以抑制血小板活化,抑制血小板结合至哺乳动物血管,抑制内膜增生,抑制哺乳动物血管中的炎症,抑制血栓形成,抑制血管痉挛,刺激内皮细胞增殖,结合至哺乳动物血管中的暴露的选择素、ICAM、VCAM或其组合。例如,这样的EC-SEAL可以抑制或减少溶血患者的多器官衰竭的发生率。
相应地,在一个实施方式中,本发明提供用于治疗患与内皮功能失调相关的疾病的患者的方法。在一个实施方式中,本发明还提供用于在有需要的患者中治疗或抑制内皮功能失调的方法。本发明的另一个方面涉及一种方法,该方法包括使用本文所述的任何EC-SEAL偶联物接触一个或多个内皮细胞。
与内皮功能失调相关的疾病的非限制性例子包括动脉粥样硬化、冠状动脉疾病、糖尿病、高血压、高胆固醇血症、类风湿性关节炎、系统性红斑狼疮、青光眼、尿毒症、败血症和器官衰竭。在某些方面,给药方式为静脉内的、腹膜内的、局部的或通过植入装置给药。
在一些方面,所述内皮功能失调的特征在于渗透的内皮内衬或受损的内皮细胞。在一些方面,所述内皮功能失调的特征在于糖萼的缺失。在一些方面,所述内皮功能失调的特征在于表达于内皮细胞的表面上并暴露于血液循环的选择素蛋白。在一些方面,患病位点有炎症。
在一个实施方式中,本发明提供抑制内皮细胞功能失调的方法,其包含提供如本发明提供的EC-SEAL偶联物;以及施用所述EC-SEAL于至少一种功能失调的内皮细胞,其中所述EC-SEAL被施用以抑制选择素分子在所述功能失调内皮细胞上的生成。
在一些方面,本发明所提供的所述EC-SEAL偶联物抑制在细胞内的炎症反应。在一些方面,所述EC-SEAL偶联物抑制血小板的结合。在一些方面,所述EC-SEAL聚合物抑制内皮增生。在一些方面,所述EC-SEAL偶联物抑制慢性炎症。在一些方面,所述EC-SEAL偶联物抑制多系统的器官衰竭。在一些方面,所述EC-SEAL偶联物治疗青光眼。在一些方面,所述EC-SEAL偶联物刺激内皮细胞增殖。
在一个实施方式中,本发明还提供预防或减少在患者体内的血管位点处的炎症的方法,其中所述位点(a)包含渗透的内皮内衬或受损的内皮细胞,并且(b)没有正在经历血管介入手术或正从血管介入手术中恢复,所述方法包括向所述患者施用包含有效量的如本文所述的EC-SEAL偶联物的药物组合物。
在一些方面,所述血管介入手术包括经皮冠状动脉介入(PCI)手术。
在一些方面,所述患者没有正在经历血管介入手术或正从血管介入手术中恢复。在一些方面,所述血管介入手术包括经皮冠状动脉介入(PCI)手术。在一些方面,所述血管介入手术包括血管剥离。
在一个实施方式中,本发明提供用于在患者体内的血管介入的复合物,所述的复合物包含EC-SEAL偶联物,其中所述EC-SEAL偶联物结合至患者体内的被剥离的血管。在一些方面,所述EC-SEAL偶联物抑制血小板激活。在一些方面,所述EC-SEAL偶联物抑制血小板结合至被剥离的血管。在一些方面,所述EC-SEAL偶联物抑制内膜增生。在一些方面,所述EC-SEAL偶联物抑制由于血管剥离导致的炎症。
在一些方面,所述EC-SEAL偶联物抑制血栓生成。在一些方面,所述EC-SEAL偶联物抑制血管痉挛。在一些方面,所述EC-SEAL偶联物刺激内皮细胞增殖。在一些方面,所述EC-SEAL偶联物结合至在被剥离的血管上的暴露的胶原。
附图说明
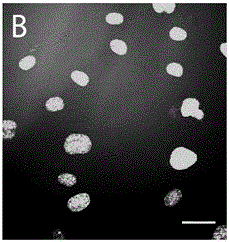
图1A和1B显示用5ng/ml TNFα 或等体积的 PBS 刺激 4h,然后用2 mg/ml 生物素-EC-SEAL处理1h的人冠状内皮细胞(HAEC)的图像(参见实施例2)。所使用的EC-SEAL分子(DS-QAR20-生物素)为选择素配体肽(IELLQARGSC, SEQ ID NO:2)和氧化硫酸皮肤素的偶联物。在这样的处理后,细胞被冲洗和固定,然后用抗生物素蛋白-alexafluor探测DS-QAR20-生物素与HAEC上的选择素的结合。图1A显示这样处理后的TNFα刺激的内皮细胞(细胞核用SYTOX-绿标记),其结合了DS-QAR20-生物素(红色),黄色箭头突出显示带有特别大的DS-QAR20-生物素外层的细胞(红色区域)。图1B显示用DS-QAR20-生物素处理的PBS刺激的内皮细胞,表明DS-QAR20-生物素很少结合至未曾用TNFα刺激的细胞。比例尺为30 μm。
图2显示能结合选择素的EC-SEAL偶联物在内皮细胞(EC)上的相对结合亲和力。
图3显示能结合ICAM的 EC-SEAL偶联物在内皮细胞(EC)上的相对结合亲和力。
图4显示了能结合单一的选择素或ICAM的EC-SEAL偶联物及具有同时结合选择素和ICAM的肽的EC-SEAL偶联物在内皮细胞(EC)上的相对结合亲和力。
发明详述
除非另有定义,本文所用的全部技术术语和科学术语具有如本发明所属技术领域的普通技术人员通常理解的相同的含义。本文所用以下术语具有以下含义。
如本发明中所使用的,术语“包括”是指该组合物和方法包括所引述的内容,但不排除其他内容。当用来定义组合物和方法时,“实质上由…组成”意味着排除对于该组合物或方法具有任何实质性意义的其他内容。。因此,实质上由本发明所定义的元素组成的组合物不排除不实质性影响所要求保护的基本的和新颖的特征的其他材料或步骤。“由….组成”应排除超过痕量的其他成分和实质性的方法步骤。由每个这些过渡术语定义的实施方式都在本发明的范围之内。
术语“约”当用于数字表示(如温度、时间、数量和浓度,含范围值)前时,是指可有(+)或(-)10%、5%或1%的变化的近似值。
如本文所用,术语“组合物”是指适用于为了治疗的目的给药至预期患者且包含至少一种药物活性成分的制剂,包括其任何固体形式。所述组合物可包括至少一种药学上可接受的成分以提供化合物的改进的配方,如合适的载体。
肽偶联物
本发明涉及肽偶联物,其保护血管的内皮细胞内衬免受损伤、尿毒症、氧化应激和炎症。所述肽偶联物可形成一种S/E选择素结合的和ICAM-结合的抗中性粒细胞/单核细胞的管腔内衬(EC-SEAL),其特别可用于受手术影响的血管的和被插管的血管的内皮细胞内衬的保护。
所述EC-SEAL肽偶联物包括一个或多个肽配体,这些肽配体可结合至选择素、ICAM和/或 VCAM。所述肽配体被偶联至糖胺聚糖(GAG),如硫酸皮肤素,并且所述偶联物还可包括约一个至约三个疏水尾部(如烷基尾部)。
本文所述的EC-SEAL偶联物可包含一种或多种类型肽配体,使得所述EC-SEAL偶联物能够结合至选择素、ICAM和/或VCAM。例如,本发明包括包含选择素结合肽和ICAM结合肽两者的EC-SEAL偶联物。本发明还包括包含选择素结合肽和VCAM结合肽两者的EC-SEAL偶联物,或包含ICAM结合肽和VCAM结合肽两者的EC-SEAL偶联物。此外,所述肽配体可在单个肽内包含一个或多个选择素结合单元(或序列)、ICAM结合单元(或序列)和/或VCAM结合单元(或序列)。相应地,在一个实施方式中,本发明公开了一种EC-SEAL偶联物,其包含具有选择素结合单元(或序列)和ICAM结合单元(序列)的肽。本发明还包括EC-SEAL偶联物,其包含选择素结合单元(或序列)及VCAM结合单元(或序列)。本发明还包括EC-SEAL偶联物,其包含ICAM结合单元(或序列)及VCAM结合单元(或序列)。
肽配体为可具有多种结构的合成肽。如本文所用的,术语“肽配体”是指通过肽(或酰胺)键连接的氨基酸链。在一个实施方式中,所述肽配体包含约3至约120个氨基酸,或约3至约110个氨基酸,或约 3至约100个氨基酸,或约3至约90 个氨基酸,或约 3至约80个氨基酸, 或约 3至约70个氨基酸,或约 3至约60个氨基酸,或约 3至约50个氨基酸,或约 3至约40 个氨基酸,或约5至约120个氨基酸,或约5至约100个氨基酸,或约5至约90 个氨基酸,或约5至约80个氨基酸,或约5至约70个氨基酸,或约5至约60个氨基酸,或约5至约50个氨基酸,或约5至约40个氨基酸,或约5至约30个氨基酸,或约5至约20个氨基酸,或约5至约10个氨基酸。尽管所述肽配体可具有不同的长度,但是肽配体通常具有约5至约40个氨基酸。有用的肽配体的例子包括如下的可结合至选择素的肽序列(或单元):IELLQAR (SEQ ID NO:1)、 IELLQARGSC (SEQ ID NO:2)、IDLMQAR (SEQ ID NO:3)、IDLMQARGSC (SEQ ID NO:4)、 QITWAQLWNMMK (SEQ ID NO:5)、 QITWAQLWNMMKGSC (SEQ ID NO:6)和其组合。所述选择素可为S-选择素、P-选择素或 E-选择素。用于筛选具有E-选择素结合亲和力的肽序列(或E-选择素结合单元)的各种方法是本领域中常规的(参见例如Martens, C. L. et al. J. Biol. Chem. 1995, 270(36), 21129-21136; and Koivunen, E. et al. J. Nucl. Med. 1999, 40, 883-888)。
其他显示具有E-选择素结合亲和力(或E-选择素结合单元)且可用于本文所公开的EC-SEAL偶联物和方法中的肽序列,包括但不限于,LRRASLGDGDITWDQLWDLMK (SEQ ID NO: 13),HITWDQLWNVMN (SEQ ID NO: 14),QITWAQLWNMMK (SEQ ID NO: 5),YGNSNITWDQLWSIMNRQTT (SEQ ID NO: 15),WTDTHITWDQLWHFMNMGEQ (SEQ ID NO: 16), EPWDQITWDQLWIIMNNGDG (SEQ ID NO: 17),HITWDQLWLMMS (SEQ ID NO: 18),DLTWEGLWILMT (SEQ ID NO: 19),RGVWGGLWSMTW (SEQ ID NO: 20),DYSWHDLWFMMS (SEQ ID NO: 21),KKEDWLALWRIMSVPDEN (SEQ ID NO: 22),RNMSWLELWEHMK (SEQ ID NO: 23),KEQQWRNLWKMMS (SEQ ID NO: 24),SQVTWNDLWSVMNPEVVN (SEQ ID NO: 25) 和RSLSWLQLWDWMK (SEQ ID NO: 26) (参见例如Martens, C. L. et al. J. Biol. Chem. 1995, 270(36), 21129-21136),DITWDQLWDLMK (SEQ ID NO: 27) (参见例如Koivunen, E. et al. J. Nucl. Med. 1999, 40, 883-888),DITWDELWKIMN (SEQ ID NO: 28),DYTWFELWDMMQ (SEQ ID NO: 29),DMTHDLWLTLMS (SEQ ID NO: 30),EITWDQLWEVMN (SEQ ID NO: 31),HVSWEQLWDIMN (SEQ ID NO: 32),HITWDQLWRIMT (SEQ ID NO: 33),DISWDDLWIMMN (SEQ ID NO: 34),QITWDQLWDLMY (SEQ ID NO: 35),RNMSWLELWEHMK (SEQ ID NO: ),AEWTWDQLWHVMNPAESQ (SEQ ID NO: 36),HRAEWLALWEQMSP (SEQ ID NO: 37),KKEDWLALWRIMSV (SEQ ID NO: 38),KRKQWIELWNIMS (SEQ ID NO: 39),WKLDTLDMIWQD (SEQ ID NO: 40) 和HITWDQLWNVMLRRAASLG (SEQ ID NO: 41) (参见,例如 Simanek, E. E. Chem. Rev. 1998, 98, 833-862), 或其组合, 其中每一篇文献都通过引用整体并入本文。
用于筛选具有ICAM-结合亲和力的肽序列(或ICAM结合单元)的各种方法是本领域中常规的(参见例如, Martens, C. L. et al. J. Biol. Chem. 1995, 270(36), 21129-21136; and Koivunen, E. et al. J. Nucl. Med. 1999, 40, 883-888)。有用的可结合ICAM的肽配体的例子包括如下:NAFKILVVITFGEK (SEQ ID NO:7)、NAFKILVVITFGEKGSC (SEQ ID NO:8)、ITDGEA (SEQ ID NO:9)、ITDGEAGSC (SEQ ID NO:10)、DGEATD (SEQ ID NO:11)、DGEATDGSC (SEQ ID NO:12)和其组合。
其他显示具有ICAM结合亲和力且可用于本文所公开的EC-SEAL偶联物及方法的肽序列(或ICAM结合单元),包括但不限于,EWCEYLGGYLRYCA (SEQ ID NO: 42) (参见例如, Welply, J. K. et al. Proteins: Structure, Function, and Bioinformatics 1996, 26(3): 262-270),FEGFSFLAFEDFVSSI (SEQ ID NO: 43) (参见例如, US Publication No. WO2014059384), NNQKIVNLKEKVAQLEA (SEQ ID NO: 44),NNQKIVNIKEKVAQIEA (SEQ ID NO: 45),NNQKLVNIKEKVAQIEA (SEQ ID NO: 46),YPASYQR (SEQ ID NO: 47),YQATPLP (SEQ ID NO: 48),GSLLSAA (SEQ ID NO: 49),FSPHSRT (SEQ ID NO: 50),YPFLPTA (SEQ ID NO: 51) 和GCKLCAQ (SEQ ID NO: 52) (参见例如, US Patent 8,926,946),GGTCGGGGTGAGTTTCGTGGTAGGGATAATTCTGTTTGGGTGGTT (SEQ ID NO: 53),EWCEYLGGYLRCYA (SEQ ID NO: 54) (参见例如, Koivunen, E. et al. J. Nucl. Med. 1999, 40, 883-888),GRGEFRGRDNSVSVV (SEQ ID NO: 55) (see, e.g., CN Publication No. CN1392158),QTSVSPSKVI (SEQ ID NO. 56),PSKVILPRGG (SEQ ID NO. 57),LPRGGSVLVTG (SEQ ID NO. 58) 和QTSVSPSKVILPRGGSVLVTG (SEQ ID NO. 59) (参见例如,Tibbetts, S. A. et al. Peptides 21 (2000) 1161–1167)及其组合,其中每一篇文献都以引用方式整体并入本文。
用于筛选具有VCAM-结合亲和力的肽序列(或VCAM结合单位)的各种方法是本领域中常规的(参见例如, Martens, C. L. et al. J. Biol. Chem. 1995, 270(36), 21129-21136; and Koivunen, E. et al. J. Nucl. Med. 1999, 40, 883-888)。其他显示具有VCAM结合亲和力且可用于本文所公开的EC-SEAL偶联物及方法的肽序列(或VCAM结合单元),包括但不限于,YRLAIRLNER (SEQ ID NO: 60), YRLAIRLNERRENLRIALRY (SEQ ID NO: 61) 和 RENLRIALRY (SEQ ID NO: 62) (参见例如EP公开号EP1802352)和其组合,文献都以引用方式整体并入本文。
肽配体序列中可存在可变性。例如,本文所述的合成肽配体可通过包括一个或多个保守的氨基酸替换来修饰。如本领域的技术人员熟知的,通过保守的替换来改变肽的任何非关键氨基酸不会明显改变所述肽的活性,因为替换的氨基酸的侧链应该能形成与被替换的氨基酸的侧链相似的键和接触点。因此,本文所述的任何肽序列可被修饰,以使得具有至少约80%序列同一性、或至少约83%序列同一性、或至少约85%的序列同一性、或至少约90%的序列同一性、或至少约95%的序列同一性、或至少约98%的序列同一性的序列被整合在EC-SEAL偶联物中,前提是该序列能够结合至选择素、ICAM 和/或VCAM。因此,例如在某些实施方式中,所述肽配体可具有与任何所述氨基酸序列具有80%、85%、90%、 95%或98%同源性的氨基酸序列。
在一个实施方式中,所述肽配体或所述肽的结合单元结合至选择素、ICAM和/或VCAM的解离常数(Kd)小于约1 mM,或小于约 900 µM,或小于约800 µM,或小于约 700 µM,或小于约 600 µM,或小于约500 µM,或小于约400 µM,或小于约300 µM,或小于约200 µM,或小于约100 µM。
在一些实施方式中,所述EC-SEAL偶联物进一步包含一个或多个具有胶原结合单元的肽配体。所述胶原结合单元可位于与选择素、ICAM和/或VCAM结合单位相同或不同的肽内。因此,在一些实施方式中,所述肽配体包含一个或多个选择素结合单元、ICAM结合单元和/或VCAM-结合单元以及胶原结合单元。所述胶原结合单元可与胶原蛋白原纤维形成中通常涉及或不涉及的蛋白的一部分具有氨基酸同源性。在一些实施方式中,这些单元与小富亮氨酸蛋白聚糖的氨基酸序列、血小板受体序列或调控胶原蛋白原纤维形成的蛋白具有同源性或序列同一性。在不同的实施方式中,所述胶原结合单元包含选自以下序列的氨基酸序列:RRANAALKAGELYKSILY (SEQ ID NO: 63)、GELYKSILY (SEQ ID NO: 64)、RRANAALKAGELYKCILY (SEQ ID NO: 65)、GELYKCILY (SEQ ID NO: 66)、RLDGNEIKR (SEQ ID NO: 67)、AHEEISTTNEGVM (SEQ ID NO: 68)、NGVFKYRPRYFLYKHAYFYPPLKRFPVQ (SEQ ID NO: 69)、CQDSETRTFY (SEQ ID NO: 70)、TKKTLRT (SEQ ID NO: 71)、 GLRSKSKKFRRPDIQYPDATDEDITSHM (SEQ ID NO: 72)、SQNPVQP (SEQ ID NO: 73)、SYIRIADTNIT (SEQ ID NO: 74)、KELNLVYT (SEQ ID NO: 75)或 GSITTIDVPWNV (SEQ ID NO: 76);或与它们具有至少约80%序列同一性、或至少约83% 的序列同一性、或至少约85%的序列同一性、或至少约90%的序列同一性、或至少约95%的序列同一性、或至少约98%序列同一性的序列,前提是该序列能结合至胶原。
在某些实施方式中,所述胶原结合单元包含的氨基酸序列与von Willebrand因子(vWF)的胶原结合域或血小板胶原受体(如Chiang, T.M., et al. J. Biol. Chem., 2002, 277: 34896-34901, Huizinga, E.G. et al., Structure, 1997, 5: 1147-1156, Romijn, R.A., et al., J. Biol. Chem., 2003, 278: 15035-15039,及Chiang, et al., Cardio. & Haemato. Disorders-Drug Targets, 2007, 7: 71-75中所述,每一篇都以引用方式并入本文)具有至少约80%、或至少约83%、或至少约85%、或至少约90%、或至少约95%、或至少约98%、或至少约100%序列同一性。非限制性的例子为源自vWF 的WREPSFCALS (SEQ ID NO: 77)。
用于筛选具有胶原结合亲和力的氨基酸序列(或胶原结合结构域)的各种方法是本领域中常规的。其他的显示具有结合亲和力且可用于本发明公开的肽聚糖和方法中的的氨基酸序列,包括但不限于,βAWHCTTKFPHHYCLYBip (SEQ ID NO: 78),βAHKCPWHLYTTHYCFTBip (SEQ ID NO: 79),βAHKCPWHLYTHYCFT (SEQ ID NO: 80)等, 其中Bip为苯丙氨酸和βA为β-丙氨酸(参见,Abd-Elgaliel, W.R., et al., Biopolymers, 2013, 100(2), 167–173), GROGER (SEQ ID NO: 81),GMOGER (SEQ ID NO: 82),GLOGEN (SEQ ID NO: 83),GLOGER (SEQ ID NO: 84),GLKGEN (SEQ ID NO: 85),GFOGERGVEGPOGPA (SEQ ID NO: 86)等,其中O为4-羟基脯氨酸(参见Raynal, N., et al., J. Biol. Chem., 2006, 281(7), 3821-3831),HVWMQAPGGGK (SEQ ID NO: 87) (参见 Helms, B.A., et al., J. Am. Chem. Soc. 2009, 131, 11683–11685),WREPSFCALS (SEQ ID NO: 77) (参见, Takagi, J., et al., Biochemistry, 1992, 31, 8530–8534),WYRGRL (SEQ ID NO: 88)等(参见Rothenfluh D.A., et al., Nat Mater. 2008, 7(3), 248-54),WTCSGDEYTWHC (SEQ ID NO: 89),WTCVGDHKTWKC (SEQ ID NO: 90),QWHCTTRFPHHYCLYG(SEQ ID NO: 91)等(参见, U.S. 2007/0293656), STWTWNGSAWTWNEGGK (SEQ ID NO: 92), STWTWNGTNWTRNDGGK(SEQ ID NO: 93)等(参见WO/2014/059530),CVWLWEQC (SEQ ID NO: 94) (参见Depraetere H., et al., Blood. 1998, 92, 4207-4211; and Duncan R., Nat Rev Drug Discov, 2003, 2(5), 347-360),CMTSPWRC (SEQ ID NO: 95)等(参见Vanhoorelbeke, K., et al., J. Biol. Chem., 2003, 278, 37815-37821),CPGRVMHGLHLGDDEGPC (SEQ ID NO: 96) (参见 Muzzard, J., et al., PLoS one. 4 (e 5585) I- 10),KLWLLPK (SEQ ID NO: 112) (参见 Chan, J. M., et al., Proc Natl Acad Sci U.S.A., 2010, 107, 2213- 2218)和CQDSETRTFY (SEQ ID NO: 113)等(参见U.S. 2013/0243700),其中每一篇文献都以引用方式整体并入本文。
氨基酸的“保守取代”或肽的“保守替换变体”是指维持:1)肽的二级结构;2)氨基酸的电荷或疏水性;和3)侧链体积(bulkiness) 或任何一个或多个这些特性的氨基酸取代。为说明性目的,熟知的术语“亲水性残基”涉及丝氨酸或苏氨酸。“疏水性残基”是指亮氨酸、异亮氨酸、苯丙氨酸、缬氨酸或丙氨酸等。“带正电的残基”是指赖氨酸、精氨酸、鸟氨酸或组氨酸。“带负电的残基”是指天门冬氨酸或谷氨酸。具有“大体积侧链”的残基是指苯丙氨酸、色氨酸或酪氨酸等。表1中给出了氨基酸缩写列表和示例性的保守氨基酸取代。
表1
在肽配体中也可以存在非保守替换,条件是这些替换不会过度地影响肽的结合活性和/或降低它在以下任何方面的抑制效力:血小板激活、血小板结合至内皮、血栓形成、由于剥离内皮导致的炎症、内皮增生和或血管痉挛,或降低其在刺激内皮细胞增殖或结合至剥离血管方面的效力。
粘附于合成肽配体的糖胺聚糖(简写为GAG或多糖)可选自:藻酸盐、琼脂糖、葡聚糖、软骨素、皮肤素、硫酸皮肤素、肝素、硫酸乙酰肝素、角蛋白和透明质酸。在一个实施方式中,所述多糖选自:硫酸皮肤素、葡聚糖和肝素。在一些实施方式中,所述多糖为硫酸皮肤素。硫酸皮肤素为天然糖胺聚糖,其主要存在于皮肤中,但血管、心脏瓣膜、腱、肺和肠粘膜中也存在。除了作为皮肤和其他器官的主要成分发挥作用之外,硫酸皮肤素被认为在修复创伤、调控血液的凝结及对于感染的响应中起作用,尽管它在这些过程中的作用还不很清楚。
肽配体可直接连接至糖胺聚糖或通过接头连接至糖胺聚糖。所述接头可包括一个或多个二价片段,这些二价片段在每种情况下独立地选自:亚烷基、杂亚烷基、环亚烷基、环杂亚烷基、亚芳基和杂亚芳基(它们各自任选地被取代)。本文所使用的杂亚烷基代表直链或支链亚烷基上的一个或多个碳原子被在每种情况下独立地选自氧、氮、磷和硫的原子取代而形成的基团。
每一个糖胺聚糖可具有约1至约50个,或约3至约50个连接其上的肽配体。在一些实施方式中,每一个糖胺聚糖可被共价结合至至少3个肽配体,或至少5个肽配体,或至少8个肽配体,或至少10个肽配体,或至少15个肽配体,或至少20个肽配体、或至少25个肽配体。在一些实施方式中,每一个糖胺聚糖可以被共价结合至约5个至约45个肽配体,或约7至约45个肽配体,或约8至约40个肽配体,或约10至约35个肽配体,或约10至约30个肽配体,或约15至约30个肽配体。
EC-SEAL偶联物也可包括约1至约3个烷基尾部,其可以用于调节EC-SEAL偶联物的疏水性。例如,当采用烷基尾部时,纳米粒子EC-SEAL偶联物可形成胶束。EC-SEAL胶束形成在体内缓慢解离的纳米颗粒,从而递送额外的游离的EC-SEAL至血管位点,例如递送至瘘管腔。本文所用的术语“烷基尾部”旨在表示基本上疏水的烷基链。烷基链通常包含具有2个至约25个碳原子,更具体地2个至约18个碳原子的饱和的单价的烃基。如果所述烷基链(或烷基尾部)是基本上疏水的,那么所述烷基链可包含直链的、支链的或环状的基团,并且可包含不饱和位点和/或其他任选的官能团。所用的烷基尾部通常为2至18碳(C2-18)的烷基链。在一些实施方式中,所述烷基尾部(即,烷基链)具有2-25个碳原子(C2-25)或3-25个碳原子(C3-25),或 4-14个碳原子(C4-14),或5-12个碳原子(C5-12)。例如,可使用烷基链如异丙基(C3)、丁基(C4)、己基(C6)、辛基(C8)、癸基(C10)或十二烷基(C12)。烷基链(即烷基尾部)可被连接至糖胺聚糖的官能基团。在一些实施方式中,在烷基尾部和糖胺聚糖间使用醚、酯、酰胺、氨基或酰基连接是方便的。
因此,所述EC-SEAL偶联物可具有如下式的结构:
(R)m-GAG-(P)n
其中:
R为直链或支链C2-25烷基链;
GAG为糖胺聚糖;
每一个P独立地为具有3个至约50个氨基酸且包括一个或多个选择素结合单元、ICAM-结合单元和/或VCAM-结合单元的肽;
n为1-50的整数;并且
m为0、1、2或3。
制备方法
EC-SEAL偶联物可通过可用的工艺或本文所述的任何工艺制备。例如,合成肽配体可根据本领域的技术人员可用的固相肽合成方案被合成。在一个实施方式中,根据众所周知的Fmoc方案在固体支持物上合成肽前体,并根据本领域的技术人员可用的方法利用三氟乙酸从所述支持物上切除该肽前体,再通过色谱法纯化。
合成肽配体也可利用本领域技术人员可用的生物技术的方法合成。在一个实施方式中,编码肽配体氨基酸序列的DNA序列通过本领域的技术人员熟知的重组DNA技术被连接进入表达盒或表达载体(例如,包含了用于肽的亲和纯化的亲和标记的质粒),用表达盒或表达载体来转染或转化宿主细胞,以允许肽配体的重组表达,然后根据本领域的技术人员熟知的方法(如通过亲和纯化)从宿主生物或培养基中分离所述肽。重组DNA技术方法如Sambrook et al.所述(“Molecular Cloning: A Laboratory Manual,” 3rd Edition, Cold Spring Harbor Laboratory Press, (2001)),以引用的方式并入本文,且为本领域的技术人员所熟知。
肽(或多肽或肽区)与另一序列具有一定百分比(例如至少约60%、或至少约65%、或至少约70%、或至少约75%、或至少约80%、或至少约83%、或至少约85%、或至少约90%、或至少约95%、或至少约98%、或至少约99%)的“序列同一性”是指,当比对时,在比较这两个序列时,该百分比的碱基(或氨基酸)是相同的。应注意,对于本申请公开的任何序列(参比序列),与参比序列具有至少约60%、或至少约 65%、或至少约70%、或至少约75%、或至少约80%、或至少约83%、或至少约85%、或至少约90%、或至少约95%、或至少约98%或至少约99%的序列同一性的序列也在本发明公开的范围内。同样地,本发明还包括,与参比序列相比具有一个、两个、三个、四个或五个氨基酸残基或核苷酸的替换、缺失或增加的序列。
利用本领域技术人员已知的方法,在还原剂的存在下,通过所述肽的游离氨基酸基团与多糖的醛官能团反应,合成的肽配体可与多糖偶联,从而得到肽聚糖偶联物。在一个实施方式中,多糖(如聚糖或糖胺聚糖)的醛官能团根据本领域的技术人员的熟知的方法通过所述多糖与过碘酸钠反应而形成。
所述多糖的疏水化可通过将疏水基团(如烷基链缩水甘油醚偶联物,例如异丙基(C3)、丁基(C4)、己基(C6)、辛基(C8)、癸基(C10)或十二烷基(C12)的缩水甘油醚)偶联至适当官能化的多糖(例如,包含胺官能团的多糖)而实现。尽管烷基链通常被用于EC-SEAL偶联物的疏水化,但可预期在烷基尾部中也可并入其他官能团(如氨基、硫基、醚基等)。
所述合成肽配体可通过以下方法与多糖偶联:所述多糖的醛官能团与交联剂(如,(2-吡啶基二硫代)丙酰肼(PDPH))反应,以形成中间体多糖,进一步地将中间体多糖与含有游离巯基的肽反应,以生成肽多糖偶联物。在本文所述的各种实施方式中,所述肽的序列可被修饰以包括甘氨酸-半胱氨酸片段,以提供用于多糖或多糖接头偶联物的接合点。在本文所述的任何实施方式中,所述交联剂可为N-[β-马来酰亚胺基丙酸]酰肼(BMPH)。
尽管具体的实施方式已经在上述段落中阐明,但本文所述的EC-SEAL聚合物可通过使用任何本领域公认的用于肽与多糖(如聚糖或糖胺聚糖)的偶联的方法制备。这些方法包括共价键、离子键或氢键键合,直接或通过连接基团(如二价接头)间接键合。所述偶联物通常通过肽与多糖的共价结合形成,通过在偶联物各自组分上的酸、醛、羟基、氨基或亚肼基团间形成酰胺、酯或亚氨基键而实现。所有这些方法为本领域已知的或进一步在本发明的实施例部分阐述的或在Hermanson G.T., Bioconjugate Techniques, Academic Press, pp.169-186 (1996)中描述(通过引用并入本文)。所述接头通常包含约1至约30个碳原子,更通常为约2至约20个碳原子。通常使用小分子量的接头(即分子量为约20至500的接头)。
此外,偶联物的接头部分的结构修饰是为本发明所预期的。例如,所述接头可包括氨基酸,并且偶联物的接头部分可具有大量的氨基酸替换,包括但不限于,天然氨基酸和从常规合成方法得到的氨基酸。在另一方面,β,γ和较长链氨基酸可以用于替代一个或多个α氨基酸。在另一方面,所述接头可被缩短或延长,这可通过改变所包括的氨基酸数量来实现,或通过包括更多或更少的β,γ或较长链氨基酸来实现。相似地,本文所述的接头的其他化学片段的长度和形状可被修饰。
因此,如本文所述的任何实施方式中,任一个或多个的合成肽配体可具有包含一个至约五个氨基酸的间隔序列。可预期任何天然或非天然的氨基酸可被用于间隔序列,只要所述间隔序列不明显干扰所述肽的预期的结合。示例性间隔序列包括,但不限于,包含1至5个甘氨酸单元的短序列(如G、GG、GGG、GGGG (SEQ ID NO: 97)或GGGGG (SEQ ID NO: 98)),任选地包含半胱氨酸(如GC、GCG、GSGC(SEQ ID NO: 99)或GGC)和/或丝氨酸(如GSG或GSGSG (SEQ ID NO: 100)),或一至五个精氨酸单元(如R、RR、RRR等)。所述间隔序列也可包含非氨基酸部分,如聚乙二醇(PEG)、6-氨基己酸或其组合,可具有或不具有氨基酸间隔序列。所述间隔序列可附着于肽的C端或N端,以提供用于多糖或多糖接头偶联物的结合点。
在某些实施方式中,所述间隔序列包含不止一个结合位点(可为直链或支链的),因此产生支链的构建体。在间隔序列上的结合位点可相同或不同,并且可为任何合适的结合位点(如胺或羧酸),以使得期望的肽序列可结合至此(例如通过酰胺键)。因此,在某些实施方式中,所述间隔序列包含一个或多个赖氨酸、谷氨酸或天冬氨酸残基。这样的构建体可提供具有不止一个选择素结合单元、ICAM结合单元和/或VCAM的结合单元式PnL的肽,其中P为选择素结合序列、ICAM结合序列和/或VCAM-结合序列,L为间隔序列,n为约2至10、或2至8、或2至6、或2至5、或2至4的整数、或2、或3、或4、或5、或6、或7、或8、或9、或10。例如,间隔序列L可为提供2、3或4个结合位点的氨基酸序列,如KGSG (SEQ ID NO: 111)、KGC、KKGSG (SEQ ID NO: 101)、KKGC (SEQ ID NO: 102)、KKKGSG (SEQ ID NO: 103)或KKKGC (SEQ ID NO: 104)等。
在本文所述的EC-SEAL偶联物中,肽配体可在任何合适的结合点结合至多糖,如C端、N端或通过氨基酸的侧链。例如,肽可通过所述肽的氨基酸侧链(例如甘氨酸或天冬氨酸残基的侧链)结合至多糖。此外,所述肽配体可为直链的、支链的或可包含一个或多个环状肽序列。
使用方法
所述EC-SEAL偶联物可用于抑制血小板结合至内皮,抑制血液中其他细胞结合至暴露的内皮,抑制血小板活化,抑制血栓形成,抑制由于剥离内皮导致的炎症,抑制内皮增生,和/或抑制血管痉挛。本文所述的EC-SEAL偶联物也可刺激内皮细胞增殖并可结合至血管的表面。在任何这些实施方式中,上述这些效果可在血管介入手术(如基于导管的手术)中出现。在任何这些实施方式中,任何上述EC-SEAL偶联物都可被使用。
在一个实施方式中,本发明提供用于治疗患有内皮功能失调相关疾病的患者的组合物及方法。本发明还涉及抑制以下一个或多个方面:血小板结合至内皮、血小板激活、血栓形成、由于剥离内皮导致的炎症、内皮增生和/或血管痉挛,或其在刺激内皮细胞增殖或结合至剥离的血管的效力,包括对有此需要的患者施用有效量的本文所提供的组合物。在一些实施方式中,所述组合物包括本发明的EC-SEAL偶联物。
本发明所提供的EC-SEAL偶联物可在急性和慢性疾病中减轻内皮功能失调或损伤的炎症影响。可预期这样的偶联物抑制或降低结合至功能失调的内皮的血小板,因此降低血小板介导的炎症。炎症可通过血小板过程而被激活,如血小板-血小板结合、血小板-白细胞结合、白细胞渗出的促进或仅仅是从血小板释放局部和区域性细胞因子。
在一些实施方式中,本发明还提供用于在患有内皮功能失调的血管位点预防或减轻炎症的方法。所述方法包括将包含本发明的EC-SEAL偶联物的药物组合物施用至所述位点。
本文所阐述的,EC-SEAL偶联物靶定暴露于血流的内皮选择素和ICAM/VCAM受体,其中它们能保持足够长时间的结合,从而阻止血小板结合至剥离的内皮,因此阻止血小板激活、血栓形成、由于内皮剥离导致的炎症、内皮增生和血管痉挛。因此,这些EC-SEAL聚合物可通过抑制在功能失调的内皮细胞中的选择素或ICAM/VCAM的生成而抑制炎症反应。
术语“内皮功能失调”也被称作“内皮细胞(EC)功能失调”、“功能失调的内皮”或“功能失调的内皮细胞”。内皮功能失调可通过显示或暴露在内皮细胞的细胞表面上的ICAM 和VCAM受体或选择素受体而被确定。P-选择素和E-选择素是被暴露的选择素受体的例子,它们由于损伤和炎症而暂时表达在细胞表面,但在功能失调的内皮中长期表达。
在一些实施方式中,内皮功能失调的特征在于渗透的内皮内衬或受损的内皮细胞。在一些实施方式中,所述内皮功能失调的特征在于选择素的缺失。在一些实施方式中,所述内皮功能失调的特征在于选择素表达于内皮细胞表面和暴露于血液循环。在一些实施方式中,患病位点具有炎症。
本文所用的“与内皮功能失调相关的疾病”是指至少部分是由内皮功能失调引起的或诱发内皮功能失调的人类疾病或病症。因此,治疗与内皮功能失调相关的疾病,指治疗所述疾病,恢复功能失调的内皮,或预防或改善由功能失调内皮引起的病症或病症,例如炎症、内膜增生和血栓形成。
如本文所公开的,在一些实施方式中,EC-SEAL偶联物可抑制功能失调的内皮细胞以治疗、抑制或减缓炎症疾病。如Ley, “The role of selectins in inflammation and disease”, Vol. 9, Elsevier Science, (2003)一文所证实的,功能失调的内皮细胞与炎症和其他炎症疾病相关。其他炎症疾病和自免疫疾病的例子包括动脉粥样硬化、冠状动脉疾病、糖尿病、高血压、高胆固醇血症、类风湿性关节炎、系统性红斑狼疮、青光眼、尿毒症,败血症和器官衰竭。
通过抑制选择素受体的生成和暴露VCAM/ICAM受体,EC-SEAL偶联物可用于治疗患有这些暂时的或慢性的疾病的患者。选择素抑制与抑制或减轻这些疾病相关的证据在Ridings et al., “A dual- binding antibody to E- and L-selectin attenuates sepsis-induced lung injury”, Vol. 152, American Journal of Respiratory and Critical Care Medicine, (1995), Weyrich et al., “In Vivo Neutralization of P-Selectin Protects Feline Heart and Endothelium in Myocardial Ischemia and Reperfusion Injury”, Vol. 91, The American Society for Clinical Investigation, (1993) 中得到支持,每一篇文献都以引用方式并入本文。本领域已知某些癌症也与炎症和慢性炎症相关,因此所述EC-SEAL偶联物可用于治疗、抑制或减弱肿瘤细胞的生长。
在一个示例性的实施方式中,本发明的EC-SEAL偶联物可用于血管介入手术,从而例如防止以下任何一种情形或它们的组合:血小板结合至剥离的内皮,血小板激活,血栓生成,剥离内皮导致的炎症,内皮增生和血管痉挛。本文所述的EC-SEAL偶联物还可通过抑制在功能失调的内皮细胞中的选择素或ICAM/VCAM的生成而抑制炎症反应。
给药和制剂
本文所述的EC-SEAL偶联物可被施用至患者(例如,需要治疗以抑制血小板激活的患者,如牵涉到血栓生成、血小板结合至剥离的内皮、由于内皮剥离导致的炎症、内皮增生或血管痉挛的患者)。例如,在各种实施方式中,EC-SEAL偶联物可被静脉内或肌肉内施用。用于胃肠外给药的合适途径包括血管内、静脉内、动脉内、肌内、皮肤、皮下、经皮、皮内和表皮内递送。胃肠外给药的合适方式包括针(包括微针)注射器、输注技术和基于导管的递送。
本文所述的任何EC-SEAL偶联物的药物组合物可被配制用于胃肠外给药或基于导管的药物递送。例如,这样药物组合物可包括:
a)药学上有效量的一种或多种EC-SEAL偶联物;
b)药学上可接受pH缓冲剂,以提供约pH 4.5至约pH 9的pH范围;
c)约0至约300 mM浓度范围的离子强度改性剂;和
d)占总配方重量约0.25%至约10%的浓度范围的水溶性的粘度改性剂,或提供任何单独组分a)、b)、c)或d),或通过a)、b)、c) 和d)的任何组合。
在本文所述的各种实施方式中,用于本文所述的组合物和方法的所述pH缓冲剂为本领域技术人员已知的试剂,包括,如乙酸盐缓冲液、硼酸盐缓冲液、碳酸盐缓冲液、柠檬酸盐缓冲液和磷酸盐缓冲液以及盐酸、氢氧化钠、氧化镁、磷酸二氢钾、碳酸氢盐、氨、碳酸、盐酸、柠檬酸钠、柠檬酸、乙酸、磷酸氢二钠、硼砂、硼酸、氢氧化钠、二乙基巴比妥酸和蛋白质,以及各种生物缓冲液(例如TAPS、Bicine、Tris、Tricine、HEPES、TES、MOPS、PIPES、二甲胂酸盐或MES)。
在本文所述的各种实施方式中,离子强度改性剂包括本领域已知的试剂,如甘油、丙二醇、甘露醇、葡萄糖、右旋葡萄糖、山梨醇、氯化钠、氯化钾和其他电解质。
可用的粘度调节剂包括但不限于,离子和非离子水溶性聚合物;交联的丙烯酸聚合物,例如“卡波姆”聚合物家族,例如可在商业上获得Carbopol®商标的羧基聚亚烷基;亲水性聚合物,如聚环氧乙烷,聚氧乙烯-聚氧丙烯共聚物和聚乙烯醇;纤维素聚合物和纤维素聚合物衍生物,如羟丙基纤维素,羟乙基纤维素,羟丙基甲基纤维素,羟丙基甲基纤维素邻苯二甲酸酯,甲基纤维素,羧甲基纤维素和醚化纤维素;胶,如黄蓍胶和黄原胶;藻酸钠;明胶,透明质酸及其盐,壳聚糖,胶凝糖或其任何组合。通常使用非酸性粘度增强剂(如中性或碱性试剂)以便于实现制剂的所需pH。
在本文所述的各种实施方式中,胃肠外制剂可适当地配制为无菌非水溶液或干燥形式,而与合适的载体(如无菌的、无热源水)联合使用。在无菌条件下胃肠道制剂的制备(如冻干法),可通过本领域的技术人员可用的标准药物技术而轻易完成。
在本文所述的各种实施方式中,用于制备胃肠外制剂的EC-SEAL偶联物的溶解度可通过使用合适制剂技术来增加,例如加入增溶成分,如甘露醇、乙醇、甘油、聚乙二醇、丙二醇、泊洛沙姆和其他本领域已知的成分。
在本文所述的各种实施方式中,胃肠外制剂可被配制用于瞬时和/或缓释给药。缓释制剂包括延迟、持续、脉冲、控制、靶向和程序性释放的制剂。因此,一种或多种EC-SEAL偶联物可被制成固体、半固体或触变性液体,以作为植入型药物贮库施用,而提供活性化合物的缓释作用。这样的制剂的示例包括药物涂层支架和聚乳酸-羟基乙酸共聚物(PLGA)微球。在另一个实施方式中,一种或多种EC-SEAL偶联物或包含一种或多种偶联物的组合物可在适当时持续地被施用。
在本文所述的任何的实施方式中,EC-SEAL偶联物可以通过任何适当方式被血管内地施用至患者(如进入动脉或静脉)。本文所述的各种实施方式中,EC-SEAL偶联物可在血管介入之前、期间或之后被施用进入患者的血管。在各种实施方式中,血管介入(如经皮冠状动脉介入(PCI))可包括例如支架术、动脉粥样硬化切除术、移植术和血管成形术(如气囊血管成形术)。举例来说,所述血管介入可为涉及暂时闭塞动脉(例如冠状动脉或静脉)的血管介入(例如气囊血管成形术),或者它可为不涉及暂时闭塞动脉或静脉的介入(例如非气囊血管成形术,不涉及气囊血管成形术的支架植入术等)。示例性的递送模式可包括导管、胃肠外给药、气囊上的包衣,多孔气囊,药物涂层支架及其任何组合或任何其它已知的在血管介入手术期间进行药物递送的方法。在一个示例性的实施方式中,靶血管可包括冠状动脉,如任何供血至患者心脏组织的血管,包括天然冠状动脉以及例如在先前的冠状动脉旁路手术中移植到患者中的冠状动脉。
在本文所述的任何实施方式中,将要被施用EC-SEAL偶联物且将要进行血管介入手术的靶血管可包含阻塞,例如狭窄或导致通过血管的血流减少的一些其它形式的完全或部分阻塞。因此,所述EC-SEAL偶联物可通过导管(如扩张导管、线上(over-the-wire)血管成形术气囊导管、输注导管、快速更换导管或单轨导管或本领域已知的任何其它导管装置)被传送至血管,导管可经皮插入到患者体内并且通过患者的血管到达靶血管。本领域内具有各种基于导管的设备,包括如美国专利号7,300,454所述的多种实施方式,该专利以引用方式并入本文。在本文所述的使用导管的各种实施方式中,所述用于递送EC-SEAL偶联物的导管可以是与血管介入所用导管相同的导管,或者可以是不同导管(例如,经由相同或不同的皮肤切口经皮插入到患者体内的不同导管,和/或经由相同或不同途径通过患者血管到达靶血管的不同导管)。在另一个实施方式中,所述EC-SEAL 偶联物可被直接注射进入靶血管。在另一个实施方式中,所述EC-SEAL 偶联物可被系统地递送(即,并非直接递送至靶血管,而是通过不基于导管递送的胃肠外给药)。
在血管含有阻塞(如狭窄)的情况下,可通过将EC-SEAL偶联物直接递送至在阻塞位点处或远离阻塞位点或这两处的靶血管而进行给药。在另一个实施方式中,所述EC-SEAL偶联物可被递送至一个或多个临近所述阻塞的位点。示例性地,当EC-SEAL偶联物正被递送时,所述导管尖端可保持静态的,或当EC-SEAL偶联物正被递送时,所述导管尖端可移动(例如,在近端方向上从最初远离阻塞的位置到达或通过阻塞的位置,或到达接近阻塞的位置)。
如上文所述,EC-SEAL偶联物可在血管介入(如经皮冠状动脉介入)前直接被施用进入患者的血管。例如,EC-SEAL偶联物的递送可在血管介入即将开始前进行(例如,在约1小时内,如在血管介入前约30分钟内、约15分钟内、和/或约5分钟内)。任选地,直接至靶血管的EC-SEAL偶联物递送在整个或部分的血管介入手术期间和/或在完成这样的手术后是持续进行的,或直接至靶血管的EC-SEAL偶联物的递送可以在开始血管介入手术前结束并且随后不再重新开始。在如本文所述的任何实施方式中,EC-SEAL偶联物的递送可为持续性的,或者它可通过单次或多次给药而起效。在所述EC-SEAL偶联物被施用至靶血管之前、期间和/或之后,可施用相同EC-SEAL偶联物或一种或多种不同EC-SEAL偶联物。
在本文所述的任何实施方式中,EC-SEAL偶联物可单独施用或与适合的药物载体或稀释剂联合施用。用于EC-SEAL偶联物制剂中的稀释剂或载体组分的选择使它们不减少EC-SEAL偶联物的预期效果。EC-SEAL偶联物制剂可为任何合适的形式。合适的剂量形式的例子包括EC-SEAL偶联物的水溶液,例如,等渗盐水溶液、5%葡萄糖溶液或其他已知的药学上可接受的液体载体(如醇、二醇、酯和酰胺)中的溶液。
EC-SEAL偶联物的合适剂量可通过标准方法确定,如通过在实验动物模型或临床实验中建立剂量-反应曲线。示例性地,EC-SEAL偶联物的适当剂量 (单个药丸给药或逐渐给药)包括约1 ng/kg至10 mg/kg,约100 ng/kg至1 mg/kg,约1 μg/kg至约500 μg/kg,或约100 μg/kg至约400 μg/kg。在每一个这些实施方式中,剂量/kg是指每千克患者质量或体重的剂量。在其他的示例性的方面,有效剂量范围为约0.01 μg至约1000 mg每剂量,约1 μg至约100 mg每剂量,或约100 μg至约50 mg每剂量,或约500 μg至约10 mg每剂量,或约1 mg至约10 mg每剂量,或约1至约100 mg每剂量, 或约1 mg至5000 mg每剂量,或约1 mg 至约3000 mg每剂量,或约100 mg至3000 mg每剂量,或约1000 mg至3000 mg每剂量。
血管介入(如经皮冠状动脉介入治疗)可通过任何常规手术在施用EC-SEAL偶联物之前、期间或之后实施。预期与本发明的方法结合使用的血管介入手术的实例包括支架术、粥样斑块切除术和血管成形术(例如气囊血管成形术)。血管介入手术可为涉及暂时闭塞血管的手术(例如气囊血管成形术),或者可以是不涉及暂时阻塞血管的手术(例如非气囊血管成形术手术,不涉及气囊血管成形术的支架手术等)。示例性的递送模式可包括导管、肠胃外给药、气囊上包衣、通过多孔气囊、药物涂层架及其任何组合,或任何其它已知的在血管介入手术期间进行药物递送的方法。
可预期任何本文所述的制剂可被用来在不存在或存在基于导管的装置的情况下施用EC-SEAL偶联物(如一种或多种类型)。EC-SEAL偶联物可被配制在赋形剂中。在本文所述的任何实施方式中,所述赋形剂具有约0.4 mg/ml至约6 mg/ml的浓度范围。在各个实施方式中,赋形剂浓度范围为约0.5 mg/ml至约10 mg/ml,约0.1 mg/ml至约6 mg/ml,约0.5 mg/ml至约3 mg/ml,约1 mg/ml至约3 mg/ml, 约0.01 mg/ml至约10 mg/ml和约2 mg/ml至约4 mg/ml。
EC-SEAL偶联物的剂量可根据患者病况、被治疗的疾病的状态、给药途径和组织分布以及其他治疗共同使用的可能性而显著变化。施用至患者的有效量是基于体表面积、患者体重或质量及患者病况的医生评估而确定的。在各种示例的实施方式中,有效剂量范围为约1 ng/kg至约10 mg/kg,约100 ng/kg至约1 mg/kg,约 1 μg/kg 至约500 μg/kg,或约100 μg/kg 至约400 μg/kg。在每一个这些实施方式中,剂量/kg是指每千克患者质量或体重的剂量。在其他的示例性的方面,有效剂量范围约0.01 μg 至约1000 mg每剂量,约1 μg 至约100 mg 每剂量,或约100 μg至约50 mg每剂量,或约500 μg 至约10 mg每剂量或约1 mg至10 mg每剂量,或约1至约100 mg每剂量,或约 1 mg至5000 mg每剂量,或约1 mg至3000 mg每剂量,或约100 mg至3000 mg每剂量,或约1000 mg至3000 mg 每剂量。本文所述的各种实施方式中,有效剂量范围为约0.01 μg 至约1000 mg 每剂量,1 μg至约100 mg每剂量,约100 μg至约1.0 mg,约50 μg至约600 μg,约50 μg至约700 μg,约100 μg至约200 μg,约100 μg至约600 μg,约100 μg至约500 μg,约200 μg至约600μg,或约100 μg至约50 mg每剂量,或约500 μg至约10 mg每剂量或约1 mg至10 mg每剂量。在其他的示例的实施方式中,有效剂量可为1 μg、10 μg、25 μg、50 μg、75 μg、100 μg、125 μg、150μg、200 μg、250 μg、275 μg、300 μg、350μg、400μg、450μg、500 μg、550 μg、575 μg、600 μg、625 μg、650 μg、675 μg、700μg、800 μg、900μg、1.0 mg、1.5 mg、2.0 mg、10 mg、100 mg或100 mg至30克。
任何用于施用EC-SEAL偶联物的有效治疗方案都可被使用。例如,所述EC-SEAL偶联物可以单一剂量、或以多剂量每日治疗方案被施用。进一步地,交替方案(例如每周一至五天)可以用作每日治疗的替代方案。
在某些实施方式中,还可配制混合胶束,其包括胶原结合糖胺聚糖(如US 2013/0190246所述的DS-SILY偶联物)和本文所述的一种或多种类型的EC-SEAL偶联物。所述DS-SILY偶联物和EC-SEAL偶联物都可具有烷基尾部,因而可通过组合DS-SILY-尾部:EC-SEAL-尾部(如 1:1)而生成混合胶束,以结合至内皮或暴露的ICAM、VCAM、选择素和/或胶原。所述烷基尾部的结构可被优化而有利于胶束形成和胶束随时间的解离。
在本文的各种实施方式中,以多次注射EC-SEAL偶联物的方式治疗患者。在一种实施方式中,患者被多次注射(约2至约50次)EC-SEAL偶联物,例如以12-72小时间隔或48-72小时间隔注射。在首次注射后,间隔数天或数月,可对患者进行额外的EC-SEAL偶联物注射。
本文所述的任何实施方式中,应当理解的是,两种或更多种EC-SEAL偶联物(在肽部分、多糖部分或这两部分存在区别)的组合物,可用于替换单一EC-SEAL偶联物。
还应当意识到的是,在上述实施方式中,所述化合物、组合物和方法的某些方面以在列表中的替代性方案的方式呈现。例如,可选择任何一种或多种GAG和肽。因此,应当理解本发明的各种替换的实施方式包括这些列表的单独个体,以及这些列表的各种子集。这些组合的每一个都应当被理解为已通过列表的方式而在本文被描述。
EC-SEAL偶联物可以在形成制剂之前、期间和/或之后被灭菌。本文所用的“灭菌”是指通过去除不想要的污染物(包括但不限于内毒素和感染剂)来对EC-SEAL偶联物进行消毒。
在各种示例性实施方式中,可使用常规灭菌技术对EC-SEAL偶联物进行消毒和/或灭菌,包括环氧丙烷或环氧乙烷处理、气体等离子体灭菌、γ辐照、电子束和/或过酸(如过乙酸)灭菌。可使用不会负面影响EC-SEAL偶联物的结构和生物特性的灭菌技术。示例性的灭菌技术包括将EC-SEAL偶联物暴露于过乙酸、1-4兆拉德γ辐射(或1-2.5兆拉德的γ辐射)、环氧乙烷处理、无菌过滤或气体等离子体灭菌。在一个实施方式中,所述EC-SEAL偶联物可进行一个或多个灭菌过程。例如,所述EC-SEAL偶联物可进行无菌过滤。所述EC-SEAL偶联物可被分配到任何类型的容器(可被包装在塑料包装或箔包装中)中,并且可在这样放置在容器中之后进一步被灭菌。
EC-SEAL偶联物可与矿物质、氨基酸、糖、肽、蛋白质、维生素(例如抗坏血酸)、层粘连蛋白、胶原、纤连蛋白、透明质酸、纤维蛋白、弹性蛋白、聚集蛋白聚糖、生长因子(例如表皮生长因子、血小板衍生生长因子、转化生长因子β或成纤维细胞生长因子)、糖皮质激素(例如地塞米松)、粘弹性改变剂(例如离子型和非离子型水溶性聚合物)、丙烯酸聚合物、亲水性聚合物(如聚环氧乙烷、聚氧乙烯-聚氧丙烯共聚物和聚乙烯醇)、纤维素聚合物和纤维素聚合物衍生物(如羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、羟丙基甲基纤维素邻苯二甲酸酯、甲基纤维素、羧甲基纤维素和醚化纤维素)、聚乳酸、聚乙醇酸、乳酸和乙醇酸的共聚物或其他天然的和合成的聚合物试剂。
试剂盒
EC-SEAL偶联物可以一种或多种类型的试剂盒形式提供。所述试剂盒可包括用一个或多个容器包装,至少一个容器含有EC-SEAL偶联物。所述试剂盒还包含试剂盒组分使用说明。在一个实施方式中,所述试剂盒包含容纳一种或多种EC-SEAL偶联物的一个或多个器皿、小瓶或容器。所述试剂盒还可包括任何下述组分:一种或多种制剂或浓度(剂量)的EC-SEAL偶联物、缓冲液、灭菌剂或消毒剂、注射器、针、蛋白质或多糖,和/或描述使用试剂盒试剂的方法的说明材料。在任何这些实施方式中,所述试剂盒可含有选自导管、支架、气囊及其组合的组分。EC-SEAL偶联物可在例如缓冲液或水中被冻干。
在本文所述的任何实施方式中,用于进行血管介入的试剂盒(如上述试剂盒)是可预期的。所述试剂盒包括导管或支架以及一种或多种EC-SEAL偶联物。EC-SEAL偶联物可以任何上文讨论的制剂形式提供,并且提供的剂量为进行单次血管介入的所需量,如约1 ng/kg至约10 mg/kg,约100 ng/kg至约1 mg/kg,约1 μg/kg至约500 μg/kg,或约100 μg/kg至约400 μg/kg。在每一个这些实施方式中,剂量/kg是指每公斤的患者质量或体重的剂量。在本文所述的各种实施方式中,在所述制剂中提供的有效剂量的范围为约0.01 μg至约1000 mg每剂量,约1 μg至约100 mg每剂量,或约100 μg 至约50 mg每剂量,或约500 μg至约10 mg每剂量或约1 mg 至约10 mg每剂量,或约1至约100 mg每剂量,或约1 mg至约5000 mg每剂量,或约1 mg 至3000 mg每剂量,或约100 mg至3000 mg每剂量,或约1000 mg至3000 mg每剂量。
任何这些实施方式还预期提供制品。在本文所述的任何试剂盒或制品实施方式中,所述试剂盒或制品可包含一个剂量或多剂量的EC-SEAL偶联物。EC-SEAL偶联物可在初级容器中,例如玻璃小瓶(例如具有橡胶塞和/或铝撕开密封件的琥珀色玻璃小瓶)。在另一个实施方式中,初级容器可为塑料的或铝制的,并且初级容器可被密封。在另一个实施方式中,初级容器可以被包含在次级容器中以进一步保护组合物免受光照。
在本文所述的任何实施方式中,所述试剂盒或制品可包含使用说明。其他适当的试剂盒或制品组分包括赋形剂、崩解剂、粘合剂、盐、局部麻醉剂(例如利多卡因)、稀释剂、防腐剂、螯合剂、缓冲剂、张度剂、抗菌剂、润湿剂、乳化剂、分散剂、稳定剂等。这些组分可单独获得或与EC-SEAL偶联物混合。本文所述的任何组合物实施方式可用于制备所述试剂盒或制品。
在本文所述的不同实施方式中,所述试剂盒可含有不止一个的导管或支架以及多个单独的容器,每个容器都含有进行单次或多次血管介入所需的量的无菌EC-SEAL偶联物制剂。任何类型的支架或导管都可被包括在所述试剂盒中,包括例如扩张导管、线上血管成形术气囊导管、输注导管、快速更换导管或单轨导管等。
以下为替换性实施方式。
1. 一种EC-SEAL偶联物,其包含肽配体、糖胺聚糖和任选的烷基尾部。
2. 根据声明1所述的EC-SEAL偶联物,其包含下式的结构:
a. 烷基-GAG(P)n
b. 其中烷基为C2-18烷基链;
1. GAG为糖胺聚糖,如藻酸盐、琼脂糖、葡聚糖、硫酸葡聚糖、软骨素、硫酸软骨素、皮肤素、硫酸皮肤素、肝素、硫酸乙酰肝素、角蛋白、硫酸角质素、透明质酸或其组合;
2. P为具有约5至约40个氨基酸的肽,其可结合至选择素和ICAM或VCAM;并且
3. n为3-50的整数。
3. 根据声明1或2所述的EC-SEAL偶联物,其中所述糖胺聚糖(如所述GAG基团)为肝素、硫酸软骨素和硫酸乙酰肝素。
4. 根据声明1-3任一项所述的EC-SEAL偶联物,其中EC-SEAL偶联物结合至内皮细胞。
5. 根据声明1-4任一项所述的EC-SEAL偶联物,其中所述EC-SEAL偶联物结合至哺乳动物血管中的内皮组织。
6. 根据声明1-5任一项所述的EC-SEAL偶联物,其中所述EC-SEAL偶联物抑制血小板激活,抑制血小板结合至哺乳动物血管,抑制哺乳动物血管中的内膜增生、炎症,抑制血栓形成,抑制血管痉挛,刺激内皮细胞增殖,结合至哺乳动物血管中暴露的选择素、ICAM、VCAM或其组合。
7. 根据声明1-6任一项所述的EC-SEAL偶联物,其中EC-SEAL偶联物抑制或降低溶血患者中动静脉瘘手术失败的发生率。
8. 根据声明1-7任一项所述的EC-SEAL偶联物,其中EC-SEAL偶联物具有烷基尾部(如烷基基团),其为C3-16烷基链、或C4-15烷基链、或 C5-14 烷基链、或C3-12烷基链。
9. 根据声明1-8任一项所述的EC-SEAL偶联物,其中糖胺聚糖(如GAG基团)为硫酸皮肤素、葡聚糖、透明质酸、肝素或其组合。
10. 根据声明1-9任一项所述的EC-SEAL偶联物,其中所述糖胺聚糖(如GAG基团)为硫酸皮肤素。
11. 根据声明1-10任一项所述的EC-SEAL偶联物,其中肽配体(如P基团)为约5至约35个氨基酸的肽,或约5至约30个氨基酸的肽,或约5至约25个氨基酸的肽。
12. 根据声明1-11任一项所述的EC-SEAL偶联物,其中肽配体为与以下任何序列具有至少80%序列同一性的肽:IELLQAR (SEQ ID NO: 1),IELLQARGSC (SEQ ID NO: 2),IDLMQAR (SEQ ID NO: 3),IDLMQARGSC (SEQ ID NO: 4), QITWAQLWNMMK (SEQ ID NO: 5),QITWAQLWNMMKGSC (SEQ ID NO: 6)、NAFKILVVITFGEK (SEQ ID NO: 7),NAFKILVVITFGEKGSC (SEQ ID NO: 8), ITDGEA (SEQ ID NO: 9); ITDGEAGSC (SEQ ID NO: 10),DGEATD (SEQ ID NO: 11)或DGEATDGSC (SEQ ID NO: 12)。
13. 根据声明1-12任一项所述的EC-SEAL偶联物,其中所述肽配体为与以下任何序列具有至少80%、或至少85%、或至少90%、或至少95%序列同一性的肽:IELLQAR (SEQ ID NO: 1),IELLQARGSC (SEQ ID NO: 2),IDLMQAR (SEQ ID NO: 3),IDLMQARGSC (SEQ ID NO: 4),QITWAQLWNMMK (SEQ ID NO: 5),QITWAQLWNMMKGSC (SEQ ID NO: 6)、NAFKILVVITFGEK (SEQ ID NO: 7),NAFKILVVITFGEKGSC (SEQ ID NO: 8),ITDGEA (SEQ ID NO: 9), ITDGEAGSC (SEQ ID NO: 10)、DGEATD (SEQ ID NO: 11)或DGEATDGSC (SEQ ID NO: 12)。
14. 根据声明1-13任一项所述的EC-SEAL偶联物,其中所述肽配体通过交联剂被连接至糖胺聚糖。
15. 一种组合物,其包含声明1-14任一项所述的EC-SEAL偶联物。
16. 根据声明15所述的组合物,其包含赋形剂或载体。
17. 根据声明15或16所述的组合物,其包含药学上可接受的赋形剂或载体。
18. 根据声明15-17任一项所述的组合物,其被配制以用于胃肠外的、血管内的、静脉内的、动脉内的、肌内的、皮肤的、皮下的、经皮的、皮内的和/或表皮内给药。
19. 根据声明15-18任一项所述的组合物,其被配制以用于使用针或输注装置的胃肠外给药。
20. 根据声明15-19任一项所述的组合物,其被配制成通过导管、作为气囊涂层、通过多孔气囊或作为支架涂层而给药至哺乳动物。
21. 用于血管介入的方法,该方法包括在血管介入期间或之后将声明1-14任一项所述的EC-SEAL聚合物或声明15-20任一项所述的组合物施用至哺乳动物。
22. 根据声明21所述的方法,其中所述EC-SEAL聚合物结合至哺乳动物血管中的内皮组织。
23. 根据声明21或22所述的方法,其中所述EC-SEAL聚合物减轻内皮功能失调。
24. 根据声明21-23所述的方法,其中所述EC-SEAL聚合物抑制血小板活化,抑制血小板与哺乳动物血管结合,抑制哺乳动物血管中的内膜增生、炎症,抑制血栓形成,抑制血管痉挛,刺激内皮细胞增殖,结合至暴露于哺乳动物血管中的选择素、ICAM、VCAM或其组合。
25. 根据声明21-24任一项所述的方法,其中EC-SEAL聚合物抑制或降低溶血患者中动静脉瘘手术失败的发生率。
26. 一种试剂盒,包含如声明1-14,任一项所述的EC-SEAL聚合物或声明15-20任一项所述的组合物,以及使用EC-SEAL聚合物或所述组合物的使用说明。
27. 根据声明26所述的试剂盒,进一步包含缓冲液、灭菌剂或消毒剂、注射器、针、蛋白质或多糖、导管、支架、气囊及其组合。
下述非限制性的例子阐明本发明各方面的进步。
实施例
实施例1:结合选择素和ICAM的肽偶联物
三种结合选择素的肽和三种结合ICAM的肽被选择用于EC-SEAL分子的研发。所述肽的选择基于以下条件:
1)亲水性,其可促进被用来合成偶联物分子的偶联化学,以及确保终产物能够溶于水性溶液(包括血液)中;
2)半胱氨酸硫醇偶合至官能化的糖胺聚糖的可用性;以及
3)对于主要靶标的相对结合亲和力。
表2中的肽被选择用于EC-SEAL分子的研究和潜在发展。
表2. 靶定选择素和ICAM的肽序列
*氨基酸 GSC 将被添加至每一个肽的C末端以用于结合。
# 肽结合至E-选择素和S-选择素。
实施例2:结合选择素的EC-SEAL结合至内皮细胞
此实施例描述了第一代EC-SEAL分子,其包括结合至选择素的肽,该选择素偶合至硫酸皮肤素,还说明了此EC-SEAL分子结合至上皮细胞。
方法
肽聚糖合成:通过高碘酸盐氧化氧化硫酸皮肤素(DS),其中通过不同量的偏高碘酸钠控制氧化程度。避光于室温氧化2小时之后,被氧化的硫酸皮肤素通过使用填充有Bio-gel P-6 (BioRad)的柱的尺寸排阻色谱被脱盐进1xPBS pH 7.2。杂合双功能交联剂3-马来酰亚胺基丙酸酰肼(BMPH)以超过硫酸皮肤素的量30倍摩尔的量被加至被氧化的硫酸皮肤素,然后反应混合物在室温反应4小时而同时避光。中间体硫酸皮肤素-交联剂产物然后通过使用Bio-gel P-6柱和1xPBS pH 7.2作为运行缓冲液的尺寸排阻色谱纯化过量的交联剂。附着至硫酸皮肤素的交联剂的数量通过交联剂的消耗来计算,其从215 nm交联剂峰面积而测定,其通过使用交联剂浓度与吸光度的标准曲线而光谱学地测定。
游离的肽IELLQARGC (SEQ ID NO: 105)(有时称为QAR)以10 mg/mL的浓度被溶解进二甲基甲酰胺(DMF),并以多于附着的交联剂的数量1摩尔的量被加入。在室温孵育反应混合物2小时。终产物DS-QARn通过使用Bio-gel P-6柱及 Millipore 水作为运行缓冲液的尺寸排阻色谱而被纯化。该终产物立即被冷冻、冻干、并储存在-20 C直至进一步测试。
生物素标记的糖胺聚糖也被合成,其通过每摩尔DS-BMPH的1摩尔QAR生物素反应1h,随后通过加入未标记的QAR,以完成反应并生成DS-QARn-生物素。
细胞培养:人主动脉内皮细胞(HAEC) (Invitrogen)被培养在生长培养基(补充有低血清生长补充剂的培养基200,Invitrogen)中。来自通道3-5的细胞被用于所有实验。生长培养基被用于所有实验,除非另有说明。
DS-QAR至HAEC的结合:以1x105个细胞/cm2 将HAEC播种在培养基中至Ibidi血管生成μ-载玻片(Ibidi)上,且允许粘附24小时。吸出生长培养基,并在含有1 ng/mL肿瘤生成因子-α (TNF-α)的生长培养基中孵育细胞4小时。吸出TNF-α刺激的培养基,并将在具有150 mM氯化钙的Tris缓冲的盐水(TBS)中的50 μM EC-SEAL20-生物素加入至每一个孔。在37°C孵育细胞15min,并用TBS漂洗3次。然后在室温用在 TBS中的1% BSA封闭细胞30分钟。使用1 μg/mL SYTOX 绿(Invitrogen)对细胞核染色10分钟。用含有1% BSA的TBS对平板漂洗3次。使用链霉亲和素-Dylight 633(Thermo Scientific)测定EC-SEAL20-生物素。使用含有1% BSA bef的TBS对平板漂洗3次。使用具有60x物镜的Olympus FV1000 共聚焦显微镜使细胞可视化。将缺乏TNF-α刺激的细胞用作对照。
结果
被氧化的硫酸皮肤素(DS, MW 60KDa)被用作支架,用于将平均结合20个选择素的肽(每一个带有序列IELLQAR, SEQ ID NO: 106)连接至每一个硫酸皮肤素分子。这样的构建体为测试的第一代EC-SEAL分子。
为了评价该第一代EC-SEAL分子的结合,将人主动脉内皮细胞暴露至5 ng/ml TNFα 4小时来诱导炎症和E-和P-选择素的上调,然后用2 mg/ml生物素-EC-SEAL处理细胞1小时。作为对照,将一些人主动脉内皮细胞暴露至等体积的PBS 4小时,然后用2 mg/ml 生物素-EC-SEAL处理1小时。在这样的处理之后,细胞被漂洗、固定及用avidin-alexafluor探测。
图1A显示了带有结合的EC-SEAL分子(红色,黄色箭头指向EC-SEAL围绕的某些细胞)的TNFα刺激的内皮细胞的图像(细胞核-绿色)。图1B显示了用EC-SEAL处理的PBS刺激的内皮细胞的图像,其显示在没有诱导炎症和E-选择素和P-选择素的上调时,少量或没有EC-SEAL分子被结合。
因此,第一代EC-SEAL结合到这些人主动脉细胞,但没有结合到在缺少TNF-α的情况下被培养的内皮细胞(图1)。
实施例3:肽与糖胺聚糖支架的最佳比率
此实施例描述了可被用来评价肽配体与糖胺聚糖(GAG)支架分子的最佳比率的实验。
为了确定肽特性和每个GAG最佳的肽比率,首先检测了每个支架的肽的数量,然后评价了结合选择素与ICAM的肽的不同比率。
使用硫酸皮肤素作为用于偶联物的支架,对每一个结合选择素的肽和每一个结合ICAM的肽,生成不同的偶联物分子。使用硫酸皮肤素骨架和每个骨架10、15、20或30个肽(仅一种类型的结合选择素的肽或仅一种类型的结合ICAM的肽),制备偶联物分子。如Paderi et al., Biomaterials 32:2516-23 (2011)所述,每一个分子也将含有平均一个肽,其标记有生物素标签,以用于监测所述分子的存在。
HUVEC细胞可被用来评价所述在TNF-α激活的和未激活的内皮细胞上的覆盖的程度。TNF-α激活E-选择素和ICAM 合成(Sakhalkar et al., Proc. Nat’l. Acad. Sci. 100:15895-900 (2003))。TNF-α激活的和未激活的内皮细胞分别与选择的肽偶联物混合。对于结合到激活的内皮细胞但不结合到未激活的内皮细胞的那些偶联物,在4小时然后每日监测细胞覆盖的程度7日。每隔一天会改变培养基,并进行持续的TNF-α刺激。可以通过两种方式评估通过肽偶联物的所述细胞的覆盖。首先,可以通过用荧光抗生物素蛋白进行的染色来评估细胞覆盖。第二,可以评估细胞(例如通常会结合至被激活的内皮细胞的HL60细胞)的结合 (Fukuda et al., Cancer Res 60:450-6 (2000))。可以用白细胞细胞系HL60刺激内皮细胞培养物,并且可以评价结合至被激活的内皮的HL60的抑制。如Scott et al., PloS one 8:e82456 (2013))所述,可以使用Meso Scale Discovery (MSD)评估细胞因子分泌。下调的细胞因子分泌是减少的炎症的标志Butterfield et al., Biochemistry 49:1549-55 (2010))。
以下EC-SEAL偶联物(肽偶联物)已经被如上所述地合成和测试。
*每一个肽包括用于偶联至DS的GC。
在上述表格中,DS代表硫酸皮肤素,IDL (IDLMQARGC(SEQ ID NO: 107))、IEL (IELLQARGC(SEQ ID NO: 108))和QIT (QITWAQLWMMKGC(SEQ ID NO: 109)) 为结合选择素的肽,而ITD (ITDGEAGCSEQ ID NO: 114) 和 DGE (DGEATDGC(SEQ ID NO:110))为结合细胞内粘附分子(ICAM)的肽。每一个分子平均含有一个生物素化的肽以用于标记目的。
为了测定每一个EC-SEAL偶联物对内皮细胞(EC)的相对结合亲和力,播种EC以形成96孔板中的单层细胞。然后用在细胞培养基中的5ng/mL的肿瘤坏死因子-α (TNF-α)刺激培养物4小时。去除培养基之后,用具有150 mM氯化钙的tris缓冲盐水(TBS)(“对照”)或30 µM的具有150 mM氯化钙的TBS中的EC-SEAL的每个变体(“ABC-##”)处理细胞1小时。去除处理物,漂洗细胞被并将链霉亲和素-HRP (1:200 在TBS中的 1% 牛血清清蛋白 (BSA))加入至每一个孔并且在室温孵育20分钟。漂洗之后,将颜色试剂的底物溶液加入至每一个孔(1:1过氧化氢:四甲基联苯胺)并再次在室温孵育20分钟。使用2N硫酸 (H2SO4)停止终反应,随后在450nm和540nm 在M5 Plate Reader 上读取吸光度。
图2和3显示了如本文所述的用于EC-SEAL偶联物的内皮细胞结合实验结果。这些结果表明,EC-SEAL偶联物确实结合至EC,并且每一个肽群组(以及在每一个肽群组中的变体)具有对TNF-α刺激的细胞的不同的结合亲和力。具体地,IEL(结合选择素)和DGE(结合 ICAM)似乎表现出最好的结合,而QIT(结合选择素)似乎具有最少的结合。还值得注意的是,在所有肽群组中,每个DS分子30个肽的处理倾向具有降低的结合亲和力。
已经考虑的是,靶定选择素和ICAM受体都将增加结合亲和力,因此使用硫酸皮肤素(DS)合成并测试了同时具有结合选择素和ICAM的肽的EC-SEAL偶联物。所述EC-SEAL偶联物具有每个DS平均约10个IEL (IELLQARGC(SEQ ID NO: 108))肽和平均约10个DGE (DGEATDGC(SEQ ID NO: 110))肽。测试了所述EC-SEAL偶联物(简写为IEL/DGE-10,10),以确定至EC的结合(与结合单个受体的肽EC-SEAL偶联物相比)。如上所述地完成细胞播种和刺激,并且施加3 µM处理物,以确定相对结合亲和力(图4)。这些结果表明,与各个结合单一的选择素或ICAM的变体(具有每个GAG总共相约的肽配体)相比,结合组合的选择素/ICAM的分子确实展现出对EC的更好的结合。
实施例4:用于EC-SEAL的制剂和递送方法
此实施例描述了在内皮细胞激活提高的情况下,便于通过如本文所述的EC-SEAL偶联物包覆细胞方法。可以使用EC-SEAL偶联物的纳米颗粒,其将缓慢地在体内解离以递送额外的游离的EC-SEAL至血管的腔。
下文描述了用脂肪族尾部末端官能化DS以诱导胶束形成的方法。所有GAG都具有还原末端,对其可以实现容易的偶联。我们将利用在还原末端的偶联来形成在体内~48小时解离的胶束。这些胶束被设计来在前48小时内结合至暴露的内皮组织并释放额外的EC-SEAL。在额外的内皮细胞活化或丧失的情况下,所述胶束提供额外的EC-SEAL来包覆新剥离的区域,并且在稍后的时间点包覆上调选择素和ICAM的内皮细胞。
胶束合成:为了将胺官能团添加到DS的还原末端,将所述DS在室温下在碳酸氢铵的饱和溶液中孵育4-5小时,随后进行延长的冻干以除去未反应的碳酸氢铵,如我们先前所做的那样(Butterfield et al., Biochemistry 49:1549-55 (2010))。官能化后,疏水尾部将被偶联至GAG(例如硫酸皮肤素),然后如上所述将肽配体或结合选择素和ICAM的组合的肽偶联至GAG(例如硫酸皮肤素)。所述尾部将迫使EC-SEAL烷基尾在水性环境中成为胶束。也可以制成和使用如下混合胶束,其包括结合有如本文所述的一种或多种EC-SEAL偶联物的如在US 2013/0190246中 所述的DS-SILY偶联物。DS-SILY和EC-SEAL偶联物都具有烷基尾部。通过组合1:1 DS-SILY-尾部:EC-SEAL-尾部,生成将结合至内皮或暴露的ICAM、VCAM、选择素和/或胶原的混合胶束。在递送后48小时内,DS-SILY-尾部和EC-SEAL-尾部分子的释放可以包覆任何新暴露的胶原或激活的内皮细胞。可以对于胶束形成和随时间的胶束解离而优化所述烷基尾部结构。
通过利用烷基链(例如异丙基(C3)、丁基(C4)、己基(C6)、辛基(C8)、癸基(C10)或十二烷基缩水甘油醚)的缩水甘油醚偶联物来实现胺修饰的硫酸皮肤素的疏水性。在缩水甘油醚和胺之间发生的反应优先于其它可用的亲核试剂(例如水或羟基单元)发生(Shechter et al., Industrial & Engineering Chemistry 48:94-7 (1956))。可以通过选择C3至C12范围内的正确的烷基尾长度来控制得到的烷基DS的相对疏水性。DS-胺和烷基缩水甘油醚之间的反应将如下进行。在搅拌下将DS (1.0 g)分散于70 mL的异丙醇中。随后将预定的摩尔量的烷基缩水甘油醚加入至所述混合物,然后在63 °C反应3h。通过过滤收集得到的烷基化的DS,然后用甲苯清洗以去除过量的未反应的烷基缩水甘油醚。所述烷基化的DS将被疏水化来获得干燥材料。此方法已经成功地被用于合成壳聚糖烷基化物,其在随后的磺化中形成能够促进溶解性差的鱼藤酮的溶解度的胶束(Lao et al., Carbohydrate Polymers 82:1136-42 (2010))。
胶束特征:CMC /直径/ζ电位: 使用zetasizer仪器测定烷基化的-DS的临界胶团浓度(CMC)。与高于CMC的浓度相反,在低于CMC的浓度,散射光的强度与水的强度没有显著差异。此外,获得的自相关函数显示出较差的信噪比,并且没有获得尺寸分布信息(查看网站quimica.udea.edu.co /~coloides/Anexo1.pdf). 2006 (2006) )。还将在不同条件下,在存在和不存在血清蛋白的情况下,表征胶束尺寸和ζ电位,以研究蛋白质的影响和相互作用 (Takeuchi K-I et al., FEBS letters 397:207-9 (1996))。
胶束解离:荧光(使用M5板读数器监测在各个波长的发射光谱)将被用于测定胶束解离,其使用根据环境的疏水性显示不同的荧光光谱的芘(Wilhelm et al., Macromolecules 24:1033-40 (1991))。此技术将使得我们能够通过测定在芘荧光上的变化,测定存在血清和全血的情况下在内皮细胞表面上的胶束的解离。重要的是,可用生物素标记所述EC-SEAL,用于在胶原内皮细胞表面上的探测。这将允许验证随着胶束解离,EC-SEAL偶联物结合至其靶标。
胶束解离和结合至胶原和激活的内皮细胞:发明人以前使用过ibidi Flow试剂盒(Martinsried, Germany)以评价细胞结合至胶原表面(Paderi et al., Biomaterials 32:2516-23 (2011))。相似的步骤将被用于评价胶束结合,以及评价胶束解离,以及在流动下在胶束解离时DS-SILY-尾和EC-SEAL-尾结合至胶原和活化的内皮细胞。简略地说,使用纤维状胶原、或使用纤维状胶原和激活的内皮细胞斑块涂覆每一个通道。过量的胶原和未结合的内皮细胞将被从流动通道去除,其通过用穿过通道的PBS进行大量冲洗。在37 ºC以2 mM的浓度在所述通道中孵育胶束15 min,并用PBS冲洗未结合的胶束。对照通道将由未用胶束处理的胶原和内皮细胞组成。以5.6 mL/h的流速通过注射器泵将全血推动通过流动通道,该流速对应于1000s-1的生理相关剪切速率(Badimon et al., Circulation 78:1431-42 (1988))。对于短期实验,在5 min的流动后,以相同的流速将PBS pH7.4推动穿过10 min来清洗未结合的细胞。对于长期实验,在暴露至流动5 min后,血液将被替换为完全培养基,并且细胞将被放回至培养箱24h,然后再次暴露至流动5 min,成像并放回至培养箱另外24小时。然后它们将被再次暴露至流动5 min,然后最终进行成像。通过10X物镜对每个流动通道获取明场和荧光图像。分别使用ImageJ(NIH,Bethesda,MD)和MatLab(Mathworks,Natick,MA)对图像进行阈值化和量化,用于胶束覆盖、细胞覆盖,并且通过应用抗生物素蛋白-Cy5的添加步骤进行成像以用于DS-SILY-尾或EC-SEAL-尾覆盖。
一旦优选的制剂被决定(形成胶束,解离~48小时,结合至胶原和激活的内皮细胞),我们进一步挑战系统,其通过在递送含有胶束和游离的DS-SILY和游离的EC-SEAL的制剂时评估胶束,以确保胶束的结合在游离的DS-SILY和EC-SEAL的存在下发生。因为所述胶束具有每个单元更大量的结合肽,没有理由认为所述胶束将不能有效地与游离分子竞争以用于结合。但是,50:50、75:25和90:10的比率的游离分子:胶束将会在上述段落所述的流动系统中被评估,以确定支持游离分子和胶束的有效结合的比率。
最好地支持游离分子和胶束的结合的比率将在30分钟、24小时和48小时用全血来挑战,以评估血小板结合,如我们已经对DS-SILY分子做的一样(Paderi et al., Biomaterials 32:2516-23 (2011))。所述比率也将在HUVEC和白细胞细胞系HL60共培养模型中被评估,其中HUVEC用TNF-a挑战,用最佳比率处理,用HL60挑战和评价DS-SILY/EC-SEAL涂覆、HL60结合和细胞因子生成。
在完成这样的步骤后,DS-SILY和 EC-SEAL尾部尺寸被适当地调节来引导胶束形成,以及允许48小时期间内的解离。我们也将评价在从胶束中解离之后,DS-SILY和EC-SEAL分别结合至胶原和激活的内皮细胞的能力。基于此,我们能进一步调节被偶联至用于形成胶束的DS-SILY-尾部和EC-SEAL-尾部的选择素和ICAM肽的数量,以优化结合至新暴露的胶原和活化的内皮细胞的概率。
替代的方法:如果烷基化发生在还原性末端之外的位置,我们将在在还原性末端制造新的芳香胺之前首先乙酰化所有的胺。这将会如下进行,在室温下将1g的DS溶解在10 mL的甲酰胺中,并加入预定的摩尔量的吡啶和乙酸酐。将反应混合物搅拌12小时,然后用蒸馏水透析(MWCO 3,500Da)3天,并冷冻干燥。这已经被成功地应用于相似的硫酸软骨素以获得所述硫酸软骨素的乙酰化(Li & Na, Biomacromolecules 12:1724-30 (2011))。这些反应已证明是有效的,其以受控的方式将烷基链加至DS,导致自我聚集成胶束和纳米微粒。
如果必要,可以使用替代的耦合化学。由于胺易于通过碳二亚胺化学反应,所以脂肪酸可以利用1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺(EDC)作为中间体与DS-胺直接反应。为了实现此反应,将DS-胺(1g)溶解在适当酸性的水性溶液(~100ml,pH 5-6)中,并用85 mL甲醇稀释。所选的脂肪酸将以预定的摩尔比加入至DS溶液,然后在室温下搅拌的同时逐滴加入EDC甲醇溶液(1:1摩尔EDC:脂肪酸)。24h后,将反应物倒入过量的甲醇中以进行沉淀。沉淀的物质依次用甲醇和乙醚进行洗涤,然后冻干。此前,已经通过该方法将亚油酸(LA)结合至壳聚糖,以获得自聚集的LA-壳聚糖纳米颗粒,其在加入1M NaCl溶液时自发形成尺寸范围为200-600nm的纳米颗粒(Chen et al., J. Agricult. & Food Chem. 51:3135-9 (2003))。
在ζ尺寸、共聚焦显微镜和ELISA不足以表征相互作用的情况下,可以使用其他的表征技术,包括在胶原、选择素、ICAM和/或VCAM表面上的胶束的场发射扫描电子显微镜。在芘不足够灵敏以允许监测胶束解离的情况下,可以使用先前已用来测定细胞-多糖相互作用的荧光偶联的多糖纳米颗粒(Huang et al., Pharmaceutical research 19:1488-94 (2002)。这通过将荧光团直接结合到烷基化的硫酸皮肤素来实现。各种各样的荧光染料可以被结合至硫酸皮肤素,包括将会可能地允许体内成像的近红外染料(Leevy et al., Bioconjugate chemistry 19:686-92 (2008))。
参考文献
1.Allon M. Current management of vascular access. Clin J Am Soc Nephrol 2007;2:786-800.
2.Roy-Chaudhury P, Lee, T. Vascular Stenosis: Biology and Interventions. Current Opinion in Nephrology and Hypertension 2007;16:516-22.
3.Roy-Chaudhury P, Kelly BS, Melhem M, et al. Vascular access in hemodialysis: issues, management, and emerging concepts. Cardiol Clin 2005;23:249-73.
4.Roy-Chaudhury P, Sukhatme VP, Cheung AK. Hemodialysis Vascular Access Dysfunction: A Cellular and Molecular Viewpoint. Journal of the American Society of Nephrology 2006;17:1112-27.
5.Pisoni RL, Arrington CJ, Albert JM, et al. Facility hemodialysis vascular access use and mortality in countries participating in DOPPS: an instrumental variable analysis. Am J Kidney Dis 2009;53:475-91.
6.Lee T, Chauhan V, Krishnamoorthy M, et al. Severe venous neointimal hyperplasia prior to dialysis access surgery. Nephrology, dialysis, transplantation : official publication of the European Dialysis and Transplant Association - European Renal Association 2011;26:2264-70.
7.Chang CJ, Ko PJ, Hsu LA, et al. Highly increased cell proliferation activity in the restenotic hemodialysis vascular access after percutaneous transluminal angioplasty: implication in prevention of restenosis. Am J Kidney Dis 2004;43:74-84.
8.Roy-Chaudhury P, Khan R, Campos B, et al. Pathogenetic role for early focal macrophage infiltration in a pig model of arteriovenous fistula (AVF) stenosis. The journal of vascular access 2013;0:0.
9.Rajabi-Jagahrgh E, Krishnamoorthy MK, Roy-Chaudhury P, et al. Longitudinal Assessment of Hemodynamic Endpoints in Predicting Arteriovenous Fistula Maturation. Seminars in dialysis 2012.
10. Krishnamoorthy MK, Banerjee RK, Wang Y, Choe AK, Rigger D, Roy-Chaudhury P. Anatomic configuration affects the flow rate and diameter of porcine arteriovenous fistulae. Kidney Int 2012;81:745-50.
11. Lee T, Roy-Chaudhury P. Advances and new frontiers in the pathophysiology of venous neointimal hyperplasia and dialysis access stenosis. Adv Chronic Kidney Dis 2009;16:329-38.
12. Krishnamoorthy MK, Banerjee RK, Wang Y, et al. Hemodynamic wall shear stress profiles influence the magnitude and pattern of stenosis in a pig AV fistula. Kidney Int 2008;74:1410-9.
13. Badimon L, Badimon JJ, Turitto VT, Vallabhajosula S, Fuster V. Platelet thrombus formation on collagen type I. A model of deep vessel injury. Influence of blood rheology, von Willebrand factor, and blood coagulation. Circulation 1988;78:1431-42.
14. Kim MC, Nam JH, Lee CS. Near-wall deposition probability of blood elements as a new hemodynamic wall parameter. Ann Biomed Eng 2006;34:958-70.
15. Wu MH, Kouchi Y, Onuki Y, et al. Effect of differential shear stress on platelet aggregation, surface thrombosis, and endothelialization of bilateral carotid-femoral grafts in the dog. Journal of vascular surgery 1995;22:382-90; discussion 90-2.
16. Liani M, Salvati F, Tresca E, et al. Arteriovenous fistula obstruction and expression of platelet receptors for von Willebrand factor and for fibrinogen (glycoproteins GPib and GPiib/iiia) in hemodialysis patients. The International journal of artificial organs 1996;19:451-4.
17. Chuang YC, Chen JB, Yang LC, Kuo CY. Significance of platelet activation in vascular access survival of haemodialysis patients. Nephrology, dialysis, transplantation : official publication of the European Dialysis and Transplant Association - European Renal Association 2003;18:947-54.
18. Roy-Chaudhury P, Y Wang, M Krishnamoorthy, J Zhang, R Banerjee, R Munda, SC Heffelfinger, L Arend Cellular Phenotypes in Hemodialysis Vascular Access Dysfunction. Nephrology , Dialysis and Transplantation 2007 In Revision.
19. Roy-Chaudhury P, Kelly BS, Miller MA, et al. Venous neointimal hyperplasia in polytetrafluoroethylene dialysis grafts. Kidney Int 2001;59:2325-34.
20. Oberleithner H. Vascular endothelium leaves fingerprints on the surface of erythrocytes. Pflugers Archiv : European journal of physiology 2013;465:1451-8.
21. Vlahu CA, Lemkes BA, Struijk DG, Koopman MG, Krediet RT, Vink H. Damage of the endothelial glycocalyx in dialysis patients. Journal of the American Society of Nephrology : JASN 2012;23:1900-8.
22. Briet M, Burns KD. Chronic kidney disease and vascular remodeling: molecular mechanisms and clinical implications. Clin Sci (Lond) 2012;123:399-416.
23. Stinghen AE, Pecoits-Filho R. Vascular damage in kidney disease: beyond hypertension. International journal of hypertension 2011;2011:232683.
24. Brunet P, Gondouin B, Duval-Sabatier A, et al. Does uremia cause vascular dysfunction. Kidney & blood pressure research 2011;34:284-90.
25. Wu CC, Wen SC, Yang CW, Pu SY, Tsai KC, Chen JW. Plasma ADMA predicts restenosis of arteriovenous fistula. J Am Soc Nephrol 2009;20:213-22.
26. Himmelfarb J, Hakim RM. Oxidative stress in uremia. Curr Opin Nephrol Hypertens 2003;12:593-8.
27. Morris ST, Jardine AG. The vascular endothelium in chronic renal failure. J Nephrol 2000;13:96-105.
28. Verbeke FH, Pannier B, Guerin AP, Boutouyrie P, Laurent S, London GM. Flow-mediated vasodilation in end-stage renal disease. Clin J Am Soc Nephrol;6:2009-15.
29. Reitsma S, Slaaf DW, Vink H, van Zandvoort MA, oude Egbrink MG. The endothelial glycocalyx: composition, functions, and visualization. Pflügers Archiv-European Journal of Physiology 2007;454:345-59.
30. Schouten M, Wiersinga WJ, Levi M, van der Poll T. Inflammation, endothelium, and coagulation in sepsis. Journal of leukocyte biology 2008;83:536-45.
31. van den Berg BM, Nieuwdorp M, Stroes E, Vink H. Glycocalyx and endothelial (dys) function: from mice to men. Pharmacol Rep 2006;58:75-80.
32. Paderi JE, Stuart K, Sturek M, Park K, Panitch A. The inhibition of platelet adhesion and activation on collagen during balloon angioplasty by collagen-binding peptidoglycans. Biomaterials 2011;32:2516-23.
33. Haverslag R, Pasterkamp G, Hoefer IE. Targeting Adhesion Molecules in Cardiovascular Disorders. Cardiovascular & Haematological Disorders - Drug Targets 2008;8:252-60.
34. Ait-Oufella H, Maury E, Lehoux S, Guidet B, Offenstadt G. The endothelium: physiological functions and role in microcirculatory failure during severe sepsis.Applied Physiology in Intensive Care Medicine 2: Springer; 2012:237-49.
35. Wong C-Y, de Vries MR, Wang Y, et al. Vascular remodeling and intimal hyperplasia in a novel murine model of arteriovenous fistula failure. Journal of Vascular Surgery 2014;59:192-201.e1.
36. Karagkiozaki V. Nanomedicine highlights in atherosclerosis. Journal of Nanoparticle Research 2013;15:1-17.
37. Lewis DR, Kamisoglu K, York AW, Moghe PV. Polymer-based therapeutics: nanoassemblies and nanoparticles for management of atherosclerosis. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology 2011;3:400-20.
38. Wang Y, Krishnamoorthy M, Banerjee R, et al. Venous stenosis in a pig arteriovenous fistula model--anatomy, mechanisms and cellular phenotypes. Nephrol Dial Transplant 2008;23:525-33.
39. Weinhart M, Gröger D, Enders S, Dernedde J, Haag R. Synthesis of Dendritic Polyglycerol Anions and Their Efficiency Toward L-Selectin Inhibition. Biomacromolecules 2011;12:2502-11.
40. Nishida Y, Uzawa H, Toba T, Sasaki K, Kondo H, Kobayashi K. A facile synthetic approach to L-and P-selectin blockers via copolymerization of vinyl monomers constructing the key carbohydrate modules of sialyl LewisX mimics. Biomacromolecules 2000;1:68-74.
41. Butterfield KC, Caplan M, Panitch A. Identification and sequence composition characterization of chondroitin sulfate-binding peptides through peptide array screening. Biochemistry 2010;49:1549-55.
42. Ferrante EA, Pickard JE, Rychak J, Klibanov A, Ley K. Dual targeting improves microbubble contrast agent adhesion to VCAM-1 and P-selectin under flow. Journal of Controlled Release 2009;140:100-7.
43. Kalstad MM, Panitch A, Ehteshami GR, Massia SP. Inhibition of ICAM-mediated monocyte adhesion with a bioresponsive dextran-based conjugate.Engineering in Medicine and Biology, 2002 24th Annual Conference and the Annual Fall Meeting of the Biomedical Engineering Society EMBS/BMES Conference, 2002 Proceedings of the Second Joint; 2002 2002. p. 736-7 vol.1.
44. Fukuda MN, Ohyama C, Lowitz K, et al. A peptide mimic of E-selectin ligand inhibits sialyl Lewis X-dependent lung colonization of tumor cells. Cancer Res 2000;60:450-6.
45. Martens CL, Cwirla SE, Lee RY, et al. Peptides which bind to E-selectin and block neutrophil adhesion. J Biol Chem 1995;270:21129-36.
46. Scott RA, Paderi JE, Sturek M, Panitch A. Decorin mimic inhibits vascular smooth muscle proliferation and migration. PloS one 2013;8:e82456.
47. Stenvinkel P, Ekstrom TJ. Does the uremic milieu affect the epigenotype. J Ren Nutr 2009;19:82-5.
48. Himmelfarb J. Uremic toxicity, oxidative stress, and hemodialysis as renal replacement therapy. Seminars in dialysis 2009;22:636-43.
49. Vaziri ND. Oxidative stress in uremia: nature, mechanisms, and potential consequences. Semin Nephrol 2004;24:469-73.
50. Himmelfarb J, Stenvinkel P, Ikizler TA, Hakim RM. The elephant in uremia: oxidant stress as a unifying concept of cardiovascular disease in uremia. Kidney Int 2002;62:1524-38.
51. Serradell M, Diaz-Ricart M, Cases A, et al. Uremic medium causes expression, redistribution and shedding of adhesion molecules in cultured endothelial cells. Haematologica 2002;87:1053-61.
52. Caballo C, Palomo M, Cases A, et al. NFkappaB in the development of endothelial activation and damage in uremia: an in vitro approach. PloS one 2012;7:e43374.
53. Li F, Na K. Self-assembled chlorin e6 conjugated chondroitin sulfate nanodrug for photodynamic therapy. Biomacromolecules 2011;12:1724-30.
54. Chen X-G, Lee CM, Park H-J. O/W emulsification for the self-aggregation and nanoparticle formation of linoleic acid modified chitosan in the aqueous system. Journal of agricultural and food chemistry 2003;51:3135-9.
55. Leevy WM, Gammon ST, Johnson JR, et al. Noninvasive optical imaging of staphylococcus aureus bacterial infection in living mice using a Bis-dipicolylamine-Zinc (II) affinity group conjugated to a near-infrared fluorophore. Bioconjugate chemistry 2008;19:686-92.
56. Rafat M, Rotenstein LS, Hu JL, Auguste DT. Engineered endothelial cell adhesion via VCAM1 and E-selectin antibody-presenting alginate hydrogels. Acta Biomaterialia 2012;8:2697-703.
57. Feng Y, Chung D, Garrard L, et al. Peptides derived from the complementarity-determining regions of anti-Mac-1 antibodies block intercellular adhesion molecule-1 interaction with Mac-1. Journal of Biological Chemistry 1998;273:5625-30.
58. Yusuf-Makagiansar H, Yakovleva TV, Tejo BA, et al. Sequence Recognition of α-LFA-1-derived Peptides by ICAM-1 Cell Receptors: Inhibitors of T-cell Adhesion. Chemical Biology & Drug Design 2007;70:237-46.
59. Sakhalkar HS, Dalal MK, Salem AK, et al. Leukocyte-inspired biodegradable particles that selectively and avidly adhere to inflamed endothelium in vitro and in vivo. Proceedings of the National Academy of Sciences 2003;100:15895-900.
60. Shechter L, Wynstra J, Kurkjy RP. Glycidyl ether reactions with amines. Industrial & Engineering Chemistry 1956;48:94-7.
61. Lao S-B, Zhang Z-X, Xu H-H, Jiang G-B. Novel amphiphilic chitosan derivatives: Synthesis, characterization and micellar solubilization of rotenone. Carbohydrate Polymers 2010;82:1136-42.
62. Application Note Surfactant micelle characterization using dynamic light scattering (see website at quimica.udea.edu.co/~coloides/Anexo1.pdf). 2006.
63. Takeuchi K-i, Ishihara M, Kawaura C, Noji M, Furuno T, Nakanishi M. Effect of zeta potential of cationic liposomes containing cationic cholesterol derivatives on gene transfection. FEBS letters 1996;397:207-9.
64. Wilhelm M, Zhao CL, Wang Y, et al. Poly (styrene-ethylene oxide) block copolymer micelle formation in water: a fluorescence probe study. Macromolecules 1991;24:1033-40.
65. Huang M, Ma Z, Khor E, Lim L-Y. Uptake of FITC-chitosan nanoparticles by A549 cells. Pharmaceutical research 2002;19:1488-94。
本文中引用或提及的所有专利和出版物表明本发明所属领域的技术人员的技术水平,并且每一篇如此引用的专利或出版物通过引用至相同程度的方式被具体地并入,如同通过引用整体单独地并入或在本文中提出其全部内容。申请人保留将来自任何如此引用的专利或出版物的任何和所有材料和信息明确地并入到本说明书中的权利。
本文所述的具体的方法和组合物是优选的实施方案的代表,并且是示例性的,而不意图作为对本发明范围的限制。在考虑本说明书之后,本领域技术人员将想到其他目的、方面和实施方式,并且其被包括在由权利要求的范围限定的本发明的精神内。对本领域技术人员显而易见的是,在不脱离本发明的范围和精神的情况下,可以对本文公开的本发明进行各种替换和修改。可以在不存在本文中没有被具体地公开为必要的任何一个或多个元素、或一个或多个限制的情况下,实施本文示例性描述的本发明。
本文所述的示例性的方法和过程可以以步骤的不同的顺序来实践,并且方法和过程不一定受限于本文或权利要求中显示的步骤的顺序。如在本文和所附权利要求书中所使用的,单数形式“一”、“一个”、“一种”和“所述”包括复数指代,除非上下文另有明确指示。因此,例如,对“一种核酸”或“一种启动子”的引用包括多个这样的核酸或启动子(例如,核酸的溶液或一系列的启动子)等。在任何情况下,本专利不应被解释为被限制至本文具体公开的具体实施例或实施方式或方法。在任何情况下,专利不得被解释为受任何审查员或专利商标局的任何其他官员或雇员的任何声明的限制,除非申请人在书面回应中明确地并且没有限制或保留地采纳该声明。
已经采用的术语和表达被用作描述性术语而不是限制性术语,并且在使用这些术语和表达时没有意图排除所示和所描述的特征或其部分的任何等同物,而是认识到在所要求保护的本发明的范围内的各种修改是可能的。因此,应当理解,虽然本发明已经通过优选的实施方案和任选的特征被具体地公开,但是本文公开的概念的修改和变化可以被本领域技术人员采用,并且这样的修改和变化被认为是在由所附权利要求和本发明的声明所限定的本发明的范围内。
本发明的以下声明旨在描述和概述根据说明书中的前述描述的本发明的各种实施例。
- 还没有人留言评论。精彩留言会获得点赞!