用于引起抗肿瘤应答的基于李斯特菌的免疫原性组合物的制作方法
本发明获得合作研发协议(Cooperative Research and Development Agreement,CRADA)#02648的部分支持。美国政府可能具有本发明中的某些权利。
技术领域
本发明涉及包含免疫检查点抑制剂或T细胞刺激剂以及活的减毒重组李斯特菌菌株的组合物,所述菌株包含融合到肿瘤相关抗原的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸的融合蛋白。本发明还涉及治疗、防御肿瘤以及诱导对肿瘤的免疫应答的方法,所述方法包括施用所述组合物的步骤。
背景技术:
单核细胞增多性李斯特菌(Listeria monocytogenes)(Lm)是导致李斯特菌溶血的革兰氏阳性兼性细胞内病原体。一旦侵入宿主细胞,Lm即可通过产生裂解血管膜的成孔蛋白李斯特菌溶血素O(LLO)而逃离吞噬溶酶体,使其进入细胞质,在该处根据肌动蛋白多聚化蛋白(ActA)的迁移性复制并传播到相邻的细胞。在细胞质中,Lm分泌蛋白被蛋白酶降解,并加工为内质网中与MHC I类分子相关的肽。此独特特性使其成为非常有吸引力的癌症疫苗载体,因为肿瘤抗原可通过MHC I类分子呈递,以活化肿瘤特异性细胞毒性T淋巴细胞(CTL)。
肿瘤介导的免疫抑制的若干机理之一是肿瘤对T细胞共刺激分子的表达。这些分子在接合到其配体之后可抑制外周和肿瘤微环境中的效应淋巴细胞。
D-1在活化的淋巴细胞和骨髓细胞表面上表达。PD-L1除了在广泛的非造血细胞外还在活化的T细胞、B细胞、树突细胞和巨噬细胞上表达。PD-L1在许多人类肿瘤上上调,并且已证实其表达与不同类型的癌症中的存活逆相关。还已证明了PD-L2在各种肿瘤细胞上的表达。
据证实,肿瘤根除可通过PD-L1/PD-1相互作用的阻断而增强。最近,已证明,PD-1靶向作用与疫苗和低剂量环磷酰胺的组合明显增强抗原特异性免疫应答,降低肿瘤负荷,并提高所治疗的小鼠的存活。令人感兴趣的是,李斯特菌感染导致PD-L1在小鼠细胞上上调。
目前,仍需要提供有效的可消除肿瘤生长和癌症的组合式肿瘤靶向方法。本发明通过提供基于李斯特菌的疫苗与PD-1/PD-L相互作用的阻断的组合而解决这一需求。如在下文“具体实施方式”中所见,这种组合可改善免疫疗法的总体抗肿瘤功效。
技术实现要素:
在一个方面,本发明涉及一种免疫源性组合物,所述组合物包含免疫检查点抑制剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在一个相关的方面,本发明涉及一种免疫源性组合物,所述组合物包含T细胞刺激剂和重组减毒李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个方面,本发明涉及一种免疫源性组合物,所述组合物包含免疫检查点抑制剂、T细胞刺激剂和重组减毒李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在一个实施例中,本发明涉及一种免疫源性组合物,所述组合物包含程序性细胞死亡受体-1(PD-1)信号传导通路抑制剂、或CD-80/86CTLA4信号传导通路抑制剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
本发明的其他特征和优点将由于以下详细描述的实例和附图而变得显而易见。但是,应当理解,该详细描述和具体实例尽管指出了本发明的优选实施例,但是仅仅通过例证给出,因为本发明的精神和范围内的各种变化和修改对阅读了该详细描述的本领域技术人员而言将是显而易见的。
附图说明
以下附图形成了本说明书的一部分,将它们包括进来以进一步说明本公开的某些方面,通过参考一个或多个这些附图并结合本文提供的对具体实施例的描述可更好地理解本发明。本专利或申请文件包含至少一个用彩色表现的附图。根据请求并支付必要的费用后,专利局将提供带有彩色附图的本专利或专利申请公开的副本。
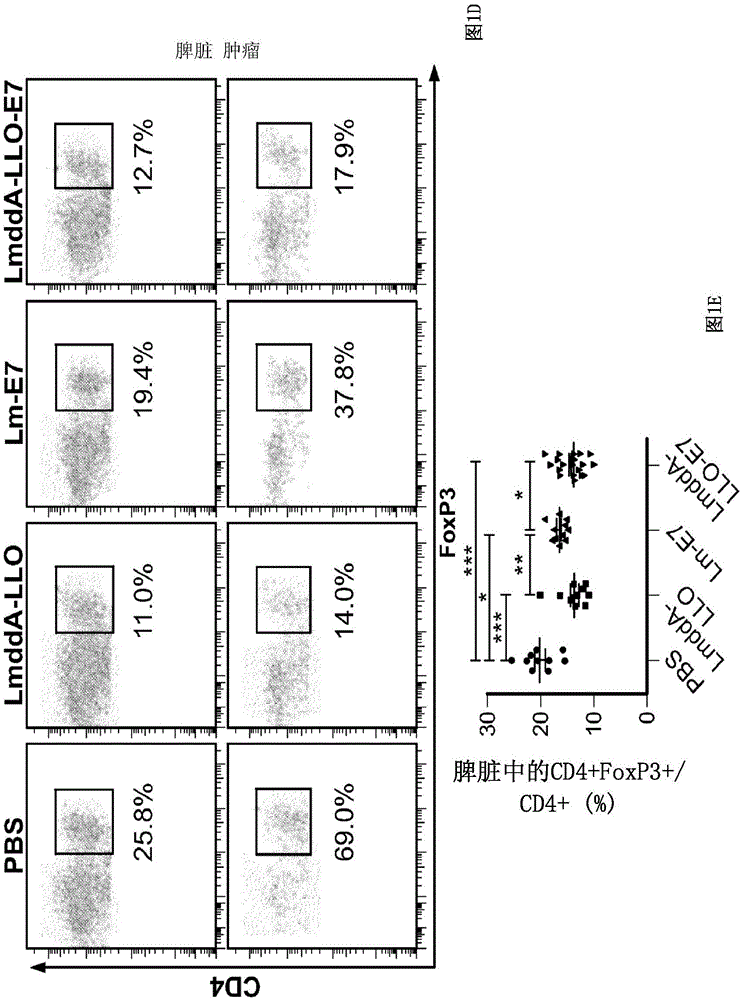
图1A-1H.LmddA-LLO-E7诱导已建立的TC-1肿瘤的消退,伴随着Treg频率降低。给每只C57BL6小鼠皮下接种1×105个TC-1肿瘤细胞,并且在肿瘤挑战后第10天和第17天腹膜内免疫溶于PBS(100μl)的0.1LD50LmddA-LLO-E7(1×108个CFU)、Lm-E7(1×106个CFU)或LmddA-LLO(1×108个CFU)。每周两次使用电子卡尺测量肿瘤。肿瘤体积以下式计算:长×宽×宽/2。当肿瘤直径达到大约2.0cm时或在第24天处死小鼠,以进行流式细胞分析。(图1A)从第10天至第24天的平均肿瘤体积。(图1B)第24天的肿瘤体积。(图1C)存活百分比。(图1D)CD4+T细胞中的CD4+FoxP3+T细胞的流式细胞谱。(图1E)在脾脏中CD4+T细胞中的CD4+FoxP3+T细胞的百分比。(图1F)在脾脏中CD4+FoxP3+T细胞与CD8+T细胞的比率。(图1G)在肿瘤中CD4+T细胞中的CD4+FoxP3+T细胞的百分比。(图1H)在肿瘤中CD4+FoxP3+T细胞与CD8+T细胞的比率。数据以平均值±SEM表示。*P<0.05,**P<0.01,以及***P<0.001(Mann-Whitney检验)。数据来自3个独立的实验(图1A和图1B),并且代表3个独立的实验(图1C-1H)。
图2A-2D.LmddA-LLO-E7诱导已建立的TC-1肿瘤的消退。给每只C57BL6小鼠皮下接种1×105个TC-1肿瘤细胞,并且在肿瘤挑战后第10天和第17天腹膜内免疫溶于PBS(100μl)的0.1LD50LmddA-LLO-E7(1×108个CFU)、Lm-E7(1×106个CFU)或LmddA-LLO(1×108个CFU)。每周两次使用电子卡尺测量肿瘤。肿瘤体积以下式计算:长×宽×宽/2。(图2A)PBS。(图2B)LmddA。(图2C)Lm-E7。(图2D)LmddA-LLO-E7。数据来自3个独立的实验。
图3A-3E.LmddA-LLO-E7和Lm-E7诱导相似的E7特异性CD8+T细胞应答。给每只C57BL6小鼠皮下接种1×105个TC-1肿瘤细胞,并且在肿瘤挑战后第10天和第17天腹膜内免疫溶于PBS(100μl)的0.1LD50LmddA-LLO-E7(1×108个CFU)、LmddA-LLO(1×108个CFU)、LmddA(1×108个CFU)、Lm-E7(1×106个CFU)或0.5LD50野生型Lm 10403S(1×104个CFU)。在第24天处死小鼠,并且通过流式细胞术分析从脾脏和肿瘤分离的淋巴细胞。图3A.在脾脏和肿瘤中CD8+T细胞中的H-2Db E7四聚体+CD8+T细胞的流式细胞谱。(图3B和图3C)在脾脏(图13B)和肿瘤(图3C)中CD8+T细胞中的H-2Db E7四聚体+CD8+T细胞的百分比。(图3D和图3E)每只小鼠脾脏(图3D)和每百万个肿瘤细胞(图3E)的H-2Db E7四聚体+CD8+T细胞数量。n=3-10。数据代表3个独立的实验。
图4A-4E.单核细胞增多性李斯特菌足以诱导Treg频率降低。给每只C57BL6小鼠皮下接种1×105个TC-1肿瘤细胞,并且在肿瘤挑战后第10天和第17天腹膜内免疫溶于PBS(100μl)的0.1LD50LmddA(1×108个CFU)或0.5LD50野生型Lm 10403S(1×104个CFU)。在第24天处死小鼠,并且通过流式细胞术分析从脾脏和肿瘤分离的淋巴细胞。(图4A)CD4+T细胞中的CD4+FoxP3+T细胞的流式细胞谱。(图4B)在脾脏中CD4+T细胞中的CD4+FoxP3+T细胞的百分比。(图4C)在脾脏中CD4+FoxP3+T细胞与CD8+T细胞的比率。(图4D)在肿瘤中CD4+T细胞中的CD4+FoxP3+T细胞的百分比。(图4E)在肿瘤中CD4+FoxP3+T细胞与CD8+T细胞的比率。数据以平均值±SEM表示。*P<0.05,**P<0.01,以及***P<0.001(Mann-Whitney检验)。数据代表3个独立的实验。
图5.单核细胞增多性李斯特菌通过优先诱导CD4+FoxP3-T细胞和CD8+T细胞扩增而降低Treg频率。给每只C57BL6小鼠皮下接种1×105个TC-1肿瘤细胞,并且在肿瘤挑战后第10天和第17天腹膜内免疫溶于PBS(100μl)的0.1LD50LmddA-LLO-E7(1×108个CFU)、LmddA-LLO(1×108个CFU)、LmddA(1×108个CFU)、Lm-E7(1×106个CFU)或0.5LD50野生型Lm 10403S(1×104个CFU)。在第24天处死小鼠,并且通过流式细胞术分析从肿瘤分离的淋巴细胞。数据以平均值±SEM表示。n=3-10。*P<0.05,**P<0.01(Mann-Whitney检验)。数据代表3个独立的实验。
图6A-6D.单核细胞增多性李斯特菌诱导的CD4+FoxP3-T细胞和CD8+T细胞扩增依赖于LLO并由LLO介导。给C57BL6小鼠腹膜内注射溶于PBS(100μl)的1×104个CFU10403S、Δhly、Δhly::pfo或hly::Tn917-lac(pAM401-hly)。在注射后第7天处死小鼠,并且通过流式细胞术分析从脾脏分离的淋巴细胞。(图6A)脾脏中的T细胞数量。(图6B)CD4+T细胞中的CD4+FoxP3+T细胞的流式细胞谱。(图6C)CD4+T细胞中的CD4+FoxP3+T细胞的百分比。(图6D)CD4+FoxP3+T细胞与CD8+T细胞的比率。*P<0.05(Mann-Whitney检验)。数据代表3个独立的实验。
图7A-7G.LmddA中截短的LLO的游离型表达诱导CD4+FoxP3-T细胞和CD8+T细胞扩增达到较高水平。给C57BL6小鼠腹膜内注射溶于PBS(100μl)的1×108个CFU LmddA或LmddA-LLO。在注射后第7天处死小鼠,并且通过流式细胞术分析从脾脏分离的淋巴细胞。(图7A)脾脏中的T细胞数量。(图7B)CD4+T细胞中的CD4+FoxP3+T细胞的流式细胞谱。(图7C)CD4+T细胞中的CD4+FoxP3+T细胞的百分比。(图7D)CD4+FoxP3+T细胞与CD8+T细胞的比率。(图7E)Ki-67+T细胞的流式细胞谱。(图7F)Ki-67+T细胞的百分比。(图7G)Ki-67+T细胞的荧光强度。(图7H)在存在LmddA和LmddA-LLO以及对照-无载体(PBS)的情况下,在CD4+FoxP3-T细胞和CD8+T细胞中的Ki-67表达水平。数据以平均值±SEM表示。*P<0.05,**P<0.01,以及***P<0.001(Mann-Whitney检验)。数据代表3个独立的实验。
图8A-8G.Lm-E7和LmddA-LLO的组合诱导已建立的TC-1肿瘤的消退。给每只C57BL/6小鼠皮下接种1×105个TC-1肿瘤细胞,并且在肿瘤挑战后第10天和第17天腹膜内免疫溶于PBS(100μl)的0.05LD50Lm-E7(5×105个CFU)、0.05LD50LmddA-LLO(5×107个CFU)、0.05LD50Lm-E7+0.05LD50LmddA-LLO。每周两次使用电子卡尺测量肿瘤,并且肿瘤体积以下式计算:长×宽×宽/2。观察小鼠的存活,或在第24天处死小鼠,并且通过流式细胞术分析从脾脏分离的淋巴细胞。(图8A)从第10天至第24天的平均肿瘤体积。(图8B)第24天的肿瘤体积。(图8C)存活百分比。(图8D)脾脏中的T细胞数量。(图8E)CD4+T细胞中的CD4+FoxP3+T细胞的流式细胞谱。(图8F)CD4+T细胞中的CD4+FoxP3+T细胞的百分比。(图8G)CD4+FoxP3+T细胞与CD8+T细胞的比率。数据以平均值±SEM表示。*P<0.05,**P<0.01,以及***P<0.001(Mann-Whitney检验)。数据代表2个独立的实验。
图9A-9G.Treg的过继转移危害LmddA-LLO-E7对已建立的TC-1肿瘤的抗肿瘤功效。给每只C57BL6小鼠(11周龄)皮下注射1×105个TC-1肿瘤细胞,并且在肿瘤挑战后第9天静脉注射CD4+CD25+Treg(每只1×106个细胞)。在肿瘤挑战后第10天和第17天给小鼠腹膜内免疫溶于PBS(100μl)的0.1LD50LmddA-LLO-E7(1×108个CFU)。每周两次使用电子卡尺测量肿瘤,并且肿瘤体积以下式计算:长×宽×宽/2。在第24天处死小鼠,并且通过流式细胞术分析从脾脏分离的淋巴细胞。(图9A)从第10天至第24天的平均肿瘤体积。(图9B)第24天的肿瘤体积。((图9C)CD4+T细胞中的CD4+FoxP3+T细胞的流式细胞谱。(图9D)在脾脏中CD4+T细胞中的CD4+FoxP3+T细胞的百分比。(图9E)在肿瘤中CD4+T细胞中的CD4+FoxP3+T细胞的百分比。(图9F)脾脏中的T细胞数量。(图9G)每百万个肿瘤细胞的T细胞数量。数据以平均值±SEM表示。*P<0.05,**P<0.01,以及***P<0.001(Mann-Whitney检验)。数据代表2个独立的实验。
图10.LmddA不会增加Lm-E7抗肿瘤活性。给每只C57BL/6小鼠皮下接种1×105个TC-1肿瘤细胞,并且在肿瘤挑战后第10天和第17天腹膜内免疫溶于PBS(100μl)的0.05LD50Lm-E7(5×105个CFU)、0.05LD50LmddA(5×107个CFU)或0.05LD50Lm-E7+0.05LD50LmddA。使用电子卡尺测量肿瘤,并且肿瘤体积以下式计算:长×宽×宽/2。示出了第24天的肿瘤体积。数据以平均值±SEM表示。
图11A-11B.Lm-LLO和Lm-LLO-E7感染上调小鼠DC表面上的PD-L1表达。(图11A)在用不同浓度的Lm-LLO或Lm-LLO-E7处理后,相比于未经处理的对照,在骨髓源小鼠DC上PD-L1表达的倍数增加。(图11B)得自三个独立实验之一的代表性柱状图。
图12.向Lm-LLO-E7添加抗PD-1Ab增强治疗的疗效。A.治疗计划表。B.每3-4天测量的每种处理的各个小鼠的肿瘤体积。C.Kaplan-Meier图描绘了总体存活。从三个独立实验得到了类似的结果。
图13.向Lm-LLO-E7添加抗PD-1Ab增强抗原特异性免疫应答,并提高肿瘤浸润的CD8T细胞的水平。将C57BL/6小鼠(n=5只/组)如图2A上进行处理,但在肿瘤植入后第21天,将小鼠处死。A.在得自脾脏的单细胞悬液中分析了在存在或不存在E7肽的情况下的IFN-γ产生。值代表得自E7再刺激的培养物的斑点计数减去得自不相关抗原再刺激的培养物的斑点计数±SD。B.被浸润的CD45+CD8+T细胞的绝对数按10e6个总肿瘤细胞标准化,并以平均值±SD呈现。*P<0.05,**P<0.01和***P<0.001。从两个独立实验得到了类似的结果。
图14A-14B.Lm-LLO处理降低了脾和肿瘤浸润性MDSC的水平。(图14A)得自经处理的和对照的C57BL/6小鼠(n=5)的脾CD11b+Gr-1+MDSC的百分比。(图14B)按10e6个总肿瘤细胞标准化的浸润CD45+CD11b+Gr-1+MDSC的绝对数以平均值±SD呈现。*P<0.05。从两个独立实验得到了类似的结果。
图15A-15B.Lm-LLO处理降低了脾和肿瘤浸润性Treg的水平。(图15A)得自实验组和对照组的脾细胞的CD4+细胞群中CD4+FoxP3+Treg细胞的百分比。(图15B)按10e6个总肿瘤细胞标准化的浸润CD45+CD4+FoxP3+Treg的绝对数以平均值±SD呈现。*P<0.05。从两个独立实验得到了类似的结果。
图16A-16B.Lm-LLO感染上调了单核细胞来源的人DC表面上的PD-L1表达。(图16A)在用不同浓度的Lm-LLO处理后,相比于未经处理的对照,在人DC上PD-L1表达的倍数增加。(图16B)在用不同浓度的Lm-LLO处理的人DC上的PD-L1表达的代表性柱状图。从三个独立实验得到了类似的结果。
应当理解,为了阐述的简洁和清楚,显示在图中的要素未必是按比率绘制的。例如,为了清楚,一些要素的尺寸可以是相对其他要素而放大的。另外,在认为适合时,附图标记可以在附图之间重复,以指出对应的或类似的要素。
具体实施方式
本发明在一个实施例中提供一种免疫源性组合物,所述组合物包含免疫检查点抑制剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个实施例中,一种免疫源性组合物包含免疫检查点抑制剂或激动剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个实施例中,本文提供一种免疫源性组合物,所述组合物包含T细胞刺激剂和重组减毒李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。在另一个实施例中,T细胞刺激剂的施用可与重组李斯特菌菌株的施用同时进行。在另一个实施例中,T细胞刺激剂的施用可在重组李斯特菌菌株的施用之前进行。在另一个实施例中,T细胞刺激剂的施用可在重组李斯特菌菌株的施用之后进行。
在另一个实施例中,本文提供一种免疫源性组合物,所述组合物包含免疫检查点抑制剂、T细胞刺激剂和重组减毒李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。在另一个实施例中,检查点抑制剂和T细胞刺激剂的施用可与重组李斯特菌菌株的施用同时进行。在另一个实施例中,检查点抑制剂和T细胞刺激剂的施用可在重组李斯特菌菌株的施用之前进行。在另一个实施例中,检查点抑制剂和T细胞刺激剂的施用可在重组李斯特菌菌株的施用之后进行。
在另一个实施例中,本文提供一种免疫源性组合物,所述组合物包含程序性细胞死亡受体-1(PD-1)信号传导通路抑制剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个实施例中,本文提供一种免疫源性组合物,所述组合物包含程序性细胞死亡受体-1(PD-1)信号传导通路抑制剂、或CD-80/86和CTLA4信号传导通路抑制剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个实施例中,本文提供一种引起受试者中增强的抗肿瘤T细胞应答的方法,所述方法包括向所述受试者施用一种免疫源性组合物的步骤,所述组合物包含程序性细胞死亡受体-1(PD-1)信号传导通路抑制剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个实施例中,本文提供一种引起受试者中增强的抗肿瘤T细胞应答的方法,所述方法包括向所述受试者施用一种免疫源性组合物的步骤,所述组合物包含免疫检查点抑制剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个实施例中,本文提供一种引起受试者中增强的抗肿瘤T细胞应答的方法,所述方法包括向所述受试者施用一种免疫源性组合物的步骤,所述组合物包含T细胞刺激剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个实施例中,本文提供一种引起受试者中增强的抗肿瘤T细胞应答的方法,所述方法包括向所述受试者施用一种免疫源性组合物的步骤,所述组合物包含免疫检查点抑制剂、T细胞刺激剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个实施例中,检查点抑制剂的施用可与重组李斯特菌菌株的施用同时进行。在另一个实施例中,检查点抑制剂的施用可在重组李斯特菌菌株的施用之前进行。在另一个实施例中,检查点抑制剂的施用可在重组李斯特菌菌株的施用之后进行。
在一个实施例中,本文提供一种抑制受试者中肿瘤介导的免疫抑制的方法,所述方法包括向所述受试者施用如本文所提供的免疫原性组合物的步骤。
在另一个实施例中,本文提供一种抑制受试者中肿瘤介导的免疫抑制的方法,所述方法包括向所述受试者施用一种免疫源性组合物的步骤,所述组合物包含程序性细胞死亡受体-1(PD-1)信号传导通路抑制剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个实施例中,本文提供一种抑制受试者中肿瘤介导的免疫抑制的方法,所述方法包括向所述受试者施用一种免疫源性组合物的步骤,所述组合物包含免疫检查点抑制剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个实施例中,本文提供一种抑制受试者中肿瘤介导的免疫抑制的方法,所述方法包括向所述受试者施用一种免疫源性组合物的步骤,所述组合物包含T细胞刺激和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个实施例中,本文提供一种抑制受试者中肿瘤介导的免疫抑制的方法,所述方法包括向所述受试者施用一种免疫源性组合物的步骤,所述组合物包含免疫检查点抑制剂、T细胞刺激剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个实施例中,本文提供一种预防或治疗受试者中的肿瘤生长或癌症的方法,所述方法包括向所述受试者施用一种免疫源性组合物的步骤,所述组合物包含程序性细胞死亡受体-1(PD-1)信号传导通路抑制剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个实施例中,异源性抗原是肿瘤相关抗原。在另一个实施例中,肿瘤相关抗原是天然存在的肿瘤相关抗原。在另一个实施例中,肿瘤相关抗原是合成的肿瘤相关抗原。
在一个实施例中,本文提供提高受试者脾脏和肿瘤微环境中的效应T细胞与调节性T细胞(Treg)的比率的方法,包括施用本文提供的免疫原性组合物。在另一个实施例中,本文提供一种提高受试者脾脏和肿瘤中效应T细胞与调节性T细胞(Treg)的比率的方法,所述方法包括向所述受试者施用一种免疫源性组合物的步骤,所述组合物包含免疫检查点抑制剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个实施例中,本文提供一种提高受试者脾脏和肿瘤中效应T细胞与调节性T细胞(Treg)的比率的方法,所述方法包括向所述受试者施用一种免疫源性组合物的步骤,所述组合物包含T细胞刺激剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个实施例中,本文提供一种提高受试者脾脏和肿瘤中效应T细胞与调节性T细胞(Treg)的比率的方法,所述方法包括向所述受试者施用一种免疫源性组合物的步骤,所述组合物包含免疫检查点抑制剂、T细胞刺激剂和重组李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列。
在另一个实施例中,提高受试者的脾脏和肿瘤微环境中效应T细胞与调节性T细胞(Treg)的比率使得所述受试者中可以实现更明显的抗肿瘤应答。
在一个实施例中,本文提供的重组李斯特菌菌株缺乏抗生素抗性基因。在另一个实施例中,本文提供的重组李斯特菌菌株包含质粒,所述质粒包含编码抗生素抗性基因的核酸。
在一个实施例中,本文提供的重组李斯特菌能够逃离吞噬溶酶体。
在另一个实施例中,该效应T细胞包括CD4+FoxP3-T细胞。在另一个实施例中,该效应T细胞是CD4+FoxP3-T细胞。在另一个实施例中,该效应T细胞包括CD4+FoxP3-T细胞和CD8+T细胞。在另一个实施例中,该效应T细胞是CD4+FoxP3-T细胞和CD8+T细胞。在另一个实施例中,该调节性T细胞是CD4+FoxP3+T细胞。
在一个实施例中,本发明提供治疗肿瘤、防御肿瘤以及诱导对肿瘤或癌症的免疫应答的方法,该方法包括将本文提供的免疫原性组合物施用于受试者的步骤。
在一个实施例中,本发明提供一种预防或治疗人类受试者中的肿瘤或癌症的方法,包括向所述受试者施用本文提供的免疫原性组合物的步骤,所述组合物包含免疫检查点抑制剂和重组减毒李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列,于是所述组合物的施用诱导对所述异源性抗原的免疫应答,从而治疗人类受试者中的肿瘤或癌症。在另一个实施例中,异源性抗原包括肿瘤相关抗原,于是重组李斯特菌菌株诱导对肿瘤相关抗原的免疫应答,从而治疗人类受试者中的肿瘤或癌症。在另一个实施例中,该免疫应答是T细胞应答。在另一个实施例中,该T细胞应答是CD4+FoxP3-T细胞应答。在另一个实施例中,该T细胞应答是CD8+T细胞应答。在另一个实施例中,该T细胞应答是CD4+FoxP3-和CD8+T细胞应答。
在一个实施例中,本发明提供一种预防或治疗人类受试者中的肿瘤或癌症的方法,包括向所述受试者施用本文提供的免疫原性组合物的步骤,所述组合物包含T细胞刺激剂和重组减毒李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列,于是所述组合物的施用诱导对所述异源性抗原的免疫应答,从而治疗人类受试者中的肿瘤或癌症。在另一个实施例中,异源性抗原包括肿瘤相关抗原,于是重组李斯特菌菌株诱导对肿瘤相关抗原的免疫应答,从而治疗人类受试者中的肿瘤或癌症。在另一个实施例中,该免疫应答是T细胞应答。在另一个实施例中,该T细胞应答是CD4+FoxP3-T细胞应答。在另一个实施例中,该T细胞应答是CD8+T细胞应答。在另一个实施例中,该T细胞应答是CD4+FoxP3-和CD8+T细胞应答。
在一个实施例中,本发明提供一种预防或治疗人类受试者中的肿瘤或癌症的方法,包括向所述受试者施用本文提供的免疫原性组合物的步骤,所述组合物包含免疫检查点抑制剂、T细胞刺激剂和重组减毒李斯特菌菌株,所述菌株包含核酸分子,所述核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白、截短的ActA蛋白或PEST氨基酸序列,于是所述组合物的施用诱导对所述异源性抗原的免疫应答,从而治疗人类受试者中的肿瘤或癌症。在另一个实施例中,异源性抗原包括肿瘤相关抗原,于是重组李斯特菌菌株诱导对肿瘤相关抗原的免疫应答,从而治疗人类受试者中的肿瘤或癌症。在另一个实施例中,该免疫应答是T细胞应答。在另一个实施例中,该T细胞应答是CD4+FoxP3-T细胞应答。在另一个实施例中,该T细胞应答是CD8+T细胞应答。在另一个实施例中,该T细胞应答是CD4+FoxP3-和CD8+T细胞应答。
在另一个实施例中,本发明提供避免受试者罹患肿瘤或癌症的方法,该方法包括将本文提供的免疫原性组合物施用于受试者的步骤。在另一个实施例中,本发明提供诱导受试者中的肿瘤消退的方法,该方法包括将本文提供的免疫原性组合物施用于受试者的步骤。在另一个实施例中,本发明提供减少肿瘤或癌症的发生或复发的方法,该方法包括将本文提供的免疫原性组合物施用于受试者的步骤。在另一个实施例中,本发明提供抑制受试者中的肿瘤形成的方法,该方法包括将本文提供的免疫原性组合物施用于受试者的步骤。在另一个实施例中,本发明提供一种诱导受试者中癌症缓解的方法,包括向所述受试者施用本文提供的免疫原性组合物的步骤。在一个实施例中,将包含编码融合多肽的第一开放阅读框的核酸分子整合进李斯特菌基因组。在另一个实施例中,核酸在所述重组李斯特菌菌株的质粒中。在另一个实施例中,核酸在所述重组李斯特菌菌株的细菌人工染色体质粒中。
在一个实施例中,李斯特菌基因组包含内源性actA基因的缺失,在一个实施例中,该基因是毒力因子。在一个实施例中,这样的缺失提供了供人类使用的进一步减毒从而更安全的李斯特菌菌株。根据一个实施例,异源性抗原或抗原多肽与LLO同框整合进李斯特菌染色体中。在另一个实施例中,该整合的核酸分子整合进actA基因座。在另一个实施例中,编码ActA的染色体核酸被编码抗原的核酸分子替代。
技术人员将认识到,术语“抗原性多肽”是指在存在于受试者细胞中的MHC I类和/或II类分子上加工和呈递从而当存在于宿主体内时或在另一个实施例中被宿主检测到时导致产生免疫应答的如上文所述的多肽、肽或重组肽。
在一个实施例中,抗原可以是外来的,即宿主异源性的,并在本文称为“异源性抗原”。在另一个实施例中,异源性抗原是重组表达所述抗原的本文所提供的李斯特菌菌株异源性的。在另一个实施例中,异源性抗原是宿主和重组表达所述抗原的本文所提供的李斯特菌菌株异源性的。在另一个实施例中,抗原是存在于宿主中但宿主因免疫耐受而不引起对该抗原的免疫应答的自身抗原。技术人员将认识到,异源性抗原以及自身抗原可涵盖肿瘤抗原、肿瘤相关抗原或血管新生抗原。
在一个实施例中,本文提供的核酸分子包含编码融合多肽的第一开放阅读框,其中所述融合多肽包含融合到异源性抗原或其片段的截短的李斯特菌溶血素O蛋白(LLO)、截短的ActA蛋白或PEST氨基酸序列。在另一个实施例中,截短的LLO蛋白是N末端LLO或其片段。在另一个实施例中,截短的ActA蛋白是N末端ActA蛋白或其片段。
在一个实施例中,本文提供的核酸分子还包含编码代谢酶的第二开放阅读框。在另一个实施例中,该代谢酶补充重组李斯特菌菌株的染色体中缺乏的内源性基因。在另一个实施例中,由该第二开放阅读框编码的代谢酶为丙氨酸消旋酶(dal)。在另一个实施例中,由该第二开放阅读框编码的代谢酶为D-氨基酸转移酶(dat)。在另一个实施例中,本文提供的李斯特菌菌株在内源性dal/dat基因中包含突变。在另一个实施例中,该李斯特菌缺乏dal/dat基因。
在另一个实施例中,本发明的方法和组合物的核酸分子可操作地连接至启动子/调控序列。在另一个实施例中,本发明的方法和组合物的第一开放阅读框可操作地连接至启动子/调控序列。在另一个实施例中,本发明的方法和组合物的第二开放阅读框可操作地连接至启动子/调控序列。在另一个实施例中,每个开放阅读框可操作地连接至启动子/调控序列。
“代谢酶”在另一个实施例中是指参与宿主细菌所需的营养物的合成的酶。在另一个实施例中,该术语是指宿主细菌所需的营养物的合成所需的酶。在另一个实施例中,该术语是指参与宿主细菌所利用的营养物的合成的酶。在另一个实施例中,该术语是指参与宿主细菌持续生长所需的营养物的合成的酶。在另一个实施例中,该酶为营养物的合成所需。每种可能性代表了本发明的独立实施例。
在另一个实施例中,重组李斯特菌是减毒的。在另一个实施例中,重组李斯特菌是减毒营养缺陷型菌株。在另一个实施例中,重组李斯特菌是如美国专利No.8,114,414中所述的Lm-LLO-E7菌株,该专利以引用方式全文并入本文。
在一个实施例中,该减毒的菌株为Lm dal(-)dat(-)(Lmdd)。在另一个实施例中,该减毒的菌株为Lm dal(-)dat(-)ΔactA(LmddA)。LmddA基于李斯特菌载体,该载体因缺失毒力基因actA而为减毒的并保留了质粒,以通过补充dal基因用于期望的异源性抗原或截短的LLO在体内和体外表达。
在另一个实施例中,该减毒菌株为Lm△actA。在另一个实施例中,该减毒菌株为Lm△prfA。在另一个实施例中,该减毒菌株为Lm△PlcB。在另一个实施例中,该减毒菌株为Lm△plcA。在另一个实施例中,该菌株为任何上文提及的菌株的双突变体或三突变体。在另一个实施例中,该菌株发挥强烈的佐剂效应,这是基于李斯特菌的疫苗的固有特性。在另一个实施例中,该菌株从EGD李斯特菌骨架构建。在另一个实施例中,用于本发明的菌株为表达非溶血LLO的李斯特菌菌株。
在一个实施例中,本文所公开的李斯特菌是李斯特菌疫苗株。在另一个实施例中,本文所公开的利用李斯特菌菌株的疗法是基于李斯特菌的免疫疗法。
在另一个实施例中,李斯特菌菌株为营养缺陷型突变体。在另一个实施例中,该李斯特菌菌株是编码维生素合成基因的基因缺陷的。在另一个实施例中,该李斯特菌菌株是编码泛酸合酶的基因缺陷的。
在一个实施例中,D-丙氨酸缺陷的李斯特菌AA菌株的生成例如可以按本领域的技术人员熟知的多种方式实现,这些方式包括缺失诱变、插入诱变、以及导致生成移码突变的诱变、导致蛋白的提前终止的突变、或影响基因表达的调控序列的突变。在另一个实施例中,诱变可使用重组DNA技术或使用传统诱变技术实现,所述传统诱变技术使用诱变化学品或辐射,随后选择突变体。在另一个实施例中,由于伴随的营养缺陷型表型反转的可能性很低,缺失突变体是优选的。在另一个实施例中,可在简单的实验室培养分析中测试根据本文提供的方案生成的D-丙氨酸突变体在不存在D-丙氨酸的情况下的生长能力。在另一个实施例中,选择在不存在该化合物的情况下不能生长的那些突变体进行进一步研究。
在另一个实施例中,除上述D-丙氨酸相关基因之外,如本文所提供的涉及代谢酶合成的其他基因可用作李斯特菌诱变的靶标。
在另一个实施例中,该代谢酶补充重组细菌菌株的染色体其余部分中缺乏的内源性代谢基因。在另一个实施例中,该内源性代谢基因在染色体中是突变的。在另一个实施例中,该内源性代谢基因从染色体缺失。在另一个实施例中,所述代谢酶是氨基酸代谢酶。在另一个实施例中,所述代谢酶催化用于所述重组李斯特菌菌株中的细胞壁合成的氨基酸的形成。在另一个实施例中,所述代谢酶是丙氨酸消旋酶。在另一个实施例中,所述代谢酶是D-氨基酸转移酶。每种可能性代表了如本文所提供的方法和组合物的独立实施例。
在一个实施例中,所述营养缺陷型李斯特菌菌株包含游离型表达载体,该游离型表达载体包含补充所述营养缺陷型李斯特菌菌株的营养缺陷体的代谢酶。在另一个实施例中,该构建体以游离型形式包含于李斯特菌菌株中。在另一个实施例中,外源抗原从重组李斯特菌菌株携带的载体表达。在另一个实施例中,所述游离型表达载体缺乏抗生素抗性标记。在一个实施例中,如本文所提供的方法和组合物的抗原融合到截短的李斯特菌溶血素O蛋白(LLO)、截短的ActA蛋白或PEST氨基酸序列。在另一个实施例中,如本文所提供的方法和组合物的抗原融合到截短的LLO。在另一个实施例中,如本文所提供的方法和组合物的抗原融合到截短的ActA蛋白。在另一个实施例中,如本文所提供的方法和组合物的抗原融合到PEST氨基酸序列。
在另一个实施例中,该李斯特菌菌株是氨基酸代谢酶缺陷的。在另一个实施例中,该李斯特菌菌株是D-谷氨酸合酶基因缺陷的。在另一个实施例中,该李斯特菌菌株是dat基因缺陷的。在另一个实施例中,该李斯特菌菌株是dal基因缺陷的。在另一个实施例中,该李斯特菌菌株是dga基因缺陷的。在另一个实施例中,该李斯特菌菌株是二氨基庚二酸合成中涉及到的基因缺陷的。CysK.在另一个实施例中,该基因为维生素-B12非依赖性甲硫氨酸合酶。在另一个实施例中,该基因为trpA。在另一个实施例中,该基因为trpB。在另一个实施例中,该基因为trpE。在另一个实施例中,该基因为asnB。在另一个实施例中,该基因为gltD。在另一个实施例中,该基因为gltB。在另一个实施例中,该基因为leuA。在另一个实施例中,该基因为argG。在另一个实施例中,该基因为thrC。在另一个实施例中,该李斯特菌菌株是一个或多个上文描述的基因缺陷的。
在另一个实施例中,该李斯特菌菌株是合酶基因缺陷的。在另一个实施例中,该基因为氨基酸合成基因。在另一个实施例中,该基因为folP。在另一个实施例中,该基因为二氢尿苷合酶家族蛋白。在另一个实施例中,该基因为ispD。在另一个实施例中,该基因为ispF。在另一个实施例中,该基因为磷酸烯醇丙酮酸合酶。在另一个实施例中,该基因为hisF。在另一个实施例中,该基因为hisH。在另一个实施例中,该基因为fliI。在另一个实施例中,该基因为核糖体大亚基假尿苷合酶。在另一个实施例中,该基因为ispD。在另一个实施例中,该基因为双功能GMP合酶/谷氨酰胺氨基转移酶蛋白。在另一个实施例中,该基因为cobS。在另一个实施例中,该基因为cobB。在另一个实施例中,该基因为cbiD。在另一个实施例中,该基因为尿卟啉-III C-甲基转移酶/尿卟啉原-III合酶。在另一个实施例中,该基因为cobQ。在另一个实施例中,该基因为uppS。在另一个实施例中,该基因为truB。在另一个实施例中,该基因为dxs。在另一个实施例中,该基因为mvaS。在另一个实施例中,该基因为dapA。在另一个实施例中,该基因为ispG。在另一个实施例中,该基因为folC。在另一个实施例中,该基因为柠檬酸合酶。在另一个实施例中,该基因为argJ。在另一个实施例中,该基因为3-脱氧-D-阿拉伯-庚酮糖-7-磷酸合酶。在另一个实施例中,该基因为吲哚-3-甘油-磷酸合酶。在另一个实施例中,该基因为邻氨基苯甲酸合酶/谷氨酰胺氨基转移酶组分。在另一个实施例中,该基因为menB。在另一个实施例中,该基因为甲基萘醌特异的异分支酸合酶。在另一个实施例中,该基因为磷酸核糖甲酰甘氨脒合酶I或II。在另一个实施例中,该基因为磷酸核糖氨基咪唑-琥珀酸甲酰胺合酶。在另一个实施例中,该基因为carB。在另一个实施例中,该基因为carA。在另一个实施例中,该基因为thyA。在另一个实施例中,该基因为mgsA。在另一个实施例中,该基因为aroB。在另一个实施例中,该基因为hepB。在另一个实施例中,该基因为rluB。在另一个实施例中,该基因为ilvB。在另一个实施例中,该基因为ilvN。在另一个实施例中,该基因为alsS。在另一个实施例中,该基因为fabF。在另一个实施例中,该基因为fabH。在另一个实施例中,该基因为假尿苷合酶。在另一个实施例中,该基因为pyrG。在另一个实施例中,该基因为truA。在另一个实施例中,该基因为pabB。在另一个实施例中,该基因为atp合酶基因(例如,atpC、atpD-2、aptG、atpA-2等)。
在另一个实施例中,该基因为phoP。在另一个实施例中,该基因为aroA。在另一个实施例中,该基因为aroC。在另一个实施例中,该基因为aroD。在另一个实施例中,该基因为plcB。
在另一个实施例中,该李斯特菌菌株是肽转运蛋白缺陷的。在另一个实施例中,该基因为ABC转运蛋白/ATP结合/通透酶蛋白。在另一个实施例中,该基因为寡肽ABC转运蛋白/寡肽结合蛋白。在另一个实施例中,该基因为寡肽ABC转运蛋白/通透酶蛋白。在另一个实施例中,该基因为锌ABC转运蛋白/锌结合蛋白。在另一个实施例中,该基因为糖ABC转运蛋白。在另一个实施例中,该基因为磷酸转运蛋白。在另一个实施例中,该基因为ZIP锌转运蛋白。在另一个实施例中,该基因为EmrB/QacA家族的耐药转运蛋白。在另一个实施例中,该基因为硫酸转运蛋白。在另一个实施例中,该基因为质子依赖性寡肽转运蛋白。在另一个实施例中,该基因为镁转运蛋白。在另一个实施例中,该基因为甲酸/硝酸转运蛋白。在另一个实施例中,该基因为亚精胺/腐胺ABC转运蛋白。在另一个实施例中,该基因为Na/Pi-协同转运蛋白。在另一个实施例中,该基因为磷酸糖转运蛋白。在另一个实施例中,该基因为谷氨酰胺ABC转运蛋白。在另一个实施例中,该基因为主要协助家族转运蛋白。在另一个实施例中,该基因为甘氨酸甜菜碱/L-脯氨酸ABC转运蛋白。在另一个实施例中,该基因为钼ABC转运蛋白。在另一个实施例中,该基因为磷壁酸ABC转运蛋白。在另一个实施例中,该基因为钴ABC转运蛋白。在另一个实施例中,该基因为铵转运蛋白。在另一个实施例中,该基因为氨基酸ABC转运蛋白。在另一个实施例中,该基因为细胞分裂ABC转运蛋白。在另一个实施例中,该基因为锰ABC转运蛋白。在另一个实施例中,该基因为铁化合物ABC转运蛋白。在另一个实施例中,该基因为麦芽糖/麦芽糖糊精ABC转运蛋白。在另一个实施例中,该基因为Bcr/CflA家族的耐药转运蛋白。在另一个实施例中,该基因为上述蛋白之一的亚基。
在一个实施例中,本文提供了核酸分子,该核酸分子用于转化李斯特菌以便获得重组李斯特菌。在另一个实施例中,本文提供的用于转化李斯特菌的核酸缺乏毒力基因。在另一个实施例中,该核酸分子整合进李斯特菌基因组并携带非功能性毒力基因。在另一个实施例中,该毒力基因在该重组李斯特菌中是突变的。在又一个实施例中,该核酸分子用于使李斯特菌基因组中存在的内源性基因失活。在又一个实施例中,该毒力基因为actA基因、inlA基因和inlB基因、inlC基因、inlJ基因、plbC基因、bsh基因或prfA基因。技术人员应当理解,该毒力基因可为本领域已知的任何与重组李斯特菌中的毒力相关的基因。
在又一个实施例中,李斯特菌菌株为inlA突变体、inlB突变体、inlC突变体、inlJ突变体、prfA突变体、ActA突变体、dal/dat突变体、prfA突变体、plcB缺失突变体或缺乏plcA和plcB的双突变体。在另一个实施例中,该李斯特菌包含这些基因的缺失或突变,无论是单独的,还是组合的。在另一个实施例中,本文提供的李斯特菌缺乏所述基因的每一个。在另一个实施例中,本文提供的李斯特菌缺乏至少1个且最多10个本文提供的任何基因,包括actA、prfA和dal/dat基因。在另一个实施例中,该prfA突变体为D133V prfA突变体。
在一个实施例中,减毒活李斯特菌为重组李斯特菌。在另一个实施例中,该重组李斯特菌包含基因组内化素C(inlC)基因的突变或缺失。在另一个实施例中,该重组李斯特菌包含基因组actA基因和基因组内化素C基因的突变或缺失。在一个实施例中,李斯特菌向邻近细胞的迁移通过参与该过程的actA基因和/或inlC基因的缺失而被抑制,由此产生出乎意料的高水平减毒,具有增加的免疫原性,并用作疫苗的骨架。每种可能性代表了本发明的独立实施例。
在一个实施例中,代谢基因、毒力基因等是李斯特菌菌株的染色体中缺乏的。在另一个实施例中,代谢基因、毒力基因等是李斯特菌菌株的染色体以及任何游离型遗传元件中缺乏的。在另一个实施例中,所述代谢基因、毒力基因等在毒力菌株的染色体中是缺乏的。在另一个实施例中,该毒力基因在染色体中是突变的。在另一个实施例中,该毒力基因从染色体缺失。每种可能性代表了本发明的独立实施例。
在一个实施例中,本文提供的重组李斯特菌菌株为减毒的。在另一个实施例中,该重组李斯特菌缺乏actA毒力基因。在另一个实施例中,该重组李斯特菌缺乏prfA毒力基因。在另一个实施例中,该重组李斯特菌缺乏inlB基因。在另一个实施例中,该重组李斯特菌同时缺乏actA和inlB基因。在另一个实施例中,本文提供的重组李斯特菌菌株包含内源性actA基因的失活突变。在另一个实施例中,本文提供的重组李斯特菌菌株包含内源性inlB基因的失活突变。在另一个实施例中,本文提供的重组李斯特菌菌株包含内源性inlC基因的失活突变。在另一个实施例中,本文提供的重组李斯特菌菌株包含内源性actA和inlB基因的失活突变。在另一个实施例中,本文提供的重组李斯特菌菌株包含内源性actA和inlC基因的失活突变。在另一个实施例中,本文提供的重组李斯特菌菌株包含内源性actA、inlB和inlC基因的失活突变。在另一个实施例中,本文提供的重组李斯特菌菌株包含内源性actA、inlB和inlC基因的失活突变。在另一个实施例中,本文提供的重组李斯特菌菌株包含内源性actA、inlB和inlC基因的失活突变。在另一个实施例中,本文提供的重组李斯特菌菌株包含以下基因中任何单个基因或组合中的失活突变:actA、dal、dat、inlB、inlC、prfA、plcA、plcB。
技术人员将理解的是,术语“突变”及其语法等同形式包括对序列(核酸或氨基酸序列)的任何类型的突变或修饰,并包括缺失突变、截短、失活、破坏或易位。这些类型的突变是本领域众所周知的。
在一个实施例中,为了选择包含编码代谢酶或补充本文提供的基因的质粒的营养缺陷型细菌,使转化的营养缺陷型细菌在将会选择氨基酸代谢基因或补充基因的表达的培养基上生长。在另一个实施例中,用包含用于D-谷氨酸合成的基因的质粒转化D-谷氨酸合成缺陷型细菌,并且该营养缺陷型细菌将在不存在D-谷氨酸的情况下生长,而未被该质粒转化或者不表达编码用于D-谷氨酸合成的蛋白的质粒的营养缺陷型细菌将不会生长。在另一个实施例中,如果本发明的质粒包含编码用于D-丙氨酸合成的氨基酸代谢酶的分离的核酸,D-丙氨酸合成营养缺陷型的细菌当被转化且表达所述质粒时,将在不存在D-丙氨酸的情况下生长。这样的用于制备适当的培养基(其包含或缺少必需生长因子、补充剂、氨基酸、维生素、抗生素等)的方法是本领域熟知的,且可商购获得(Becton-Dickinson,Franklin Lakes,NJ)。
在另一个实施例中,一旦在适当培养基上选择了包含本发明的质粒的营养缺陷型细菌,细菌即可在存在选择压力的情况下繁殖。这样的繁殖包括使细菌在无营养缺陷因子的培养基中生长。表达氨基酸代谢酶的质粒在营养缺陷型细菌中的存在将确保,该质粒将与该细菌一起复制,从而连续地选择携带该质粒的细菌。技术人员在获知本文的公开内容和方法后将能够容易地通过调整培养基(包含质粒的营养缺陷型细菌在其中生长)的体积来放大李斯特菌疫苗载体的生产。
技术人员应当理解,在另一个实施例中,其他营养缺陷型菌株和互补系统适合与本发明一起使用。
在一个实施例中,N末端LLO蛋白片段和异源性抗原在另一个实施例中直接互相融合。在另一个实施例中,编码N末端LLO蛋白片段和异源性抗原的基因直接互相融合。在另一个实施例中,N末端LLO蛋白片段和异源性抗原通过接头肽可操作地连接。在另一个实施例中,N末端LLO蛋白片段和异源性抗原通过异源性肽连接。在另一个实施例中,N末端LLO蛋白片段是异源性抗原的N末端。在另一个实施例中,N末端LLO蛋白片段是融合蛋白的最N末端部分。在另一个实施例中,截短的LLO在C末端截短以得到N末端LLO。如本文所提供,表达LLO的重组李斯特菌菌株出乎意料地使脾脏中CD4+FoxP3-T细胞和CD8+T细胞数量增加至高于不表达截短的LLO的重组李斯特菌菌株的水平(实例5),从而显示CD4+FoxP3-T细胞和CD8+T细胞的扩增直接由LLO介导(实例6)。如本文所进一步提供,游离型表达截短的LLO的重组李斯特菌,通过诱导CD4+FoxP3-T细胞和CD8+T的扩增,而不减少Treg的数量,出乎意料地提高了CD4+FoxP3-T细胞和CD8+T细胞与CD4+FoxP3+T细胞(调节性T细胞或Treg)的比率,从而以成比例的方式降低Treg频率。
在一个实施例中,截短的ActA蛋白和异源性抗原在另一个实施例中直接互相融合。在另一个实施例中,编码截短的ActA蛋白和异源性抗原的基因直接互相融合。在另一个实施例中,截短的ActA蛋白和异源性抗原通过接头肽可操作地连接。在另一个实施例中,截短的ActA蛋白和异源性抗原通过异源性肽连接。在另一个实施例中,截短的ActA蛋白在异源性抗原的N末端。在另一个实施例中,截短的ActA蛋白是融合蛋白的最N末端部分。在另一个实施例中,截短的ActA蛋白在C末端截短的以得到N末端ActA。
在一个实施例中,PEST氨基酸序列和异源性抗原在另一个实施例中直接互相融合。在另一个实施例中,编码PEST氨基酸序列和异源性抗原的基因直接互相融合。在另一个实施例中,PEST氨基酸序列和异源性抗原通过接头肽可操作地连接。在另一个实施例中,PEST氨基酸序列和异源性抗原通过异源性肽连接。在另一个实施例中,PEST氨基酸序列在异源性抗原的N末端。
在一个实施例中,包含在本发明的李斯特菌中的核酸分子编码重组多肽。在另一个实施例中,本文提供的重组李斯特菌菌株表达重组多肽。在另一个实施例中,该重组李斯特菌菌株包含编码重组多肽的质粒。在另一个实施例中,本文提供的重组核酸在本文提供的重组李斯特菌菌株的质粒中。在另一个实施例中,该质粒是不整合进所述重组李斯特菌菌株染色体中的游离型质粒。在另一个实施例中,该质粒是整合进所述李斯特菌菌株染色体中的整合型质粒。在另一个实施例中,该质粒为多拷贝质粒。
在一个实施例中,所述方法包括将重组李斯特菌与另外的疗法共施用的步骤。在另一个实施例中,该另外的疗法是手术、化疗、免疫疗法或它们的组合。在另一个实施例中,该另外的疗法在重组李斯特菌的施用之前进行。在另一个实施例中,该另外的疗法在重组李斯特菌的施用之后进行。在另一个实施例中,该另外的疗法是抗体疗法。在另一个实施例中,该抗体疗法是抗PD1、抗CTLA4。在另一个实施例中,该重组李斯特菌以增大剂量施用,以提高效应T细胞与调节性T细胞的比率,并产生更强大的抗肿瘤免疫应答。技术人员将会理解,抗肿瘤免疫应答可通过给患有肿瘤的受试者提供细胞因子进一步增强,该细胞因子包括但不限于IFN-γ、TNF-α以及本领域已知的增强细胞免疫应答的其他细胞因子,这些细胞因子中的一些可见于美国专利No.6,991,785,该专利以引用方式并入本文。
在一个实施例中,该异源性抗原是肿瘤相关抗原。在一个实施例中,如本文所提供的组合物和方法的重组李斯特菌菌株表达融合多肽,该融合多肽包含肿瘤细胞表达的抗原。
在另一个实施例中,该肿瘤相关抗原为人乳头瘤病毒(HPV)。在另一个实施例中,该肿瘤相关抗原为HPV-E7。在另一个实施例中,该抗原为HPV-E6。在另一个实施例中,该抗原为Her-2。在另一个实施例中,该抗原为NY-ESO-1。在另一个实施例中,该抗原为端粒酶。在另一个实施例中,该抗原为SCCE。在另一个实施例中,该抗原为WT-1。在另一个实施例中,该抗原为HIV-1Gag。在另一个实施例中,该抗原为蛋白酶3。在另一个实施例中,该抗原为酪氨酸酶相关蛋白2。在另一个实施例中,该抗原选自E7、E6、Her-2、NY-ESO-1、端粒酶、SCCE、WT-1、HIV-1Gag、蛋白酶3、酪氨酸酶相关蛋白2。在另一个实施例中,该抗原是肿瘤相关抗原。在另一个实施例中,该抗原是感染性疾病抗原。
在另一个实施例中,该肿瘤相关抗原是血管新生抗原。在另一个实施例中,该血管新生抗原在肿瘤新生血管中的活化周细胞和周细胞二者上表达,在另一个实施例中,它与体内新血管形成相关。在另一个实施例中,该血管新生抗原是HMW-MAA。在另一个实施例中,该血管新生抗原是本领域已知的抗原,并且在WO2010/102140中提供,该专利以引用方式并入本文。
在一个实施例中,本发明的组合物诱导强烈的干扰素-γ先天刺激,该干扰素-γ在一个实施例中具有抗血管新生性质。在一个实施例中,本发明的李斯特菌诱导强烈的干扰素-γ先天刺激,该干扰素-γ在一个实施例中具有抗血管新生性质(Dominiecki等人,Cancer Immunol Immunother.2005年5月;54(5):477-88.2004年10月6日电子版,以引用方式全文并入本文;Beatty和Paterson,J Immunol.2001年2月15日;166(4):2276-82,以引用方式全文并入本文)。在另一个实施例中,本发明的方法增加产干扰素γ细胞的水平。在一个实施例中,李斯特菌的抗血管新生性质通过CD4+T细胞介导(Beatty and Paterson,2001)。在另一个实施例中,李斯特菌的抗血管新生性质通过CD8+T细胞介导。在另一个实施例中,因李斯特菌疫苗接种导致的IFN-γ分泌由NK细胞、NKT细胞、Th1CD4+T细胞、TC1CD8+T细胞或它们的组合介导。
在另一个实施例中,本发明的组合物诱导一种或多种抗血管新生蛋白或因子的生成。在一个实施例中,该抗血管新生蛋白为IFN-γ。在另一个实施例中,该抗血管新生蛋白为色素上皮衍生因子(PEDF)、血管新生抑制素、内皮抑素、fms样酪氨酸激酶(sFlt)-1或可溶性内皮因子(sEng)。在一个实施例中,本发明的李斯特菌参与抗血管新生因子的释放,由此,在一个实施例中,除了作为用于将抗原引入受试者的载体之外还具有治疗作用。每个李斯特菌菌株及其类型代表了本发明的独立实施例。
在一个实施例中,该抗原源自真菌病原体、细菌、寄生虫、蠕虫或病毒。在另一个实施例中,该抗原选自破伤风类毒素、来自流感病毒的血凝素分子、白喉类毒素、HIV gp120、HIV gag蛋白、IgA蛋白酶、胰岛素肽B、马铃薯粉痂病菌(Spongospora subterranea)抗原、弧菌抗原、沙门氏菌(Salmonella)抗原、肺炎球菌抗原、呼吸道合胞体病毒抗原、流感嗜血杆菌(Haemophilus influenza)外膜蛋白、幽门螺杆菌(Helicobacter pylori)脲酶、脑膜炎奈瑟球菌(Neisseria meningitidis)菌毛蛋白、淋病奈瑟菌(N.gonorrhoeae)菌毛蛋白、黑素瘤相关抗原(TRP-2、MAGE-1、MAGE-3、gp-100、酪氨酸酶、MART-1、HSP-70、β-HCG)、来自HPV-16、HPV-18、HPV-31、HPV-33、HPV-35或HPV-45型人类乳头瘤病毒的人类乳头瘤病毒抗原E1和E2、肿瘤抗原CEA、突变或者其他形式的ras蛋白、突变或者其他形式的p53蛋白、Muc1、间皮素、EGFRVIII。
在其他实施例中,该抗原与以下疾病之一相关:霍乱、白喉、嗜血杆菌、甲型肝炎、乙型肝炎、流感、麻疹、脑膜炎、腮腺炎、百日咳、天花、肺炎球菌肺炎、脑灰质炎、狂犬病、风疹、破伤风、肺结核、伤寒、水痘-带状疱疹、百日咳、黄热病、来自爱迪生氏病的免疫原和抗原、过敏症、过敏反应、布鲁顿综合征、癌症、包括实体和血源性肿瘤、湿疹、桥本氏甲状腺炎、多肌炎、皮肌炎、1型糖尿病、获得性免疫缺陷综合征、移植排斥、例如肾、心脏、胰腺、肺、骨骼和肝脏移植物、格雷夫斯病、多内分泌自身免疫病、肝炎、显微镜下多动脉炎、结节性多动脉炎、天疱疮、原发性胆汁性肝硬化、恶性贫血、乳糜泻、抗体介导的肾炎、血管球性肾炎、风湿病、全身性红斑狼疮、类风湿性关节炎、血清阴性脊椎关节病、鼻炎、Sjogren综合征、全身性硬化症、硬化性胆管炎、韦格纳氏肉芽肿、疱疹样皮炎、牛皮癣、白癜风、多发性硬化症、脑脊髓炎、吉兰-巴雷综合征、重症肌无力、兰伯特-伊顿综合征、巩膜、巩膜外层、色素层炎、慢性粘膜皮肤念珠菌病、风疹、婴儿短暂性低丙种球蛋白血症、骨髓瘤、X-连锁高IgM综合征、斯科特-奥尔德里奇综合征、共济失调性毛细血管扩张症、自身免疫性溶血性贫血、自身免疫性血小板减少症、自身免疫性中性粒细胞减少症、瓦尔登斯特伦巨球蛋白血、淀粉样变性、慢性淋巴细胞白血病、非霍奇金淋巴瘤、疟疾circumsporozite蛋白、微生物抗原、病毒抗原、自身抗原以及李斯特菌病。
在另一个实施例中,本文提供的异源性抗原为肿瘤相关抗原,其在一个实施例中为以下肿瘤抗原之一:MAGE(黑素瘤相关抗原E)蛋白,例如MAGE 1、MAGE 2、MAGE 3、MAGE 4、酪氨酸酶;突变体ras蛋白;突变体p53蛋白;p97黑素瘤抗原、与晚期癌症相关的ras肽或p53肽;与子宫颈癌相关的HPV16/18抗原、与乳腺癌相关的KLH抗原、与结肠直肠癌相关的CEA(癌胚抗原)、gp100、与黑素瘤相关的MART1抗原。在另一个实施例中,用于如本文所提供的组合物和方法的抗原是黑素瘤相关抗原,在一个实施例中,它是TRP-2、MAGE-1、MAGE-3、gp-100、酪氨酸酶、HSP-70、β-HCG或它们的组合。
在一个实施例中,该抗原为美国专利No.9,084,747中描述的嵌合Her2抗原,该专利据此以引用方式全文并入本文。
在另一个实施例中,该抗原为HPV-E7。在另一个实施例中,该抗原为HPV-E6。在另一个实施例中,该抗原为Her-2/ne。在另一个实施例中,该抗原为NY-ESO-1。在另一个实施例中,该抗原为端粒酶(TERT)。在另一个实施例中,该抗原为SCCE。在另一个实施例中,该抗原为CEA。在另一个实施例中,该抗原为LMP-1。在另一个实施例中,该抗原为p53。在另一个实施例中,该抗原为碳酸酐酶IX(CAIX)。在另一个实施例中,该抗原为PSMA。在另一个实施例中,该抗原为前列腺干细胞抗原(PSCA)。在另一个实施例中,该抗原为HMW-MAA。在另一个实施例中,该抗原为WT-1。在另一个实施例中,该抗原为HIV-1Gag。在另一个实施例中,该抗原为蛋白酶3。在另一个实施例中,该抗原为酪氨酸酶相关蛋白2。在另一个实施例中,该抗原选自HPV-E7、HPV-E6、Her-2、NY-ESO-1、端粒酶(TERT)、SCCE、HMW-MAA、EGFR-III、存活素、凋亡重复序列包含棒状病毒抑制因子5(BIRC5)、WT-1、HIV-1Gag、CEA、LMP-1、p53、PSMA、PSCA、蛋白酶3、酪氨酸酶相关蛋白2、Muc1或它们的组合。
在一个实施例中,本发明的李斯特菌表达的融合多肽可包含神经肽生长因子拮抗剂,其在一个实施例中为[D-Arg1,D-Phe5,D-Trp7,9,Leu11]物质P、[Arg6,D-Trp7,9,NmePhe8]物质P(6-11)。这些实施例和相关的实施例是本领域技术人员可理解的。
在另一个实施例中,该异源性抗原是感染性疾病抗原。在一个实施例中,该抗原是自体抗原或自身抗原。
在另一个实施例中,该异源性抗原源自真菌病原体、细菌、寄生虫、蠕虫或病毒。在另一个实施例中,该抗原选自破伤风类毒素、来自流感病毒的血凝素分子、白喉类毒素、HIV gp120、HIV gag蛋白、IgA蛋白酶、胰岛素肽B、马铃薯粉痂病菌(Spongospora subterranea)抗原、弧菌抗原、沙门氏菌(Salmonella)抗原、肺炎球菌抗原、呼吸道合胞体病毒抗原、流感嗜血杆菌(Haemophilus influenza)外膜蛋白、幽门螺杆菌(Helicobacter pylori)脲酶、脑膜炎奈瑟球菌(Neisseria meningitidis)菌毛蛋白、淋病奈瑟菌(N.gonorrhoeae)菌毛蛋白、来自HPV-16、HPV-18、HPV-31、HPV-33、HPV-35或HPV-45型人类乳头瘤病毒的人类乳头瘤病毒抗原E1和E2、或它们的组合。
在另外的实施例中,该异源性抗原与以下疾病之一相关:霍乱、白喉、嗜血杆菌、甲型肝炎、乙型肝炎、流感、麻疹、脑膜炎、腮腺炎、百日咳、天花、肺炎球菌肺炎、脑灰质炎、狂犬病、风疹、破伤风、肺结核、伤寒、水痘-带状疱疹、百日咳、黄热病、来自爱迪生氏病的免疫原和抗原、过敏症、过敏反应、布鲁顿综合征、癌症、包括实体和血源性肿瘤、湿疹、桥本氏甲状腺炎、多肌炎、皮肌炎、1型糖尿病、获得性免疫缺陷综合征、移植排斥、例如肾、心脏、胰腺、肺、骨骼和肝脏移植物、格雷夫斯病、多内分泌自身免疫病、肝炎、显微镜下多动脉炎、结节性多动脉炎、天疱疮、原发性胆汁性肝硬化、恶性贫血、乳糜泻、抗体介导的肾炎、血管球性肾炎、风湿病、全身性红斑狼疮、类风湿性关节炎、血清阴性脊椎关节病、鼻炎、Sjogren综合征、全身性硬化症、硬化性胆管炎、韦格纳氏肉芽肿、疱疹样皮炎、牛皮癣、白癜风、多发性硬化症、脑脊髓炎、吉兰-巴雷综合征、重症肌无力、兰伯特-伊顿综合征、巩膜、巩膜外层、色素层炎、慢性粘膜皮肤念珠菌病、风疹、婴儿短暂性低丙种球蛋白血症、骨髓瘤、X-连锁高IgM综合征、斯科特-奥尔德里奇综合征、共济失调性毛细血管扩张症、自身免疫性溶血性贫血、自身免疫性血小板减少症、自身免疫性中性粒细胞减少症、瓦尔登斯特伦巨球蛋白血、淀粉样变性、慢性淋巴细胞白血病、非霍奇金淋巴瘤、疟疾circumsporozite蛋白、微生物抗原、病毒抗原、自身抗原以及李斯特菌病。每种抗原代表了如本文所提供的方法和组合物的独立实施例。
如本文所提供的方法和组合物所诱导的免疫应答在另一个实施例中为T细胞应答。在另一个实施例中,该免疫应答包括T细胞应答。在另一个实施例中,该应答为CD8+T细胞应答。在另一个实施例中,该应答包括CD8+T细胞应答。
在一个实施例中,如本文所提供的组合物和方法的重组李斯特菌包含编码血管新生多肽或血管新生抗原的核酸。在另一个实施例中,抗血管新生癌症疗法大有前景,并且在一个实施例中,一种类型的此类抗血管新生疗法靶向周细胞。在另一个实施例中,在血管内皮细胞和周细胞上的分子靶标是抗肿瘤疗法的重要靶标。在另一个实施例中,血小板源生长因子受体(PDGF-B/PDGFR-β)信号传导对于将周细胞募集到新形成的血管具有重要意义。因此,在一个实施例中,如本文所提供的血管新生多肽抑制周细胞信号传导中涉及到的分析,该分子在一个实施例中为PDGFR-β。
在一个实施例中,本发明的组合物包含血管新生因子或其免疫原性片段,其中在一个实施例中,免疫原性片段包含由宿主免疫系统识别的一个或多个表位。在一个实施例中,血管新生因子是在新的血管的形成中涉及到的分子。在一个实施例中,血管新生因子是VEGFR2。在另一个实施例中,本发明的血管新生因子是:血管生成素;血管生成素-1;Del-1;成纤维细胞生长因子:酸性(aFGF)和碱性(bFGF);卵泡抑素;粒细胞集落刺激因子(G-CSF);肝细胞生长因子(HGF)/分散因子(SF);白细胞介素-8(IL-8);痩素;中期因子;胎盘生长因子;血小板衍生内皮细胞生长因子(PD-ECGF);血小板衍生生长因子-BB(PDGF-BB);多效生长因子(PTN);颗粒蛋白前体;增殖素;存活素;转化生长因子-α(TGF-α);转化生长因子-β(TGF-β);肿瘤坏死因子-α(TNF-α);血管内皮生长因子(VEGF)/血管渗透因子(VPF)。在另一个实施例中,血管新生因子血管新生蛋白。在一个实施例中,生长因子是血管新生蛋白。在一个实施例中,用于本发明的组合物和方法的血管新生蛋白是:成纤维细胞生长因子(FGF)、VEGF、VEGFR和神经菌毛素1(NRP-1)、血管生成素1(Ang1)和Tie2、血小板源生长因子(PDGF、BB-同二聚体)和PDGFR、转化生长因子-β(TGF-β)、内皮因子和TGF-β受体、单核细胞趋化蛋白-1(MCP-1)、整合素αVβ3、αVβ5和α5β1、VE-钙粘素和CD31、肝配蛋白(ephrin)、纤溶酶原激活物、纤溶酶原激活物抑制剂-1、一氧化氮合酶(NOS)和COX-2、AC133或Id1/Id3。在一个实施例中,用于本发明的组合物和方法的血管新生蛋白是血管生成素,其在一个实施例中是血管生成素1、血管生成素3、血管生成素4或血管生成素6。在一个实施例中,内皮因子也称为CD105、EDG、HHT1、ORW或ORW1。在一个实施例中,内皮因子TGFβ共受体。
在一个实施例中,本文提供的免疫原性组合物可用于预防、阻遏、抑制或治疗自身免疫疾病。在一个实施例中,自身免疫疾病为本领域已知的任何自身免疫疾病,包括但不限于:风湿性关节炎(RA)、胰岛素依赖型糖尿病(1型糖尿病)、多发性硬化症(MS)、克罗恩病(Crohn's disease)、系统性红斑狼疮(SLE)、硬皮病、干燥综合征(Sjogren's syndrome)、寻常型天疱疮、类天疱疮、阿狄森氏病(addison's disease)、强直性脊柱炎、再生障碍性贫血、自身免疫性溶血性贫血、自身免疫性肝炎、腹腔疾病、皮肌炎、肺出血-肾炎综合征(Goodpasture's syndrome)、格雷夫斯病(Graves'disease)、Guillain-Barre综合征、桥本氏病(Hashimoto's disease)、特发性白细胞减少症、特发性血小板减少性紫癜、男性不育、混合型结缔组织病、重症肌无力、恶性贫血、致病性葡萄膜炎、原发性胆汁性肝硬化、原发性粘液性水肿、瑞特综合征(Reiter's syndrome)、僵人综合征、甲状腺毒症、溃疡性结肠炎和韦氏肉芽肿病(Wegener's granulomatosis)。在另一个实施例中,本发明还涉及根据本发明的针对ICOS的激动剂抗体或其衍生物用于治疗炎性障碍,所述炎性障碍选自神经系统的炎性障碍诸如多发性硬化症,粘膜炎性障碍诸如炎性肠病、哮喘或扁桃体炎,炎性皮肤疾病诸如皮炎、牛皮癣或接触性超敏反应,以及自身免疫性关节炎诸如类风湿性关节炎。
在一个实施例中,如本文所提供的组合物及其使用方法生成能够浸润肿瘤、破坏肿瘤细胞并根除疾病的效应T细胞。在另一个实施例中,本发明的使用方法增强效应T细胞对肿瘤的浸润。在另一个实施例中,效应T细胞包括CD45+CD8+T细胞。在另一个实施例中,效应T细胞包括CD4+Fox3P T细胞。
在一个实施例中,天然存在的肿瘤浸润性淋巴细胞(TIL)与多种肿瘤诸如结肠癌、卵巢癌和黑素瘤中更好的预后相关。在结肠癌中,不具有微转移信号的肿瘤具有增加的免疫细胞浸润和Th1表达谱,这与改善的患者存活相关。此外,T细胞对肿瘤的浸润在临床前和临床试验中都已与免疫疗法的成功相关。在一个实施例中,淋巴细胞浸润到肿瘤部位中依赖于肿瘤血管的内皮细胞中粘附分子的上调,这种上调通常通过促炎性细胞因子诸如IFN-γ、TNF-α和IL-1进行。若干粘附分子已在淋巴细胞浸润到肿瘤中的过程中牵涉,包括细胞间粘附分子1(ICAM-1)、血管内皮细胞粘附分子1(V-CAM-1)、血管粘附蛋白1(VAP-1)和E-选择素。然而,这些细胞粘附分子通常在肿瘤血管中下调。因此,在一个实施例中,如本文所提供的癌症疫苗增加TIL,上调粘附分子(在一个实施例中,ICAM-1、V-CAM-1、VAP-1、E-选择素或它们的组合),上调促炎性细胞因子(在一个实施例中,IFN-γ、TNF-α、IL-1或它们的组合)或它们的组合。
在一个实施例中,该HPV抗原为HPV 16。在另一个实施例中,该HPV为HPV-18。在另一个实施例中,该HPV选自HPV-16和HPV-18。在另一个实施例中,该HPV为HPV-31。在另一个实施例中,该HPV为HPV-35。在另一个实施例中,该HPV为HPV-39。在另一个实施例中,该HPV为HPV-45。在另一个实施例中,该HPV为HPV-51。在另一个实施例中,该HPV为HPV-52。在另一个实施例中,该HPV为HPV-58。在另一个实施例中,该HPV为高风险HPV型。在另一个实施例中,该HPV为粘膜HPV型。每种可能性代表了本发明的独立实施例。
在一个实施例中,HPV E6来自HPV-16。在另一个实施例中,HPV E7来自HPV-16。在另一个实施例中,HPV-E6来自HPV-18。在另一个实施例中,HPV-E7来自HPV-18。在另一个实施例中,在用于治疗或改善HPV相关疾病、障碍或症状的本发明的组合物和方法中,代替E7抗原或作为其补充,使用HPV E6抗原。在另一个实施例中,代替HPV-18E6和E7或与之组合,使用HPV-16E6和E7。在这样的实施例中,重组李斯特菌可从染色体表达HPV-16E6和E7并从质粒表达HPV-18E6和E7,或反之亦然。在另一个实施例中,HPV-16E6和E7抗原以及HPV-18E6和E7抗原从存在于本文提供的重组李斯特菌中的质粒表达。在另一个实施例中,HPV-16E6和E7抗原以及HPV-18E6和E7抗原从本文提供的重组李斯特菌的染色体表达。在另一个实施例中,HPV-16E6和E7抗原以及HPV-18E6和E7抗原在以上实施例的任何组合中表达,包括其中得自各HPV株的各E6和E7抗原从质粒或染色体表达的实施例。
在一个实施例中,本文提供的疾病为癌症或肿瘤。在一个实施例中,由本发明的方法处理的癌症为乳腺癌。在另一个实施例中,癌症为宫颈癌。在另一个实施例中,癌症为含Her2的癌症。在另一个实施例中,癌症为黑素瘤。在另一个实施例中,癌症为胰腺癌。在另一个实施例中,癌症为卵巢癌。在另一个实施例中,癌症为胃癌。在另一个实施例中,癌症为胰腺的癌性病变。在另一个实施例中,癌症为肺腺癌。在另一个实施例中,其为多形性胶质母细胞瘤。在另一个实施例中,癌症为结直肠腺癌。在另一个实施例中,癌症为肺鳞癌。在另一个实施例中,癌症为胃腺癌。在另一个实施例中,癌症为卵巢表面上皮肿瘤(例如其良性的、增生性的或恶性的种类)。在另一个实施例中,癌症为口腔鳞状细胞癌。在另一个实施例中,癌症为非小细胞肺癌。在另一个实施例中,癌症为子宫内膜癌。在另一个实施例中,癌症为膀胱癌。在另一个实施例中,癌症为头颈癌。在另一个实施例中,癌症为前列腺癌。在另一个实施例中,癌症为口咽癌。在另一个实施例中,癌症为肺癌。在另一个实施例中,癌症为肛门癌。在另一个实施例中,癌症为结肠直肠癌。在另一个实施例中,癌症为食道癌。在另一个实施例中,癌症为间皮瘤。每种可能性代表了本发明的独立实施例。
在一个实施例中,截短的LLO包含PEST氨基酸(AA)序列。在另一个实施例中,该PEST氨基酸序列为KENSISSMAPPASPPASPKTPIEKKHADEIDK(SEQ ID NO:1)。在另一个实施例中,抗原与李斯特菌的其他LM PEST AA序列的融合也将提高抗原的免疫原性。
本发明的方法和组合物的N末端LLO蛋白片段在另一个实施例中包含SEQ ID No:2。在另一个实施例中,该片段包含LLO信号肽。在另一个实施例中,该片段包含SEQ ID No:3。在另一个实施例中,该片段大约由SEQ ID No:3组成。在另一个实施例中,该片段基本上由SEQ ID No:3组成。在另一个实施例中,该片段对应于SEQ ID No:3。在另一个实施例中,该片段与SEQ ID No:3同源。在另一个实施例中,该片段与SEQ ID No:3的片段同源。用于一些实例的ΔLLO的长度为416个AA(不包括信号序列),因为包括含有半胱氨酸484的激活域在内的氨基末端的88个残基被截短。本领域的技术人员将会知道,无激活域具体地讲无半胱氨酸484的任何ΔLLO均适用于本发明的方法和组合物。在另一个实施例中,异源性抗原与任何ΔLLO(包括PEST AA序列SEQ ID NO:1)的融合增强了抗原的细胞介导的抗肿瘤免疫性。每种可能性代表了本发明的独立实施例。
在另一个实施例中,用于构建本发明的疫苗的LLO蛋白具有以下序列:
MKKIMLVFITLILVSLPIAQQTEAKDASAFNKENSISSMAPPASPPASPKTPIEKKHADEIDKYIQGLDYNKNNVLVYHGDAVTNVPPRKGYKDGNEYIVVEKKKKSINQNNADIQVVNAISSLTYPGALVKANSELVENQPDVLPVKRDSLTLSIDLPGMTNQDNKIVVKNATKSNVNNAVNTLVERWNEKYAQAYPNVSAKIDYDDEMAYSESQLIAKFGTAFKAVNNSLNVNFGAISEGKMQEEVISFKQIYYNVNVNEPTRPSRFFGKAVTKEQLQALGVNAENPPAYISSVAYGRQVYLKLSTNSHSTKVKAAFDAAVSGKSVSGDVELTNIIKNSSFKAVIYGGSAKDEVQIIDGNLGDLRDILKKGATFNRETPGVPIAYTTNFLKDNELAVIKNNSEYIETTSKAYTDGKINIDHSGGYVAQFNISWDEVNYDPEGNEIVQHKNWSENNKSKLAHFTSSIYLPGNARNINVYAKECTGLAWEWWRTVIDDRNLPLVKNRNISIWGTTLYPKYSNKVDNPIE(GenBank登录号P13128;SEQ ID NO:4;核酸序列在GenBank登录号X15127中示出)。对应于该序列的前蛋白的前25个AA为信号序列,并在由细菌分泌时从LLO切除。因此,在本实施例中,全长的活性LLO蛋白为504个残基长。在另一个实施例中,将以上LLO片段用作并入本发明的疫苗中的LLO片段的来源。
在另一个实施例中,用于本发明的组合物和方法的LLO蛋白的N末端片段具有以下序列:
MKKIMLVFITLILVSLPIAQQTEAKDASAFNKENSISSVAPPASPPASPKTPIEKKHADEIDKYIQGLDYNKNNVLVYHGDAVTNVPPRKGYKDGNEYIVVEKKKKSINQNNADIQVVNAISSLTYPGALVKANSELVENQPDVLPVKRDSLTLSIDLPGMTNQDNKIVVKNATKSNVNNAVNTLVERWNEKYAQAYSNVSAKIDYDDEMAYSESQLIAKFGTAFKAVNNSLNVNFGAISEGKMQEEVISFKQIYYNVNVNEPTRPSRFFGKAVTKEQLQALGVNAENPPAYISSVAYGRQVYLKLSTNSHSTKVKAAFDAAVSGKSVSGDVELTNIIKNSSFKAVIYGGSAKDEVQIIDGNLGDLRDILKKGATFNRETPGVPIAYTTNFLKDNELAVIKNNSEYIETTSKAYTDGKINIDHSGGYVAQFNISWDEVNYD(SEQ ID NO:2)。
在另一个实施例中,该LLO片段对应于本文所用的LLO蛋白的约AA 20-442。
在另一个实施例中,该LLO片段具有以下序列:
MKKIMLVFITLILVSLPIAQQTEAKDASAFNKENSISSVAPPASPPASPKTPIEKKHADEIDKYIQGLDYNKNNVLVYHGDAVTNVPPRKGYKDGNEYIVVEKKKKSINQNNADIQVVNAISSLTYPGALVKANSELVENQPDVLPVKRDSLTLSIDLPGMTNQDNKIVVKNATKSNVNNAVNTLVERWNEKYAQAYSNVSAKIDYDDEMAYSESQLIAKFGTAFKAVNNSLNVNFGAISEGKMQEEVISFKQIYYNVNVNEPTRPSRFFGKAVTKEQLQALGVNAENPPAYISSVAYGRQVYLKLSTNSHSTKVKAAFDAAVSGKSVSGDVELTNIIKNSSFKAVIYGGSAKDEVQIIDGNLGDLRDILKKGATFNRETPGVPIAYTTNFLKDNELAVIKNNSEYIETTSKAYTD(SEQ ID NO:3)。
在另一个实施例中,“截短的LLO”或“ΔLLO”指包含推定的PEST氨基酸序列的LLO片段。在另一个实施例中,该术语是指包含推定的PEST域的LLO片段。在另一个实施例中,术语“截短的LLO”和“N末端LLO”在本文可互换使用。
在另一个实施例中,该术语是指不包含氨基末端的活化域并且不包含胱氨酸484的LLO片段。在另一个实施例中,该术语是指非溶血性LLO片段。在另一个实施例中,LLO片段因活化域的缺失或突变而成为非溶血的。在另一个实施例中,LLO片段因半胱氨酸484的缺失或突变而成为非溶血的。在另一个实施例中,LLO片段因另一位置的缺失或突变而成为非溶血的。在另一个实施例中,LLO因胆固醇结合域(CBD)的缺失或突变而成为非溶血性的,如美国专利No.8,771,702中所述,该专利以引用方式并入本文。
在另一个实施例中,该LLO片段由该LLO蛋白的大约前441个AA构成。在另一个实施例中,该LLO片段由LLO的大约前420个AA构成。在另一个实施例中,该LLO片段为LLO蛋白的非溶血形式。
在另一个实施例中,该LLO片段由大约残基1-25构成。在另一个实施例中,该LLO片段由大约残基1-50构成。在另一个实施例中,该LLO片段由大约残基1-75构成。在另一个实施例中,该LLO片段由大约残基1-100构成。在另一个实施例中,该LLO片段由大约残基1-125构成。在另一个实施例中,该LLO片段由大约残基1-150构成。在另一个实施例中,该LLO片段由大约残基1-175构成。在另一个实施例中,该LLO片段由大约残基1-200构成。在另一个实施例中,该LLO片段由大约残基1-225构成。在另一个实施例中,该LLO片段由大约残基1-250构成。在另一个实施例中,该LLO片段由大约残基1-275构成。在另一个实施例中,该LLO片段由大约残基1-300构成。在另一个实施例中,该LLO片段由大约残基1-325构成。在另一个实施例中,该LLO片段由大约残基1-350构成。在另一个实施例中,该LLO片段由大约残基1-375构成。在另一个实施例中,该LLO片段由大约残基1-400构成。在另一个实施例中,该LLO片段由大约残基1-425构成。
在另一个实施例中,该LLO片段包含对应于以上AA范围之一的同源LLO蛋白的残基。残基编号在另一个实施例中不必精确对应以上列举的残基编号;例如,如果该同源LLO蛋白相对于本文所用的LLO蛋白具有插入或缺失,则可因此而调整该残基编号。在另一个实施例中,该LLO片段为本领域已知的任何其他LLO片段。
在另一个实施例中,同源LLO是指与LLO序列(如,与SEQ ID No:2-4之一)的同一性大于70%。在另一个实施例中,同源LLO是指与SEQ ID No:2-4之一的同一性大于72%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性大于75%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性大于78%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性大于80%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性大于82%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性大于83%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性大于85%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性大于87%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性大于88%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性大于90%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性大于92%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性大于93%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性大于95%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性大于96%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性大于97%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性大于98%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性大于99%。在另一个实施例中,同源是指与SEQ ID No:2-4之一的同一性为100%。
在另一个实施例中,当提及本文提供的任何核酸序列时,术语“同源性”类似地指候选序列中与相应天然核酸序列的核苷酸相同的核苷酸的百分比。
在一个实施例中,通过序列比对的计算机算法、通过本领域中充分描述的方法来确定同源性。例如,核酸序列同源性的计算机算法分析可以包括使用多种可用软件包,比如BLAST、DOMAIN、BEAUTY(BLAST Enhanced Alignment Utility)、GENPEPT和TREMBL软件包。
在另一个实施例中,“同源性”是指与选自本文提供的序列的序列的同一性大于68%。在另一个实施例中,“同源性”是指与选自本文提供的序列的序列的同一性大于70%。在另一个实施例中,“同源性”是指与选自本文提供的序列的序列的同一性大于72%。在另一个实施例中,该同一性大于75%。在另一个实施例中,该同一性大于78%。在另一个实施例中,该同一性大于80%。在另一个实施例中,该同一性大于82%。在另一个实施例中,该同一性大于83%。在另一个实施例中,该同一性大于85%。在另一个实施例中,该同一性大于87%。在另一个实施例中,该同一性大于88%。在另一个实施例中,该同一性大于90%。在另一个实施例中,该同一性大于92%。在另一个实施例中,该同一性大于93%。在另一个实施例中,该同一性大于95%。在另一个实施例中,该同一性大于96%。在另一个实施例中,该同一性大于97%。在另一个实施例中,该同一性大于98%。在另一个实施例中,该同一性大于99%。在另一个实施例中,该同一性为100%。
在另一个实施例中,通过确定候选序列杂交来确定同源性,其方法在现有技术中有充分描述(参见,例如“Nucleic Acid Hybridization"Hames,B.D.和Higgins S.J.编(1985);Sambrook等人,2001,Molecular Cloning,A Laboratory Manual,Cold Spring Harbor Press,N.Y.;以及Ausubel等人,1989,Current Protocols in Molecular Biology,Green Publishing Associates and Wiley Interscience,N.Y)。例如,可在中等至严格条件下进行与编码天然半胱天冬酶肽的DNA的互补序列杂交的方法。杂交条件为例如在包含以下物质的溶液中42℃下温育过夜:10-20%甲酰胺、5X SSC(150mM NaCl,15mM柠檬酸三钠)、50mM磷酸钠(pH 7.6)、5X登哈特溶液、10%硫酸葡聚糖和20μg/ml变性的经剪切的鲑鱼精DNA。
在如本文所提供的方法和组合物的另一个实施例中,“核酸”或“核苷酸”指一串至少两个碱基-糖-磷酸的组合。在一个实施例中,该术语包括DNA和RNA。在一个实施例中,“核苷酸”是指核酸聚合物的单体单元。在一个实施例中,RNA可为tRNA(转运RNA)、snRNA(小核RNA)、rRNA(核糖体RNA)、mRNA(信使RNA)、反义RNA、小干扰RNA(siRNA)、微RNA(miRNA)和核糖酶的形式。siRNA和miRNA的使用已有所描述(Caudy AA等人,Genes&Devel 16:2491-96及其中引用的参考文献)。DNA可以是质粒DNA、病毒DNA、线性DNA或染色体DNA或这些分组的衍生物的形式。此外,这些形式的DNA和RNA可以是单链、双链、三链或四链的。在另一个实施例中,该术语还包括可包含其他类型的主链但具有相同碱基的人工核酸。在一个实施例中,人工核酸是PNA(肽核酸)。PNA包含肽主链和核苷酸碱基,并且在一个实施例中能够结合DNA和RNA两种分子。在另一个实施例中,核苷酸是氧杂环丁烷修饰的。在另一个实施例中,核苷酸通过用硫代磷酸键代替一个或多个磷酸二酯键来修饰。在另一个实施例中,人工核酸包含本领域已知的天然核酸的磷酸主链的任何其他变体。硫代磷酸核酸和PNA的使用是本领域的技术人员已知的,并且在例如Neilsen PE,Curr Opin Struct Biol 9:353-57和Raz NK等人Biochem Biophys Res Commun.297:1075-84中有所描述。核酸的制备和使用是本领域的技术人员已知的,并且在例如Molecular Cloning,(2001),Sambrook和Russell编,和Methods in Enzymology:Methods for molecular cloning in eukaryotic cells(2003)Purchio and G.C.Fareed中有所描述。每种核酸衍生物代表了如本文所提供的独立实施例。
在一个实施例中,术语“肽”是指原生肽(降解产物、合成法合成的肽或重组肽)和/或模拟肽(通常为合成法合成的肽),诸如作为肽类似物的拟肽和半拟肽,所述肽类似物可具有例如能使肽在体内时更稳定或更能够渗透到细胞中的修饰。此类修饰包括但不限于N末端修饰、C末端修饰、肽键修饰(包括但不限于CH2-NH、CH2-S、CH2-S=O、O=C-NH、CH2-O、CH2-CH2、S=C-NH、CH=CH或CF=CH)、主链修饰和残基修饰。制备模拟肽化合物的方法是本领域熟知的,并在例如Quantitative Drug Design,C.A.Ramsden Gd.,Chapter 17.2,F.Choplin Pergamon Press(1992)中有详细说明,该文献以引用方式并入,如同在本文完整示出一样。下文提供该方面的进一步细节。
肽当中的肽键(-CO-NH-)可例如被以下键取代:N-甲基化键(-N(CH3)-CO-)、酯键(-C(R)H-C-O-O-C(R)-N-)、酮亚甲基键(-CO-CH2-)、*-氮杂键(-NH-N(R)-CO-)(其中R为任何烷基,例如甲基)、亚甲基氨基键(carba bond)(-CH2-NH-)、羟亚乙基键(-CH(OH)-CH2-)、硫代酰胺键(-CS-NH-)、烯烃双键(-CH=CH-)、反酰胺键(-NH-CO-)、肽衍生物(-N(R)-CH2-CO-),其中R为天然存在于碳原子上的“正常”侧链。
这些修饰可出现在沿着肽链的任何键上,甚至同时出现在几个(2-3个)键上。天然芳族氨基酸Trp、Tyr和Phe可被合成的非天然酸诸如TIC、萘基丙氨酸(Nol)、Phe的环甲基化衍生物、Phe的卤化衍生物或o-甲基-Tyr取代。
除以上之外,如本文所提供的肽还可包含一个或多个经修饰的氨基酸或一个或多个非氨基酸单体(例如脂肪酸、复合碳水化合物等)。
在一个实施例中,术语“寡核苷酸”可与术语“核酸”互换,并且可以指可包括但不限于原核序列、真核mRNA、得自真核mRNA的cDNA、得自真核(例如哺乳动物)DNA的基因组DNA序列和甚至合成DNA序列的分子。该术语还指包括任何已知的DNA和RNA碱基类似物的序列。
在一个实施例中,通过本领域充分描述的方法确定蛋白和/或肽对本文列出的任何氨基酸序列的同源性,包括免疫印迹分析,或通过建立的方法采用多种可用软件包中的任一种通过氨基酸序列的计算机算法分析进行。例如,这些软件包中的一些可包括FASTA、BLAST、MPsrch或Scanps软件包,并且可利用Smith和Waterman算法,和/或整体/局部或BLOCKS比对用于分析。每种确定同源性的方法代表了本发明的独立实施例。
在一个实施例中,本文提供的李斯特菌菌株编码融合到HPV-E7抗原的截短LLO的融合蛋白。在另一个实施例中,编码tLLO-E7融合蛋白的序列包含SEQ ID NO:13:
atgaaaaaaataatgctagtttttattacacttatattagttagtctaccaattgcgcaacaaactgaagcaaaggatgcatctgcattcaataaagaaaattcaatttcatccatggcaccaccagcatctccgcctgcaagtcctaagacgccaatcgaaaagaaacacgcggatgaaatcgataagtatatacaaggattggattacaataaaaacaatgtattagtataccacggagatgcagtgacaaatgtgccgccaagaaaaggttacaaagatggaaatgaatatattgttgtggagaaaaagaagaaatccatcaatcaaaataatgcagacattcaagttgtgaatgcaatttcgagcctaacctatccaggtgctctcgtaaaagcgaattcggaattagtagaaaatcaaccagatgttctccctgtaaaacgtgattcattaacactcagcattgatttgccaggtatgactaatcaagacaataaaatagttgtaaaaaatgccactaaatcaaacgttaacaacgcagtaaatacattagtggaaagatggaatgaaaaatatgctcaagcttatccaaatgtaagtgcaaaaattgattatgatgacgaaatggcttacagtgaatcacaattaattgcgaaatttggtacagcatttaaagctgtaaataatagcttgaatgtaaacttcggcgcaatcagtgaagggaaaatgcaagaagaagtcattagttttaaacaaatttactataacgtgaatgttaatgaacctacaagaccttccagatttttcggcaaagctgttactaaagagcagttgcaagcgcttggagtgaatgcagaaaatcctcctgcatatatctcaagtgtggcgtatggccgtcaagtttatttgaaattatcaactaattcccatagtactaaagtaaaagctgcttttgatgctgccgtaagcggaaaatctgtctcaggtgatgtagaactaacaaatatcatcaaaaattcttccttcaaagccgtaatttacggaggttccgcaaaagatgaagttcaaatcatcgacggcaacctcggagacttacgcgatattttgaaaaaaggcgctacttttaatcgagaaacaccaggagttcccattgcttatacaacaaacttcctaaaagacaatgaattagctgttattaaaaacaactcagaatatattgaaacaacttcaaaagcttatacagatggaaaaattaacatcgatcactctggaggatacgttgctcaattcaacatttcttgggatgaagtaaattatgatctcgagCATGGAGATACACCTACATTGCATGAATATATGTTAGATTTGCAACCAGAGACAACTGATCTCTACTGTTATGAGCAATTAAATGACAGCTCAGAGGAGGAGGATGAAATAGATGGTCCAGCTGGACAAGCAGAACCGGACAGAGCCCATTACAATATTGTAACCTTTTGTTGCAAGTGTGACTCTACGCTTCGGTTGTGCGTACAAAGCACACACGTAGACATTCGTACTTTGGAAGACCTGTTAATGGGCACACTAGGAATTGTGTGCCCCATCTGTTCTCAGAAACCA(SEQ ID NO:13),其中大写字母序列编码E7,小写字母序列编码tLLO,并且带下划线的“ctcgag”序列表示用于在质粒中将肿瘤抗原连接到截短的LLO的Xho I限制性位点。
在另一个实施例中,编码融合到E7的tLLO的氨基酸序列包含SEQ ID NO:14:
MKKIMLVFITLILVSLPIAQQTEAKDASAFNKENSISSMAPPASPPASPKTPIEKKHADE
IDKYIQGLDYNKNNVLVYHGDAVTNVPPRKGYKDGNEYIVVEKKKKSINQNNADIQVVNA
ISSLTYPGALVKANSELVENQPDVLPVKRDSLTLSIDLPGMTNQDNKIVVKNATKSNVNN
AVNTLVERWNEKYAQAYPNVSAKIDYDDEMAYSESQLIAKFGTAFKAVNNSLNVNFGAIS
EGKMQEEVISFKQIYYNVNVNEPTRPSRFFGKAVTKEQLQALGVNAENPPAYISSVAYGR
QVYLKLSTNSHSTKVKAAFDAAVSGKSVSGDVELTNIIKNSSFKAVIYGGSAKDEVQIID
GNLGDLRDILKKGATFNRETPGVPIAYTTNFLKDNELAVIKNNSEYIETTSKAYTDGKIN
IDHSGGYVAQFNISWDEVNYDLEHGDTPTLHEYMLDLQPETTDLYCYEQLNDSSEEEDEI
DGPAGQAEPDRAHYNIVTFCCKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP(SEQ ID NO:14)。
在一个实施例中,包含编码融合到E7的tLLO且含SEQ ID NO:14的氨基酸序列的重组李斯特菌称为ADXS-HPV。在另一个实施例中,“ADXS-HPV”和“ADXS11-001”在本文可互换使用。
在另一个实施例中,本文提供的构建体或核酸分子使用同源重组整合进李斯特菌染色体。用于同源重组的技术是本领域熟知的,并且例如在Baloglu S,Boyle SM等人(Immune responses of mice to vaccinia virus recombinants expressing either Listeriamonocytogenes partial listeriolysin or Brucella abortus ribosomal L7/L12protein.Vet Microbiol 2005,109(1-2):11-7)和Jiang LL,Song HH等人(Characterization of a mutant Listeriamonocytogenes strain expressing green fluorescent protein.Acta Biochim Biophys Sin(Shanghai)2005,37(1):19-24)中有所描述。在另一个实施例中,如美国专利No.6,855,320所述进行同源重组。在这种情况下,通过hly启动子控制下的E7基因的染色体整合,制备表达E7的重组Lm菌株,并且包含hly信号序列以确保基因产物的分泌,从而产生称作Lm-AZ/E7的重组体。在另一个实施例中,将温敏质粒用于选择重组体。
在另一个实施例中,该构建体或核酸分子采用转座子插入整合进李斯特菌染色体。用于转座子插入的技术在本领域是熟知的,尤其是Sun等人(Infection and Immunity 1990,58:3770-3778)在DP-L967的构建中所描述的。在另一个实施例中,转座子诱变具有可形成稳定的基因组插入突变体的优点,但缺点是外源基因在基因组中的插入位置是未知的。
在另一个实施例中,使用噬菌体整合位点将该构建体或核酸分子整合进李斯特菌染色体(Lauer P,Chow MY等人,Construction,characterization,and use of two Listeriamonocytogenes site-specific phage integration vectors.J Bacteriol 2002;184(15):4177-86)。在该方法的某些实施例中,使用噬菌体(例如U153或PSA李斯特噬菌体)的整合酶基因和连接位点将异源基因插入对应的连接位点,该连接位点可以是基因组中的任何适当的位点(例如comK,或arg tRNA基因的3’末端)。在另一个实施例中,内源性原噬菌体在构建体或异源基因整合之前从所利用的连接位点解离。在另一个实施例中,该方法产生单拷贝整合体。在另一个实施例中,本发明还包括用于临床应用的基于噬菌体的染色体整合系统,其中可使用必需酶(包括但不限于D-丙氨酸消旋酶)营养缺陷的宿主菌株,例如Lmdal(-)dat(-)。在另一个实施例中,为了避免“噬菌体解离步骤”,使用基于PSA的噬菌体整合系统。这在另一个实施例中需要通过抗生素持续选择以维持整合基因。因此,在另一个实施例中,本发明使得能建立基于噬菌体的染色体整合系统,该系统不需要以抗生素选择。作为替代,可补充营养缺陷型宿主菌株。
在如本文所提供的方法和组合物的一个实施例中,术语“重组位点”或“位点特异性重组位点”是指核酸分子中的碱基序列,该序列可被重组酶(在一些情况下连同相关蛋白)识别,该重组酶介导位于重组位点侧翼的核酸片段的交换或切除。重组酶及相关蛋白统称为“重组蛋白”,参见例如Landy,A.,(Current Opinion in Genetics&Development)3:699-707;1993)。
“噬菌体表达载体”或“噬粒”指用于在体外或体内在任何细胞(包括原核、酵母、真菌、植物、昆虫或哺乳动物细胞)中组成型或诱导型表达如本文所提供的方法和组合物的核酸序列的目的的任何基于噬菌体的重组表达系统。噬菌体表达载体通常既可在细菌细胞中繁殖,又可在适合条件下产生噬菌体颗粒。该术语还包括线状或环状表达系统,并涵盖保持游离或者整合进宿主细胞基因组的两种基于噬菌体的表达载体。
在一个实施例中,如本文所用的术语“可操作地连接”意味着将转录和翻译调控核酸相对于任何编码序列以使得引发转录的方式定位。一般来讲,这意味着将启动子和转录引发或起始序列定位在编码区的5'。
在一个实施例中,“开放阅读框”或“ORF”为生物体基因组的一部分,其含有可潜在地编码蛋白的碱基序列。在另一个实施例中,该ORF的开始和结束端不等同于mRNA的末端,但它们通常包含在该mRNA内。在一个实施例中,ORF位于基因的开始密码子序列(起始密码子)和结束密码子序列(终止密码子)之间。因此,在一个实施例中,作为带有内源多肽的开放阅读框可操作地整合进基因组的核酸分子为已整合进基因组中与内源多肽处于相同开放阅读框中的核酸分子。
在一个实施例中,本发明提供包含接头序列的融合多肽。在一个实施例中,“接头序列”是指连接两个异源性多肽或其片段或域的氨基酸序列。一般来讲,如本文所用,接头是共价连接多肽以形成融合多肽的氨基酸序列。接头通常包含在从展示载体移除报告基因后从剩余重组信号翻译的氨基酸,以产生包含由开放阅读框编码的氨基酸序列和展示蛋白的融合蛋白。如本领域技术人员将认识到,接头可包含另外的氨基酸,诸如甘氨酸和其他小中性氨基酸。
在一个实施例中,如本文所用的“内源性”描述已在参考生物体内发育或起源的或因参考生物体内的成因而产生的某物。在另一个实施例中,内源性是指天然的。
技术人员将认识到,术语“PEST氨基酸序列”或“含PEST序列的多肽”或“含PEST序列的蛋白”或“含PEST序列的肽”可互换使用,都具有相同的含义和质量,并且可以涵盖截短的LLO蛋白,其在一个实施例中为N末端LLO;和截短的ActA蛋白,其在一个实施例中为N末端ctA;或其片段。PEST氨基酸序列在本领域是已知的,并在美国专利序列号7,635,479和美国专利公开序列号2014/0186387中有所描述,这两篇专利均据此全文并入本文。
在另一个实施例中,原核生物体的PEST氨基酸序列可根据诸如Rechsteiner和Roberts(TBS 21:267-271,1996)针对单核细胞增多性李斯特菌所述的方法按照常规方式鉴定。或者,来自其他原核生物体的PEST氨基酸序列也可基于这种方法来鉴定。可预期其中存在PEST氨基酸序列的其他原核生物体包括但不限于其他李斯特菌菌种。例如,单核细胞增多性李斯特菌蛋白ActA包含四个这样的序列。这些序列为KTEEQPSEVNTGPR(SEQ ID NO:5)、KASVTDTSEGDLDSSMQSADESTPQPLK(SEQ ID NO:6)、KNEEVNASDFPPPPTDEELR(SEQ ID NO:7)和RGGIPTSEEFSSLNSGDFTDDENSETTEEEIDR(SEQ ID NO:8)。来自链球菌菌种(Streptococcus sp.)的链球菌溶血素O也包含PEST序列。例如,酿脓链球菌(Streptococcus pyogenes)链球菌溶血素O包含在氨基酸35-51处的PEST序列KQNTASTETTTTNEQPK(SEQ ID NO:9),并且类马链球菌(Streptococcus equisimilis)链球菌溶血素O包含在氨基酸38-54处的PEST样序列KQNTANTETTTTNEQPK(SEQ ID NO:10)。另外,据信,PEST序列可嵌入抗原性蛋白内。因此,出于本发明的目的,当关于PEST序列融合时,所谓“融合”是指抗原性蛋白既包含抗原也包含连在抗原一端或嵌入抗原内的PEST氨基酸序列。
在另一个实施例中,构建体或核酸分子从游离型或质粒载体表达,该游离型或质粒载体具有编码融合多肽的核酸序列,该融合多肽包含融合到异源性抗原或其片段的PEST氨基酸序列。在另一个实施例中,该质粒在不存在抗生素选择的情况下稳定保持在重组李斯特菌疫苗菌株中。在另一个实施例中,该质粒不赋予重组李斯特菌抗生素抗性。在另一个实施例中,该片段为功能性片段。在另一个实施例中,该片段为免疫原性片段。
在另一个实施例中,“稳定保持”是指核酸分子或质粒在不存在选择(例如抗生素选择)的情况下保持10代,而没有可检测的损失。在另一个实施例中,该周期为15代。在另一个实施例中,该周期为20代。在另一个实施例中,该周期为25代。在另一个实施例中,该周期为30代。在另一个实施例中,该周期为40代。在另一个实施例中,该周期为50代。在另一个实施例中,该周期为60代。在另一个实施例中,该周期为80代。在另一个实施例中,该周期为100代。在另一个实施例中,该周期为150代。在另一个实施例中,该周期为200代。在另一个实施例中,该周期为300代。在另一个实施例中,该周期为500代。在另一个实施例中,该周期为更多代。在另一个实施例中,该核酸分子或质粒在体外(例如培养物中)稳定保持。在另一个实施例中,该核酸分子或质粒在体内稳定保持。在另一个实施例中,该核酸分子或质粒在体外和体内都稳定保持。
在另一个实施例中,如本文所提供的方法和组合物的重组李斯特菌菌株包含作为具有内源性ActA序列的开放阅读框可操作地整合进李斯特菌基因组中的核酸分子。在另一个实施例中,如本文所提供的方法和组合物的重组李斯特菌菌株包含游离型表达载体,该载体包含编码融合蛋白的核酸分子,该融合蛋白包含融合到ActA或截短的ActA的抗原。在一个实施例中,抗原的表达和分泌受actA启动子和ActA信号序列的控制,并且其作为与ActA的1-233号氨基酸(截短的ActA或tActA)的融合体而表达。在另一个实施例中,截短的ActA由野生型ActA蛋白的前390个氨基酸组成,如美国专利No.7,655,238中所述,该专利以引用方式全文并入本文。在另一个实施例中,截短的ActA是ActA-N100或其修饰型式(称为ActA-N100*),其中PEST基序缺失,并且包含非保守的QDNKR置换,如美国专利公布No.2014/0186387中所述。
在另一个实施例中,“功能性片段”是免疫原性片段,当给受试者单独或在本文提供的疫苗组合物中施用时引起免疫应答。在另一个实施例中,功能性片段具有生物学活性,如技术人员所了解的并且如本文所进一步提供。
在另一个实施例中,存在于向受试者施用的免疫原性组合物中的免疫检查点抑制剂(例如,PD-1信号传导通路抑制剂)的剂量为每2周5-10mg/kg、每3周5-10mg/kg或每3周1-2mg/kg。在另一个实施例中,该剂量为每周1-10mg/kg的范围。在另一个实施例中,该剂量为每2周1-10mg/kg的范围。在另一个实施例中,该剂量为每3周1-10mg/kg的范围。在另一个实施例中,该剂量为每4周1-10mg/kg的范围。
在另一个实施例中,本文提供的免疫原性组合物所含的重组李斯特菌菌株以1×107-3.31×1010个CFU的剂量施用给受试者。在另一个实施例中,该剂量为1×108-3.31×1010个CFU。在另一个实施例中,该剂量为1×109-3.31×1010个CFU。在另一个实施例中,该剂量为5-500×108个CFU。在另一个实施例中,该剂量为7-500×108个CFU。在另一个实施例中,该剂量为10-500×108个CFU。在另一个实施例中,该剂量为20-500×108个CFU。在另一个实施例中,该剂量为30-500×108个CFU。在另一个实施例中,该剂量为50-500×108个CFU。在另一个实施例中,该剂量为70-500×108个CFU。在另一个实施例中,该剂量为100-500×108个CFU。在另一个实施例中,该剂量为150-500×108个CFU。在另一个实施例中,该剂量为5-300×108个CFU。在另一个实施例中,该剂量为5-200×108个CFU。在另一个实施例中,该剂量为5-150×108个CFU。在另一个实施例中,该剂量为5-100×108个CFU。在另一个实施例中,该剂量为5-70×108个CFU。在另一个实施例中,该剂量为5-50×108个CFU。在另一个实施例中,该剂量为5-30×108个CFU。在另一个实施例中,该剂量为5-20×108个CFU。在另一个实施例中,该剂量为1-30×109个CFU。在另一个实施例中,该剂量为1-20×109个CFU。在另一个实施例中,该剂量为2-30×109个CFU。在另一个实施例中,该剂量为1-10×109个CFU。在另一个实施例中,该剂量为2-10×109个CFU。在另一个实施例中,该剂量为3-10×109个CFU。在另一个实施例中,该剂量为2-7×109个CFU。在另一个实施例中,该剂量为2-5×109个CFU。在另一个实施例中,该剂量为3-5×109个CFU。
在另一个实施例中,该剂量为1×107个生物体。在另一个实施例中,该剂量为1×108个生物体。在另一个实施例中,该剂量为1×109个生物体。在另一个实施例中,该剂量为1.5×109个生物体。在另一个实施例中,该剂量为2×109个生物体。在另一个实施例中,该剂量为3×109个生物体。在另一个实施例中,该剂量为4×109个生物体。在另一个实施例中,该剂量为5×109个生物体。在另一个实施例中,该剂量为6×109个生物体。在另一个实施例中,该剂量为7×109个生物体。在另一个实施例中,该剂量为8×109个生物体。在另一个实施例中,该剂量为10×109个生物体。在另一个实施例中,该剂量为1.5×1010个生物体。在另一个实施例中,该剂量为2×1010个生物体。在另一个实施例中,该剂量为2.5×1010个生物体。在另一个实施例中,该剂量为3×1010个生物体。在另一个实施例中,该剂量为3.3×1010个生物体。在另一个实施例中,该剂量为4×1010个生物体。在另一个实施例中,该剂量为5×1010个生物体。
技术人员将认识到,术语“强化”可涵盖向受试者施用单独的或组合的另外的疫苗或免疫原性组合物或重组李斯特菌菌株剂量或免疫检查点抑制剂。在本发明方法的另一个实施例中,施用2次强化(或总共3次接种)。在另一个实施例中,施用3次强化。在另一个实施例中,施用4次强化。在另一个实施例中,施用5次强化。在另一个实施例中,施用6次强化。在另一个实施例中,施用超过6次强化。
在另一个实施例中,本发明的方法还包括用如本文所提供的重组李斯特菌菌株或免疫检查点抑制剂强化受试者的步骤。在另一个实施例中,用于强化接种的重组李斯特菌菌株与用于初始的“初免”接种的菌株相同。在另一个实施例中,该强化菌株不同于初免菌株。在另一个实施例中,用于强化接种的重组免疫检查点抑制剂与用于初始的“初免”接种的抑制剂相同。在另一个实施例中,该强化抑制剂不同于初免抑制剂。在另一个实施例中,将相同的剂量用于初免和强化接种。在另一个实施例中,将大剂量用于强化。在另一个实施例中,将小剂量用于强化。在另一个实施例中,本发明的方法还包括将强化疫苗接种施用于受试者的步骤。在一个实施例中,该强化疫苗接种在单次初免疫苗接种之后。在另一个实施例中,单次强化疫苗接种在初免疫苗接种后施用。在另一个实施例中,两次强化疫苗接种在初免疫苗接种后施用。在另一个实施例中,三次强化疫苗接种在初免疫苗接种后施用。在一个实施例中,初免和强化疫苗之间的周期由技术人员通过实验确定。在另一个实施例中,初免和强化疫苗之间的间隔时间为1周,在另一个实施例中为2周,在另一个实施例中为3周,在另一个实施例中为4周,在另一个实施例中为5周,在另一个实施例中为6-8周,在又另一个实施例中强化疫苗在初免疫苗后8-10周给药。
在另一个实施例中,本发明的方法还包括用包含本文提供的PD-1信号通路抑制剂和重组李斯特菌菌株的免疫原性组合物强化受试者。在另一个实施例中,本发明的方法包括施用强化剂量的免疫原性组合物的步骤,该组合物包含本文提供的重组李斯特菌菌株。在另一个实施例中,本发明的方法还包括用包含本文提供的T细胞刺激剂和重组李斯特菌菌株的免疫原性组合物强化受试者。在另一个实施例中,该强化剂量是所述免疫原性组合物的替代形式。在另一个实施例中,本发明的方法还包括将强化免疫原性组合物施用于受试者的步骤。在一个实施例中,该强化剂量在所述免疫原性组合物的单次初免剂量之后。在另一个实施例中,单次强化剂量在初免剂量后施用。在另一个实施例中,两次强化剂量在初免剂量后施用。在另一个实施例中,三次强化剂量在初免剂量后施用。在一个实施例中,包含本文提供的重组李斯特菌的免疫原性组合物的初免和强化剂量之间的周期由技术人员以实验方法确定。在另一个实施例中,该剂量由技术人员以实验方法确定。在另一个实施例中,初免和强化剂量之间的周期为1周,在另一个实施例中为2周,在另一个实施例中为3周,在另一个实施例中为4周,在另一个实施例中为5周,在另一个实施例中为6-8周,在又一个实施例中强化剂量在免疫原性组合物的初免剂量后8-10周施用。
异源性“初免强化”策略对于增强免疫应答和防御众多病原体是有效的。Schneider等人,Immunol.Rev.170:29-38(1999);Robinson,H.L.,Nat.Rev.Immunol.2:239-50(2002);Gonzalo,R.M.等人,Vaccine 20:1226-31(2002);Tanghe,A.,Infect.Immun.69:3041-7(2001)。抗原以不同形式在初免和强化注射中提供似乎使对该抗原的免疫应答最大化。以DNA疫苗初免,接着以佐剂中的蛋白或者通过病毒载体递送编码抗原的DNA来强化似乎是改善抗原特异性抗体以及各自的CD4+T细胞应答或CD8+T细胞应答的最有效方式。Shiver J.W.等人,Nature 415:331-5(2002);Gilbert,S.C.等人,Vaccine 20:1039-45(2002);Billaut-Mulot,O.等人,Vaccine 19:95-102(2000);Sin,J.I.等人,DNA Cell Biol.18:771-9(1999)。最近的来自猴疫苗接种研究的数据提示,当以HIV gag DNA对猴进行初免接种后接着以表达HIV gag的腺病毒载体(Ad5-gag)强化时,向编码HIV gag抗原的DNA添加CRL1005泊洛沙姆(12kDa,5%POE)增强了T细胞应答。针对DNA/泊洛沙姆初免和随后的Ad5-gag强化的细胞免疫应答强于以DNA(无泊洛沙姆)初免和随后进行Ad5-gag强化所诱导的应答或者针对单独的Ad5-gag的应答。Shiver,J.W.等人Nature 415:331-5(2002)。美国专利申请公开No.US 2002/0165172 A1描述了以编码抗原的免疫原性部分的载体构建体和包含抗原的该免疫原性部分的蛋白同时施用,由此产生免疫应答。该文献仅限于乙型肝炎抗原和HIV抗原。此外,美国专利No.6,500,432涉及通过以所关注的多核苷酸和多肽同时施用来增强核酸疫苗接种的免疫应答的方法。根据该专利,同时施用意指在相同的免疫应答期间,优选地在彼此的0-10天或3-7天内施用多核苷酸和多肽。该专利所考虑的抗原包括:肝炎(所有形式)、HSV、HIV、CMV、EBV、RSV、VZV、HPV、脊髓灰质炎、流感、寄生虫(例如,来自疟原虫(Plasmodium)属)和病原菌(包括但不限于结核分枝杆菌(M.tuberculosis)、麻风杆菌(M.leprae)、衣原体(Chlamydia)、志贺氏菌(Shigella)、伯氏疏螺旋体(B.burgdorferi)、肠毒素大肠杆菌(enterotoxigenic E.coli)、伤寒沙门氏菌(S.typhosa)、幽门螺杆菌(H.pylori)、霍乱弧菌(V.cholerae)、百日咳杆菌(B.pertussis)等)抗原等。所有以上参考文献均以引用方式全文并入本文。
技术人员将认识到,本发明的方法和组合物的术语“融合多肽”可在某些实施例中与“重组多肽”互换使用。在另一个实施例中,本发明的方法的融合多肽由重组李斯特菌菌株表达。在另一个实施例中,该表达由重组李斯特菌菌株携带的核苷酸分子介导。
本发明的方法和组合物的重组李斯特菌菌株在另一个实施例中是重组单核细胞增多性李斯特菌菌株。在另一个实施例中,该李斯特菌菌株是重组西尔李斯特菌(Listeriaseeligeri)菌株。在另一个实施例中,该李斯特菌菌株是重组格雷李斯特菌(Listeriagrayi)菌株。在另一个实施例中,该李斯特菌菌株是重组伊万诺夫李斯特菌(Listeriaivanovii)菌株。在另一个实施例中,该李斯特菌菌株是重组默里李斯特菌(Listeriamurrayi)菌株。在另一个实施例中,该李斯特菌菌株是重组威耳逊李斯特菌(Listeriawelshimeri)菌株。在另一个实施例中,该李斯特菌菌株是本领域已知的任何其他李斯特菌属菌种的重组菌株。
在另一个实施例中,本发明的重组李斯特菌菌株已在动物宿主中传代。在另一个实施例中,该传代使该菌株作为疫苗载体的功效最大化。在另一个实施例中,该传代稳定李斯特菌菌株的免疫原性。在另一个实施例中,该传代稳定李斯特菌菌株的毒力。在另一个实施例中,该传代增强李斯特菌菌株的免疫原性。在另一个实施例中,该传代增强李斯特菌菌株的毒力。在另一个实施例中,该传代除去李斯特菌菌株的不稳定亚株。在另一个实施例中,该传代降低李斯特菌菌株的不稳定亚株的普遍性。在另一个实施例中,该李斯特菌菌株包含编码含抗原重组肽的基因的基因组插入。在另一个实施例中,该李斯特菌菌株携带包含编码含抗原重组肽的基因的质粒。在另一个实施例中,该传代如本文所述进行。在另一个实施例中,该传代通过本领域已知的任何其他方法进行。
在一个实施例中,本文提供包含本文提供的免疫检查点抑制剂、本文提供的T细胞刺激剂和本文提供的重组减毒李斯特菌的免疫原性组合物。在另一个实施例中,本文提供的免疫原性组合物的每个组分在本文提供的免疫原性组合物的另一组分之前、同时或之后施用。
在另一个实施例中,本文提供包含本文提供的免疫检查点抑制剂和重组减毒李斯特菌的免疫原性组合物。在另一个实施例中,本文提供包含本文提供的免疫检查点抑制剂、T细胞刺激剂和重组减毒李斯特菌的免疫原性组合物。在一个实施例中,该免疫检查点蛋白抑制剂为程序性死亡1(PD-1)信号传导通路抑制剂。在另一个实施例中,该PD-1信号传导通路抑制剂为阻断PD-1受体与PD-1配体1(PD-L1)和PD-1配体2(PD-L2)相互作用的分子。在另一个实施例中,PD-L1也称为CD274或B7-H1。在另一个实施例中,PD-L2也称为CD273或B7-DC。在另一个实施例中,该阻断PD-1受体与PD-1配体1(PD-L1)和PD-1配体2(PD-L2)相互作用的分子为与PD-1、PD-L1或PD-L2相互作用的分子。在另一个实施例中,该阻断PD-1受体与PD-1配体1(PD-L1)或PD-1配体2(PD-L2)相互作用的分子为与PD-1、PD-L1或PD-L2相互作用的分子。术语“相互作用”或其语法上的等同物可以涵盖结合或接触另一分子。在另一个实施例中,该分子结合到PD-1。在另一个实施例中,PD-1信号传导通路抑制剂为抗PD1抗体。在另一个实施例中,与PD-L2相互作用的分子为抗PD-L1抗体,或者结合PD-L1的小分子。在另一个实施例中,抗PD-L1抗体为MEDI4736。在另一个实施例中,与PD-L2相互作用的分子为抗PD-L2抗体,或者结合PD-L2的小分子。
在一个实施例中,与PD-1相互作用的该分子为截短的PD-L1蛋白。在另一个实施例中,该截短的PD-L1蛋白包含PD-L1蛋白的细胞质结构域。在另一个实施例中,与PD-1相互作用的该分子为截短的PD-L2蛋白。在另一个实施例中,该截短的PD-L2蛋白包含PD-L2蛋白的细胞质结构域。在另一个实施例中,该阻断PD-1受体与PD-1配体1(PD-L1)和PD-1配体2(PD-L2)相互作用的分子为与PD-L1和PD-L2相互作用的分子。在另一个实施例中,与PD-L1或PD-L2相互作用的该分子为截短的PD-1蛋白、PD-1模拟物或结合PD-L1或PD-L2的小分子。在另一个实施例中,该截短的PD-1蛋白包含PD-L1蛋白的细胞质结构域。
在一个实施例中,该免疫检查点抑制剂为CD80/86信号传导通路抑制剂。在另一个实施例中,CD80也称为B7.1。在另一个实施例中,CD86也称为B7.2。在另一个实施例中,该CD80信号传导通路抑制剂为与CD80相互作用的小分子。在另一个实施例中,该CD80抑制剂为抗CD80抗体。在另一个实施例中,该CD86信号传导通路抑制剂为与CD86相互作用的小分子。在另一个实施例中,该CD86抑制剂为抗CD86抗体。
在一个实施例中,该免疫检查点抑制剂为CTLA-4信号传导通路抑制剂。在另一个实施例中,CTLA-4也称为CD152。在另一个实施例中,该CTLA-4信号传导通路抑制剂为与CTLA-4相互作用的小分子。在另一个实施例中,该CTLA-4抑制剂为抗CTLA-4抗体。在另一个实施例中,该免疫检查点抑制剂为CD40信号传导通路抑制剂。在另一个实施例中,该免疫检查点抑制剂为本领域已知的任何其他抗原呈递细胞:T细胞信号传导通路抑制剂。
技术人员将理解,已知的任何免疫检查点蛋白可以是本领域已知的任何检查点抑制剂。免疫检查点蛋白可以选自但不限于:程序性细胞死亡蛋白1(PD1)、T细胞膜蛋白3(TIM3)、腺苷A2a受体(A2aR)和淋巴细胞活化基因3(LAG3)、杀伤细胞免疫球蛋白受体(KIR)或细胞毒性T淋巴细胞抗原-4(CTLA-4)。在另一个实施例中,检查点抑制剂蛋白是属于B7/CD28受体超家族的蛋白。在一个实施例中,T细胞刺激剂是抗原呈递细胞(APC)/T细胞激动剂。在另一个实施例中,该T细胞刺激剂为CD134或其配体或其片段、CD-137或其配体或其片段或诱导型T细胞共刺激剂(ICOS)或其配体或其片段。
在另一个实施例中,本文提供免疫原性组合物,其包含T细胞刺激剂和本文提供的重组减毒李斯特菌。在一个实施例中,该T细胞刺激剂为抗原呈递细胞(APC)/T细胞激动剂。在另一个实施例中,该T细胞刺激剂为CD134或其配体或其片段、CD-137或其配体或其片段或诱导型T细胞共刺激剂(ICOS)或其配体或其片段。
在另一个实施例中,本发明的组合物还包含佐剂。在另一个实施例中,本发明的方法和组合物所用的佐剂是粒细胞/巨噬细胞集落刺激因子(GM-CSF)蛋白。在另一个实施例中,该佐剂包含GM-CSF蛋白。在另一个实施例中,该佐剂为编码GM-CSF的核苷酸分子。在另一个实施例中,该佐剂为包含编码GM-CSF的核苷酸分子。在另一个实施例中,该佐剂为皂苷QS21。在另一个实施例中,该佐剂包含皂苷QS21。在另一个实施例中,该佐剂为单磷酰脂质A。在另一个实施例中,该佐剂包含单磷酰脂质A。在另一个实施例中,该佐剂为SBAS2。在另一个实施例中,该佐剂包含SBAS2。在另一个实施例中,该佐剂为含有未甲基化的CpG的寡核苷酸。在另一个实施例中,该佐剂包含含有未甲基化的CpG的寡核苷酸。在另一个实施例中,该佐剂为免疫刺激性细胞因子。在另一个实施例中,该佐剂包含免疫刺激性细胞因子。在另一个实施例中,该佐剂为编码免疫刺激性细胞因子的核苷酸分子。在另一个实施例中,该佐剂包含编码免疫刺激性细胞因子的核苷酸分子。在另一个实施例中,该佐剂为或包含刺糖苷(quill glycoside)。在另一个实施例中,该佐剂为或包含细菌有丝分裂原。在另一个实施例中,该佐剂为或包含细菌毒素。在另一个实施例中,该佐剂为或包含本领域已知的任何其他佐剂。
在一个实施例中,本文提供的方法还包括在所述重组李斯特菌菌株施用之前或之后共施用免疫检查点蛋白抑制剂的步骤。
在一个实施例中,该免疫检查点蛋白抑制剂为程序性死亡1(PD-1)信号传导通路抑制剂。在另一个实施例中,该PD-1信号传导通路抑制剂为阻断PD-1受体与PD-1配体1(PD-L1)和PD-1配体2(PD-L2)相互作用的分子。在另一个实施例中,PD-L1也称为CD274或B7-H1。在另一个实施例中,PD-L2也称为CD273或B7-DC。在另一个实施例中,该阻断PD-1受体与PD-1配体1(PD-L1)和PD-1配体2(PD-L2)相互作用的分子为与PD-1、PD-L1或PD-L2相互作用的分子。在另一个实施例中,该阻断PD-1受体与PD-1配体1(PD-L1)或PD-1配体2(PD-L2)相互作用的分子为与PD-1、PD-L1或PD-L2相互作用的分子。术语“相互作用”或其语法上的等同物可以涵盖结合或接触另一分子。在另一个实施例中,该分子结合到PD-1。在另一个实施例中,PD-1信号传导通路抑制剂为抗PD1抗体。在另一个实施例中,与PD-L2相互作用的分子为抗PD-L1抗体,或者结合PD-L1的小分子。在另一个实施例中,抗PD-L1抗体为MEDI4736。在另一个实施例中,与PD-L2相互作用的分子为抗PD-L2抗体,或者结合PD-L2的小分子。
在一个实施例中,与PD-1相互作用的该分子为截短的PD-L1蛋白。在另一个实施例中,该截短的PD-L1蛋白包含PD-L1蛋白的细胞质结构域。在另一个实施例中,与PD-1相互作用的该分子为截短的PD-L2蛋白。在另一个实施例中,该截短的PD-L2蛋白包含PD-L2蛋白的细胞质结构域。在另一个实施例中,该阻断PD-1受体与PD-1配体1(PD-L1)和PD-1配体2(PD-L2)相互作用的分子为与PD-L1和PD-L2相互作用的分子。在另一个实施例中,与PD-L1或PD-L2相互作用的该分子为截短的PD-1蛋白、PD-1模拟物或结合PD-L1或PD-L2的小分子。在另一个实施例中,该截短的PD-1蛋白包含PD-L1蛋白的细胞质结构域。
在一个实施例中,该免疫检查点抑制剂为CD80/86信号传导通路抑制剂。在另一个实施例中,CD80也称为B7.1。在另一个实施例中,CD86也称为B7.2。在另一个实施例中,该CD80信号传导通路抑制剂为与CD80相互作用的小分子。在另一个实施例中,该CD80抑制剂为抗CD80抗体。在另一个实施例中,该CD86信号传导通路抑制剂为与CD86相互作用的小分子。在另一个实施例中,该CD86抑制剂为抗CD86抗体。
在一个实施例中,该免疫检查点抑制剂为CTLA-4信号传导通路抑制剂。在另一个实施例中,CTLA-4也称为CD152。在另一个实施例中,该CTLA-4信号传导通路抑制剂为与CTLA-4相互作用的小分子。在另一个实施例中,该CTLA-4抑制剂为抗CTLA-4抗体。在另一个实施例中,该免疫检查点抑制剂为CD40信号传导通路抑制剂。在另一个实施例中,该免疫检查点抑制剂为本领域已知的任何其他抗原呈递细胞:T细胞信号传导通路抑制剂。
技术人员应当理解,本领域任何已知的免疫检查点蛋白都可被免疫检查点抑制剂靶向。免疫检查点蛋白可以选自但不限于:程序性细胞死亡蛋白1(PD1)、T细胞膜蛋白3(TIM3)、腺苷A2a受体(A2aR)和淋巴细胞活化基因3(LAG3)、杀伤细胞免疫球蛋白受体(KIR)或细胞毒性T淋巴细胞抗原-4(CTLA-4)。在另一个实施例中,该检查点抑制剂蛋白是属于B7/CD28受体超家族的蛋白。
在一个实施例中,该T细胞刺激剂为抗原呈递细胞(APC)/T细胞激动剂。在另一个实施例中,该T细胞刺激剂为CD134或其配体或其片段、CD-137或其配体或其片段或诱导型T细胞共刺激剂(ICOS)或其配体或其片段。
在一个实施例中,本文提供的方法还包括将本文提供的免疫原性组合物与在所述受试者中增强抗肿瘤免疫应答的细胞因子共施用的步骤。起到增强免疫应答作用的细胞因子是熟知的,并且技术人员将会理解为包括I型干扰素(IFN-α/IFN-β)、TNF-α、IL-1、IL-4、IL-12、INF-γ以及已知增强免疫应答的任何其他细胞因子。在另一个实施例中,该细胞因子是炎性细胞因子。在另一个实施例中,免疫原性组合物包含本领域已知的或如本文所提供的细胞因子。在另一个实施例中,细胞因子的施用可在本文提供的免疫原性组合物的施用之前进行。在另一个实施例中,细胞因子的施用可与本文提供的免疫原性组合物的施用同时进行。在另一个实施例中,细胞因子的施用可在如本文所提供的免疫原性组合物的施用之后进行。
在一个实施例中,本文提供的方法还包括将本文提供的免疫原性组合物与吲哚胺2,3-双加氧酶(IDO)通路抑制剂共施用的步骤。IDO通路抑制剂包括结合IDO或与IDO相互作用的小分子,或抗IDO抗体。用于本发明的IDO通路抑制剂包括任何本领域已知的IDO通路抑制剂,其包括但不限于1-甲基色氨酸(1MT)、1-甲基色氨酸(1MT)、Necrostatin-1、吡哆醛异烟腙、依布硒啉、5-甲基吲哚M-3-甲醛、CAY10581、抗IDO抗体或小分子IDO抑制剂。在另一个实施例中,IDO通路抑制剂的施用可在本文提供的免疫原性组合物的施用之前进行。在另一个实施例中,IDO通路抑制剂的施用可与本文提供的免疫原性组合物的施用同时进行。在另一个实施例中,任何IDO通路抑制剂的施用可在如本文所提供的免疫原性组合物的施用之后进行。
在另一个实施例中,本文提供的组合物和方法还与在前的或随后的化疗或放疗方案联合使用。在另一个实施例中,IDO抑制增强化疗剂的功效。
在一个实施例中,本文提供的方法还包括将本文提供的免疫原性组合物与在所述受试者中增强抗肿瘤免疫应答的肿瘤激酶抑制剂共给药的步骤。肿瘤激酶抑制剂(TKI)起干扰特定细胞信号通路的作用,由此使得能对所选的恶性肿瘤进行靶特异性治疗。TKI为熟知的,技术人员应理解其包括在以下表1中列出的那些以及任何其他的已知增强抗肿瘤应答的TKI。在另一个实施例中,TKI的施用可在本文提供的免疫原性组合物的施用之前进行。在另一个实施例中,TKI的施用可与本文提供的免疫原性组合物的施用同时进行。在另一个实施例中,TKI的施用可在如本文所提供的免疫原性组合物的施用之后进行。
表1.
在一个实施例中,本文提供的任何上述化合物可在本发明中与化疗、放疗或手术方案结合使用。
应当理解“免疫原性组合物”可包含本文提供的重组李斯特菌,以及佐剂、免疫检查点蛋白抑制剂、T细胞刺激剂、TKI、或细胞因子或它们的任意组合。在另一个实施例中,免疫原性组合物包含本文提供的重组李斯特菌。在另一个实施例中,免疫原性组合物包含本领域已知的或如本文所提供的佐剂。在另一个实施例中,免疫原性组合物包含本领域已知的或如本文所提供的免疫检查点抑制剂。在另一个实施例中,免疫原性组合物包含本领域已知的或如本文所提供的免疫检查点抑制剂和T细胞刺激剂。在另一个实施例中,免疫原性组合物包含本领域已知的或如本文所提供的T细胞刺激剂。还应当理解,这样的组合物增强免疫应答或提高效应T细胞与调节性T细胞比率或引起抗肿瘤免疫应答,如本文进一步提供的。
在施用本文提供的免疫原性组合物之后,本文提供的方法诱导外周淋巴器官中的效应T细胞扩增,从而导致肿瘤部位存在的效应T细胞增加。在另一个实施例中,本文提供的方法诱导外周淋巴器官中的效应T细胞扩增,从而导致外周存在的效应T细胞增加。效应T细胞的这种扩增导致外周中和肿瘤部位的效应T细胞与调节性T细胞的比率提高,而不影响Treg的数量,如本文所示(参见实例)。技术人员将会理解,外周淋巴器官包括但不限于脾脏、培氏斑、淋巴结、腺状肿等。在一个实施例中,效应T细胞与调节性T细胞的比率提高出现于外周中,而不影响Treg的数量。在另一个实施例中,效应T细胞与调节性T细胞的比率提高出现于外周、淋巴器官和肿瘤部位,而不影响这些部位的Treg数量。在另一个实施例中,效应T细胞的比率提高降低Treg的频率,而非这些部位的Treg总数。在另一个实施例中,本发明的引起增强的抗肿瘤T细胞应答的方法包括这样的免疫应答,该免疫应答包括脾脏和肿瘤微环境中调节性T细胞(Treg)的频率降低。在另一个实施例中,本发明的引起增强的抗肿瘤T细胞应答的方法包括这样的免疫应答,该免疫应答包括脾脏和肿瘤微环境中髓源性抑制细胞(MDSC)的频率降低。
在一个实施例中,使表达截短的LLO和异源性抗原的融合蛋白的减毒重组李斯特菌菌株与表达相同抗原的重组李斯特菌组合导致完全肿瘤消退。
在另一个实施例中,本发明的重组核酸可操作地连接至驱动编码肽在李斯特菌菌株中表达的启动子/调控序列。可用于驱动基因的组成型表达的启动子/调控序列是本领域熟知的,并且包括但不限于例如李斯特菌的PhlyA、PActA和p60启动子,链球菌(Streptococcus)bac启动子,灰色链霉菌(Streptomyces griseus)sgiA启动子以及苏云金芽孢杆菌(B.thuringiensis)phaZ启动子。在另一个实施例中,编码本发明的肽的核酸的诱导型和组织特异性表达通过将编码该肽的核酸置于诱导型或组织特异性启动子/调控序列的调控下实现。可用于此目的的组织特异性或诱导型启动子/调控序列的例子包括但不限于MMTV LTR诱导型启动子和SV40晚期增强子/启动子。在另一个实施例中,采用响应于诱导剂(诸如金属、糖皮质素等等)而诱导的启动子。因此,应当理解,本发明包括使用任何已知或未知的并且能够驱动与其可操作地连接的所需蛋白的表达的启动子/调控序列。技术人员将认识到,术语“异源性”涵盖源自与参考物种不同的物种的核酸、氨基酸、肽、多肽或蛋白。因此,例如,表达异源性多肽的李斯特菌菌株在一个实施例中将表达不是该李斯特菌菌株天然的或内源性的多肽,或在另一个实施例中,通常不由该李斯特菌菌株表达的多肽,或在另一个实施例中,来自该李斯特菌菌株之外的来源的多肽。在另一个实施例中,异源性可用于描述源自同一物种内的不同生物体的某物。在另一个实施例中,异源性抗原由李斯特菌的重组菌株表达,并在哺乳动物细胞被该重组菌株感染后加工且呈递到细胞毒性T细胞。在另一个实施例中,由李斯特菌菌种表达的异源性抗原不需要与肿瘤细胞或传染原中对应的未修饰的抗原或蛋白精确匹配,只要其导致可识别在哺乳动物中天然表达的未修饰抗原或蛋白的T细胞应答即可。术语异源性抗原在本文可称为“抗原性多肽”、“异源性蛋白”、“异源性蛋白抗原”、“蛋白抗原”、“抗原”等。
技术人员将认识到,术语“游离型表达载体”涵盖这样的核酸载体,其可以为线性的或环状的,并且其通常为双链的形式且在染色体外,因为其存在于宿主细菌或细胞的细胞质中,而不是整合进细菌或细胞的基因组。在一个实施例中,游离型表达载体包含所关注的基因。在另一个实施例中,游离型载体在细菌细胞质中保持多个拷贝,从而导致所关注的基因的扩增,并在另一个实施例中,在必要时提供病毒反式作用因子。在另一个实施例中,游离型表达载体在本文可被称为质粒。在另一个实施例中,“整合型质粒”包含这样的序列,该序列将该质粒的插入或所携带的所关注基因的插入靶向宿主基因组内。在另一个实施例中,插入的所关注基因不中断,或不受到通常因整合进细胞DNA中而发生的调控约束。在另一个实施例中,存在所插入的异源性基因不导致细胞自身重要区域的重排或中断。在另一个实施例中,在稳定的转染程序中,使用游离型载体通常导致比使用染色体整合质粒更高的转染效率(Belt,P.B.G.M.等人(1991)Efficient cDNA cloning by direct phenotypic correction of a mutant human cell line(HPRT2)using an Epstein-Barr virus-derived cDNA expression vector.Nucleic Acids Res.19,4861-4866;Mazda,O.等人(1997)Extremely efficient gene transfection into lympho-hematopoietic cell lines by Epstein-Barr virus-based vectors.J.Immunol.Methods 204,143-151)。在一个实施例中,如本文所提供的方法和组合物的游离型表达载体可通过用于将DNA分子递送到细胞的多种方法中的任一种递送到体内、离体、体外细胞。载体也可以单独地或以增强向受试者细胞递送的药物组合物的形式递送。
在一个实施例中,术语“融合”是指通过共价键合可操作地连接。在一个实施例中,该术语包括(核酸序列或其开放阅读框的)重组融合。在另一个实施例中,该术语包括化学偶联。
在一个实施例中,“转化”是指将细菌细胞工程化为吸收质粒或其他异源性DNA分子。在另一个实施例中,“转化”是指将细菌细胞工程化为表达质粒的基因或其他异源性DNA分子。每种可能性代表了如本文所提供的方法和组合物的独立实施例。
在另一个实施例中,使用接合将遗传物质和/或质粒引入细菌中。接合的方法是本领域熟知的,并例如在Nikodinovic J等人(A second generation snp-derived Escherichia coli-Streptomyces shuttle expression vector that is generally transferable by conjugation.Plasmid.2006Nov;56(3):223-7)和Auchtung JM等人(Regulation of a Bacillus subtilis mobile genetic element by intercellular signaling and the global DNA damage response.Proc Natl Acad Sci U S A.2005年8月30日;102(35):12554-9)中有所描述。每种方法代表了如本文所提供的方法和组合物的独立实施例。
在一个实施例中,如本文所用的术语“减毒”表示细菌在动物中的致病能力降低。换句话讲,减毒李斯特菌菌株的病原学特性与野生型李斯特菌相比已降低,虽然减毒李斯特菌能够在培养中生长和维持。例如,使用减毒李斯特菌对Balb/c小鼠的静脉内接种,50%的接种动物存活所处的致死剂量(LD50)优选地比野生型李斯特菌的LD50升高至少约10倍,更优选地至少约100倍,更优选地至少约1,000倍,甚至更优选地至少约10,000倍,最优选地至少约100,000倍。李斯特菌的减毒菌株因此是不杀死施用该菌株的动物的菌株,或是仅当施用的细菌数远高于杀死相同动物所需的野生型非减毒细菌数时才杀死动物的菌株。减毒细菌还应被解释为意指不能够在一般环境中复制的细菌,因为在该环境中不存在其生长所需的营养物。因此,该细菌在提供了所需营养物的受控环境中以受限方式复制。本发明的减毒菌株因此是环境安全的,因为它们不能以不可控制的方式复制。
在另一个实施例中,通过本领域的技术人员已知的任何方法,诸如肠胃外、癌旁侧、经粘膜、鼻内、肌内、静脉内、皮内、皮下、腹膜内、心室内、颅内、阴道内或肿瘤内将包含本发明的疫苗和组合物的药物组合物施用于受试者。
在本文提供的方法和组合物的另一个实施例中,该疫苗或组合物经口施用,并因此将其被配制为适合经口施用的形式,即,作为固体或液体制备物。适合的固体口服制剂包括片剂、胶囊剂、丸剂、颗粒剂、药丸等。适合的液体口服制剂包括溶液、混悬液、分散剂、乳剂、油剂等。在本发明的另一个实施例中,将活性成分配制在胶囊中。根据该实施例,除活性化合物和惰性载体或稀释剂之外,本发明的组合物还包括硬明胶胶囊。
在另一个实施例中,通过静脉内、动脉内或肌肉内注射液体制备物来以疫苗或组合物施用。适合的液体制剂包括溶液、混悬剂、分散剂、乳剂、油剂等。在一个实施例中,将药物组合物静脉内施用,因此将其配制为适合静脉内施用的形式。在另一个实施例中,将药物组合物动脉内施用,因此将其配制为适合动脉内施用的形式。在另一个实施例中,将药物组合物肌肉内施用,因此将其配制为适合肌肉内施用的形式。
在一个实施例中,如本文所提供的方法和组合物的疫苗可单独地或与药学上可接受的载体相结合地施用给宿主脊椎动物,优选哺乳动物,更优选人。在另一个实施例中,以有效诱导针对李斯特菌菌株本身或针对已对李斯特菌菌种进行修饰后而表达的异源性抗原的免疫应答的量施用疫苗。在另一个实施例中,待施用的疫苗或异源性抗原的量可由本领域的技术人员在拥有本公开时按常规方式确定。在另一个实施例中,药学上可接受的载体包括但不限于无菌蒸馏水、盐水、磷酸盐缓冲溶液或碳酸氢盐缓冲溶液。在另一个实施例中,所选择的药学上可接受的载体和将用到的载体的量将取决于多种因素,包括但不限于施用模式、李斯特菌菌株以及接种者的年龄和疾病状态。在另一个实施例中,疫苗的施用可以通过经口途径进行,或其可以是肠胃外的、经鼻内的、经肌内的、经直肠内的、经腹膜内的或多种熟知的施用途径。在另一个实施例中,施用途径可根据传染原或待治疗的肿瘤的类型而选择。
在另一个实施例中,本发明提供治疗、阻遏或抑制受试者中的至少一种肿瘤的方法,该方法包括施用本文提供的免疫原性组合物。
在另一个实施例中,本发明提供用于便利地实践如本文所提供的方法的试剂盒,该试剂盒包含如本文所提供的李斯特菌菌株、施用装置和描述如何使用试剂盒组成部分来实践如本文所提供的方法的指导性材料。
如本文所用,术语“约”是数量术语,意指加或减5%,或在另一个实施例中,加或减10%,或在另一个实施例中,加或减15%,或在另一个实施例中,加或减20%。
在一个实施例中,术语“受试者”是指需要治疗病症或其后遗症或易受该病症或其后遗症影响的哺乳动物(包括人)。该受试者可包括狗、猫、猪、牛、绵羊、山羊、马、大鼠和小鼠以及人。术语”受试者”不排除在所有方面都正常的个体。
为了更充分地举例说明本发明的优选实施例,提供了以下实例。然而,它们绝不应解释为限制本发明的广泛范围。
实例
材料与方法(实例1至7):
小鼠
雌性6-8周龄C57BL/6小鼠(除非另外指明)购自弗雷德里克国家癌症研究实验室(Frederick National Laboratory for Cancer Research,FNLCR)。小鼠在贝塞斯达国家癌症研究所(National Cancer Institute,Bethesda)的动物设施安置。实验小鼠的使用方案经美国国立卫生研究院的动物护理和使用委员会(Animal Care and Use Committee at National Institutes of Health)批准。
细胞系
表达低水平E6和E7的TC-1细胞通过用HPV-16E6和E7以及活化的ras癌基因转化而来源于原代C57BL/6小鼠肺上皮细胞。细胞在补充有10%FBS、100U/ml青霉素、100μg/ml链霉素、2mM L-谷氨酰胺、1mM丙酮酸钠、100μM非必需氨基酸和0.4mg/ml G418的RPMI 1640中在37℃和5%CO2下生长。
单核细胞增多性李斯特菌菌株
LmddA-LLO-E7及其对照LmddA-LLO和LmddA在Advaxis Inc(Princeton,NJ)生成。dal datΔactA菌株(LmddA)从dal dat菌株构建,dal dat菌株基于Lm野生型菌株10403S,其中链霉素抗性基因整合进染色体。由于dal、dat和actA突变,LmddA是高度减毒的。在质粒中缺失prfA以及氯霉素抗性基因后,用pTV3质粒转化LmddA来构建LmddA-LLO-E7菌株。LLO-E7融合蛋白的表达和分泌在LmddA-LLO-E7菌株的培养物上清液中通过前述Western印迹确定。LmddA-LLO对照菌株的构建类似于LmddA-LLO-E7菌株,但pTV3质粒中缺失prfA和E7。Lm野生型菌株10403S和一些突变菌株,包括Δhly、Δhly::pfo和hly::Tn917-lac(pAM401-hly),由D.Portnoy博士(University of California,Berkeley,CA)慷慨提供。菌株hly::Tn917-lac是野生型Lm的非溶血突变体,其中Tn917-lac融合基因插入hly基因(编码LLO的基因),以破坏LLO溶血活性。当用表达LLO的质粒(pAM401-hly)转染该突变体时,由于具有LLO再次获得溶血活性。其中E7基因的全长整合进Lm染色体的Lm-E7菌株由Y.Paterson博士(University of Pennsylvania,Philadelphia,PA)慷慨提供。细菌在脑心浸液培养基加上链霉素(100μg/ml)中在存在或不存在D-丙氨酸(100μg/ml)的情况下培养。
试剂
荧光偶联的抗小鼠抗体CD4-PerCP-Cy5.5(GK1.5)和CD8-Brillient Violet 421(53-6.7)得自Biolegend(San Diego,CA)。FoxP3-FITC(FJK-16s)得自eBioscience(San Diego,CA)。载有E7肽(RAHYNIVTF)SEQ ID NO:11的H-2Db四聚体由美国国家过敏症及传染病研究所四聚体核心实验室(National Institute of Allergy and Infectious Diseases Tetramer Core Facility)和美国国立卫生研究院艾滋病研究和参考试剂计划(National Institutes of Health AIDS Research and Reference Reagent Program)慷慨提供。CountBrightTM绝对计数微珠得自Life Technologies(Grand Island,NY)。
肿瘤接种和小鼠疫苗接种
第0天在小鼠的右胁腹皮下植入TC-1细胞(105个细胞/小鼠)。在第10天,当肿瘤的直径变为5-6mm时,给小鼠腹膜内注射0.1LD50剂量的LmddA-LLO-E7疫苗或适当的对照。在第17天强化疫苗接种。每周两次使用电子卡尺测量肿瘤,并且肿瘤尺寸以下式计算:长×宽×宽/2。当肿瘤的直径达到2.0cm时对小鼠实施安乐死。
流式细胞术
用CD4-PerCP-Cy5.5、CD8-Brillient Violet 421和H-2Db E7四聚体-APC给小鼠脾细胞或从肿瘤收集的细胞染色30min。将细胞固定、透化并用FoxP3-FITC染色过夜。通过流式细胞术分析细胞。对淋巴细胞设门,其中Treg被鉴定为CD4+FoxP3+。加入CountBrightTM绝对计数微珠,以进行绝对细胞数量计数。
CD4+CD25+Treg的过继转移
通过CD4+CD25+Treg试剂盒(Life Technologies,Grand Island,NY)从小鼠脾脏分离CD4+CD25+T细胞。在肿瘤细胞接种后第9天,将细胞静脉注入具有TC-1肿瘤的小鼠。在Treg转移后一天,给小鼠腹膜内免疫LmddA-LLO-E7(0.1LD50)两次,间隔一周。监测肿瘤生长。
统计
使用非参数Mann-Whitney检验分析数据。以P<0.05确定显著性。
实例1:LmddA-LLO-E7诱导已建立的TC-1肿瘤的消退,伴随着Treg频率降低
据此前报道,其中融合蛋白LLO-E7以及PrfA在李斯特菌XFL-7的prfA阴性菌株中游离型表达的基于Lm的疫苗Lm-LLO-E7诱导了已建立的TC-1肿瘤的完全消退。此处,研究了另一个高减毒的基于Lm的疫苗LmddA-LLO-E7(它在dal、dat和actA突变的Lm菌株中通过质粒生成融合蛋白LLO-E7)的抗肿瘤活性。与Lm-LLO-E7相比,LmddA-LLO-E7是进一步减毒的,因为氯霉素抗性基因和PrfA已从质粒移除。据观察,与Lm-LLO-E7类型,LmddA-LLO-E7显著抑制了已建立的TC-1肿瘤的生长(图1A和图1B,图2)。在大约40%的具有TC-1肿瘤的小鼠中,LmddA-LLO-E7疫苗接种两次后肿瘤完全消退(图1B和图2)。除一只小鼠复发并且在3个月时死亡之外,显示出肿瘤消退的其他小鼠(总动物的33%)存活至少6个月无复发(图1C)。虽然Lm-E7减缓了TC-1肿瘤生长,但它不能诱导完全的肿瘤消退(图1A和图1B以及图2)。LmddA-LLO(无E7)不能显著抑制TC-1肿瘤生长(图1A和图1B以及图2),暗示先天免疫应答不足以根除TC-1肿瘤细胞。LmddA-LLO-E7和Lm-E7在脾脏中诱导了类似的H-2Db E7四聚体+CD8+T细胞应答(图3A-上插图,图3B,和图3D),与先前的发现一致。然后分析CD4+FoxP3+Treg。出乎意料的是,据观察,与PBS对照相比,LmddA-LLO-E7、Lm-E7和LmddA-LLO在脾脏中均显著降低了Treg频率,并且在肿瘤中更显著,尽管与Lm-E7相比,LmddA-LLO-E7和LmddA-LLO更能降低频率(图1D-1H)。
实例2:Lm足以诱导Treg频率降低
最初,怀疑Treg频率降低由截短的LLO介导。但不表达截短的LLO的Lm-E7也能降低Treg频率(图1D-1H)。此观察结果暗示,Lm也许能够降低Treg频率。实际上,LmddA-LLO-E7的载体对照LmddA以及野生型Lm菌株和Lm-E7的载体对照10403S均显著降低了脾脏中尤其是肿瘤中的Treg频率(图4)。
实例3:Lm通过优先诱导CD4+FoxP3-T细胞和CD8+T细胞扩增降低Treg频率
相对Treg频率(总T细胞的比例)不仅通过Treg的数量而且还通过CD4+FoxP3-T细胞和CD8+T细胞的数量确定。为研究Lm如何降低Treg频率,对LmddA-LLO-E7、LmddA-LLO、LmddA、Lm-E7或Lm(10403S)处理的具有TC-1肿瘤的小鼠中CD4+FoxP3+Treg、CD4+FoxP3-T细胞和CD8+T细胞的数量进行定量。如图5所示,出乎意料的是,据发现,LmddA不会显著改变肿瘤中CD4+FoxP3+T细胞的数量。它实际上增加了CD4+FoxP3-T细胞和CD8+T细胞,从而按比例降低了Treg频率。截短的LLO在LmddA-LLO和LmddA-LLO-E7中的游离型表达还增加了CD4+FoxP3-T细胞和CD8+T细胞,从而进一步降低了CD4+FoxP3+T细胞频率。野生型Lm 10403S和Lm-E7还诱导了CD4+FoxP3-T细胞和CD8+T细胞的增加,而不显著改变CD4+FoxP3+T细胞的数量。Lm-LLO-E7显著增加了肿瘤中CD4+FoxP3-T细胞和CD8+T细胞的密度。这些结果显示,Lm优先诱导CD4+FoxP3-T细胞和CD8+T细胞扩增,以提高CD4+FoxP3+T细胞频率。
实例4:Lm诱导的CD4+FoxP3-T细胞和CD8+T细胞扩增依赖于LLO并且由LLO介导
hly基因编码的LLO是Lm逃离宿主细胞吞噬体液泡进入细胞质所依赖的成孔溶细胞素。由于LmddA-LLO-E7、Lm-E7以及所有它们的对照均产生LLO,所以使用来源于10403S的LLO缺陷型Lm突变体(其中hly基因使用穿梭载体然后是同源重组而缺失)研究LLO是否在诱导CD4+FoxP3-T细胞和CD8+T细胞的扩增中发挥作用。据发现,在单次施用后第7天Δhly Lm不能增加小鼠脾脏中的CD4+FoxP3-T细胞和CD8+T细胞(图6A),表明CD4+FoxP3-T细胞和CD8+T细胞扩增的诱导依赖于LLO。这可以是LLO的直接效应或逃离吞噬溶酶体的必要条件。为解决这个问题,研究了LLO被PFO替换的LM。产气荚膜梭菌(Clostridium perfringens)产生的产气夹膜羧菌溶血素O(PFO)与LLO具有43%的氨基酸同一性,并且还可裂解液泡膜。将编码在hly启动子控制下的PFO的pfo基因重组至Δhly菌株的染色体,形成Δhly::pfo菌株。虽然Δhly::pfo能够逃离吞噬进入细胞质,但它不能增加小鼠脾脏中的CD4+FoxP3-T细胞和CD8+T细胞(图6A)。相比之下,用表达LLO的质粒pAM401-hly转染的野生型Lm的非溶血Tn917-lac突变体hly::Tn917-lac(pAM401-hly)(其中Tn917-lac融合基因插入hly基因,以破坏LLO溶血活性)诱导了小鼠脾脏CD4+FoxP3-T细胞和CD8+T细胞扩增(图6A)。这些结果暗示,CD4+FoxP3-T细胞和CD8+T细胞的扩增由LLO直接介导。由于Lm不会显著诱导CD4+FoxP3+T细胞扩增,CD4+FoxP3-T细胞和CD8+T细胞的增加导致了Lm诱导的Treg的频率降低(图6A-6D)。
实例5:LmddA中截短的LLO的游离型表达诱导CD4+FoxP3-T细胞和CD8+T细胞扩增达到较高水平
接下来,比较LmddA和LmddA-LLO在健康、不具有肿瘤的小鼠中的T细胞增殖的诱导,其中后者通过质粒游离型生成截短的LLO。据发现,在单次施用后第7天LmddA能够稍微增加小鼠脾脏中CD4+FoxP3-T细胞和CD8+T细胞数量,但LmddA-LLO进一步诱导这种增加达到较高水平(图7A)。相比之下,在LmddA或LmddA-LLO感染后,CD4+FoxP3+T细胞数量无显著变化(图17A)。与PBS对照相比,在LmddA-LLO施用后,这导致Treg显著地按比例减少(图7B-7D)。检查了这些细胞中细胞增殖标记Ki-67的存在。LmddA提高了Ki-67+CD4+FoxP3-T细胞和Ki-67+CD8+T细胞的频率和绝对数量,但LmddA-LLO使该数量增加至更大的程度(图7E-7G)。因此CD4+FoxP3-T细胞和CD8+T细胞中Ki-67的表达水平也提高(图7H)。相比之下,Ki-67+CD4+FoxP3+T细胞的频率和绝对数量以及CD4+FoxP3+T细胞中的Ki-67表达无显著变化,表明LmddA和LmddA-LLO并未诱导它们的增殖。
实例6:Lm-E7和LmddA-LLO的组合诱导已建立的TC-1肿瘤的消退。
Lm-E7疫苗单独不能诱导CD4+FoxP3-T细胞和CD8+T细胞的大量扩增(图5)。这可解释其不能诱导TC-1肿瘤消退。由于LmddA-LLO诱导了CD4+FoxP3-T细胞和CD8+T细胞扩增(图5和图7A),可以想象,在存在LmddA-LLO的情况下,可改善Lm-E7的抗肿瘤效应。实际上,Lm-E7和LmddA-LLO的组合诱导了已建立的TC-1肿瘤的几乎完全消退(图8A-8C)。相比之下,LmddA的加入未能增加Lm-E7诱导的抗肿瘤活性(数据未示出),表明截短的非溶血LLO在改善Lm-E7疫苗的抗肿瘤功效中的重要性。可以预知,与Lm-E7或PBS处理的那些小鼠相比,组合组小鼠的脾脏中CD4+FoxP3-T细胞和CD8+T细胞的数量显著增加(图8D)。再次,因为CD4+FoxP3+数量相对无变化,通过组合Lm-E7和LmddA-LLO使CD4+FoxP3-T细胞和CD8+T细胞的数量增加至较高水平导致了CD4+FoxP3+T细胞比例的更大下降(图8E-8G)。
此外,LmddA还与Lm-E7对照共施用,以确定LmddA-LLO和Lm-E7的共施用期间非溶血、截短的LLO发挥的作用。据观察,LmddA菌株的加入未能增加Lm-E7诱导的抗肿瘤活性,表明LmddA产生的内源性LLO不能促进Lm-E7诱导的抗肿瘤活性(图10)。
实例7:Treg的过继转移危害LmddA-LLO-E7对已建立的TC-1肿瘤的抗肿瘤功效
LmddA-LLO-E7并未显著改变Treg的数量,虽然它降低了Treg的频率(图1D-1H)。Treg与CD4+FoxP3-T细胞或与CD8+T细胞的比率是确定Treg的抑制能力的公认参数。为确定Treg比例是否对LmddA-LLO-E7的抗肿瘤功效有任何影响,从未暴露的C57BL/6小鼠分离了CD4+CD25+Treg,并将其静脉注入具有TC-1肿瘤的小鼠,然后进行LmddA-LLO-E7疫苗接种。LmddA-LLO-E7在无Treg过继转移的小鼠中显著抑制了TC-1肿瘤生长(图9A和图9B)。然而,在给予Treg的小鼠中,LmddA-LLO-E7未能显著抑制TC-1肿瘤生长(图9A和图9B)。接受Treg的小鼠显示出脾脏中的Treg数量稍微增加,但肿瘤中进一步减少。在另一个方面,与LmddA-LLO-E7对照相比,在LmddA-LLO-E7疫苗接种后,接受Treg的小鼠具有的CD4+FoxP3-T细胞和CD8+T细胞更少,表明Treg的过继转移抑制了CD4+FoxP3-T细胞和CD8+T细胞的扩增(图9,F和G)。这些共同导致了Treg受体小鼠中Treg频率的提高(图9C-9E)。
熟知的是,肿瘤抗原特异性CTL在杀死肿瘤细胞的过程中具有支配作用,并且Lm作为细胞内细菌可递送与MHC I类分子相关的抗原以活化CTL。然而,为什么两个基于Lm的疫苗Lm-LLO-E7和Lm-E7在脾脏中诱导了相似水平的HPV E7特异性CTL,但表现出明显不同的抗肿瘤活性,而前者诱导了强得多的抗肿瘤效应(图1A-1C,图2,图3)。毫无疑问,CD8+T细胞参与杀死肿瘤细胞,因为它们的缺失消除了Lm-LLO-E7诱导的肿瘤消退。同样明确的是,一定水平的肿瘤抗原特异性CTL对于杀死肿瘤细胞是必需的,因为缺乏E7表达的LmddA-LLO不能显著抑制TC-1肿瘤生长(图1A-1C和图2)。据提出,Lm-E7诱导了Treg的增加,抑制了宿主免疫应答,从而破坏了其抗肿瘤免疫性。然而,据发现,实际上与PBS对照相比,Lm-E7和LmddA-LLO-E7均降低了TC-1肿瘤模型中的Treg频率(图1D-1H)。此外,据发现,在疫苗接种后,无论是Lm-E7还是LmddA-LLO-E7均未显著增加TC-1肿瘤中的Treg总数(图5)。
实际上,据发现,LmddA-LLO-E7和Lm-E7之间的主要差异是,前者能够诱导CD4+FoxP3-T细胞和CD8+T细胞数量的显著增加,而后者诱导的增加程度低得多(图5)。这解释了为什么LmddA-LLO-E7降低Treg百分比的程度大于Lm-E7(图1D-1H)。据观察,Lm载体足以增加CD4+FoxP3-T细胞和CD8+T细胞的数量。然而,对于截短的LLO的游离型表达,Lm使CD4+FoxP3-T细胞和CD8+T细胞的数量显著增加至较高水平,从而更进一步地降低Treg的频率(图7)。因此,可以想象,LLO在诱导CD4+FoxP3-T细胞和CD8+T细胞数量的增加中具有关键作用。实际上,LLO不仅是单核细胞增多性李斯特菌逃离吞噬体必需的,而且还直接引起CD4+FoxP3-T细胞和CD8+T细胞扩增,因为无论是LLO缺失(Δhly)单核细胞增多性李斯特菌菌株,还是Δhly::pfo菌株(其表达使Lm能够进入细胞质的PFO),均不能成功诱导CD4+FoxP3-T细胞和CD8+T细胞增殖,但用表达LLO的质粒转化非溶血LLO突变体Lm菌株恢复了CD4+FoxP3-T细胞和CD8+T细胞的扩增(图6)。LLO诱导的CD4+FoxP3-T细胞和CD8+T细胞扩增与其溶血活性不相关,因为LmddA中非溶血、截短的LLO的游离型表达大大增加了CD4+FoxP3-T细胞和CD8+T细胞的扩增(图7)。虽然LLO引起的CD4+T细胞和CD8+T细胞的扩增应答似乎具有抗原非特异性佐剂效应,但LLO也可包含这两种细胞类型的免疫显性表位。实际上,早期研究发现,LLO具有两个CD4+T细胞表位(分别为残基189-201和残基215-226)和一个CD8+T细胞表位(残基91-99)。
LmddA-LLO-E7的优异抗肿瘤效应可能是由于以下事实:它诱导了CD4+FoxP3-T细胞和CD8+T细胞的显著增加。相比之下,Lm-E7不能诱导CD4+FoxP3-T细胞和CD8+T细胞数量的显著增加解释了它不能有效根除肿瘤的原因,因为Lm-E7和LmddA-LLO的组合(与单独Lm-E7相比,该组合显著增加了CD4+FoxP3-T细胞和CD8+T细胞的数量)诱导了已建立的TC-1肿瘤的几乎完全消退(图8)。我们的数据表明,LmddA-LLO-E7诱导的Treg频率降低是CD4+FoxP3-T细胞和CD8+T细胞数量增加的结果。对于CD4+FoxP3-T细胞和CD8+T细胞功能的抑制,Treg与CD4+FoxP3-T细胞或与CD8+T细胞的比率是关键的。实际上,通过Treg过继转移到具有肿瘤的小鼠然后进行LmddA-LLO-E7疫苗接种来提高体内Treg的比率抑制了CD4+FoxP3-T细胞和CD8+T细胞的扩增,并因此破坏了疫苗的抗肿瘤功效(图9)。
除优先诱导CD4+FoxP3-T细胞和CD8+T细胞的扩增之外,截短的非溶血LLO对于LmddA-LLO-E7疫苗的抗肿瘤功效的改善还具有其他贡献。据观察,虽然Lm-E7和LmddA-LLO-E7诱导了类似的E7特异性CD8+T细胞扩增,但在肿瘤中并非如此。就截短的LLO(LmddA-LLO-E7)的游离型表达而言,更多的E7特异性CD8+T细胞趋于在肿瘤中诱导(图3E)。据发现,LmddA-LLO-E7上调了CD4+FoxP3-T细胞和CD8+T细胞上,而非CD4+FoxP3+T细胞上的趋化因子受体CCR5和CXCR3的表达,显示CCR5和CXCR3对于Th1和CD8+T细胞运输是关键的。这些结果暗示,LLO通过CCR5和CXCR3的上调,诱导CD4+FoxP3-T细胞和CD8+T抗原特异性细胞迁移至肿瘤微环境。此外,已知的是,截短的LLO对于抗原从Lm的有效分泌是必需的,而不从Lm载体分泌的抗原导致诱导不太有效的抗肿瘤免疫性。因此,缺乏Lm-E7载体的强大抗肿瘤活性不仅是由于缺乏CD4+FoxP3-T细胞和CD8+T细胞的有效扩增,而且还由于在受感染的抗原呈递细胞和低效抗原特异性T细胞应答的启动的背景中,来自Lm的抗原的低效分泌。
总之,据显示,LmddA-LLO-E7疫苗中非溶血、截短的LLO的游离型表达优先诱导了CD4+FoxP3-T细胞和CD8+T细胞扩增,这增强了疫苗的抗肿瘤活性。最后,结果显示,很多因素如一定水平的抗原特异性CTL和非肿瘤抗原特异性CD4+FoxP3-T细胞和CD8+T细胞,以及Treg比例降低,对于触发有效的抗肿瘤免疫应答均是必需的,并且这可通过本文提供的李斯特菌构建体实现。另外,本研究表明,LLO是有潜力的疫苗佐剂,因为它优先诱导CD4+FoxP3-T细胞和CD8+T细胞扩增,因此总体上提高了Treg频率,并促进免疫应答来杀死肿瘤细胞。
材料与方法(实例8至12)
动物、细胞系、疫苗和其他试剂
六至八周龄C57BL6小鼠购自NCI Frederick并保持在无病原体的条件下。小鼠根据NCI Animal Care and Use Committee批准的方案管理。通过将人乳头瘤病毒株16(HPV16)早期蛋白6和7(E6和E7)以及活化的ras癌基因共转染到原代C57BL/6小鼠肺上皮细胞而得到的TC-1细胞得自ATCC(Manassas,VA),并使细胞在补充了10%FBS、青霉素和链霉素(各100U/ml)以及L-谷氨酰胺(2mM)的RPMI 1640中在37℃和具有5%CO2的条件下生长。具有或不具有人乳头瘤病毒-16(HPV-16)E7的李斯特菌疫苗载体(Lm-LLO和Lm-LLO-E7)由Advaxis Inc.提供。Lm-LLO和Lm-LLO-E7均以5×106个CFU/小鼠的剂量经腹膜内(i.p.)注射。抗PD-1单克隆抗体得自CureTech(Israel)并以50μg/小鼠的剂量经静脉内(i.v.)注射。用于流式细胞术的所有荧光标记的抗体和适当的同种型对照均购自BD Biosciences(San Jose,CA)或eBiosciences(San Diego,CA)。
小鼠和人树突细胞分离、纯化及PD-L1表达分析
如早前所述从骨髓分离和纯化小鼠树突细胞(DC)。为了得到人DC,从健康成年血液供体(National Institute of Health,Blood bank)分离单核细胞。简而言之,将外周血单核细胞(PBMC)用Ficoll-Paque Plus(Amersham Biosciences)通过梯度离心而分离,在洗涤后,使之在37℃粘附到组织培养板保持2小时。将非粘附细胞通过洗涤而移除,并将粘附细胞在板中于37℃、5%CO2下在由RPMI 1640、2mM L-谷氨酰胺、青霉素(100U/ml)、链霉素(100ug/ml)、10mM HEPES、10%胎牛血清、10mM非必需氨基酸、1mM丙酮酸钠和5×10-5M2-巯基乙醇组成的完全RPMI 1640中培养。将细胞在存在GM-CSF(1000U/ml)和IL-4(500U/ml)的情况下培养4天以变成未成熟的DC。在第3天与新鲜培养基一起再次添加GM-CSF和IL-4。使用台盼蓝排除方案评估了培养物中的DC活力。台盼蓝阴性细胞被视为活的。在由单核细胞培养DC 4-5天后,收集DC,并转移到6孔板(1×106个细胞/ml)。将不同浓度的Lm-LLO或Lm-LLO-E7添加到DC培养物(0、107、108和109个CFU/ml)保持一小时,然后添加庆大霉素(50μg/ml)以杀灭李斯特菌,并培养48小时。
小鼠和人DC均用适当的荧光标记的抗PD-L1抗体(PE抗小鼠PD-L1和FITC抗人PD-L1)染色。将同种型匹配的mAb用作阴性对照。染色后的细胞用FACS Calibur细胞仪和CellQuest软件(BD Biosciences)分析。
肿瘤植入和处理
如早前所述开展了目的在于分析肿瘤生长和存活的治疗性实验。简而言之,第0天在小鼠的右胁腹皮下(s.c.)植入50,000个TC-1细胞/小鼠。在第8天(肿瘤直径为约3–4mm),向适当组(每组5只小鼠)中的动物经腹膜内注射具有或不具有抗PD-1Ab的Lm-LLO或Lm-LLO-E7。在肿瘤植入后15天,将小鼠用疫苗和抗PD-1Ab再处理一次。另一组动物保持不处理。每3-4天使用数显卡尺测量肿瘤,并使用公式V=(W2×L)/2计算肿瘤体积,其中V是体积,L是长度(较长的直径),且W是宽度(较短的直径)。在这些实验中,当小鼠濒死、肿瘤溃烂或肿瘤体积达到1.5立方厘米时,将小鼠处死。在免疫学实验中,对相同组的小鼠进行类似处理,但在第二次处理(第21天)后六天将小鼠处死。分离脾脏和肿瘤,并分析抗原特异性免疫应答、CD8T细胞、Treg和髓源性抑制细胞(MDSC)。
分析外周和肿瘤中的抗原特异性免疫应答、Treg、MDSC。将ELISPOT用于检测在得自经处理的小鼠和对照小鼠的E7再刺激(10μg/ml)脾细胞培养物中的IFNγ生成,如制造商(BD Biosciences,San Jose,CA)所建议的那样。CTL免疫斑点分析仪(Cellular Technology Ltd.,Shaker Heights,OH)用于分析斑点。将得自不相关肽(hgp 10025–33–KVPRNQDWL(SEQ ID NO:12)-Celtek Bioscience,Nashville,TN)再刺激的脾细胞的斑点数从E7再刺激的培养物中减去。使用GentleMACS分离器和实体瘤匀化方案处理肿瘤样品,如制造商(Miltenyi Biotec,Auburn,CA)所建议的那样。使用如早前所述的流式细胞术分析法分析CD45+造血细胞群中肿瘤浸润性CD8+、CD4+Foxp3+(Treg)和CD11b+Gr-1+(MDSC)细胞的数量。还使用相同的流式细胞术分析法在荷瘤的经处理小鼠和对照小鼠的脾脏中评价了Treg细胞和MDSC的水平。
统计学分析
所有统计学参数(平均值、DC上PD-L1表达的SD、肿瘤体积、ELISPOT和外周及肿瘤浸润性细胞分析)和组之间的统计显著性(对于外周和肿瘤浸润性细胞分析)均使用GraphPad Prism软件(San Diego,CA)计算。组之间的统计显著性通过Tukey多重比较事后检验的单因素ANOVA确定(P<0.05被视为统计显著性)。
结果
实例8:小鼠DC被Lm-LLO和Lm-LLO-E7感染上调表面PD-L1表达
之前已证明,小鼠脾细胞被Lm感染导致大部分细胞上PDL1表达的显著上调,并且
PD-L1表达水平在CD11c+DC之中最高。
考虑到DC在初免免疫应答中的重要性和PD-1/PD-L1相互作用的抑制作用,首先决定分析Lm-LLO和LmLLO-E7对DC上的PD-L1表达的影响。为了避免混合细胞群中细胞间相互作用对结果准确度的影响,测试了不同浓度的Lm-LLO和Lm-LLO-E7对纯化的CD11c+DC的表面上PD-L1表达的影响。如图11中所示,Lm-LLO和LmLLO-E7在108和109个CFU/ml的剂量下以剂量依赖性方式明显上调PD-L1表达。
重要的是,在任何所测试的剂量下在Lm-LLO和Lm-LLO-E7诱导的DC上的PD-L1上调之间未检出差异(图11),从而表明该影响与抗原无关。
实例9:抗PD-1增强Lm-LLO-E7疫苗的疗效
在确认Lm-LLO和Lm-LLO-E7对DC上的PD-L1表达的上调的影响后,并考虑到PD-1/PD-L1相互作用的抑制作用,假设PD-1/PD-L1阻断与基于李斯特菌的疫苗的组合可改善免疫疗法的抗肿瘤功效。为了检验这一假设,评价了在基于表达E7的肺上皮细胞的TC-1肿瘤模型中抗PD-1Ab和Lm-LLO-E7组合对肿瘤生长和小鼠存活的影响。有意地使用低剂量Lm-LLO-E7、延迟的治疗计划和植入大量的肿瘤细胞,以便最大程度降低单独的疫苗的影响。在第0天向小鼠经皮下植入50,000个TC-1细胞,并在肿瘤植入后第8天和第15天,向小鼠注射具有或不具有抗PD-1Ab的Lm-LLO-E7或Lm-LLO(图12A)。另一组动物保持不处理。
虽然单独的Lm-LLO-E7疫苗导致了肿瘤生长的轻微抑制,但是Lm-LLO-E7/抗PD-1组合明显显示出减慢的肿瘤生长(图12B)并在20%经处理的小鼠中导致了延长的存活和完全的肿瘤消退(图12C)。这些实验揭示,抗PD-1Ab与Lm-LLO-E7疫苗的组合是一种导致肿瘤生长受到抑制且存活得到改善甚至在用于这些实验的严格条件下也是如此的可行策略。
实例10:抗PD-1Ab和Lm-LLO-E7的组合明显增强抗原特异性免疫应答和CD8T细胞向肿瘤中的浸润
为了确定免疫机理并评价免疫学功效,接着评估了Lm-LLO-E7/抗PD-1Ab组合以确定得自经处理的荷瘤小鼠的脾脏中的抗原特异性产IFNγ细胞和肿瘤浸润的CD8T细胞的水平。向小鼠植入TC-1细胞,并如上文针对治疗性实验所述进行处理,但是在第二次处理后六天,将小鼠处死,并收获脾脏和肿瘤。使用标准ELISPOT分析法,执行了对E7特异性产IFNγ细胞的分析。如预期的那样,单独用Lm-LLO-E7处理与对照相比诱导了显著水平的产IFNγ的E7特异性细胞(P<0.001)。值得注意的是,向Lm-LLO-E7添加PD-1/PD-L1阻断与抗PD-1Ab导致了与单独的Lm-LLO-E7相比抗原特异性免疫应答进一步显著的增加(P<0.01)(图13A)。为了进一步确定合并Lm-LLO-E7/抗PD-1Ab发挥其治疗作用所依赖的机理,测试了处理对肿瘤浸润的CD8T细胞的影响。在如上所述而处理的小鼠中在肿瘤植入后21天测试了肿瘤浸润的CD8T细胞。Lm-LLO-E7和Lm-LLO-E7/抗PD-1Ab与对照组相比显示出肿瘤浸润的CD8T细胞的显著增加(对于单独的Lm-LLO-E7,P<0.05;对于Lm-LLO-E7/抗PD-1Ab,P<0.001)(图13B)。类似于外周免疫应答,向Lm-LLO-E7处理添加抗PD-1Ab导致了与单独的Lm-LLO-E7相比CD8T细胞肿瘤浸润显著增加(P<0.05)(图13B)。
实例11:Lm-LLO处理显著减少脾和肿瘤浸润的MDSC及Treg细胞,无论是否存在抗原或抗PD-1Ab
具有明显免疫应答抑制活性的两个细胞亚群为MDSC和Treg细胞。因此,在外周中以及在肿瘤微环境中均分析了这些亚群以了解Lm-LLO-E7/抗PD-1Ab组合处理的影响。对第二次疫苗接种后六天收获的脾脏和肿瘤评估了MDSC和Treg细胞的百分比(脾脏)和实际数目(肿瘤)。虽然无肿瘤的动物的脾脏中的MDSC百分比为约2.5%,但是在存在肿瘤的情况下,该百分比显著提高(~15%)(图14A)。令人惊讶的是,用Lm-LLO处理无论是否存在E7抗原或抗PD-1处理,与对照动物相比均显著降低了脾脏中的MDSC水平(P<0.05)(图14A)。类似地,在用Lm-LLO、Lm-LLO-E7和Lm-LLO-E7/抗PD-1Ab处理后,肿瘤浸润的MDSC的数目也显著降低(图14B)。重要的是,脾脏(图15A)和肿瘤(图15B)中的Treg细胞在用单独的或具有E7或抗PD-1Ab的Lm-LLO处理的组中也略微但明显地降低。
这些数据表明,仅Lm-LLO负责降低经处理的小鼠的脾脏和肿瘤中的MDSC和Treg,并且添加抗原或抗PD-1抗体不影响这些细胞的水平。
实例12:人DC被Lm-LLO感染也导致表面PD-L1表达的上调
在证明了疗效和Lm-LLO-E7/抗PD-1Ab组合发挥抗肿瘤作用所依赖的免疫机理后,测试了Lm-LLO是否也影响人DC上的PD-L1表达水平,并了解该发现是否能转化成临床。如方法章节中所述,从健康自愿者的PBMC中分离了单核细胞源人DC。将人DC用不同浓度的Lm-LLO和Lm-LLO-E7感染。据发现,类似于鼠DC,Lm-LLO和Lm-LLO-E7感染均导致了表面PD-L1的显著上调(图16A和图16B,数据未示出)。与鼠DC一样,人DC上的PD-L1上调也为剂量依赖性的。该发现表明,基于李斯特菌的疫苗与抗PD-1Ab的组合可能是一种强有力的且可临床转化的免疫疗法。
总之,以上发现表明基于Lm-LLO的疫苗与抗PD-1Ab的组合导致抗原特异性免疫应答和肿瘤浸润性CD8T细胞增加,抑制细胞(Treg细胞和MDSC)减少,并因此导致经处理的动物中肿瘤生长显著抑制和存活期延长/肿瘤完全消退。因此,证实了基于Lm-LLO的疫苗与阻断PD-1/PD-L1相互作用的组合是一种可导致抗肿瘤免疫疗法功效总体增强的可行且可转化的方法。
实例13:单独的和组合的ADXS11-001或MEDI4736免疫疗法在具有复发性/转移性宫颈癌或人乳头瘤病毒(HPV)阳性头颈癌的患者中的I/II期研究
背景
靶向癌症生长和转移的关键性HPV基因的方法可改善经诊断患有子宫颈癌或头颈癌的个体的存活。
ADXS11-001是一种活的减毒单核细胞增多性李斯特菌(Lm)-李斯特菌溶血素O(LLO)免疫疗法,其经生物工程改造以在能够呈递抗原的细胞中作为截短的LLO-E7融合蛋白分泌HPV-E7肿瘤抗原。这导致生成HPV特异性T细胞,从而减弱肿瘤微环境中的肿瘤保护。MEDI4736(一种抗程序性死亡-1配体(PD-L1)抗体)阻断PD-L1与PD-1和CD8的结合,并减轻对PD-L1依赖性免疫抑制作用的抑制。对PD-L1结合的抑制在表明ADXS11-011和抗PD-L1的组合明显阻滞动物中的肿瘤生长并延长存活期的临床前研究中增加了ADXS11-001的表观免疫效力/活性。
方法
这是一项开放标签、多中心、2部分、随机化I/II期研究(NCT02291055)。具有鳞状细胞/非鳞状细胞宫颈癌或头颈HPV相关鳞状细胞癌的在复发性/转移性情况下进行了≥1的在先铂类疗法的患者(≥18岁)符合条件。I期的主要目标是评价ADXS11-001+MEDI4736的安全性和耐受性,并选择该组合的推荐II期剂量(RP2D)。II期的主要目标是评价ADXS11-001和MEDI4736作为单一疗法和组合疗法的肿瘤相应、无进展生存(PFS)和安全性。I/II期的探索目标将评价免疫应答的生物标志物与肿瘤应答和PFS之间的关联。在I期中,最多18名患者接受固定剂量的ADXS11-001(1×109个集落形成单位[CFU]),而MEDI4736的剂量根据标准3+3设计递增(以3mg/kg开始)。在II期中,将患者(n≈48)随机化(1:1:2)以按RP2D接受ADXS11-001(1×109个CFU)或MEDI4736(10mg/kg)或两者;所有治疗组均按疾病分层。在I/II期中,ADXS11-001均每4周施用一次,MEDI4736均每2周施用一次。患者接受治疗最长1年,或直到他/她们因疾病进展或无法接受的毒性而中断。通过实体瘤治疗疗效评价标准(Response Evaluation Criteria In Solid Tumors,RECIST)和免疫相关RECIST标准评价了功效参数,并使用不良事件的常用术语标准(Common Terminology Criteria for Adverse Events,CTCAE)确定了安全性。
已参考附图对本发明的实施例进行了描述,应当理解,本发明不限于精确的实施例,本领域技术人员可在不脱离所附权利要求书中定义的本发明范围和精神的情况下对其进行各种改动和修饰。
- 还没有人留言评论。精彩留言会获得点赞!
- 抗PD-L1纳米抗体及其编码序列和用途的制造方法与工艺
- 用于HPV‑相关病症的新方法、生物试验和生物标记物与制造工艺
- 用于去除血液中的促炎介质以及粒细胞和单核细胞的系统的制造方法与工艺
- 活化人CD40的抗体和针对人PD‑L1的抗体的组合疗法的制造方法与工艺
- 免疫原性组合产品的制造方法与工艺
- 白介素2的超级激动剂、部分激动剂和拮抗剂的制造方法与工艺
- 表达免疫应答刺激细胞因子以吸引和/或激活免疫细胞的基因修饰间充质干细胞的制造方法与工艺
- 一种研究北虫草多糖对机体的体液免疫应答和细胞免疫应答反应的方法与制造工艺
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 一种干扰乙肝病毒复制的siRNA、其构建方法及应用与制造工艺