稳定的大麻素类化合物制剂的制作方法
优先权本申请要求享有在2014年5月29日提交的美国临时专利申请号62/004,495和在2015年4月29日提交的美国临时专利申请号62/154,660的优先权。每个申请的全部内容以引用的方式并入本文。本发明通常涉及基本上是纯的大麻二酚,稳定的大麻素类化合物药物制剂,和其使用方法。
背景技术:
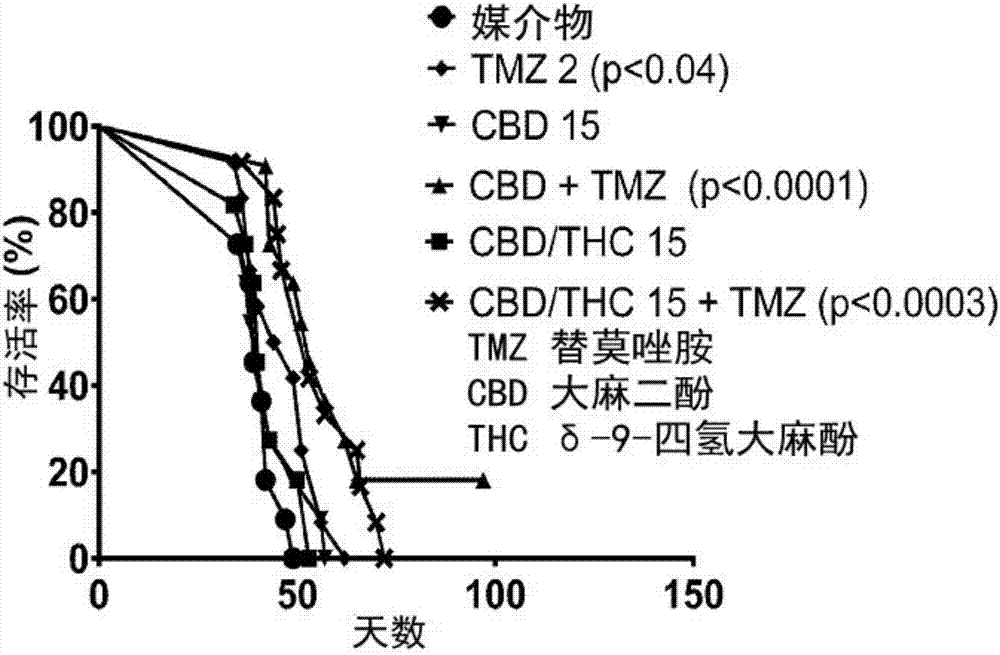
:大麻素类化合物是由大麻花生产的化学物质。大麻素类化合物模仿人体的内源性物质。大麻素类化合物包括大麻酚、大麻二酚、屈大麻酚(δ-9-四氢大麻酚)、δ-8-四氢大麻酚、11-羟基-四氢大麻酚、11-羟基-δ9-四氢大麻酚、左南曲朵、δ-11-四氢大麻酚、四氢次大麻酚(tetrahydrocannabivarin)、amandamide、大麻隆、和酸和其类似物。现在可以在实验室中合成许多大麻素类化合物,从而消除了为了提取化合物而种植大麻的需要。其中一种大麻素类化合物,大麻二酚,即左旋-反-大麻二酚((-)-trans-2-p-mentha-1,8-dien-3-yl-5-pentylresorcinol)是非精神活性的,并在治疗许多疾病和病症中显示出前景。人造的大麻二酚与天然存在的大麻二酚具有相同的结构。市售的大麻二酚通常被δ9-四氢大麻酚污染。δ-9-四氢大麻酚的存在是一个问题,因为δ-9-四氢大麻酚被美国毒品管制局作为表i类药物来管制。更高表类编号的结果是药物更容易获得,使患者倾向于用大麻二酚治疗。此外,δ-9-四氢大麻酚是一种致幻剂,并且接受大麻二酚治疗的患者希望避免δ-9-四氢大麻酚污染这种不期望的副作用。因此,需要不含δ-9-四氢大麻酚的基本上是纯的人造的合成大麻二酚。大麻素类化合物,包括大麻二酚,可适用于治疗疾病或病症,或疾病或病症的症状,例如dravet综合征、lennoxgastaut综合征、肌阵挛性痉挛(mycolonicseizures)、青少年肌阵挛性癫痫(juvenilemycolonicepilepsy)、顽固性癫痫、精神分裂症、青少年痉挛症、韦斯特综合征、顽固性婴儿痉挛症、婴儿痉挛症、管状硬化综合征(tubularsclerosiscomplex)、脑肿瘤、神经性疼痛、大麻使用障碍、创伤后应激障碍、焦虑、思觉失调、阿尔茨海默病自闭症,和从阿片类药物、可卡因、海洛因、安非他命和尼古丁的戒断。因此,需要新的稳定的大麻素类化合物制剂。也需要基本上纯的大麻二酚。技术实现要素:一方面,本发明涉及用于口服施用的稳定的药物制剂,所述试剂包括约0.1至约50%的大麻素类化合物,约0.1至约40%的聚乙二醇,约0.1至约50%的丙二醇,和约0.1至约20%的水,其中所述制剂不包括乙醇并且制剂的ph值为约5至约8。另一方面,本发明涉及用于口服施用的稳定的药物制剂,所述制剂包括约0.1至约40%的大麻素类化合物,约0.1至约25%的聚乙二醇,约0.1至约40%的丙二醇;任选地约0.1至约50%的水,和约0.1至约70%的乙醇,其中所述制剂的ph值为约5至约8。再另一方面,本发明涉及用于口服施用的稳定的药物制剂,包括约0.1至约40%的大麻素类化合物和约10至约95%的脂质。另一方面,本发明涉及使用大麻素类化合物或基本上纯的,人造合成的大麻二酚的方法:用于治疗疾病或病症,或疾病或病症的症状,例如dravet综合征、lennoxgastaut综合征、肌阵挛性痉挛、青少年肌阵挛性癫痫、顽固性癫痫、精神分裂症、青少年痉挛症、韦斯特综合征、婴儿痉挛症、顽固性婴儿痉挛症、管状硬化综合征、脑肿瘤、神经性疼痛、大麻使用障碍、创伤后应激障碍、焦虑、思觉失调、阿尔茨海默病、和自闭症;用于帮助从阿片类药物、可卡因、海洛因、安非他命和尼古丁的戒断;和作为止痛剂或帮助处理不良情绪刺激。附图说明图1显示了实施例7详细的研究结果,并且说明了施用基本上纯的,人造合成的大麻二酚制剂用于治疗神经性疼痛的优点。图2显示了实施例9详细的研究结果,并且说明了施用基本上纯的,人造合成的大麻二酚制剂用于治疗多形性成胶质细胞瘤的优点。具体实施方式申请人意外地创造了包括大麻素类化合物的新的储存稳定的制剂。申请人确定约5至约8,优选约6至约7的ph值对于制剂保持稳定是关键的。例如,如下实施例2中所示,不包括乙醇制剂的#af3和#af4在不管怎样的温度和湿度的条件下都表现出4周的优秀的稳定性。另外,在实施例4中,申请人意外地发现包括乙醇的制剂#a7和#a8在不管怎样的温度和湿度的条件下都表现出至少12个月的优秀的稳定性。申请人还确定一种抗氧化剂对保持长期储存的稳定性是重要的。这些结果是难以预测的因为制剂科学很难预测并且许多其他原本合适的药物制剂在使用期时是储存不稳定的。如上所述,申请人创造的稳定的制剂包括或不包括乙醇(参见实施例1和3)。不含乙醇的制剂特别适合施用于儿童。而且,不含乙醇的制剂的特别适合处于毒品和乙醇成瘾恢复的病人。此外,申请人创造了稳定的制剂的脂质制剂(参见实施例5)。这些制剂在储存时也意外地稳定的(参见实施例6)。此外,申请人意外地发现基本上纯的大麻二酚的制剂特别适合治疗癫痫(参见实施例6、8、10和11),神经性疼痛(参见实施例7和图1),和多形性成胶质细胞瘤(参见实施例9和图2)。不含乙醇的制剂在一个实施方式中,本发明涉及口服施用的稳定的药物制剂,所述制剂包括约0.1至约50%的大麻素类化合物,约0.1至约40%的聚乙二醇,约0.1至约50%的丙二醇,和约0.1至约20%的水,其中所述制剂不包括乙醇并且制剂的ph值为约5至约8。在一个优选的实施方式中,制剂含有约1至约40%的大麻素类化合物。在一个更优选的实施例中,制剂含有约5至约35%,约20至约35%或约30至约35%的大麻素类化合物。在另一个实施方式中,制剂包括的大麻素类化合物选自由大麻酚、大麻二酚、屈大麻酚(δ-9-四氢大麻酚)、δ-8-四氢大麻酚、11-羟基-四氢大麻酚、11-羟基-δ9-四氢大麻酚、左南曲朵、δ-11-四氢大麻酚、氢化次大麻酚(tetrahydrocannabivarin)、amandamide、大麻隆、酸、类似物、和其人造的衍生物构成的组。在一个优选的实施方式中,大麻素类化合物是大麻二酚。在一个优选的实施方式中,制剂含有约1至约40%的大麻二酚。在一个更优选的实施方式中,制剂含有约5至约35%,约20至约35%或约30至约35%的大麻二酚。在另一个实施方式中,制剂包括的基本上纯的和人造合成的大麻二酚,其中大麻二酚的纯度大于98%。在一个更优选的实施方式中,大麻二酚的纯度大于99%。在一个更优选的实施方式中,大麻二酚的纯度大于99.5%。在一个最优选的实施方式中,大麻二酚中含有不到0.3%的δ-9-四氢大麻酚。在另一个实施方式中,制剂含有约0.001至约1%的抗氧化剂。在一个优选的实施方式中,制剂含有约0.01至约1%的抗氧化剂。在一个更优选的实施方式中,制剂含有约0.02至约0.5%的抗氧化剂。合适的抗氧化剂包括二丁基羟基甲苯、丁基羟基茴香醚、α-生育酚(维生素e)、抗坏血酸棕榈酸酯、抗坏血酸、抗坏血酸钠、乙二胺四乙酸(ethylenediaminotetraaceticacid)、半胱氨酸盐酸盐、柠檬酸、柠檬酸钠、硫酸氢钠、焦亚硫酸钠、卵磷脂、没食子酸丙酯、硫酸钠、硫代甘油和其组合物。在另一个实施方式中,制剂含有约1至约40%的聚乙二醇。在一个优选的实施方式中,制剂含有约1至约35%,约5至约35%,约20至约30%,或约25至约30%的聚乙二醇。合适的聚乙二醇包括平均分子量在200和10000之间的低分子量聚乙二醇。一个优选的可以使用的聚乙二醇是聚乙二醇400。在另一个实施方式中,制剂含有约1至约40%的聚乙二醇400。在一个优选的实施方式中,制剂含有约1至约35%,约5至约35%,约20至约30%,或约25至约30%的聚乙二醇400。在另一个实施方式中,制剂含有约1至约50%的丙二醇。在一个优选的实施方式中,制剂含有约1至约40%,约5至约35%,约20至约35%,或约30至约35%的丙二醇。在一个另外的实施方式中,制剂包括水。制剂可以包括0%的水。如果制剂包括水,它们可以含有约1至约15%的水,约1至约10%的水,或约4至约8%的水。制剂的ph值可以通过使用任何药物学上可接受的方法来调整。制剂优选的ph值为约5至约8。在一个优选的实施方式中,制剂的ph值为约6至约7。在一个最优选的实施方式中,制剂的ph值为约6.2至约6.7。本发明的制剂也可以包括甜味剂、增甜剂、防腐剂、ph值调节剂、和调味剂。合适的甜味剂包括但不限于蔗糖、阿斯巴甜、糖精、葡萄糖、甘露醇、木糖醇、和其组合物。如果制剂包括甜味剂,制剂优选包括约0.001至约1%的甜味剂。如果制剂包括增甜剂,制剂优选包括约0.001至约1%的增甜剂。合适的增甜剂包括,但不限于,铵盐形式的粗制和精制的甘草酸。产品(可以从mafco全球公司获取,magnasweet是mafco全球公司的注册商标)使用铵盐形式的粗制和精炼的甘草酸。甘草酸在钠和钾盐中也能以纯粹的衍生物的形式存在。合适的ph值调节剂包括,但不限于,盐酸、抗坏血酸、柠檬酸、柠檬酸钠、富马酸、氢氧化钠、碳酸氢钠、碳酸钠、碳酸铵和其组合物。合适的防腐剂包括,但不限于,对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲醇、苯甲酸、苯甲酸钠、山梨酸和其组合物。合适的调味剂包括但不限于覆盆子、薄荷油、葡萄香精、薄荷醇、留兰香油、柑橘油、肉桂油、草莓香精、樱桃香精、覆盆子香精、橙油、柠檬油、柠檬薄荷香精、水果宾治香精和其组合物。在一个优选的实施方式中,制剂包括草莓香精。如果制剂含调味剂,制剂优选含有约0.001至约1%的调味剂。在一个更优选的实施方式中,制剂含有约0.005至约0.5%的调味剂。制剂适用于口服、含服、舌下、吸入或静脉/肌内施用。优选的,制剂是液体口服施用。含乙醇的制剂在另一个实施方式中,发明涉及口服施用的稳定的药物制剂,含有约0.1至约40%的大麻素类化合物,约0.1至约25%的聚乙二醇,约0.1至约40%的丙二醇,任选地约0.1至约50%的水,和约0.1至约70%的乙醇,其中制剂的ph值为约5至约8。在一个优选的实施方式中,制剂含有约1至35%的大麻素类化合物。在一个更优选的实施方式中,制剂含有约1至约15%,约5至约12%或约7至约11%的大麻素类化合物。可替代地,制剂可能含有来自约20至约35%或约30至约35%的大麻素类化合物。在另一个实施方式中,制剂含有的大麻素类化合物选自由大麻酚、大麻二酚、屈大麻酚(δ-9-四氢大麻酚)、δ-8-四氢大麻酚、11-羟基-四氢大麻酚、11-羟基-δ9-四氢大麻酚、左南曲朵、δ-11-四氢大麻酚、tetrahydrocannabivarin、amandamide、大麻隆、酸、类似物、和其人造的衍生物构成的组。在一个优选的实施方式中,大麻素类化合物是大麻二酚。在一个优选的实施方式中,制剂含有约1至约35%的大麻二酚。在一个更优选的实施方式中,制剂含有约1至约15%,约5至约12%或约7至约11%的大麻二酚。可替代地,制剂可含有约20至约35%或约30至约35%的大麻二酚。在另一个实施方式中,制剂含有基本上纯的和人造合成的大麻二酚,其中大麻二酚的纯度大于98%。在一个更优选的实施方式中,大麻二酚的纯度大于99%。在一个更优选的实施方式中,大麻二酚的纯度是大于99.5%。在一个最优选的实施方式中,大麻二酚制剂含有的δ-9-四氢大麻酚小于0.3%。在另一个实施方式中,制剂含有约0.001至约1%的抗氧化剂。在一个优选的实施方式中,制剂含有从约0.01至约1%的抗氧化剂。在一个更优选的实施方式中,制剂含有约0.02至0.5%的抗氧化剂。合适的抗氧化剂包括二丁基羟基甲苯、丁基羟基茴香醚、α-生育酚(维生素e)、抗坏血酸棕榈酸酯、抗坏血酸、抗坏血酸钠、乙二胺四乙酸、半胱氨酸盐酸盐、柠檬酸、柠檬酸钠、硫酸氢钠、焦亚硫酸钠、卵磷脂、没食子酸丙酯、硫酸钠和其组合物。在一个优选的实施方式中,制剂含有α-生育酚(维生素e),抗坏血酸,抗坏血酸钠,抗坏血酸棕榈酸酯或其组合物。在另一个实施方式中,制剂含有约1至约20%的丙二醇。在一个优选的实施方式中,制剂含有约1至约15%或约5至约10%的丙二醇。在一个可替代的实施方式中,制剂含有约20至约50%的丙二醇。在一个优选的实施方式中,制剂含有约30至约40%或约30至约35%的丙二醇。在另一个实施方式中,制剂含有约1至约20%的聚乙二醇。在一个优选的实施方式中,制剂含有约1至约10%或约1至约5%的聚乙二醇。在一个可替代的实施方式中,制剂含有约10至约20%的聚乙二醇。在一个优选的可替代的实施方式中,制剂含有约15至约20%的聚乙二醇。合适的聚乙二醇包括平均分子量在200和10000之间的低分子量聚乙二醇。一个可以使用的优选的聚乙二醇是聚乙二醇400。在另一个实施方式中,制剂含有约1至约20%的聚乙二醇400。在一个优选的实施方式中,制剂含有约1至约10%或约1至约5%的聚乙二醇400。在一个可替代的实施方式中,制剂含有约10至约20%的聚乙二醇400。在一个优选的可替代的实施方式中,制剂含有约15至约20%的聚乙二醇400。在一个另外的实施方式中,制剂含有水。制剂可以含有0%的水。如果制剂含有水,他们可以含有约1至约40%的水,约5至约40%的水,约10至约35%的水或约25至约35%的水。在另一个实施方式中,制剂含有约1至约65%的乙醇。在一个优选的实施方式中,制剂含有约10至约65%,约15至约60%,或约30至约55%的乙醇。在一个可替代的实施方式中,制剂含有约1至约20%的乙醇。在一个优选的可替代的实施方式中,制剂含有约1至约10%或约3至约7%的乙醇。制剂的ph值可以通过使用任何药物学上可接受的方法来调整。制剂优选的ph值是约6至约7。在一个优选的实施方式中,制剂的ph值是约6.2至约6.7。本发明的制剂也可以含有甜味剂、增甜剂、防腐剂、ph值调节剂、和调味剂。合适的甜味剂包括但不限于蔗糖,阿斯巴甜,糖精,葡萄糖,甘露醇,木糖醇和其组合物。如果制剂含有甜味剂,制剂优选含有约0.001至约1%的甜味剂。合适的增甜剂包括,但不限于,铵盐形式的粗制和精制的甘草酸。产品(可以从mafco全球公司获取,magnasweet是mafco全球公司的注册商标)使用铵盐形式的粗制和精炼的甘草酸。甘草酸在钠和钾盐中也能以纯粹的衍生物的形式存在。如果制剂含有增甜剂,制剂优选含有约0.001至约1%的增甜剂。合适的ph值调节剂包括,但不限于,盐酸、抗坏血酸、柠檬酸、柠檬酸钠、富马酸、氢氧化钠、碳酸氢钠、碳酸钠、碳酸铵和其组合物。合适的防腐剂包括,但不限于,对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲醇、苯甲酸、苯甲酸钠、山梨酸及其组合物。合适的调味剂包括但不限于覆盆子、薄荷油、葡萄香精、薄荷醇、留兰香油、柑橘油、肉桂油、草莓香精、樱桃香精、覆盆子香精、橙油、柠檬油、柠檬薄荷香精、水果宾治香精和其组合物。在一个优选的实施方式中,制剂含有水果宾治香精、覆盆子香精、葡萄香精或柠檬薄荷香精。如果制剂含有调味剂,制剂优选含有约0.001至约1%的调味剂。在一个更优选的实施例中,制剂含有约0.005至约0.5%的调味剂。制剂适用于口服、含服、舌下、吸入或静脉/肌内施用。优选的,制剂是液体施用的口服药物。含有脂质的制剂在另一个实施方式中,本发明涉及口服施用的稳定的药物制剂,含有约0.1至约40%的大麻素类化合物和约10至约40%的脂类。在一个优选的实施方式中,脂质选自由芝麻油、橄榄油、玉米油、向日葵油、红花油、亚麻油、杏仁油、花生油、核桃油、腰果油、蓖麻油、椰子油、棕榈油、大豆油、菜籽油、植物油、米糠油、中链甘油酯、癸酰酸甘油酯(decanoylglycerides)、辛酰酸甘油酯(octanoylglycerides)、辛酸/癸酸甘油三酯、油酰酸聚乙二醇-6甘油酯(oleoylpolyoxyl-6glycerides)、亚油酰酸聚乙二醇-6甘油酯(linoleoylpolyoxyl-6glycerides)、聚甘油-3二油酸酯、甘油单亚油酸酯、甘油单辛酸酯、油酸及其组合组成的组。在一个优选的实施方式中,脂质选自由芝麻油、向日葵油、大豆油、玉米油、癸酰酸甘油酯和辛酰酸甘油酯的混合物、和其组合物构成的组。脂类的合适的商业来源包括癸酰酸和辛酰酸甘油酯(脂肪酸酯)专有混合物的812n和也包括取自椰子油的癸酰酸和辛酰酸脂肪酸专有混合物的810n(miglyol购自cremeroleogmbh&co.并且是其注册商标)。在另一个实施方式中,制剂所含的大麻素类化合物选自由大麻酚、大麻二酚、屈大麻酚(δ-9-四氢大麻酚)、δ-8-四氢大麻酚、11-羟基-四氢大麻酚、11-羟基-δ9-四氢大麻酚、左南曲朵、δ-11-四氢大麻酚、tetrahydrocannabivarin、amandamide、大麻隆、酸、类似物、和其人造的衍生物构成的组。在一个优选的实施方式中,大麻素类化合物是大麻二酚。在另一个实施方式中,制剂含有基本上纯的人造合成大麻酚,其中大麻酚的纯度大于98%。在一个更优选的实施方式中,大麻二酚的纯度大于99%。在一个更优选的实施方式中,大麻二酚的纯度大于99.5%。在一个最优选的实施方式中,大麻二酚制剂包括的δ-9-四氢大麻酚小于0.3%。在一个优选的实施方式中,制剂含有约1至约35%的大麻二酚。在一个更优选的实施方式中,制剂含有约10至约32%的大麻二酚。在一个最优选的实施方式中,制剂含有约17至约29%的大麻二酚。在一个优选的实施方式中,制剂含有约20至约90%的脂质。在一个更优选的实施方式中,制剂含有约50至约90%的脂质。在一个最优选的实施方式中,制剂含有约60至约85%的脂质。在另一个实施方式中,制剂含有乙醇。制剂可以含有0%的乙醇。如果制剂包括乙醇,它们可以含有约0.1至约20%的乙醇。在一个优选的实施方式中,制剂含有约3至约17%的乙醇。在一个更优选的实施方式中,制剂含有约5至约15%的乙醇。在另一个实施方式中,制剂含有抗氧化剂。制剂可以含有0%抗氧化剂。如果制剂含有抗氧化剂,它们可以含有约0.01至约1%的抗氧化剂。在一个优选的实施方式中,制剂含有约0.02至约0.5%的抗氧化剂。在一个更优选的实施方式中,制剂含有约0.03至约0.1%的抗氧化剂。合适的抗氧化剂包括二丁基羟基甲苯、丁基羟基茴香醚、α-生育酚(维生素e)、抗坏血酸棕榈酸酯、抗坏血酸、抗坏血酸钠、乙二胺四乙酸、半胱氨酸盐酸盐、柠檬酸、柠檬酸钠、硫酸氢钠、焦亚硫酸钠、卵磷脂、没食子酸丙酯、硫酸钠、和其组合物。在一个优选的实施方式中,抗氧化剂包括α-生育酚(维生素e)、抗坏血酸、抗坏血酸钠、抗坏血酸棕榈酸酯或其组合物。合适的甜味剂包括但不限于蔗糖、阿斯巴甜、糖精、葡萄糖、甘露醇、木糖醇和其组合物。如果制剂含有甜味剂,制剂优选含有约0.1至约2%的甜味剂。在一个优选的实施方式中,制剂优选含有约0.1至约0.8%的甜味剂。在一个最优选的实施方式中,制剂优选含有约0.2至约0.5%的甜味剂。合适的增甜剂包括,但不限于,铵盐形式的粗制和精制的甘草酸。产品(可以从mafco全球公司获取,magnasweet是mafco全球公司的注册商标)使用铵盐形式的粗制和精炼的甘草酸。甘草酸在钠和钾盐中也能以纯粹的衍生物的形式存在。如果制剂含有增甜剂,则制剂优选含有约0.001至约1%的增甜剂。合适的ph值调节剂包括,但不限于,盐酸、抗坏血酸、柠檬酸、柠檬酸钠、富马酸、氢氧化钠、碳酸氢钠、碳酸钠、碳酸铵和其组合物。合适的防腐剂包括,但不限于,对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲醇、苯甲酸、苯甲酸钠、山梨酸和其组合物。合适的调味剂包括但不限于覆盆子、薄荷油、葡萄香精、薄荷醇、留兰香油、柑橘油、肉桂油、草莓香精、樱桃香精、覆盆子香精、橙油、柠檬油、柠檬薄荷香精、水果宾治香精、和其组合物。如果制剂含有调味剂,制剂优选含有约0.001至约1%的调味剂。在一个更优选的实施方式中,制剂含有约0.005至约0.5%的调味剂。制剂适用于口服、含服、舌下、吸入或静脉/肌内施用。优选的,制剂是液体施用的口服药物。使用本发明的制剂(包括乙醇的,不包括乙醇的和脂质)和人造合成的、基本上纯的,大麻二酚的示例本发明的制剂特别适用于治疗许多疾病或病症或疾病和病症的症状。此外,人造合成的和基本上纯的大麻二酚更有效并且适合用于治疗这些疾病或疾病的症状。如在美国专利申请号62/004,495中首先描述的,申请人意外地创造了用于制备大麻二酚的新的人造的途径。这新的方法消除了为了提取化合物而种植大麻的需要。申请人的大麻二酚具有高纯度水平,并且基本上不包括表i药物,包括δ-9-四氢大麻酚。申请人化学合成大麻二酚是通过将对-薄荷二烯醇(p-menthadienol)和橄榄醇在甲苯或二氯甲烷或己烷中与对甲苯磺酸催化剂组合来制备大麻二酚(参见下图)。在一个实施方式中,本发明涉及治疗脑肿瘤的方法,所述方法包括施用本发明的制剂于有需要的患者。在另一个实施方式中,本发明涉及治疗脑肿瘤的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及治疗神经胶质瘤的方法,所述方法包括施用本发明的制剂于有需要的患者。在另一个实施方式中,本发明涉及治疗神经胶质瘤的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及用于治疗多形性成胶质细胞瘤的方法,所述方法包括施用本发明的制剂于有需要的患者。在另一个实施方式中,本发明涉及用于治疗多形性成胶质细胞瘤的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及用于治疗dravet综合征的方法,所述方法包括施用本发明的制剂于有需要的患者。在另一个实施方式中,本发明涉及用于治疗dravet综合征的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在另一个实施方式中,本发明涉及治疗lennoxgastaut综合征的方法,所述方法包括施用本发明的制剂于有需要的患者。在另一个实施方式中,本发明涉及治疗lennoxgastaut综合征的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个另外的实施方式中,本发明涉及治疗肌阵挛性痉挛的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个更优选的实施方式中,不包括乙醇的制剂包括基本上纯的大麻二酚。在另一个实施方式中,本发明涉及治疗肌阵挛性痉挛的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个另外的实施方式中,本发明涉及用于治疗青少年肌阵挛性癫痫的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不包括乙醇制剂施用于有治疗需要的年轻患者。在另一个实施方式中,本发明涉及用于治疗青少年肌阵挛性癫痫的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及治疗顽固性癫痫的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不包括乙醇制剂施用于有治疗需要的年轻患者。在另一个实施方式中,本发明涉及治疗顽固性癫痫的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及用于治疗青少年痉挛的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不包括乙醇制剂施用于有治疗需要的年轻患者。在另一个实施方式中,本发明涉及用于治疗青少年痉挛的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及治疗韦斯特综合征的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不包括乙醇制剂施用于有治疗需要的年轻患者。在另一个实施方式中,本发明涉及治疗韦斯特综合征的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及治疗婴儿痉挛的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不包括乙醇制剂施用于有治疗需要的年轻患者。在另一个实施方式中,本发明涉及治疗婴儿痉挛的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及治疗顽固性婴儿痉挛的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不包括乙醇制剂施用于有治疗需要的年轻患者。在另一个实施方式中,本发明涉及治疗顽固性婴儿痉挛的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及治疗管状硬化综合征的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含乙醇的制剂施用于有治疗需要的年轻患者。在另一个实施方式中,本发明涉及治疗管状硬化综合征的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个另外的实施方式中,本发明涉及治疗神经性疼痛的方法,所述方法包括施用本发明的制剂于需要的患者。在另一个实施方式中,神经性疼痛由神经毒性化疗剂如紫杉醇,多烯紫杉醇,顺铂,奥沙利铂,卡铂,长春新碱,氨甲蝶呤,阿糖胞苷,氟尿嘧啶,异环磷酰胺,环磷酰胺,甲基苄肼,依托泊苷,卡莫司汀和洛莫司汀引起的。在另一个实施方式中,神经性疼痛由紫杉醇引起,并且患者由于乳腺,子宫颈,子宫内膜和/或卵巢癌的诊断而接受紫杉醇。在另一个实施方式中,乳腺,子宫颈,子宫内膜和/或卵巢癌是耐铂性的。在另一个实施方式中,乳腺,子宫颈,子宫内膜和/或卵巢癌是复发性的。在另一个实施方式中,本发明涉及治疗神经性疼痛的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在另一个实施方式中,神经性疼痛由神经毒性化疗剂如紫杉醇,多烯紫杉醇,顺铂,奥沙利铂,卡铂,长春新碱,氨甲蝶呤,阿糖胞苷,氟尿嘧啶,异环磷酰胺,环磷酰胺,甲基苄肼,依托泊苷,卡莫司汀和洛莫司汀引起的。在另一个实施方式中,神经性疼痛由紫杉醇引起,并且患者由于乳腺,子宫颈,子宫内膜和/或卵巢癌的诊断而接受紫杉醇。在另一个实施方式中,乳腺,子宫颈,子宫内膜和/或卵巢癌是耐铂性的。在另一个实施方式中,乳腺,子宫颈,子宫内膜和/或卵巢癌是复发性的。在另一个实施方式中,本发明涉及使用大麻二酚作为止痛剂的方法,所述方法包括施用本发明的制剂于有需要的患者。在另一个实施方式中,本发明涉及使用大麻二酚作为止痛剂的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在另一个实施方式中,本发明涉及用于治疗阿片类药物成瘾戒断的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗阿片类药物成瘾戒断的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在另一个实施方式中,本发明涉及用于治疗可卡因成瘾戒断的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗可卡因成瘾戒断的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个另外实施方式中,本发明涉及用于治疗海洛因成瘾戒断的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗海洛因成瘾戒断的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个另外实施方式中,本发明涉及用于治疗尼古丁成瘾戒断的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗尼古丁成瘾戒断的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个另外实施方式中,本发明涉及用于治疗安非他命成瘾戒断的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗安非他命成瘾戒断的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及用于治疗痤疮的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗痤疮的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及用于治疗帕金森病的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗帕金森病的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及用于治疗精神分裂症的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗精神分裂症的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及用于治疗社交焦虑症的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗社交焦虑症的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个另外的实施方式中,本发明涉及用于治疗抑郁症的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗抑郁症的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个另外的实施方式中,本发明涉及用于治疗遭遇不良情绪刺激的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗遭遇不良情绪刺激的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及用于治疗恶心的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗恶心的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及用于治疗多发性硬化的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗多发性硬化的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及用于治疗大麻使用障碍症状的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗大麻使用障碍症状的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在另一个实施方式中,本发明涉及用于治疗早期精神病症状的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗早期精神病症状症状的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在另一个实施方式中,本发明涉及用于治疗阿尔茨海默病症状的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗阿尔茨海默病症状的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在另一个实施方式中,本发明涉及用于治疗创伤后应激障碍(“ptsd”)症状的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗创伤后应激障碍症状的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及用于治疗焦虑症状的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗焦虑症状的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。在一个实施方式中,本发明涉及用于治疗自闭症症状的方法,所述方法包括施用本发明的制剂于有需要的患者。在一个优选的实施方式中,将本发明的不含醇的制剂施用于需要治疗的患者。在另一个实施方式中,本发明涉及用于治疗自闭症症状的方法,所述方法包括施用人造合成的、基本上纯的大麻二酚于有需要的患者。定义如本文所述,“患者”指的是单个患者而不是患者群体。如本文所述,“人造”指的是化学合成的大麻二酚不是从大麻植物材料中提取的大麻二酚。如本文所述用语,“基本上纯的”指的是从大麻植物材料提取的具有色谱纯度大于98%,优选大于98.5%,更优选大于99.0%,最优选大于99.5%的大麻二酚。如本文所述,“基本上不包括δ-9-四氢大麻酚”指的是通过hplc测定的具有小于0.3%的δ-9-四氢大麻酚的大麻二酚制剂。优选地,制剂包括小于0.25%的δ-9-四氢大麻酚,更优选0.2%,并且最优选小于0.1%的δ-9-四氢大麻酚。如本文所述,与量,重量等相关的数值,被定义的“约”是每个特定值的所有数值加或减10%。例如,用语“约10%w/w”应理解为“9%w/w至11%w/w”。因此,权利要求值中的数量10%包括在权利要求的范围内。如本文所述,“液体”指的是可流动的流体药物制剂。这种类型的制剂不是粉末固体。本文中所述的重量指的是总制剂的%w/w或重量百分比。如本文所述,用语“有效量”指的是治疗有需要的患者所需的量。如本文所述,用语“药物学上可接受的”指的不是在口服制剂中的生物学或另外其它方面不期望的成分。如本文所述,“qs”表示能达到所需的体积或浓度的足够量的组分。公开的实施方式仅仅是本文公开的发明构思的示例性实施例,并且不应被认为是限制性的,除非权利要求另有明确说明。以下实施方式旨在说明本发明并教导本领域普通技术人员如何使用本发明的制剂。它们不旨在以任何方式进行限制。本发明的所有权利要求,所有方面和实施方式和其具体示例旨在涵盖其等同物。实施例实施例1.不含乙醇的制剂表1中的制剂如下制备。所有溶剂在用于生产之前用氮气净化。将维生素e,对羟基苯甲酸甲酯,对羟基苯甲酸丙酯溶解在丙二醇中。将聚乙二醇400(peg400)和调味剂加入到丙二醇溶液中并充分混合。通过将三氯蔗糖和抗坏血酸钠溶解在水中来制备水相。接下来,将溶液合并,并使用ph值调节剂调节ph值。将大麻素类化合物加入到赋形剂溶液中并混合直至溶解。使用人造合成的,基本上纯的大麻二酚作为大麻素类化合物。使用草莓香精作为调味剂。表1.不含乙醇的制剂实施例2.不含乙醇制剂的稳定性表1中所列的制剂在55℃±2℃,40℃±2℃,75%±5%相对湿度和25℃±2℃,60%±5%相对湿度的条件下的稳定性。通过在特定的时间点评价其效力(测定值)和杂质水平来分析制剂的稳定性。使用具有紫外检测器的高效液相色谱法检测含量和杂质。该含量在228nm下进行并表示为%初始浓度。对于所有杂质,在228nm进行分析并表示为%面积。以每种制剂的面积的百分比的表示的特定杂质的量总杂质的量列于表2至13中。每种杂质的相对保留时间(rrt)被给出。表2.在55℃±2℃储存的大麻二酚口服溶液制剂#af1的稳定性数据nd-未检测到bql-低于定量限,仅限未知杂质表3.在55℃±2℃储存的大麻二酚口服溶液制剂#af2的稳定性数据nd-未检测到bql-低于定量限,仅限未知杂质表4.在55℃±2℃储存的大麻二酚口服溶液制剂#af3的稳定性数据nd-未检测到bql-低于定量限,仅限未知杂质表5.储存在55℃±2℃的大麻二酚口服溶液制剂#af4的稳定性数据nd-未检测到bql-低于定量限,仅限未知杂质表6.在40℃±2℃下75%±5%相对湿度下储存的大麻二酚口服溶液制剂#af1的稳定性数据nd-未检测到bql-低于定量限,仅限未知杂质表7.在40℃±2℃下75%±5%相对湿度下储存的大麻二酚口服溶液制剂#af2的稳定性数据nd-未检测到bql-低于定量限,仅限未知杂质表8.在40℃±2℃下75%±5%相对湿度下储存的大麻二酚口服溶液制剂#af3的稳定性数据nd-未检测到表9.在40℃±2℃下75%±5%相对湿度下储存的大麻二酚口服溶液制剂#af4的稳定性数据40oc-制剂#af4rrt0周2周4周含量(%初始浓度)100.0099.6399.50%顺-大麻二酚1.4370.01%0.01%0.01%%反-(1r,6r)-3'-甲基-大麻二酚1.8400.05%0.05%0.06%%未知杂质0.7760.07%0.07%0.08%总杂质(%面积)0.13%0.13%0.15%表10.在25℃±2℃下60%±5%相对湿度下储存的大麻二酚口服溶液制剂#af1的稳定性数据nd-未检测到bql-低于定量限,仅限未知杂质表11.在25℃±2℃下60%±5%相对湿度下储存的大麻二酚口服溶液制剂#af2的稳定性数据25oc-制剂#af2rrt0周4周含量(%初始浓度)100.00100.22%顺-大麻二酚1.4420.01%0.01%%反-(1r,6r)-3'-甲基-大麻二酚1.8480.05%0.05%%未知杂质0.7760.07%0.07%总杂质(%面积)0.13%0.13%表12.在25℃±2℃下60%±5%相对湿度下储存的大麻二酚口服溶液制剂#af3的稳定性数据25oc-制剂#af3rrt0周4周含量(%初始浓度)100.0097.52%顺-大麻二酚1.4420.01%0.01%%反-(1r,6r)-3'-甲基-大麻二酚1.8460.05%0.05%%未知杂质0.7750.06%0.08%总杂质(%面积)0.12%0.14%表13.在25℃±2℃下60%±5%相对湿度下储存的大麻二酚口服溶液制剂#af4的稳定性数据对照制剂(#af1)显示出总杂质水平的显着增加和含量值的降低。与对照制剂相比,将制剂(#af2)的ph值调节在约6至约7的范围内提高了制剂的稳定性。这说明ph值在大麻素类化合物制剂的稳定性中起关键作用。申请人确定约6至约7的ph值可获得最佳稳定性。加入抗氧化剂以及ph值调节剂进一步提高了大麻素类化合物制剂的稳定性。例如,包括抗氧化剂和ph值调节剂的制剂#af3和#af4在温度和湿度条件下显示出持续4周的优异的稳定性。实施例3.含乙醇制剂表14和15中的制剂如下制备。所有溶剂在用于生产之前用氮气净化。将维生素e,抗坏血酸棕榈酸酯,对羟基苯甲酸甲酯,对羟基苯甲酸丙酯,三氯蔗糖溶于乙醇。丙二醇,聚乙二醇400,甘油,调味剂和水加入到溶液中并充分混合。然后,如果适用,使用ph值调节剂调节溶液的ph值。将大麻素类化合物加入赋形剂溶液中并混合直至完全溶解。使用人造合成的,基本上纯的大麻二酚作为大麻素类化合物。使用草莓香精作为调味剂。表14.含乙醇的制剂表15.额外含乙醇的制剂制剂#a9#a10大麻素类化合物3232聚乙二醇40018.823.8丙二醇3939乙醇5大麻素类化合物55维生素e(α-生育酚)0.050.05棕榈酸抗坏血酸酯0.10.1三氯蔗糖0.050.05对羟基苯甲酸甲酯0.020.02对羟基苯甲酸丙酯0.020.02实施例4.含乙醇制剂的稳定性表14和表15中所列的制剂在25oc±2oc,60%±5%相对湿度和40oc±2oc,75%±5%相对湿度的条件下的稳定性。通过在特定的时间点评价其效力(测定值)和杂质水平来分析制剂的稳定性。使用具有紫外检测器的高效液相色谱法检测含量和杂质。该测定在228nm下进行并表示为%初始浓度。对于所有杂质,在228nm进行分析并表示为%面积。以每种制剂的面积的百分比的表示的特定杂质的量总杂质的量列于表16至22中。每种杂质的相对保留时间(rrt)被给出。表16.在25℃±2℃下60%±5%相对湿度下储存的大麻二酚口服溶液制剂#a5的稳定性数据nd-未检测到bql-低于定量限,仅限未知杂质表17.在25℃±2℃下60%±5%相对湿度下储存的大麻二酚口服溶液制剂#a6的稳定性数据nd-未检测到bql-低于定量限,仅限未知杂质表18.在25℃±2℃下60%±5%相对湿度下储存的大麻二酚口服溶液制剂#a7的稳定性数据nd-未检测到bql-低于定量限,仅限未知杂质表19.在25℃±2℃下60%±5%相对湿度下储存的大麻二酚口服溶液制剂#a8的稳定性数据nd-未检测到bql-低于定量限,仅限未知杂质表20.在40℃±2℃下75%±5%相对湿度下储存的大麻二酚口服溶液制剂#a7的稳定性数据nd-未检测到bql-低于定量限,仅限未知杂质表21.在40℃±2℃下75%±5%相对湿度下储存的大麻二酚口服溶液制剂#a8的稳定性数据nd-未检测到bql-低于定量限,仅限未知杂质表22.在40℃±2℃下75%±5%相对湿度下储存的大麻二酚口服溶液制剂#a9的稳定性数据40oc–制剂#a9rrt0周2周4周含量(%初始浓度)100.0099.77100.65%顺-大麻二酚1.4400.010.010.01%反-(1r,6r)-3'-甲基-大麻二酚1.8410.050.060.05%未知杂质0.7700.060.070.08总杂质(%面积)0.120.140.14表23.在40℃±2℃下75%±5%相对湿度下储存的大麻二酚口服溶液制剂#a10的稳定性数据nd-未检测到对照制剂(#a5)显示出总杂质水平的显着增加和测定值的降低。添加抗氧化剂,维生素e和抗坏血酸棕榈酸酯(参见#a6)显着提高了制剂的稳定性。这些结果说明抗氧化剂在稳定的大麻素类化合物制剂中的关键作用。抗氧化剂维生素e和抗坏血酸(或其盐)显示出优异的协同作用,因为抗坏血酸(或其盐)通过再生而强烈抑制维生素e的消耗。与抗氧化剂一起,加入ph值调节剂以将ph值调节至6至7的范围导致异常稳定的制剂(#a7和#a8)。稳定性测试数据说明约6至约7的ph值范围是关键的。制剂#a9和#a10在四周后也显示出良好的稳定性。实施例5.含脂质制剂表24中的制剂通过将所有固体和液体赋形剂混合在脂质中来制备。然后溶解大麻二酚。人造合成的,基本上纯的,大麻二酚用作大麻素类化合物的来源。草莓被用作调味剂的来源。表24.含脂质的制剂实施例6.含脂质的制剂的稳定性制剂#lf1在25℃±2℃,60%±5%相对湿度和40℃±2℃,75%±5%相对湿度条件下的稳定性。通过在特定的时间点评价其效力(测定值)和杂质水平来分析制剂的稳定性。使用具有紫外检测器的高效液相色谱法检测含量和杂质。该含量在228nm下进行并表示为%初始浓度。对于所有杂质,在228nm进行分析并表示为%面积。以每种制剂的面积的百分比的表示的特定杂质的量以及总杂质的量列于表25中。每种杂质的相对保留时间(rrt)被给出。表25.在40℃±2℃下75%±5%相对湿度下储存和在25℃±2℃下在60%±5%相对湿度下储存的大麻二酚口服溶液制剂#lf1的三个月稳定性数据制剂#lf1rrt0个月3个月-40oc3个月25oc含量(%初始浓度)100.00100.87100.72%顺-大麻二酚1.4370.030.040.04%δ-9-四氢大麻酚1.7360.060.060.08%反-(1r,6r)-3'-甲基-大麻二酚1.8400.020.060.02总杂质(%面积)0.110.160.14如上表25中所述,含芝麻油的制剂#lf1在25℃±2℃/60%±5%相对湿度和40oc±2oc/75%±5%相对湿度的两个储存条件下3个月后显示出良好的稳定性。实施例7.紫杉醇诱导的神经性疼痛的研究紫杉醇是对几种类型的癌症包括卵巢,乳腺,肺和头部和颈部具有活性的抗肿瘤剂。紫杉醇的作用是通过促进微管组装,可以导致神经病变的毒副作用。外周感觉神经病变是紫杉醇最常报道的神经毒性副作用,并且当单独施用或与其它神经毒性抗肿瘤剂例如顺铂一同施用时,限制了高剂量和累积剂量的紫杉醇的治疗。目前对于这种类型的疼痛没有高度有效的治疗。因此,需要高度有效的治疗以缓解紫杉醇诱发的神经病的症状。进行小鼠研究以确定大麻二醇,δ-9-四氢大麻酚和大麻二酚加上δ-9-四氢大麻酚组合物对减轻由化疗诱导的周围神经病变引起的神经性疼痛的作用。给小鼠施用的大麻二酚是基本上纯的,人造合成的大麻二酚,其纯度大于98%。图1的详细说明如下。y轴表示对机械刺激的阈值灵敏度,表示为基线灵敏度的百分比。x轴代表腹膜内施用的药物mg/kg的剂量。而点状线表示对盐水对照的机械刺激的戒断阈值水平,短划线代表紫杉醇治疗的动物。沿短划线的点表示神经性疼痛,而沿点状线的点表示对神经性疼痛的保护。所显示的数据是在治疗后第21天测量的平均值+sem敏感性。通过单因素anova测定的盐水对照的*p<0.05。当一起加入时会产生的加和效应水平,特定剂量的试剂产生了类似的明显行为效应。例子:1)如果1.25mg/kg大麻二酚产生100%的疼痛作用减轻,1.25mg/kgδ-9-四氢大麻酚产生0%作用,那么一起加入的那些剂量应该是完全有效的(2.5mg/kg大麻二酚+2.5mg/kgδ-9-四氢大麻酚)。2)如果0.625mg/kg大麻二酚和0.625δ-9-四氢大麻酚产生0%效果,那么它们剂量的组合应该是无效的。申请人发现(如图1所示),与δ-9-四氢大麻酚相比,单独施用的大麻二酚提供了减轻化疗诱发的神经性疼痛的最有效水平。存在的δ-9-四氢大麻酚取决于其浓度可以抑制大麻二酚减轻神经性疼痛的能力。δ-9-四氢大麻酚阻断大麻二酚的疼痛缓解活性的能力也取决于大麻二酚的浓度。该试验说明非常需要基本上纯的大麻二酚制剂。实施例8.抗痉挛研究本研究如下进行,根据抗痉挛药筛选的标准模型,其包括最大电休克试验(“mes”),最小阵挛性发作发作(“6hz”)试验和毒性评价(“tox”)。将数据记录为所测试的动物数目(f)中受保护的动物数目(n),参见下表26至29。该试验重复一次。施用于小鼠和大鼠的大麻二酚是基本上纯的,人造合成的大麻二酚,其纯度大于98%。将大麻二酚溶解于0.5%甲基纤维素或1:1:18比例的乙醇:聚乙氧基化蓖麻油:磷酸盐缓冲盐水(“pbs”)中。最大电休克试验是一般性强直阵挛性发作的模型,并且提供了当脑中所有神经元回路最大活性时化合物预防痉挛发作扩散的能力的指示。这些发作是高度可再现的,并且在电生理学上与人的痉挛发作一致。对于基于最大电休克痉挛的所有测试,通过用包括麻醉剂(0.5%盐酸丁卡因)的电解质溶液引发的角膜电极递送60hz的交流电流(小鼠中50ma,大鼠中150小时)0.2s。通过在腹膜内以0.01ml/g体积计注射的10,30和100mg/kg剂量的大麻二酚后,在不同的时间间隔测试小鼠。在消除痉挛发作的后肢强直伸肌部分时,动物被认为“受保护”免受最大电休克诱导的痉挛发作。使用最小运动损伤测试来测定化合物的不期望的副作用或毒性。在该测试期间,监测动物的神经功能或肌肉功能受损的明显迹象。旋转程序用于公开最小的肌肉或神经损伤。当将对照小鼠放置在以6rpm的速度旋转的杆上时,动物可以长时间保持其平衡。如果动物在60秒期间从该旋转棒上脱落三次,则认为该动物是中毒的。除了最小的运动障碍之外,动物可能展示出圆形或之字形步态,身体姿势异常和腿部伸展,震颤,多动,缺乏探索行为,嗜睡,昏迷,僵住症,放置反应丧失和肌肉张力变化。第三个测试是最小阵挛性发作(6hz)测试。类似于最大电休克试验,最小阵挛性发作(6hz)试验用于评价化合物对电诱发性发作的功效,使用较低频率(6hz)和较长的刺激持续时间(3s)。通过腹膜内注射向小鼠预施用大麻二酚。在不同时间,通过用角膜电极递送的足够电流处理个体小鼠(每个时间点4只),为了在97%的动物中引起精神运动性发作(32ma,持续3s)。未治疗的小鼠将显示以最小克隆阶段为特征的痉挛发作,随后是定型的自动行为,最初描述为类似于具有部分发作的人类患者的预兆。表现出这种行为的动物不被认为是受保护的。表26.抗痉挛药物筛选,小鼠,甲基纤维素表27.抗痉挛药物筛选,小鼠,乙醇:聚乙氧基化蓖麻油:pbs表28.抗痉挛筛查,大鼠,甲基纤维素表29.抗痉挛筛查,大鼠,乙醇:聚乙氧基化蓖麻油:pbs实施例9.多形性成胶质细胞瘤研究在使用u87细胞的多形性成胶质细胞瘤的原位小鼠模型中,进行研究以确定大麻二酚或大麻二酚加上δ-9-四氢大麻酚(大麻二酚/δ9-四氢大麻酚1:1)可抑制多形性成胶质细胞瘤发展并增强替莫唑胺活性的全身施用的程度,替莫唑胺是一种化疗药物。上述建议的大麻二酚加δ-9-四氢大麻酚的组合是指向源自u87血清源性多形性成胶质细胞瘤细胞的肿瘤最有效的疗法。研究如下进行。将人u87萤光素酶标记的细胞在具有10%胎牛血清的roswellparkmemorialinstitute培养基中生长,然后从培养皿中收获,之后在具有0.1%胰蛋白酶/乙二胺四乙酸的培养物中培养指数生长期,并用无血清的roswellparkmemorialinstitute培养基洗涤两次。对于颅内模型,在4μl的roswellparkmemorialinstitute培养基中,通过颅内注射0.3×106个u87细胞以雌性无胸腺nu/nu小鼠中产生肿瘤。使用此模型,您可以评估药物功效(体内成像)以及同一组动物的生存。根据国家卫生研究院的指南进行存活研究,包括实验性瘤形成和我们批准的机构动物护理和使用委员会协议。当组中的动物显示出任何单一征兆象征着显着的肿瘤负荷发育,包括聚集,持续降低的一般活性或重量显着降低,从研究中移除所有组中的动物。在限制肿瘤能够逃离颅内空间的条件下,当通过卡尺评估外部肿瘤测量大于5mm时,对小鼠实施安乐死。此外,将肿瘤测量>500×106辐射的小鼠从研究中移除,即使没有观察到症状以确保发生与痉挛发作相关的自发性死亡,没有存在大颅内肿瘤。将大麻素类化合物溶解在3%乙醇,3%表面活性剂和94%盐水的混合物中,并将替莫唑胺溶解在30%二甲基亚砜和70%盐水中。在本研究中使用人造合成的和基本上纯的大麻二酚。在注射肿瘤细胞9天后开始治疗。在第一次注射前的早晨对小鼠成像以确定初始肿瘤大小,然后将组安排在第一次注射开始之前具有相等的肿瘤大小分布。用替莫唑胺对小鼠每天一次治疗5天。除了研究的第一周(小鼠在周末接受注射)外,以每天一次,每周5天(周一至周五)用大麻素类化合物治疗小鼠,直到研究完成。所有小鼠通过腹膜内注射施用治疗。每组12只小鼠,总共72只小鼠。治疗量如下:大麻二酚(15mg/kg);大麻二酚/δ-9-四氢大麻酚(1:1,共15mg/kg);和替莫唑胺(2mg/kg腹膜内注射。使用单因素方差分析(one-wayanova)确定显着性差异。适当时进行bonferroni-dunn事后分析。使用长排mantel-cox试验比较组间的存活率。p值<0.05定义的统计学意义。图2的详细解释如下。x轴表示治疗后的天数,y轴表示存活率。如图2所示。单独的15mg/kg大麻二酚或大麻二酚/δ-9-四氢大麻酚(1:1)不抑制多形性成胶质细胞瘤发育,其能增强次优剂量的替莫唑胺的抗肿瘤活性,导致存活率的显着增加。此外,基本上纯的,人造合成的大麻二酚呈现20%肿瘤的完全消退。在1:1大麻二酚:δ-9-四氢大麻酚治疗后没有观察到这种效果。意想不到的是基本上纯的,人造合成的大麻二酚具有这些效果,因为以前认为1:1比例的大麻二酚(从大麻中提取并且不是基本上纯的):δ-9-四氢大麻酚将产生比单独的大麻二酚更好的效果。然而,该研究再次说明了申请人的基本上纯的,人造合成的大麻二酚的优越性。实施例10.6hz精神运动性发作试验进行该研究以确定人造合成的,基本上纯的大麻二酚阻断由长持续时间频率(6hz)刺激诱导的精神运动性发作的能力。这是对于治疗抗性部分发作的研究模型。用100mg/kg剂量的大麻二酚腹膜内预处理成年雄性cf1小鼠(体重18至25g)。给小鼠施用的大麻二酚基本上是纯的,人造合成的大麻二酚,其纯度大于98%。将大麻二酚溶解在0.5%甲基纤维素或1:1:18比例的乙醇:聚乙氧基化蓖麻油:pbs中。在用大麻二酚处理后的五个时间点(1/4,1/2,1,2和4小时)之一检查每个治疗组(n=4只小鼠/组)的抗痉挛作用。在预处理后,每只小鼠接受一滴0.5%盐酸丁卡因,施用于每只眼。然后用通过角膜电极递送的低频(6hz)刺激3秒来处理小鼠。低频,长持续时间刺激最初以32ma强度递送。手动限制动物,并在刺激后立即释放,并观察痉挛活动。如果测试化合物在32ma筛选中有效,那么使用与上述相同的方案使用其中刺激电流增加至44ma的另外的测定。此外,可以在特定刺激强度的峰值效应(tpe)时生成剂量反应曲线。通常,6hz刺激导致痉挛发作,其特征在于最小的阵挛期,随后是定型的,自动行为,包括触须的颤搐和straub-tail(斯特劳布举尾)。不显示这些行为的动物被认为是被保护的。通过mann-whitneyu检验分析数据,p<0.05确定为具有统计学显着性。对于每个时间组,结果表示为随着时间的推移,从受试的动物数量中被保护的动物总数(即2/4表示受试的4只小鼠中的2只被保护)。表30.ed50生物反应,甲基纤维素表31.到峰值效应的时间,甲基纤维素表32.ed50生物反应,乙醇:聚乙氧基化蓖麻油:pbs测试剂量时间n/f6hz500.51/86hz1000.51/86hz1300.54/86hz1700.56/86hz2000.58/8tox20020/8tox25024/8tox30026/8tox50028/8表33.达到峰值效应的时间,乙醇:聚乙氧基化蓖麻油:pbs如表30至33所示,两种溶剂中的大麻二酚在100mg/kg范围内在50%动物中抑制痉挛发作(ed50s)显示出的可比的半数有效剂量。虽然溶解在甲基纤维素溶剂中的大麻二酚的ed50为103.75mg/kg(95%置信区间为53.89mg/kg至163.84mg/kg),但当溶解于1:1:18的乙醇:聚乙氧基化蓖麻油:pbs溶剂(95%置信区间为87.83mg/kg至152.96mg/kg)时显示出121.52mg/kg的ed50。基于甲基纤维素溶剂中大麻二酚的毒性数据,50%动物(“td50”)中观察到毒性的中间毒性剂量在施用后0.5小时被确定超过500mg/kg。测试的最高剂量,在24小时500mg/kg下报告于24小时腹泻和1死亡。td50被确定为具有溶解在1:1:18的乙醇:聚乙氧基化蓖麻油:pbs溶剂中的大麻二酚的262.37mg/kg(95%置信区间为232.64至301.78)。在24小时以300mg/kg报告死亡,在6和24小时以500mg/kg报告死亡,其中使用1:1:18的乙醇:聚乙氧基化蓖麻油:pbs溶剂。这些结果进一步说明大麻二酚可能在人体中有效用于治疗痉挛和其他病症。此外,人造合成的大麻二酚可能比源自植物且不是基本上纯的大麻二酚毒性更小。实施例11.最大电休克痉挛发作和皮下注射卡地阿唑最大电休克痉挛发作(“mes”)和皮下注射卡地阿唑(“scmet”)试验是用于研究抗痉挛药物的早期鉴定和高通量筛选的两种最广泛使用的临床痉挛模型。这些测试在鉴定可用于治疗人类全身性强直阵挛性痉挛和广泛性肌阵挛性痉挛发作的新的抗痉挛药物中极为有效。mes试验提供了当脑中所有神经元回路最大活性时防止痉挛发作扩散的能力的指示。scmet测试检测cbd提高动物的化学痉挛诱发的发作阈值的能力,并因此保护其不表现出阵挛性前脑发作。对于mes测试,60hz的交流电通过角膜电极递送0.2秒。用诱发阈值强直性延伸痉挛发作所必需的5倍的电流强度引发最大痉挛发作,即小鼠中50ma,大鼠中150ma。在将角膜电极施加到眼睛之前,将一滴麻醉剂溶液(0.5%盐酸丁卡因)放置在每只动物的眼睛上,以引起电刺激。用手限制动物,并在刺激后立即释放,以允许观察整个发作。抑制后腿紧张伸肌部分作为mes试验的终点。一定剂量的卡地阿唑(在小鼠中为85mg/kg)将在97%的小鼠(cd97)中诱发痉挛。将cd97剂量的卡地阿唑注射到颈部中线的松弛的皮肤皱褶中。每年确认小鼠中卡地阿唑的cd97剂量。它以体重的0.01ml/g体积施用于小鼠。然后将动物置于隔离笼中以使应激最小化,并连续监测下一个30分钟是否存在发作。将前肢和/或后肢,颌或触须的阵挛痉挛发作约3至5秒作为终点。不显示前肢和/或后肢阵挛,下巴咬响或触须颤搐的动物认为是被保护的。所有定量体内抗痉挛/行为障碍研究通常在先前测定的tpe下进行。使用各种剂量的大麻二酚测试至少8只小鼠的组,直到在100%保护或最小毒性和0%保护或最小毒性的限度之间建立至少两个点。在每个试验中在50%动物中产生所需终点(ed50或td50)所需的药物剂量,95%置信区间,回归线的斜率,然后通过概率分析计算斜率的平均值的标准误差(s.e.m.)。给小鼠施用的大麻二酚是基本上纯的,人造合成的大麻二酚,其纯度大于98%。将大麻二酚溶解在0.5%甲基纤维素或1:1:18比例的乙醇:聚乙氧基化蓖麻油:pbs中。最大电休克痉挛发作(mes)和皮下注射卡地阿唑(“scmet”)是用于早期识别和筛选新抗痉挛药物的最广泛使用的临床痉挛发作模型。表34.ed50生物反应,甲基纤维素测试剂量时间n/fmes20025/8mes25024/8mes30024/8mes35023/8mes40023/8mes45026/8mes50028/8scmet15021/8scmet20023/8scmet30025/8scmet36027/8tox50020/8表35.到峰值效应的时间,甲基纤维素表36.ed50生物反应,乙醇:聚乙氧基化蓖麻油:pbs测试剂量时间n/fmes7521/8mes9525/8mes12027/8mes15028/8scmet12020/8scmet16022/8scmet22025/8scmet26027/8tox17520/8tox25024/8tox32526/8tox50028/8表37.达到峰值效应的时间,乙醇:聚乙氧基化蓖麻油:pbs由于u形剂量响应(1/4保护在0.5小时,1/4在1小时,4/8在2小时和2/4小时在4小时),因此不能计算溶解在甲基纤维素溶剂中的大麻二醇的mes模型中的ed50。然而,溶解在1:1:18乙醇:聚乙氧基化蓖麻油:pbs溶剂中的大麻二酚的ed50为92.21mg/kg(95%置信区间为78.4mg/kg至104.63mg/kg)。对于met模型,对于溶解在甲基纤维素溶剂中的大麻二酚的ed50为241.03mg/kg(95%置信区间为182.23至311.87),并且用于溶解在1:1:18乙醇:聚乙氧基化蓖麻油:pbs溶剂中的大麻二酚的ed50为198.51mg/kg(95%置信区间为167.76mg/kg至232.58mg/kg)。基于溶解在甲基纤维素溶剂中的大麻二酚的毒性数据,测定td50超过500mg/kg是所测试的最高剂量。在1小时内以200mg/kg剂量和在2小时时以360mg/kg剂量报告肌阵挛性抽搐。溶解在1:1:18乙醇:聚乙氧基化蓖麻油:pbs溶剂中的大麻二酚的td50被确定为266.76mg/kg(95%置信区间为222.28mg/kg至317.42mg/kg)。这些结果进一步说明大麻二酚可能在人体中有效用于治疗痉挛和其他病症。此外,人造合成的大麻二酚可能比源自植物且不是基本上纯的大麻二酚毒性更小。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1