具有高含量阳性脂质化合物的脂质体制剂及其应用的制作方法
本发明涉及脂质体制剂,具体而言,本发明涉及具有高含量的阳性脂质化合物的脂质体制剂及其应用。
背景技术:
rna干扰(rnainterference,rnai)是近十年来发现的具有调节生物体内基因表达功能的一种自身保护机制,rnai是由双链rna(double-strandedrna,dsrna)介导的、由特定酶参与的特异性基因沉默现象,它在转录水平、转录后水平和翻译水平上阻断基因的表达。随着rnai技术的越来越成熟,目前已有多种围绕rnai机制开发的核酸药物进入临床试验阶段,调节异常基因表达的核酸药物将有望成为的一种高效快捷的疾病治疗途径。
以rnai技术为研究起点的一系列核酸药物近年来得到了很好的发展,其中包括小干扰核酸(smallinterferingrna,sirna)、微小核酸(microrna,mirna)、非编码核酸(non-codingrna,ncrna)、反义核酸(antisenserna/dna)、小配体核酸(smallligandrna,slirna)及小激活核酸(smallactiverna,sarna)等,这些核酸通过包含rnai在内不同的基因调节机制发挥作用,如sirna和mirna通过rnai机制调节细胞内特定基因的表达水平,当sirna或mirna进入细胞内后,这些双链rna能与细胞内的特定蛋白结合形成rna诱导的沉默复合物(rnainducingsilencingcomplex,risc),sirna在risc中解链后通过序列互补识别并与mrna结合,mrna被切割,达到下调基因表达的效果。rnai提供了一种与靶基因互补并阻断编码蛋白的mrna表达的基因治疗方法。
虽然研究人员用基于脂质体的载体系统来传输核酸药物,在阳性脂质体中的sirna通过全身给药,有研究报道,这些核酸脂质体制剂在体内和体外 的实验中得到了很好的验证。但是目前在核酸脂质体药物制剂在运用中还存在几大难题:1)缺乏高效的体内传输系统;2)现有以脂质体作为制剂形式,其核酸载药量低;3)核酸脂质体药物体内毒性高。
为了克服上述这些难题,本领域亟需一种具有高含量阳性脂质化合物的脂质体制剂以将高含量的核酸药物安全地递送至体内。
技术实现要素:
一方面,本发明提供一种用于递送核酸的脂质体,其包含阳性脂质化合物、磷脂和长效脂质,其中,所述阳性脂质化合物的重量百分含量为50%至90%,所述磷脂的重量百分含量为5%至10%,所述长效脂质的重量百分含量为0%至10%;并且,其中,所述阳性脂质化合物由脂类脂质化合物和胆固醇类脂质化合物组成,所述脂类脂质化合物和所述胆固醇类脂质化合物的摩尔比为4:1至1:4。优选地,本发明的用于递送核酸的脂质体中阳性脂质化合物的重量百分含量为60%-90%,或70%-90%,或75%-90%,或80%-90%,或85%-90%。
本发明的脂类脂质化合物选自下述通式i、通式ii,通式iii和通式iv的化合物中的一种或多种:
其中,r,r'为c14-c22饱和或不饱和脂肪酸,a,a'为c1-c4烷基,n=1-4。
在本发明的优选实施方式中,所述通式i的化合物选自下列化合物:
化合物1:r=r’=亚油酸基,n=1,a=ch3,a’=ch3ch2;
化合物2:r=r’=亚油酸基,n=2,a=ch3,a’=ch3ch2;
化合物3:r=r’=亚油酸基,n=3,a=ch3,a’=ch3ch2;
化合物4:r=r’=亚油酸基,n=4,a=ch3,a’=ch3ch2;
化合物5:r=r’=油酸基,n=1,a=ch3,a’=ch3;
化合物6:r=r’=油酸基,n=2,a=ch3,a’=ch3;
化合物7:r=r’=油酸基,n=3,a=ch3,a’=ch3;
化合物8:r=r’=油酸基,n=4,a=ch3,a’=ch3;
化合物9:r=r’=亚油酸基,n=1,a=ch3ch2,a’=ch3ch2;
化合物10:r=r’=亚油酸基,n=2,a=ch3ch2,a’=ch3ch2;
化合物11:r=r’=亚油酸基,n=3,a=ch3ch2,a’=ch3ch2;
化合物12:r=r’=亚油酸基,n=4,a=ch3ch2,a’=ch3ch2;
化合物13:r=r’=亚油酸基,n=1,a=ch3ch2,a’=ch3;
化合物14:r=r’=亚油酸基,n=2,a=ch3ch2,a’=ch3;
化合物15:r=r’=亚油酸基,n=3,a=ch3ch2,a’=ch3;
化合物16:r=r’=亚油酸基,n=4,a=ch3ch2,a’=ch3;
化合物17:r=r’=油酸基,n=1,a=ch3ch2,a’=ch3ch2;
化合物18:r=r’=油酸基,n=2,a=ch3ch2,a’=ch3ch2;
化合物19:r=r’=油酸基,n=3,a=ch3ch2,a’=ch3ch2;
化合物20:r=r’=油酸基,n=4,a=ch3ch2,a’=ch3ch2;
化合物21:r=r’=油酸基,n=1,a=ch3,a’=ch3ch2;
化合物22:r=r’=油酸基,n=2,a=ch3,a’=ch3ch2;
化合物23:r=r’=油酸基,n=3,a=ch3,a’=ch3ch2;
化合物24:r=r’=油酸基,n=4,a=ch3,a’=ch3ch2。
在本发明的优选实施方式中,所述通式ii的化合物选自下列化合物:
化合物1’:r=r’=亚油酸基,n=1,a=ch3,a’=ch3ch2;
化合物2’:r=r’=亚油酸基,n=2,a=ch3,a’=ch3ch2;
化合物3’:r=r’=亚油酸基,n=3,a=ch3,a’=ch3ch2;
化合物4’:r=r’=亚油酸基,n=4,a=ch3,a’=ch3ch2;
化合物5’:r=r’=油酸基,n=1,a=ch3,a’=ch3;
化合物6’:r=r’=油酸基,n=2,a=ch3,a’=ch3;
化合物7’:r=r’=油酸基,n=3,a=ch3,a’=ch3;
化合物8’:r=r’=油酸基,n=4,a=ch3,a’=ch3;
化合物9’:r=r’=亚油酸基,n=1,a=ch3ch2,a’=ch3ch2;
化合物10’:r=r’=亚油酸基,n=2,a=ch3ch2,a’=ch3ch2;
化合物11’:r=r’=亚油酸基,n=3,a=ch3ch2,a’=ch3ch2;
化合物12’:r=r’=亚油酸基,n=4,a=ch3ch2,a’=ch3ch2;
化合物13’:r=r’=亚油酸基,n=1,a=ch3ch2,a’=ch3;
化合物14’:r=r’=亚油酸基,n=2,a=ch3ch2,a’=ch3;
化合物15’:r=r’=亚油酸基,n=3,a=ch3ch2,a’=ch3;
化合物16’:r=r’=亚油酸基,n=4,a=ch3ch2,a’=ch3;
化合物13’:r=r’=油酸基,n=1,a=ch3ch2,a’=ch3ch2;
化合物14’:r=r’=油酸基,n=2,a=ch3ch2,a’=ch3ch2;
化合物15’:r=r’=油酸基,n=3,a=ch3ch2,a’=ch3ch2;
化合物16’:r=r’=油酸基,n=4,a=ch3ch2,a’=ch3ch2;
化合物17’:r=r’=油酸基,n=1,a=ch3,a’=ch3ch2;
化合物18’:r=r’=油酸基,n=2,a=ch3,a’=ch3ch2;
化合物19’:r=r’=油酸基,n=3,a=ch3,a’=ch3ch2;
化合物20’:r=r’=油酸基,n=4,a=ch3,a’=ch3ch2。
在本发明的优选实施方式中,所述通式iii的化合物选自下列化合物:
化合物1”:r=r’=亚油酸基,n=1,a=ch3,a’=ch3ch2;
化合物2”:r=r’=亚油酸基,n=2,a=ch3,a’=ch3ch2;
化合物3”:r=r’=亚油酸基,n=3,a=ch3,a’=ch3ch2;
化合物4”:r=r’=亚油酸基,n=4,a=ch3,a’=ch3ch2;
化合物5”:r=r’=油酸基,n=1,a=ch3,a’=ch3;
化合物6”:r=r’=油酸基,n=2,a=ch3,a’=ch3;
化合物7”:r=r’=油酸基,n=3,a=ch3,a’=ch3;
化合物8”:r=r’=油酸基,n=4,a=ch3,a’=ch3;
化合物9”:r=r’=亚油酸基,n=1,a=ch3ch2,a’=ch3ch2;
化合物10”:r=r’=亚油酸基,n=2,a=ch3ch2,a’=ch3ch2;
化合物11”:r=r’=亚油酸基,n=3,a=ch3ch2,a’=ch3ch2;
化合物12”:r=r’=亚油酸基,n=4,a=ch3ch2,a’=ch3ch2;
化合物13”:r=r’=亚油酸基,n=1,a=ch3ch2,a’=ch3;
化合物14”:r=r’=亚油酸基,n=2,a=ch3ch2,a’=ch3;
化合物15”:r=r’=亚油酸基,n=3,a=ch3ch2,a’=ch3;
化合物16”:r=r’=亚油酸基,n=4,a=ch3ch2,a’=ch3;
化合物17”:r=r’=油酸基,n=1,a=ch3ch2,a’=ch3ch2;
化合物18”:r=r’=油酸基,n=2,a=ch3ch2,a’=ch3ch2;
化合物19”:r=r’=油酸基,n=3,a=ch3ch2,a’=ch3ch2;
化合物20”:r=r’=油酸基,n=4,a=ch3ch2,a’=ch3ch2;
化合物21”:r=r’=油酸基,n=1,a=ch3,a’=ch3ch2;
化合物22”:r=r’=油酸基,n=2,a=ch3,a’=ch3ch2;
化合物23”:r=r’=油酸基,n=3,a=ch3,a’=ch3ch2;
化合物24”:r=r’=油酸基,n=4,a=ch3,a’=ch3ch2。
在本发明的优选实施方式中,所述通式iv的化合物选自下列化合物:
化合物1”’:r=r’=亚油酸基,n=1,a=ch3,a’=ch3ch2;
化合物2”’:r=r’=亚油酸基,n=2,a=ch3,a’=ch3ch2;
化合物3”’:r=r’=亚油酸基,n=3,a=ch3,a’=ch3ch2;
化合物4”’:r=r’=亚油酸基,n=4,a=ch3,a’=ch3ch2;
化合物5”’:r=r’=油酸基,n=1,a=ch3,a’=ch3;
化合物6”’:r=r’=油酸基,n=2,a=ch3,a’=ch3;
化合物7”’:r=r’=油酸基,n=3,a=ch3,a’=ch3;
化合物8”’:r=r’=油酸基,n=4,a=ch3,a’=ch3;
化合物9”’:r=r’=亚油酸基,n=1,a=ch3ch2,a’=ch3ch2;
化合物10”’:r=r’=亚油酸基,n=2,a=ch3ch2,a’=ch3ch2;
化合物11”’:r=r’=亚油酸基,n=3,a=ch3ch2,a’=ch3ch2;
化合物12”’:r=r’=亚油酸基,n=4,a=ch3ch2,a’=ch3ch2;
化合物13”’:r=r’=亚油酸基,n=1,a=ch3ch2,a’=ch3;
化合物14”’:r=r’=亚油酸基,n=2,a=ch3ch2,a’=ch3;
化合物15”’:r=r’=亚油酸基,n=3,a=ch3ch2,a’=ch3;
化合物16”’:r=r’=亚油酸基,n=4,a=ch3ch2,a’=ch3;
化合物17”’:r=r’=油酸基,n=1,a=ch3ch2,a’=ch3ch2;
化合物18”’:r=r’=油酸基,n=2,a=ch3ch2,a’=ch3ch2;
化合物19”’:r=r’=油酸基,n=3,a=ch3ch2,a’=ch3ch2;
化合物20”’:r=r’=油酸基,n=4,a=ch3ch2,a’=ch3ch2;
化合物21”’:r=r’=油酸基,n=1,a=ch3,a’=ch3ch2;
化合物22”’:r=r’=油酸基,n=2,a=ch3,a’=ch3ch2;
化合物23”’:r=r’=油酸基,n=3,a=ch3,a’=ch3ch2;
化合物24”’:r=r’=油酸基,n=3,a=ch3,a’=ch3ch2。
本发明的胆固醇类脂质化合物选自下述通式v的化合物:
其中,y=(c=o)、(c=s)、(-hn(o)c-)或化学键,a,a'为c1-c4烷基,n=1-4。
在本发明的优选实施方式中,所述通式v的化合物选自下列化合物:
化合物v1:y=(c=o),n=1,a=ch3,a’=ch3ch2;
化合物v2:y=(c=o),n=2,a=ch3,a’=ch3ch2;
化合物v3:y=(c=o),n=3,a=ch3ch2,a’=ch3ch2;
化合物v4:y=(c=o),n=4,a=ch3ch2,a’=ch3ch2;
化合物v5:y=(c=o),n=1,a=ch3ch2,a’=ch3;
化合物v6:y=(c=o),n=2,a=ch3,a’=ch3;
化合物v7:y=(c=o),n=3,a=ch3,a’=ch3;
化合物v8:y=(c=o),n=4,a=ch3,a’=ch3;
化合物v9:y=(c=s),n=1,a=ch3ch2,a’=ch3ch2;
化合物v10:y=(c=s),n=2,a=ch3ch2,a’=ch3ch2;
化合物v11:y=(c=s),n=3,a=ch3ch2,a’=ch3ch2;
化合物v12:y=(c=s),n=4,a=ch3ch2,a’=ch3ch2;
化合物v13:y=(c=s),n=1,a=ch3ch2,a’=ch3;
化合物v14:y=(c=s),n=2,a=ch3ch2,a’=ch3;
化合物v15:y=(c=s),n=3,a=ch3ch2,a’=ch3;
化合物v16:y=(c=s),n=4,a=ch3ch2,a’=ch3;
化合物v17:y=(-hnc=o-),n=1,a=ch3ch2,a’=ch3ch2;
化合物v18:y=(-hnc=o-),n=2,a=ch3ch2,a’=ch3ch2;
化合物v19:y=(-hnc=o-),n=3,a=ch3ch2,a’=ch3ch2;
化合物v20:y=(-hnc=o-),n=4,a=ch3ch2,a’=ch3ch2;
化合物v21:y=(-hnc=o-),n=1,a=ch3,a’=ch3ch2;
化合物v22:y=(-hnc=o-),n=2,a=ch3,a’=ch3ch2;
化合物v23:y=(-hnc=o-),n=3,a=ch3,a’=ch3ch2;
化合物v24:y=(-hnc=o-),n=4,a=ch3,a’=ch3ch2。
另一方面,本发明提供一种核酸脂质体制剂,其包含上述本发明的脂质体以及包裹在所述脂质体内的核酸,其中,所述核酸选自:小干扰核酸、微小核酸、非编码核酸、反义核酸、小配体核酸和小激活核酸。优选地,本发明的核酸脂质体制剂还可包含药学上可接受的赋形剂。在一种实施方式中,本发明的核酸脂质体制剂可以是片剂、胶囊、乳液、滴剂、粉末、溶液、气溶胶的形式。在另一实施方式中,本发明的核酸脂质体制剂可以是口服剂型、静脉内注射剂型、肌肉内注射剂型、皮下给药剂型、肠胃外给药剂型和腹膜内给药剂型。
又一方面,本发明提供制备上述核酸脂质体制剂的方法,所述方法包括:
(1)提供阳性脂质化合物、磷脂和长效脂质的混合溶液;
(2)将步骤(1)的混合溶液与核酸溶液混合,得到所述核酸脂质体制剂;
其中,所述混合溶液中阳性脂质化合物的重量百分含量为50%至90%。
优选地,在步骤(1)之后对所述混合溶液进行挤出处理,得到脂质体空囊泡,其中,将所述核酸溶液与所述脂质体空囊泡混合,从而将所述核酸装载至所述脂质体空囊泡中,得到所述核酸脂质体制剂。
再一方面,本发明提供一种治疗与基因的异常表达有关的疾病的方法,其包括将本发明的核酸脂质体制剂给药于需要这种治疗的患者。本发明的核 酸脂质体制剂以口服给药、静脉内给药、肌肉内给药、皮下给药、肠胃外给药以及腹膜内给药的方式给药于患者。在本发明的一些实施方式中,所述核酸脂质体制剂中的核酸可被传输至细胞内,例如,肝或发炎组织等一些靶组织的细胞内。
本发明还涉及本发明的上述核酸脂质体制剂在制备用于治疗与基因的异常表达有关的疾病中的应用。
本发明的脂质体制剂的优势在于:
1)核酸载药量高,本发明提供的脂质体由于其中阳性脂质化合物的含量较高,能载入的带负电荷的核酸就更多,大大提高了核酸载药量。
2)用药毒性低,本发明提供的脂质体制剂的单位脂质囊泡里能载入更多的核酸药物,在用同等给药剂量的条件下,由于载药量的提高,阳性脂质化合物量的摄入量相对减少,从而降低脂质的用量,降低毒性。
附图说明
图1是根据本发明的一种实施方式将本发明的装载了核酸药物的脂质体制剂给药于小鼠前后的小鼠体重柱形图,其中,横坐标表示各实验组,纵坐标表示小鼠体重。
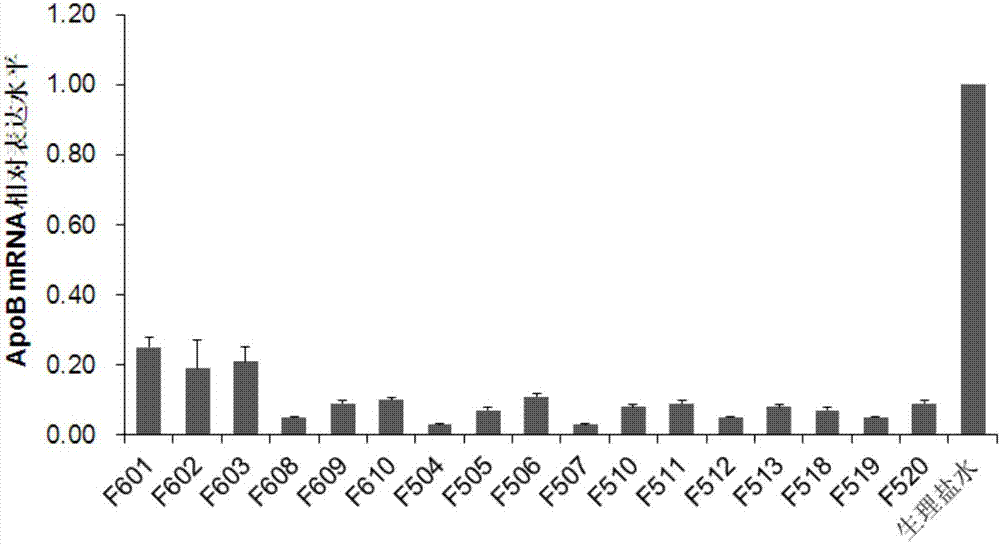
图2是将本发明的装载了核酸药物的脂质体制剂给药于小鼠后小鼠肝脏组织中apob基因的mrna相对表达水平柱形图,其中,横坐标表示各实验组,纵坐标表示apob基因的mrna相对表达水平。
图3是将本发明的装载了核酸药物的脂质体制剂给药于小鼠后小鼠血清中总胆固醇水平柱形图,其中,横坐标表示各实验组,纵坐标表示小鼠血清总胆固醇水平。
图4是根据本发明的另一实施方式将本发明的装载了核酸药物的脂质体制剂给药于小鼠前后的小鼠体重柱形图,其中,横坐标表示各实验组,纵坐标表示小鼠体重。
图5是将本发明的装载了核酸药物的脂质体制剂给药于小鼠后小鼠肝脏组织中apob基因的mrna相对表达水平柱形图,其中,横坐标表示各实验组,纵坐标表示apob基因的mrna相对表达水平。
图6是将本发明的装载了核酸药物的脂质体制剂给药于小鼠后小鼠血清中总胆固醇水平柱形图,其中,横坐标表示各实验组,纵坐标表示小鼠血清总胆固醇水平。
图7是根据本发明的再一实施方式将本发明的装载了核酸药物的脂质体制剂给药于小鼠前后的小鼠体重柱形图,其中,横坐标表示各实验组,纵坐标表示小鼠体重。
图8是将本发明的装载了核酸药物的脂质体制剂给药于小鼠后小鼠肝脏组织中apob基因的mrna相对表达水平柱形图,其中,横坐标表示各实验组,纵坐标表示apob基因的mrna相对表达水平。
图9是将本发明的装载了核酸药物的脂质体制剂给药于小鼠后小鼠血清中总胆固醇水平柱形图,其中,横坐标表示各实验组,纵坐标表示小鼠血清总胆固醇水平。
图10是根据本发明的再一实施方式将本发明的装载了核酸药物的脂质体制剂给药于小鼠前后的小鼠体重柱形图,其中,横坐标表示各实验组,纵坐标表示小鼠体重。
图11是将本发明的装载了核酸药物的脂质体制剂给药于小鼠后小鼠肝脏组织中apob基因的mrna相对表达水平柱形图,其中,横坐标表示各实验组,纵坐标表示apob基因的mrna相对表达水平。
图12是将本发明的装载了核酸药物的脂质体制剂给药于小鼠后小鼠血清中总胆固醇水平柱形图,其中,横坐标表示各实验组,纵坐标表示小鼠血清总胆固醇水平。
图13是根据本发明的再一实施方式将本发明的装载了核酸药物的脂质体制剂给药于小鼠前后的小鼠体重柱形图,其中,横坐标表示各实验组,纵坐标表示小鼠体重。
图14是将本发明的装载了核酸药物的脂质体制剂给药于小鼠后小鼠肝脏组织中apob基因的mrna相对表达水平柱形图,其中,横坐标表示各实验组,纵坐标表示apob基因的mrna相对表达水平。
图15是将本发明的装载了核酸药物的脂质体制剂给药于小鼠后小鼠血清中总胆固醇水平柱形图,其中,横坐标表示各实验组,纵坐标表示小鼠血清 总胆固醇水平。
图16是根据本发明的再一实施方式将本发明的装载了核酸药物的脂质体制剂给药于小鼠前后的小鼠体重柱形图,其中,横坐标表示各实验组,纵坐标表示小鼠体重。
图17是将本发明的装载了核酸药物的脂质体制剂给药于小鼠后小鼠肝脏组织中apob基因的mrna相对表达水平柱形图,其中,横坐标表示各实验组,纵坐标表示apob基因的mrna相对表达水平。
图18是将本发明的装载了核酸药物的脂质体制剂给药于小鼠后小鼠血清中总胆固醇水平柱形图,其中,横坐标表示各实验组,纵坐标表示小鼠血清总胆固醇水平。
具体实施方式
为了更加清楚地描述本发明的目的、特征以及优势,以下将结合附图和具体实施方式对本发明进行详细描述,但下文详细描述的本发明的实施方式,仅仅是为了对本发明的内容进行举例说明,并不对本发明构成任何限定。本发明的保护范围仅由权利要求书限定。
实施例l
本发明的脂质体制剂中使用的脂类脂质化合物和胆固醇类脂质化合物根据有机化学、合成化学以及生物化学等现有技术相关文献、专利申请和专利文件或改良技术制备,例如,r=r’=亚油酸基,n=1,a=a’=ch3的通式i的脂类脂质化合物(cl52)根据heyesj等人(jcontrolrelease2005;107:276-287)或heyesj等人(jcontrolrelease2005;107:276-287)文中的方法制备;r=r’=油酸基,n=1,a=a’=ch3的通式i的脂类脂质化合物(cl53)根据heyesj等人(jcontrolrelease2005;107:276-287)或heyesj等人(jcontrolrelease2005;107:276-287)文中的方法制备;r=r’=亚油酸基,n=2,a=a’=ch3的通式ii的脂类脂质化合物(cl54)根据jchen等人的pct申请(wo/2009/086558、wo/2010/042877)或semplesc等人(naturebiotech,2010; 28:172-176)文中的方法制备;r=r’=亚油酸基,n=3,a=a’=ch3的通式iii的脂类脂质化合物(cl51)根据jayaramanm等人(angewchemintedengl.2012;51:8529-33)文中的方法制备;r=r’=亚油酸基,n=1,a=a’=ch3的通式iv的脂类脂质化合物(cl55)根据leventisr等人(biochimbiophysacta1990;1023:124-132)文中的方法制备;r=r’=油酸基,n=1,a=a’=ch3的通式iv的脂类脂质化合物(cl56)根据leventisr等人(biochimbiophysacta1990;1023:124-132)文中的方法制备;peg-c-dma根据jchen等人的pct申请(wo/2009/086558、wo/2010/042877)或semplesc等人(naturebiotech,2010;28:172-176)文中的方法制备。
y=(c=o),a=a’=ch3,n=2的通式v的胆固醇类脂质化合物(cl66)合成方法如下:
100ml烧瓶中加入反应产物胆固醇(1.1g,2.84mmol)溶解在dcm(20ml)中,加入原料11(4-(二甲基氨基)丙酸盐酸盐)(0.7g,4.55mmol),然后加入二异丙基乙基胺(1ml)及dmap(0.056g,0.56mmol)。室温搅拌5min后,溶液中加入edc·hcl(1.1g,5.6mmol),室温搅拌过夜。tlc(5%meoh/dcm)检测反应进行程度。反应完全后,溶液用20mldcm稀释。然后用16ml饱和nahco3、16ml水及16ml饱和食盐水洗,无水na2so4干燥,过滤,浓缩有机相,得到粗产品约1.1g。使用flash柱纯化(90g硅胶,用210ml含0.1%tea的dcm上柱;流动相分别为:140ml0.1%tea的dcm;560ml2%甲醇+98%含0.1%tea的dcm;140ml2.5%甲醇+97.5%含0.1%tea的dcm;420ml3%甲醇+97%含0.1%tea的dcm)分离得到纯的产品cl66。
y=(c=o),a=a’=ch3,n=1的通式v的胆固醇类脂质化合物(cl68)合成方法如下:
100ml烧瓶中加入反应产物胆固醇(1.1g,2.84mmol)溶解在dcm(20ml)中,加入原料13(4-(二甲基氨基)丙酸盐酸盐)(0.7g,5.0mmol),然后加入二异丙基乙基胺(1ml)及dmap(0.056g,0.56mmol)。室温搅拌5min后,溶液中加入edc·hcl(1.1g,5.6mmol),室温搅拌过夜。tlc(5%meoh/dcm)检测反应进行程度。反应完全后,溶液用20mldcm稀 释。然后用16ml饱和nahco3、16ml水及16ml饱和食盐水洗,无水na2so4干燥,过滤,浓缩有机相,得到粗产品约1.1g。使用flash柱纯化(90g硅胶,用210ml含0.1%tea的dcm上柱;流动相分别为:140ml0.1%tea的dcm;560ml2%甲醇+98%含0.1%tea的dcm;140ml2.5%甲醇+97.5%含0.1%tea的dcm;420ml3%甲醇+97%含0.1%tea的dcm)分离得到纯的产品cl68。
实施例2
脂质体制剂的制备
1主要试剂、材料及仪器
1.1主要试剂:
脂类脂质化合物是r=r’=亚油酸基,n=3的通式iii的化合物(cl51);
胆固醇类脂质化合物是实施例1中制备的cl66和cl68;
磷脂为二硬脂酰磷脂酰胆碱(dspc),购自上海艾韦特医药科技有限公司;
长效脂质为实施例1制备的peg-c-dma;
荧光染料6-对甲苯氨基-2-萘磺酸钾(tns)购自sigma-aldrich公司;
其他生化试剂:无水乙醇,甲醇,氯仿,柠檬酸,柠檬酸钠,nacl等均为进口或国产分析纯试剂。
本发明的实施例中使用的示例性的核酸药物是apob-sirna,由百奥迈科生物技术有限公司合成,冻干粉状态,其序列为:
apb-s:5’-gucaucacacugaauaccaau-3’;
apb-as:5’-auugguauucagugugaugacac-3’。
1.2主要材料:离子交换柱:vivapuredminih(美国sartoriusstedim 公司),ultracel-100离心超滤管(美国millipore公司),透析膜:nucleporemembranecircles(80nm)(美国whatman公司),透析袋和针头式过滤器购自生工生物有限公司,透析袋md24(mw:20000,上海宝曼生物),针头式过滤器(上海生工),50mlfalcon管(美国corning公司)。
1.3主要仪器:漩涡振荡器(美国vwr公司),恒温水浴锅(江苏天宏仪器),离心机(美国eppendorf公司),紫外-可见分光光度计(上海精科),磁力搅拌器(上海梅颖浦仪器),nli脂质体挤出器(加拿大ats公司),超净工作台(苏州净化),高速冷冻离心机(赛特湘仪),荧光分光光度计(rf-5301pc,日本岛津公司)等。
2脂质体制剂的制备
2.1试剂准备:
2.1.1制备脂质储液:
将脂类脂质化合物cl51、胆固醇类脂质化合物cl66和cl68、磷脂dspc、长效脂质peg-c-dma在称量前在室温平衡约30min;
将脂类脂质化合物cl51用100%乙醇配制成40mg/ml的储液,胆固醇类脂质化合物cl66和cl68分别用100%乙醇配制成20mg/ml的储液,将dspc用100%乙醇配制成20mg/ml的储液。长效脂质peg-c-dma用100%乙醇配制成50mg/ml的储液。
2.2制备脂质体制剂:
按照下表1所列的脂类脂质化合物cl51和胆固醇类脂质化合物cl68的比例(其中长效脂质为peg-c-dma,含量为10%,其余用磷脂dspc补足至100%,以下实施例中长效脂质和磷脂的含量均按此添加)制备脂质体制剂f601-f520,具体而言,用无水乙醇作为溶剂,按照表1所列的比例将脂类脂质化合物cl51、胆固醇类脂质化合物cl68、长效脂质peg-c-dma以及磷脂dspc配制成脂质乙醇溶液。待所有脂质溶解后,一边搅拌一边将上述脂质乙 醇溶液加入到制剂缓冲液(50mm柠檬酸,ph4.0)中,使乙醇的终浓度为30%(v/v)。室温下,在200psi压力条件下用装有两层nucleporemembranecircles的nli脂质体挤出器挤出,即得到粒径均一的脂质体空囊泡。经过挤出器的脂质体空囊泡用粒径分析仪测量其粒径。
表1.
2.3制备装载了sirna的脂质体制剂:
2.3.1sirna储液制备:
溶解sirna:用10mm柠檬酸/30mmnacl,ph6.0的溶液配制理论终浓度为50mg/ml的apob-sirna储液;取适量的apob-sirna储液,用pbs稀释2000倍,用于检测sirna浓度。每个样品做三个平行样。紫外分光光度计检测a260值,并计算得apob-sirna储液的实际浓度。
将所需体积的脂质体空囊泡装入50mlfalcon管中,在35℃水浴中预平衡4~5min。将apob-sirna储液配制成sirna/制剂缓冲 液/乙醇溶液,保证乙醇占总体积的30%。然后将sirna/制剂缓冲液/乙醇溶液缓慢加入到上述脂质体空囊泡中,35℃孵育30min。孵育完成后取600μl孵育产物用于a260分析。用透析袋md24透析上述sirna脂质体制剂,1×pbs透析过夜,回收透析后产物,用0.2μm针头式过滤器过滤透析后产物进行过滤除菌,取600μl除菌后产物用于包封率检测。
2.4包封率测定:
取300μl除菌后产物过vivapuredminih(离子交换柱),即为层析后样品,剩余的300μl为层析前样品。根据实际测得的a260值计算实际浓度系数(mg/ml)=加入的apob-sirna储液体积(ml)×apob-sirna储液的实际浓度(mg/ml)×0.03(ml)×1000/(sirna脂质体制剂总体积(ml)×孵育产物a260值×1.1(ml)。根据sirna浓度,计算包封率,包封率的定义为:包封率=(脂质体中包封的药物/脂质体制剂中的药物总量)×100%。计算公式为:包封率=层析后样品sirna浓度/层析前样品sirna浓度。
2.5载药率=(脂质体中包封的药物量/脂质体+脂质体制剂中的药物总量)×100%。
2.6脂质体空囊泡的pka检测:
利用荧光染料tns在水溶液中不发光或只有微弱的荧光,而在有机环境中,其有很强的荧光的特性来测定脂质体空囊泡的pka值。若在阳离子脂质体溶液中加入tns,由于tns带负电,会富集于脂质体的表面而发出荧光,而游离的tns在水溶液中不发光,故溶液的荧光强度(在一定浓度内)与脂质体表面正电荷的数量成正比。这样,通过检测荧光强度,就可得到阳离子脂质体中氨基的电离程度。而根据解离常数的定义,可知当弱酸在溶液中的电离程度为50%时,溶液的ph值即为该酸的pka值。由上可知,若通过荧光光强对ph值作图,所得 荧光光强中点的ph值,即为该阳离子溶液的表观pka值。
具体测定方法为:1)在样品瓶中加入不同ph值的pbs溶液(ph值分别为2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0,用hcl及naoh调节ph值)各2ml。2)在每个样品瓶中各依次加入80μl的250mm4-吗啉乙磺酸溶液、80μl的250mm的hepes溶液、80μl的250mm的乙酸氨溶液、80μl的3.85m的氯化钠溶液及60μl的pfv。3)在ph值为2.5的样品瓶中加入40ml的83.5μmtns溶液,搅拌30s后,将溶液取出,用荧光分光光度计测量其发射光强度(激发波长为321nm,发射波长为445nm)4)按照上述方法,测量不同ph值下tns的发射光强度,并以ph值为x轴,发射光强为y轴作图,其中发射光强中点处ph值即为pfv的表观pka值,计算得到pka值。
2.7粒径分析:
用nicomp370粒径分析仪检测脂质体空囊泡及sirna脂质体制剂的粒径。
表2列出了以上制备的脂质体空囊泡的粒径、pka值、其对sirna的包封率和载药率。
表2.
从上表面2的sirna包封率和载药率测试结果可以看出,随着脂质体制剂中阳性脂质化合物的含量的增加,sirna包封率和载药率也随之增大,这表明由于阳性脂质化合物的含量增加,能载入的带负电荷的核酸就增多,因此,采用本发明的脂质体制剂可以大大提高核酸载药量。由此,本发明提供的脂质体制剂的单位脂质囊泡里能载入更多的核酸药物,在用同等给药剂量的条件下,由于载药量的提高,阳性脂质化合物量的摄入量相对减少,从而降低脂质的用量,降低毒性。
实施例3
验证脂质体制剂的有效性
1主要试剂、材料及仪器
1.1主要试剂、材料:脂质体制剂(上述实施例2制备),氯化钠注射液(山东康宁药业有限公司),risotmrna提取试剂(百奥迈科生物技术有限公司)),onestepqpcrkit(百奥迈科生物技术有限公司),1ml无菌注射器(河南曙光健士医疗器械集团有限公司),总胆固醇(cho酶法)测试盒(南京建成生物)。
1.2实验动物:4-6周龄icr小鼠,雌性,18-22g,购自南通大学比较医学中心。
1.3主要仪器:lightcycler480实时荧光定量pcr仪(美国roche公司),紫外-可见分光光度计uv759s(上海精科)。
2实验方法
2.1实验分组:给药前称量小鼠体重,按体重进行分组,共分3组,分 别为sirna脂质体制剂处理组(表1),生理盐水组,注射量如下:
sirna脂质体制剂处理组:注射量按脂质体制剂中sirna的量为3mg/kg计算;
生理盐水组:注射300μl氯化钠注射液。
2.2给药:用小鼠固定器固定小鼠,用1ml无菌注射器按脂质体制剂中sirna量为3mg/kg通过小鼠尾静脉进行注射给药,对照组注射300μl氯化钠注射液。
2.3小鼠血清总胆固醇含量检测
给药后48h称量小鼠体重,通过摘取眼球采集小鼠血液,约800μl,4℃放置1h,3000rpm离心10min分离出血清,待检测。取10μl分离的小鼠血清按总胆固醇(cho酶法)测试盒说明书进行血清总胆固醇检测,测定500nm吸光度值。
胆固醇含量计算方法为:胆固醇含量=(测定样品a500值/标准品a500值)×标准液浓度(标准液浓度:200mg/dl(5.17mm))。
2.4实时定量pcr(realtimequantitypcr,rt-qpcr)检测小鼠肝脏中apob基因的mrna表达水平
注射脂质体制剂后48h,处死小鼠,解剖小鼠从肝脏的不同部位取3块组织,用risotmrna提取试剂,按照说明书提取小鼠肝脏组织的总rna,用rt-qpcr检测小鼠肝脏apob基因的mrna表达水平。
用基因特异性引物检测样本中apob基因mrna的表达水平,同时扩增看家基因gapdh作为内参对照。每个样本同时扩增apob基因和内参基因gapdh,每个反应做3个平行。用onestepqpcrkit进行定量反应,建立如下反应体系:2μlrna模板,12.5μl的2×mastermix,5’端引物(10μm)和3’端引物(10μm)各0.5μl,0.5μl的50×sybrgreenisolution,用无rnase的水补足体系至25μl。混合均匀后,置于实时定量pcr仪上反应。
检测apob基因mrna的5’端引物为:aagcacctccgaaagtacgtg, 3’端引物为:ctccagctctaccttacagttga。检测看家基因gapdh的5’端引物为:gtatgactccactcacggcaaa,3’端引物为:ggtctcgctcctggaagatg。所需引物均由百奥迈科生物技术有限公司合成。
反应条件:42℃反转录30min,95℃预变性5min,95℃变性20sec,58℃退火30sec,72℃延伸30sec,循环45次。并做溶解曲线反应:95℃/5min,58℃/5min,以0.5℃/5sec升温至95℃。
2.5统计处理
用spss14.0统计软件分析,计量数据用
3实验结果
3.1小鼠体重变化,分别检测注射脂质体制剂前后小鼠体重的变化,可以间接反应毒性,如图1所示,各组在给药前后小鼠体重无明显变化,表明本发明的脂质体制剂无明显毒性。
3.2apob基因的mrna水平变化,如图2所示,本发明的脂质体制剂有效抑制了肝脏apobmrna的表达。
3.3总胆固醇含量变化,如图3所示,与对照组相比,本发明的脂质体制剂均同时降低了小鼠血清中的总胆固醇水平。
综合实验结果可以看出,本发明的脂质体制剂能够将核酸药物,如sirna传输至靶组织或器官,并能有效发挥核酸药物的功能。
实施例4
1装载有sirna的脂质体制剂制备
1.1阳性脂质化合物由脂类脂质化合物cl52和胆固醇类脂质化合物cl68构成。磷脂为dspc,购自上海艾韦特医药科技有限公司;长效脂质为 peg-c-dma。
1.2按实施例2中的步骤制备装载有sirna的脂质体制剂并检测各项指标,各脂质化合物的比例在表3中列出,表4列出了制备的脂质体制剂的粒径和pka值以及装载了sirna的脂质体制剂包封率和载药率。
表3
表4
从上表4可以看出,随着脂质体制剂中阳性脂质化合物的含量的增加,sirna包封率和载药率也随之增大,这表明由于阳性脂质化合物的含量增加,能载入的带负电荷的核酸就增多,因此,采用本发明的脂质体制剂可以大大提高核酸载药量。由此,本发明提供的脂质体制剂的单位脂质囊泡里能载入更多的核酸药物,在用同等给药剂量的条件下,由于载药量的提高,阳性脂质化合物量的摄入量相对减少,从而降低脂质的用量,降低毒性。
2验证装载有sirna的脂质体制剂的有效性
按实施例3的方法检测本实施例制备的装载有sirna的脂质体制剂的有效性。
3实验结果
3.1小鼠体重变化,如图4所示,各组在给药前后小鼠体重无明显变化,表明脂质体制剂无明显毒性。
3.2apob基因的mrna水平变化,如图5所示,脂质体制剂有效抑制了肝脏apobmrna的表达。
3.3总胆固醇含量变化,如图6所示,与对照组相比,脂质体制剂均同时降低了小鼠血清中的总胆固醇水平。
综上实验结果,脂质体制剂能够将核酸药物,如sirna传输至靶组织或器官,并能有效发挥核酸药物的功能。
实施例5
1装载有sirna的脂质体制剂的制备:
1.1阳性脂质化合物由脂类脂质化合物cl53和胆固醇类脂质化合物cl68构成。磷脂为dspc,购自上海艾韦特医药科技有限公司;长效脂质为peg-c-dma。
1.2按实施例2的步骤,制备装载有sirna的脂质体制剂,各脂质化合物在表5中列出,在表6列出制备脂质体制剂的粒径和pka值以及装载有sirna的脂质体制剂的包封率和载药率。
表5
表6
从上表6可以看出,随着脂质体制剂中阳性脂质化合物的含量的增加,sirna包封率和载药率也随之增大,这表明由于阳性脂质化合物的含量增加,能载入的带负电荷的核酸就增多,因此,采用本发明的脂质体制剂可以大大提高核酸载药量。由此,本发明提供的脂质体制剂的单位脂质囊泡里能载入更多的核酸药物,在用同等给药剂量的条件下,由于载药量的提高,阳性脂质化合物量的摄入量相对减少,从而降低脂质的用量,降低毒性。
2验证脂质体制剂的有效性
按实施例3的方法检测本实施例制备的装载有sirna的脂质体制剂的有效性。
3实验结果
3.1小鼠体重变化,如图7所示,各组在给药前后小鼠体重无明显变化,表明脂质体制剂无明显毒性。
3.2apob基因的mrna水平变化,如图8所示,脂质体制剂有效抑制了肝脏apobmrna的表达。
3.3总胆固醇含量变化,如图9所示,与对照组相比,脂质体制剂均同时降低了小鼠血清中的总胆固醇水平。
综上实验结果,脂质体制剂能够将核酸药物,如sirna传输至靶组织或器官,并能有效发挥核酸药物的功能。
实施例6
1装载有sirna的脂质体制剂的制备
1.1阳性脂质化合物由脂类脂质化合物cl54和胆固醇类脂质化合物cl68构成。磷脂为dspc,购自上海艾韦特医药科技有限公司;长效脂质为 peg-c-dma。
1.2按实施例2制备装载有sirna的脂质体制剂,各脂质化合物的比例在表7中列出,在表8中列出了本实施例制备的脂质体制剂的粒径和pka值以及装载sirna的脂质体制剂的包封率和载药率。
表7
表8
从上表8可以看出,随着脂质体制剂中阳性脂质化合物的含量的增加,sirna包封率和载药率也随之增大,这表明由于阳性脂质化合物的含量增加,能载入的带负电荷的核酸就增多,因此,采用本发明的脂质体制剂可以大大提高核酸载药量。由此,本发明提供的脂质体制剂的单位脂质囊泡里能载入更多的核酸药物,在用同等给药剂量的条件下,由于载药量的提高,阳性脂质化合物量的摄入量相对减少,从而降低脂质的用量,降低毒性。
2验证脂质体制剂的有效性
按实施例3的方法检测本实施例制备的装载有sirna的脂质体制剂的有效性。
3实验结果
3.1小鼠体重变化,如图10所示,各组在给药前后小鼠体重无明显变化, 表明本实施例制备的装载有sirna的脂质体制剂无明显毒性。
3.2apob基因的mrna水平变化,如图11所示,本实施例制备的装载有sirna的脂质体制剂有效抑制了肝脏apobmrna的表达。
3.3总胆固醇含量变化,如图12所示,与对照组相比,本实施例制备的装载有sirna的脂质体制剂均同时降低了小鼠血清中的总胆固醇水平。
综上实验结果,本发明的脂质体制剂能够将核酸药物,如sirna传输至靶组织或器官,并能有效发挥核酸药物的功能。
实施例7
1装载有sirna的脂质体制剂制备
1.1阳性脂质化合物由脂类脂质化合物cl55和胆固醇类脂质化合物cl68构成。磷脂为dspc,购自上海艾韦特医药科技有限公司;长效脂质为peg-c-dma。
1.2按实施例2的步骤制备装载有sirna的脂质体制剂,各脂质化合物的比例在表9中列出,在表10中列出了本实施例制备的脂质体制剂的粒径和pka值以及装载sirna的脂质体制剂的包封率和载药率。
表9
表10
从上表10可以看出,随着脂质体制剂中阳性脂质化合物的含量的增加,sirna包封率和载药率也随之增大,这表明由于阳性脂质化合物的含量增加,能载入的带负电荷的核酸就增多,因此,采用本发明的脂质体制剂可以大大提高核酸载药量。由此,本发明提供的脂质体制剂的单位脂质囊泡里能载入更多的核酸药物,在用同等给药剂量的条件下,由于载药量的提高,阳性脂质化合物量的摄入量相对减少,从而降低脂质的用量,降低毒性。
2验证脂质体制剂的有效性
按实施例3的方法检测本实施例制备的装载有sirna的脂质体制剂的有效性。
3实验结果
3.1小鼠体重变化,如图13所示,各组在给药前后小鼠体重无明显变化,表明本实施例制备的装载有sirna的脂质体制剂无明显毒性。
3.2apob基因的mrna水平变化,如图14所示,本实施例制备的装载有sirna的脂质体制剂有效抑制了肝脏apobmrna的表达。
3.3总胆固醇含量变化,如图15所示,与对照组相比,本实施例制备的装载有sirna的脂质体制剂均同时降低了小鼠血清中的总胆固醇水平。
综上实验结果,本实施例制备的脂质体制剂能够将核酸药物,如sirna传输至靶组织或器官,并能有效发挥核酸药物的功能。
实施例8
1装载有sirna的脂质体制剂的制备
1.1阳性脂质化合物由脂类脂质化合物cl56和胆固醇类脂质化合物 cl68构成。磷脂为dspc,购自上海艾韦特医药科技有限公司;长效脂质为peg-c-dma。
1.2按实施例2的方法制备装载有sirna的脂质体制剂,各脂质化合物的比例在表11中列出,在表12中列出了本实施例制备的脂质体制剂的粒径和pka值以及装载sirna的脂质体制剂的包封率和载药率。
表11
表12
从上表12可以看出,随着脂质体制剂中阳性脂质化合物的含量的增加,sirna包封率和载药率也随之增大,这表明由于阳性脂质化合物的含量增加,能载入的带负电荷的核酸就增多,因此,采用本发明的脂质体制剂可以大大提高核酸载药量。由此,本发明提供的脂质体制剂的单位脂质囊泡里能载入更多的核酸药物,在用同等给药剂量的条件下,由于载药量的提高,阳性脂质化合物量的摄入量相对减少,从而降低脂质的用量,降低毒性。
2验证脂质体制剂的有效性
按实施例3的方法检测本实施例制备的装载有sirna的脂质体制剂的有效性。
3实验结果
3.1小鼠体重变化,如图16所示,各组在给药前后小鼠体重无明显变化,表明本实施例制备的装载有sirna的脂质体制剂无明显毒性。
3.2apob基因的mrna水平变化,如图17所示,本实施例制备的装载有sirna的脂质体制剂有效抑制了肝脏apobmrna的表达。
3.3总胆固醇含量变化,如图18所示,与对照组相比,本实施例制备的装载有sirna的脂质体制剂均同时降低了小鼠血清中的总胆固醇水平。
综上实验结果,本实施例制备的脂质体制剂能够将核酸药物,如sirna传输至靶组织或器官,并能有效发挥核酸药物的功能。
- 还没有人留言评论。精彩留言会获得点赞!