二芳基硫醚衍生物的给药方案的制作方法
发明领域
本发明涉及可用作免疫抑制剂或免疫调节剂的二芳基硫醚衍生物或激动剂的给药方案。更具体而言,本发明涉及使用这些二芳基硫醚衍生物治疗患有自身免疫性疾病或障碍的患者的给药方案。
发明背景
用于本发明的二芳基硫醚衍生物是作为激动剂向一种或多种1-磷酸-鞘氨醇受体例如S1P1至S1P8发信号的S1P受体调节剂或激动剂。激动剂与S1P受体结合可导致例如细胞内的异源三聚体G-蛋白离解成Gα-GTP和Gβγ-GTP和/或增加激动剂占据的受体的磷酸化作用和/或下游信号途径/激酶的活化。
S1P受体调节剂或激动剂是有用的治疗性化合物,可用于治疗哺乳动物、特别是人类的各种病症。例如,已在大鼠(皮肤、心脏、肝脏、小肠)、狗(肾脏)和猴子(肾脏)模型中证实了S1P受体调节剂或激动剂在预防移植排斥中的效力。此外,由于它们的免疫调节作用,S1P受体调节剂或激动剂还可用于治疗炎性和自身免疫性疾病。具体地讲,已经在人类中证实了S1P受体激动剂FTY720在治疗多发性硬化中的效力(记载于例如“FTY720 therapy exerts differential effects on T cell subsets in multiple sclerosis(FTY720疗法对多发性硬化中的T细胞亚群发挥不同的作用)”,Mehling M,Brinkmann V,Antel J,Bar-Or A,Goebels N,Vedrine C,Kristofic C,Kuhle J,Lindberg RL,Kappos L.Neurology,2008年10月14日;71(16):1261-7;和“Oral fingolimod(FTY720)for relapsing multiple sclerosis(用于复发的多发性硬化的口服芬戈莫德(FTY720))”,Kappos L,Antel J,Comi G,Montalban X,O'Connor P,Polman CH,Haas T,Korn AA,Karlsson G,Radue EW;FTY720D2201研究小组,N Engl J Med.2006年9月14日;355(11):1124-40.)。
S1P受体调节剂或激动剂可以以治疗剂量产生负性变时作用(negative chronotropic effect),即,它们可降低心脏节律,如例如“FTY720:Placebo-Controlled Study of the Effect on Cardiac Rate and Rhythm in Healthy Subjects(FTY720:安慰剂对照的在健康个体中进行的对心率和心脏节律的影响的研究)”,Robert Schmouder,Denise Serra,Yibin Wang,John M.Kovarik,John DiMarco,Thomas L.Hunt和Marie-Claude Bastien。J.Clin.Pharmacol.2006;46;895中所述。施用1.25mg的FTY720可使心率降低约8次/分(BPM)。
作为该副作用的一个结果,一些S1P调节剂或激动剂疗法可能不得不在密切的医学监视下开始以确保心律保持在可接受的水平。这可能涉及患者的入院治疗,从而使得治疗更加昂贵和复杂。
本发明的二芳基硫醚衍生物通常耐受良好并引起相对轻的负性变时作用。然而,甚至是轻的负性变时作用也能引起一些患者不适,例如静息心率低的患者。所述不适可以影响患者依从性,例如作为治疗休息期(treatment holiday)后重新开始治疗的抑制因素。
此外,由于所观测到的负性变时作用经常随剂量增加而增加,所以负性变时作用的降低可使所使用的剂量范围更宽。
因此,需要减少可由施用以上的二芳基硫醚衍生物引起的负性变时副作用,同时仍能保证施用适当的剂量以治疗或预防通过施用该化合物来治疗或预防的疾病。此外,还需要增强患者的依从性。
发明简述
在本发明的第一个方面提供了用于治疗或预防方法、任选地用于治疗或预防自身免疫性病症的方法的式I化合物:
其中X是O、S、SO或SO2;
R1是卤素、三卤甲基、-OH、C1-7烷基、C1-4烷氧基、三氟甲氧基、苯氧基、环己基甲基氧基、吡啶基甲氧基、肉桂基氧基、萘基甲氧基、苯氧基甲基、-CH2-OH、-CH2-CH2-OH、C1-4烷硫基、C1-4烷基亚磺酰基、C1-4烷基磺酰基、苄硫基、乙酰基、硝基或氰基,或苯基、苯基C1-4烷基或苯基-C1-4烷氧基,所述苯基各自任选地被卤素、CF3、C1-4烷基或C1-4烷氧基所取代;
R2是H、卤素、三卤甲基、C1-4烷氧基、C1-7烷基、苯乙基或苄氧基;
R3是H、卤素、CF3、OH、C1-7烷基、C1-4烷氧基、苄氧基、苯基或C1-4烷氧基甲基;
R4和R5各自独立地是H或式(a)的基团
其中R8和R9各自独立地是H或任选地被卤素所取代的C1-4烷基;
n是1至4的整数;
或其可药用盐、水合物、溶剂化物、异构体或前药;
或式II化合物
其中
R1a是卤素、三卤甲基、C1-4烷基、C1-4烷氧基、C1-4烷硫基、C1-4烷基亚磺酰基、C1-4烷基-磺酰基、芳烷基、任选地被取代的苯氧基或芳烷基氧基;
R2a是H、卤素、三卤甲基、C1-4烷基、C1-4烷氧基、芳烷基或芳烷基氧基;
R3a是H、卤素、CF3、C1-4烷基、C1-4烷氧基、C1-4烷硫基或苄氧基;
R4a是H、C1-4烷基、苯基、任选地被取代的苄基或苯甲酰基、或低级脂族的C1-5酰基;
R5a是H、一卤代甲基、C1-4烷基、C1-4烷氧基-甲基、C1-4烷硫基-甲基、羟基乙基、羟基丙基、苯基、芳烷基、C2-4链烯基或–炔基;
R6a是H或C1-4烷基;
R7a是H、C1-4烷基或如上文所定义的式(a)的基团,
Xa是O、S、SO或SO2;且
na是1至4的整数;
或其可药用盐、水合物、溶剂化物、异构体或前药,
其中将所述式I或II的化合物在治疗的初始阶段期间以低于所述化合物的标准日剂量的剂量施用,然后将其增加、任选地逐步地增加至标准日剂量。
在本发明的第二个方面提供了如在第一个方面定义的式I或II的化合物或其可药用盐、水合物、溶剂化物、异构体或前药在制备药物中的应用,所述药物任选地用于治疗或预防自身免疫性病症,其中将所述化合物在治疗的初始阶段期间以低于所述化合物的标准日剂量的剂量施用,然后将其增加、任选地逐步地增加至标准日剂量。
在本发明的第三个方面提供了治疗或预防有需要的患者、任选地患有自身免疫性病症的患者的方法,所述方法包括向所述患者施用如在第一个方面定义的式I或II的化合物或其可药用盐、水合物、溶剂化物、异构体或前药,在治疗的初始阶段期间以低于所述化合物的标准的日治疗剂量的日剂量施用,之后开始以所需的标准的日治疗剂量施用所述化合物。
在本发明的第四个方面提供了评价患者对如在本发明的特定方面(例如第一至第三方面)或实施方案中的任何一项中所述的治疗方案的需要或适合性的方法,其包括以下步骤:
(i)确定待使用如在第一个方面中所定义的式I或II的化合物或其可药用盐、水合物、溶剂化物、异构体或前药进行治疗的患者是否属于上文所述的治疗方案的应用对其有益的类别;和
(ii)如果患者属于该类别,则使用如上文所述的治疗方案对该患者进行治疗。
如果患者患有或易患心力衰竭或心律失常、高度房室传导阻滞或病态窦房结综合征或者有晕厥史;或在服用β阻滞剂或进行抗心律失常治疗,例如在用抗心律失常药进行治疗;或经历过停药或维持给药方案(maintenance dosage regime)中的治疗休息期,例如大于4天、大于6、8、10、12或14天的休息期,则他或她可以属于以上类别。
在本发明的第五个方面提供了药盒,其包含具有不同日剂量的如第一个方面所定义的式I或II的化合物或其可药用盐、水合物、溶剂化物、异构体或前药的药物的多个单元(units)、任选多个每日单元,其中所述剂量低于标准日剂量。
在本发明的另一个方面提供了药盒,其包含具有如第一个方面所定义的式I或II的化合物或其可药用盐、水合物、溶剂化物、异构体或前药的药物的多个单元、任选多个每日单元,所述单元用于依据本发明的方面或实施方案中的任何一项所定义的给药方案进行施用,其中为治疗的初始阶段提供了一个或多个低于所述化合物的标准日剂量的剂量强度的低剂量单元。
发明详述中提供了另外的方面和实施方案。
发明详述
现已出人意料地发现,通过按照特定的给药方案施用本发明化合物,可降低可能与施用所述化合物有关的副作用。例如,依据本发明的特定给药方案施用化合物可显著降低或者甚至完全消除负性变时副作用。特别是它可避免心率的突然下降。
依据本发明的特定给药方案施用化合物还可显著降低或者甚至完全消除服用该化合物的患者遭受心脏影响(例如房室传导(AV)阻滞)或心脏停博(例如超过2秒钟的心脏停博)的风险。心脏影响或心脏停博的降低包括严重性、频率和/或持续时间的降低。其中心脏影响是AV阻滞,术语“AV阻滞”包括以下类别:AV阻滞I、AV阻滞II Mobitz I/Wenckebach、AV阻滞II Mobitz II和AV阻滞II。
本发明的另外的益处可包括进一步降低其它可能的副作用的风险,例如与血压变化、肾脏影响(例如通过肝酶渐进的升高而测定)或肺影响有关的副作用。
此外,本发明的特定给药方案还可允许向在其它情况下风险/获益比可能不太有利的患者类型施用本发明化合物。所述患者可包括例如患有或易患心脏问题、例如心力衰竭或心律失常的患者、患有或易患高度房室传导阻滞或病态窦房结综合征的患者、有晕厥史的患者、或服用β阻滞剂或进行抗心律失常治疗的患者,诸如在用抗心律失常药进行治疗的患者;或经历过停药或维持给药方案中的治疗休息期(例如大于4天、大于6、8、10、12或14天的休息期)的患者。
本发明的给药方案是用于开始治疗的方案,其能够在可能与S1P受体调节剂治疗有关的负性变时作用和/或房室传导阻滞作用最小的情况下实现所述化合物的标准每日治疗剂量。
式I或II的化合物
对于式(I)和(II)化合物而言,术语“卤素”包括氟、氯、溴和碘。术语“三卤甲基”包括三氟甲基和三氯甲基。“C1-7烷基”包括直链或支链烷基,例如甲基、乙基、丙基、异丙基、丁基、叔丁基、戊基、己基或庚基。短语“任选地被取代的苯氧基”包括未取代的苯氧基和那些在其苯环的任何位置具有卤素原子(例如氟、氯、溴和碘)、三氟甲基、C1-4烷基或C1-4烷氧基的苯氧基。在“芳烷基”或“芳烷基氧基”中的术语“芳烷基”包括苄基、二苯甲基、苯乙基和苯丙基。例如存在于“C1-4烷氧基”、“C1-4烷硫基”、“C1-4烷基亚磺酰基”或“C1-4烷基磺酰基”中的任何C1-4烷基基团包括直链或支链C1-4烷基,例如甲基、乙基、丙基、异丙基或丁基。短语“任选地被取代的芳烷基”包括未取代的芳烷基和那些在其苯环的任何位置具有卤素原子(例如氟、氯、溴和碘)、三氟甲基、具有1-4个碳原子的低级烷基或具有1-4个碳原子的低级烷氧基的芳烷基。
优选的式I化合物是式Ia化合物
其中
R2、R3、R4、R5和n如上述所定义;且
R6是氢、卤素、C1-7烷基、C1-4烷氧基或三氟甲基。
更优选的式(Ia)化合物是其中R3为氯的那些化合物,例如
2-氨基-2-[4-(3-苄氧基苯硫基)-2-氯苯基]乙基-丙-1,3-二醇
及其相应的磷酸酯衍生物,磷酸单-2-氨基-2-[4-(3-苄氧基苯硫基)-2-氯苯基]乙基-丙基]酯。
该磷酸单-2-氨基-2-[4-(3-苄氧基苯硫基)-2-氯苯基]乙基-丙基]酯可以通过WO2005/021503中所述的方法以对映体纯制备,得到:
磷酸单-{(S)-2-氨基-4-[4-(3-苄氧基-苯基硫烷基)-2-氯-苯基]-2-羟基甲基-丁基}酯
或
磷酸单-{(R)-2-氨基-4-[4-(3-苄氧基-苯基硫烷基)-2-氯-苯基]-2-羟基甲基-丁基}酯
优选的式II化合物是式(IIa)化合物
其中
Y是O或S;且
R2a、R3a、R5a、R7a和na如上述所定义。
优选的式(IIa)化合物是其中R3为氯的那些化合物,例如2-氨基-4-[4-(3-苄氧基苯硫基)-2-氯苯基]-2-甲基丁-1-醇;其相应的磷酸单-2-氨基-4-[4-(3-苄氧基苯硫基)-2-氯苯基]-2-甲基丁基]酯;2-氨基-4-[4-(3-苄氧基苯硫基)-2-氯苯基]-2-乙基丁-1-醇;和其相应的磷酸单-2-氨基-4-[4-(3-苄氧基苯硫基)-2-氯苯基]-2-乙基丁基]酯。
式I和II化合物是已知的,并分别公开在例如WO03/029205、WO03/029184和WO04/026817中,所述磷酸化的衍生物公开在例如WO04/074297中,将其全部内容引入本文作为参考。式I和II化合物可以用上述引用的参考文献中公开的方法制备。
式(I)化合物的磷酸化衍生物,例如磷酸单-2-氨基-2-[4-(3-苄氧基苯硫基)-2-氯苯基]乙基-丙基]酯,可以采用如在WO2005/021503(见,例如第11-12页)中公开的合成磷酸化化合物的方法进行制备。结构式(I)(特别是式(Ia))的光学活性化合物和其磷酸化衍生物,可以用例如在Hinterding等人,合成(Synthesis),第11卷,1667-1670页(2003)中描述的方法以高纯度制备。例如,光学活性的结构式(Ia)化合物,磷酸单-2-氨基-2-[4-(3-苄氧基苯硫基)-2-氯苯基]乙基-丙基]酯,可以利用上述的Hinterding等人(2003)的方法如下面流程图所示进行制备。
a)1当量化合物1和1.2当量Boc酸酐在二烷/乙腈或DMF/水(根据溶解性)中+1.2当量1M NaOH在水中(RT,过夜)。
b)1当量步骤a)化合物、1.5当量2-硝基苯甲酰氯和1.6当量吡啶在CH2Cl2中(RT,过夜)。
c)1当量步骤b)化合物、3当量丙酮缩二甲醇和0.1当量p-TsOH·H2O在甲苯中(95℃,3小时)。
d)1当量步骤c)化合物和0.075当量K2CO3(粉末)在MeOH/THF(1/1)中(RT,4小时)。
e)1当量的步骤d)化合物、6当量的四唑(从甲苯中重结晶或0.45M在CH3CN中)和2当量二-叔丁基二乙基亚磷酰胺在干燥的THF中(RT,3小时)。
f)5当量H2O2(30%)直接加到步骤e)的反应混合物中(0℃,1小时)。
分离:将反应混合物用(在水中饱和的)硫代硫酸钠淬灭,并用乙酸乙酯萃取(3×)。
式II和IIa化合物,例如2-氨基-4-[4-(3-苄氧基苯硫基)-2-氯苯基]-2-甲基丁-1-醇和2-氨基-4-[4-(3-苄氧基苯硫基)-2-氯苯基]-2-乙基丁-1-醇可以根据例如EP1548003A1所述而制备。以高光学纯度制备这些式II和IIa化合物,可以用如上述Hinterding等人(2003);和Hinterding等人,四面体快报(Tetra Lett),第43卷,第45期,8095-8097页(2002)中描述的方法进行。光学活性的结构式II和IIa化合物的磷酸酯衍生物,例如磷酸单-2-氨基-4-[4-(3-苄氧基苯硫基)-2-氯苯基]-2-甲基丁基]酯和磷酸单-2-氨基-4-[4-(3-苄氧基苯硫基)-2-氯苯基]-2-乙基丁基]酯,可以如以上Hinterding等人,(2003)中所述以高纯度制备。
式I和II化合物可以以游离形式或盐形式存在,或者作为前药、溶剂化物或水合物存在。
式I和II化合物的可药用盐的实例包括:与无机酸形成的盐,如盐酸盐和氢溴酸盐;和与有机酸形成的盐,如醋酸盐、三氟乙酸盐、柠檬酸盐、酒石酸盐和甲磺酸盐。
当式I和II化合物在分子中有一个或多个不对称中心时,得到多种光学异构体。本发明包括对映异构体、外消旋物、非对映异构体及其混合物。此外,当式I和II化合物包括几何异构体时,本发明包括顺式-化合物、反式-化合物及其混合物。
本发明提供了具有以受保护形式存在的羟基或氨基的化合物的形式;这些形式起前药的作用。前药为施用后经由一种或多种化学或生物化学转变而转化为活性药物形式的化合物。在生理条件条件下容易转化为所要求的化合物的本发明的化合物的形式为所要求的化合物的前药,且落在本发明的范围内。前药实例包括以下形式,其中羟基被酰化形成相对不稳定的酯、诸如乙酸酯,和以下形式,其中氨基被甘氨酸或L-氨基酸诸如丝氨酸的羧酸基团酰化而形成特别容易被普通的代谢酶水解的酰胺键。
给药方案
如前所述,本发明提供了全新的给药方案,该给药方案适于改善或最小化可能与使用本发明化合物治疗有关的负性变时作用和/或心脏影响。
心脏影响包括房室传导阻滞,包括一度房室传导阻滞(例如PR间隔大于0.2秒)和二度房室传导阻滞,例如一度房室传导阻滞。心脏影响包括心脏停博,例如心脏停博超过2秒。
在本发明的各方面中,例如在治疗的整个初始阶段期间或在初始治疗剂量施用的那天,将药物以使得心率(例如平均或最低日心率(daily heart rate))的日降低(daily decrease)是可接受的或者在临床上不显著、或者使得患者的窦性心律保持正常的给药方案进行施用。例如,心率(例如平均或最低日心率)的日降低可以少于约4bpm,例如少于约3bpm或低于约2bpm。
术语“正常的窦性心律”是指未进行治疗时的患者的窦性心律。对正常窦性心律的评估是在医生能力范围之内的。正常的窦性心律通常产生60-100bpm范围内的心率。
根据本发明,“治疗的初始阶段”是指将本发明化合物以低于标准日剂量的剂量施用的阶段。优选所述“治疗的初始阶段”始于第一次施用化合物。
正如以上所定义的,标准日剂量(也称为标准每日剂量)是指施用于患者以治疗或预防所要治疗或预防的疾病的所述药物的所需每日维持剂量。优选地,标准日剂量相当于治疗剂量。
治疗有效剂量(也称为治疗剂量)是指有效治疗所要治疗的疾病或病症(即,使个体中所要治疗或预防的疾病的体征或症状减少,或优选没有所述的体征和症状)所需的本发明化合物的剂量。
治疗的初始阶段可多至28天例如多至21天或多至16天例如多至14、12、10天或8天。治疗的初始阶段还可多于2天例如多于4、6、8、10或12天。例如,治疗的初始阶段可以是例如14至20天,例如16至18天或11至14天,例如12或13天;或8至10天,例如9天或8天。或者,治疗的初始阶段的范围可以是5至7天,例如6天或7天。或者,治疗的初始阶段可以更短,例如在2至4天的范围,诸如3或4天。在一个方面,治疗的初始阶段为差一天不到一周(6天)或者差一天不到两周(13天)。这能使得所述治疗剂量在施用初始剂量一周或两周后被施用,在医生在场施用初始剂量和最终治疗剂量的情况下,这使得患者能在同一天与医生会面。
在本发明的一个方面,本发明的治疗方案可应用于治疗中的停药或治疗休息期后,在停药或所述治疗休息期期间治疗中断,例如由于疏忽,或例如由于降低化合物的任何免疫抑制作用以减少机会感染的作用或持续时间的需要。治疗休息期可多于例如4天,多于6、8、10、12或14天。
在治疗的初始阶段期间,施用的首次剂量可以以比标准日剂量低约80至100-倍的剂量施用,例如比标准日剂量低约60至80-倍的剂量,例如比标准日剂量低约40至60-倍的剂量,例如比标准日剂量低约20至40-倍的剂量,例如比标准日剂量低约10至20-倍的剂量,例如比标准日剂量低约2至10-倍的剂量。例如,初始剂量可以以比标准日剂量低约3、4、5、6或7倍的剂量施用,例如以低于约4倍的剂量施用。
然后将剂量增加、任选地逐步增加至治疗剂量。例如初始阶段可包括多至10个剂量的增加,例如多至8个剂量增加,例如多至6个剂量增加,例如多至5个剂量增加,多至4个剂量增加或多至3个剂量增加,直至达到标准日剂量。例如可以有1至10、例如1至8、例如2至8、例如3至6个剂量增加或2个或3个剂量增加。在本发明的一个实施方案中,在达到标准日剂量、例如治疗剂量之前只存在一个剂量增加。
在增加剂量之前的、治疗的第一个10-18天(例如治疗的第一个12至16天)可以给予相同的剂量。在第一次剂量增加之后,在再次增加剂量之前的、治疗的接下来的10-18天(或更短的时间例如2-6天例如4天)可以给予相同的剂量。
或者,在增加剂量之前的、治疗的第一个1-5天(例如治疗的第一个2至4天、例如前两天或前三天)可以给予相同的剂量。类似地,在第一次剂量增加之后,再次增加剂量之前的、治疗的接下来的1-5天(例如治疗的接下来的2至4天、例如接下来的两天或三天)可以给予相同的剂量。这也可应用于第三个和相继的剂量增加,直至达到标准日剂量。各步骤之间的剂量增加可以是恒定的或不同的(例如增加的)。
或者,剂量可以以确定的增量比每日逐步增加至S1P受体调节剂或激动剂的标准日剂量。例如,每个相继的剂量可以是在1.0-2.0个前一日剂量的范围内,例如在1.2-1.8或1.4-1.6的范围内。
在一个实施方案中,日剂量通过斐波纳契数列(Fibonacci series)来控制,即,某一天给药的剂量是前两天的剂量的总和。在该实施方案的一个方面,允许对该安排进行某些改变。例如,某一天给药的剂量可以是前两天剂量的总和±40%,例如±30%,例如±20%或±10%。
治疗的病症
本发明的给药方案可与本发明化合物在治疗或预防可用这些化合物治疗的病症中的用途(例如移植排斥或自身免疫性病症)联合使用。
所述病症的实例包括移植排斥,诸如细胞、组织或器官的同种移植或异种移植物的急性或慢性排斥或者移植物功能延迟恢复(delayed graft function)、移植物抗宿主病。
另外的实例包括例如多肌炎、狼疮性肾炎或银屑病、类风湿性关节炎、系统性红斑狼疮、亚急性皮肤红斑狼疮(SCLE)、桥本甲状腺炎(hashimoto’s thyroidis)、多发性硬化、重症肌无力、I型糖尿病或II型糖尿病和与其相关的障碍、脉管炎、恶性贫血、干燥综合征(Sjoegren syndrome)、眼色素层炎、银屑病、Graves眼病(Graves ophthalmopathy)、斑形脱发及其它、变态反应性疾病、例如变应性哮喘、变应性皮炎、过敏性鼻炎/结膜炎、变应性接触性皮炎、炎性疾病(其任选具有潜在的异常反应)、例如炎症性肠病、局限性回肠炎或溃疡性结肠炎、内源性哮喘、炎性肺损伤、炎性肝损伤、炎性肾小球损伤、动脉粥样硬化、骨性关节炎、刺激性接触性皮炎、还有湿疹性皮炎、脂溢性皮炎、免疫-介导的障碍的皮肤表现、炎症性眼病、角结膜炎、心肌炎或肝炎、缺血/再灌注损伤、例如心肌梗死、中风、肠缺血、肾衰竭或出血性休克、外伤性休克、T细胞淋巴瘤或T细胞白血病、传染病、例如中毒性休克(例如超抗原诱导的中毒性休克)、败血症性休克、成人型呼吸窘迫综合征或病毒性感染、例如AIDS、病毒性肝炎、慢性细菌感染或老年性痴呆。细胞、组织或实质器官移植物的实例包括例如胰岛、干细胞、骨髓、角膜组织、神经元组织、心脏、肺、心肺联合、肾、肝、肠、胰、气管或食管。对于以上应用,所需剂量当然将依据施用模式、具体的待治疗病症、所需效果而变化。
此外,所述化合物可用于癌症化学疗法、特别是用于实体瘤的癌症化学疗法,例如乳腺癌,或者用作抗血管生成剂。
本发明的给药方案尤其可用于治疗有心脏副作用风险的患者,例如有心力衰竭、心律失常风险的患者、有高度房室传导阻滞或病态窦房结综合征的患者、有晕厥发作史的患者,患有心悸的患者,或需要或服用β阻滞剂的患者,或需要或进行抗心律失常治疗的患者,诸如用Ia类抗心律失常药(例如奎尼丁、普鲁卡因胺)或III类抗心律失常药(例如胺碘酮、索他洛尔)进行治疗的患者。本发明的给药方案还尤其可用于治疗患有其它的、可能相关的病症例如头晕和/或疲劳的患者。
在这些患者中,使用本发明的给药方案可将这些心脏副作用和其它病症的风险改善至例如临床不显著的水平或风险/获益比足够低的水平,所述风险/获益比足够低是指,使用本发明化合物采用依据本文所述的给药方案进行初始施用,对患者的病症进行治疗会被普通技术医生判断为对患者有益。
剂量
选择标准日剂量以提供药效与安全性之间的最佳平衡。依据本发明,化合物例如2-氨基-2-[4-(3-苄氧基苯硫基)-2-氯苯基]乙基-丙-1,3-二醇(化合物A)的标准日剂量例如治疗剂量优选在约25至约0.1mg的范围。
在一个实施方案中,标准日剂量例如治疗剂量可以在约0.8–3mg/日的范围,例如约1.0–2.0mg/日,例如1、1.2、1.4、1.5、1.6、1.8、2.0、2.2、2.4或2.5mg/日、例如约2mg/日。
这些剂量可达成在降低绝对淋巴细胞计数方面有临床意义的作用,而同时避免或最小化可能的副作用,例如心脏安全性(例如心率降低和/或AV阻滞不发生或较不显著)、肾安全性(例如通过肝酶的渐进升高而测定)或肺安全性。此外,这些剂量的应用还可提供足够的免疫抑制以治疗影响患者的病症,而基本上不增加机会性继发感染的风险。
例如在健康个体的测试中,在健康个体每日一次施用化合物A达14天(对于2mg剂量水平而言28天)期间,从给药前血液淋巴细胞水平下降的最大百分比(几何平均数,95%置信区间)对于0.3mg而言为39%,对于0.6mg而言为65%,对于1.2mg而言为74%,对于2mg而言为83%,对于3mg而言为77%。安慰剂组相应的下降为29%,这可通过正常的淋巴细胞水平变化性和终点的定义来解释。血液淋巴细胞水平通常在治疗停止后的两周内恢复至正常(1.0×109/L以上)。
在涉及药盒的方面,药盒可只包含药物的一种低剂量单元,其剂量强度相应于S1P受体调节剂或激动剂的首剂量,例如0.1mg、0.2mg、0.3mg、0.4mg、0.5mg或0.6mg。可以形成药盒来以依据患者的治疗时间表的间隔提供剂量单元,例如每周一次、每日一次、每日两次、每日三次或每日四次。
在一个方面,药盒中的剂量形式(dosage form)为日剂量形式。患者可服用低剂量药物的一个单元达特定的天数,然后任选地在之后的数天每日服用两个或多个单元,直至开始使用包含标准日剂量的S1P受体激动剂的药物单元进行治疗。这样的优势在于出治疗剂量之外,只需要生产一个额外剂量。
在备选的实施方案中,药盒可包含具有一定范围的剂量强度的药物的若干低剂量单元,使得可以每日向患者施用一个剂量单元,但施用的S1P受体调节剂或激动剂的量可以逐步增加直至开始进行标准日剂量的治疗。例如,药盒可包含2、3或4个不同的剂量形式,例如3个不同的剂量形式。这样的优势在于在给药方案中提供了额外的灵活性。
在一个方面,药盒可包含包装(包装产品),例如含1-5个、例如2-4个、例如3个不同的剂量形式的包装。所述包装可包含多个单独的存储部分,每个存储部分包含就治疗期内特定日而言的患者的日剂量。所述日剂量可由不同剂量形式中的一个或多个组成。在该实施方案的一个方面,药盒包含泡罩包装,所述泡罩包装含2-4个例如3个不同的剂量形式,其中所述包装中的泡罩包含用于在初始治疗期内施用于患者的日剂量,其中所述日剂量由不同剂量形式中的一个或多个组成。在该实施方案的一个方面,所述包装例如泡罩包装可包含对应于治疗的初始阶段的若干天的若干泡罩。在另一个方面,所述泡罩包装还可包含一个或多个含例如最终治疗剂量的泡罩,例如使得包括低剂量和治疗剂量形式的总的治疗期持续至临床上方便的时间,例如一周或两周。
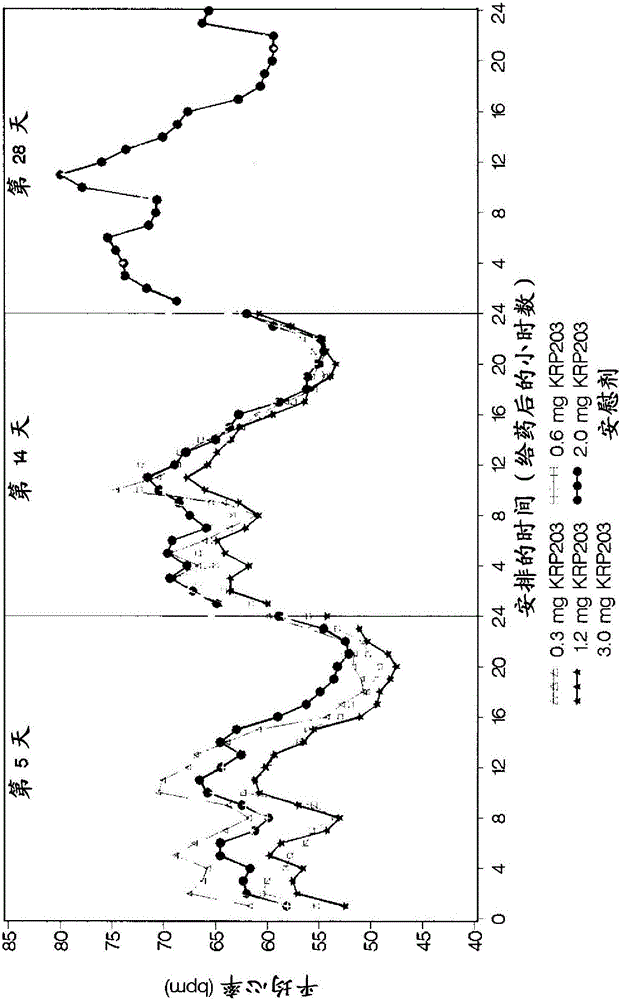
实施例1
在健康受试者经28天的时间测定2-氨基-2-[4-(3-苄氧基苯硫基)-2-氯苯基]乙基-丙-1,3-二醇(化合物A,或KRP203)对心率的影响,并将其与安慰剂进行对比。
在健康受试者研究化合物A的多个增加的剂量。对分为5个同期组群的60个受试者(每组12个受试者)每日一次给药0.3mg、0.6mg、1.2mg和3mg达14天,且给药2mg达28天。在每个同期组群中,受试者随机服用化合物A(9个受试者)和安慰剂(3个受试者)。
如在图1(部分1和部分2)所见,给药后心率的下降随化合物A的剂量增加而增加。这种差别随试验进行而缩小。2mg剂量水平与安慰剂治疗的受试者在第28天的心率相似。
图1(部分1和部分2)显示所示试验日以每小时平均心率计的平均分布图,其始于第-1天,其中所有受试者均接受安慰剂,并在第1天、第2天、第3天、第5天和第14天持续进行。第28天的图比较了安慰剂和2mg剂量。
实施例2
所述给药方案在减弱负性变时作用和/或提供其它的安全性益处(例如减少超过3秒的心脏停博的数量)方面的功效可在标准动物或临床试验中证实,例如依据下文所述的方法进行的试验。
总数56人的健康男性志愿者加入了双盲的、平行的、安慰剂对照的、剂量调整、每日一次、多次口服给药的研究。53位(95%)受试者完成了研究。
向受试者施用增加剂量的2-氨基-2-[4-(3-苄氧基苯硫基)-2-氯苯基]乙基-丙-1,3-二醇(化合物A),开始为每日一次0.3mg或0.5mg,结束为每日一次2mg的最大治疗剂量,如下表1所述。
表1
每个受试者参加最长21-天的筛选期、基线期(-2日)、磨合期(-1日)、21-天治疗期,14-天随访期(在第35日随访)和第42日的研究完成评估。受试者被分配至四组之一(#1或#2剂量调整组、安慰剂组或固定剂量组),并以双盲方式接受每日一次(o.d.)治疗。
在筛选中满足所有资格标准的受试者在第-2日进入研究中心,并留在中心直至最后一次给药后24小时(第22天)。
在第-1日(磨合期),所有的受试者服用安慰剂,并进行包括24小时Holter监测在内的基线评估。
所有的研究药物均在8:00至8:30施用,其是在始于给药前30分钟的适度的早餐后立即进行的。在受试者之间尽可能接近地给药(例如15分钟之内)。
在第22日,在完成预定程序和经研究员评价后,受试者离开研究中心。在第35日受试者返回研究中心(最后一次给药后两周)进行随访,在第42日进行结束研究(End-of-study)的诊视。
受试者被分配至四个治疗组中的一个:
T#1剂量调整组(N=14)
T#2剂量调整组(N=14)
Plac:安慰剂组(N=14)
Fix:固定剂量组(N=14)
评价和评估:
在图2中显示4个组(即T#1、T#2、Fix和Plac)从第1日至第21日中每日心动过缓发作的次数。图2显示了每日心动过缓发作的次数的盒式图。在第1天两个剂量调整方案的心动过缓发作均比固定剂量组的少。使用剂量调整方案所观测到的作用的强度和持续时间方面T#2显示比T#1更有利。然而,在考察的任何一天中T#1和T#2在心动过缓事件的次数方面没有统计学差别。
安全性和耐受性
如预料的一样,基于活性成分(即化合物A,S1P激动剂)的作用机制,在所有的活性治疗组中绝对淋巴细胞计数(ALC)从基线至第21日减少。在考察访问的末尾,剂量调整组的ALC水平恢复至基线值附近。
两个剂量调整方案均为安全的和耐受良好的。据报道没有SAE(严重的不良事件)。在AE(不良事件)方面观测到化合物A各剂量调整组和安慰剂组之间没有可分辨差异。
统计方法
通过重复泊松模型(repeated Poisson model)对主导变量(在主要目标中所定义的每日心动过缓发作的次数)建模,所述模型根据在基线心动过缓发作的次数、天、治疗和治疗-日交互作用。使用广义估计方程(Generalized Estimating Equations)评价所述模型的参数,包括每天每个治疗组的心动过缓发作的平均(和95%CI)次数。
研究主要目标由每个剂量调整方案中在每个‘剂量增加日’心动过缓发作的平均次数与固定剂量组在第1日心动过缓发作的平均次数之间的估计比率(estimated ratio)以及从该比率的95%CI进行评价,所述估计比率从以上的模型获得。
从该模型得到感兴趣的其它的对比,例如用以比较每天的剂量调整方案与安慰剂。
使用适合的模型还研究了就心动过缓的其它测定方面(包括每小时(每日)最低和平均心率与基线相比的变化)而言的治疗效果。
图3显示了与基线相比每小时最低HR(心率)的变化。
与2个剂量调整方案相比固定给药方案中的HR在第1天和第2天有最大的下降,并且其在第5天被解决。在第13天后,与匹配的基线相比所有的受试者显示没有HR下降。
- 还没有人留言评论。精彩留言会获得点赞!