一种琥珀酸曲格列汀的片剂的制作方法
本发明属于医药技术领域,具体涉及一种琥珀酸曲格列汀的片剂及其制备方法。
背景技术:
II型糖尿病史糖尿病的主要类型,占所有糖尿病患者90%以上,随着经济的发展、生活水平提高及人口老龄化,人类的疾病谱正在发生显著的变化,慢性非传染性疾病已成为威胁人类健康的主要原因。II型糖尿病是以高血糖为主要标志的内分泌代谢性疾病,其患病率逐年增加,加之其并发症多,治疗时间长,治疗费用大,给社会带来沉重的负担。
DPP-4是一种酶,能够引发肠促胰岛素(胰高血糖素样肽-1,GLP-1)和糖尿病依赖性促胰岛素多肽(GIP)的失活,而这2种降肠胰岛素在血糖调节中发挥着重要的作用,抑制DPP-4能够增加血糖水平依赖性胰岛素分泌,从而控制血糖水平。口服DPP-4(二肽基肽酶)抑制剂因其强效降糖、同时可保护胰岛功能、安全性良好等优势备受关注。2015年3月,由武田公司和Furiex公司联合研发的全球首个1周1次的长效口服降糖药曲格列汀(trelagliptin succinate,商品名Zafatek)宣布在日本获批用于2型糖尿病治疗。
CN201510269594.0公开了一种琥珀酸曲格列汀的片剂,克服了制粒过程中的不良现象,但是该发明片重大每片300mg不合适吞咽困难的患者,且处方中应用的润滑剂量较多(2%-10%,优选2%-5%)造成该片剂崩解迟缓,不易快速吸收。
因此,有必要提供一种质量稳定、崩解快速溶出度好、片重小且易于工业化生产的琥珀酸曲格列汀片剂。
技术实现要素:
本发明旨在提供一种质量稳定、崩解快速溶出度好、片重小、生产工艺简单易操作,适于工业化生产的琥珀酸曲格列汀片剂。
为了达到上述目的,本发明采用以下技术方案:
本发明提供了一种琥珀酸曲格列汀片剂,包含以下重量份的组分:琥珀酸曲格列汀64.0%-78.2%、交联羧甲基纤维素钠3.7%~5.0%、羟丙基纤维素2.2%~5.0%、甘露醇6.8%-25.1%、微晶纤维素6.8%-15.2%和硬脂酰富马酸钠0.1%-5%。
优选地,琥珀酸曲格列汀重量份为71.1%。
优选地,交联羧甲基纤维素钠重量份为5.0%。
优选地,羟丙基纤维素重量份为3.0%。
优选地,甘露醇和微晶纤维素的重量比为3:1~1:1,更有选为2:1。
优选地,硬脂酰富马酸钠重量份为1.0%。
优选地,琥珀酸曲格列汀的粒径≤180μm。
本发明还提供了一种琥珀酸曲格列汀片剂的制备方法,包括以下步骤:
(1)将以下重量份的琥珀酸曲格列汀64.0%-78.2%、交联羧甲基纤维素钠3.7%~5.0%、羟丙基纤维素2.2%~5.0%、甘露醇6.8%-25.1%和微晶纤维素6.8%-15.2%混合后过筛,得到混粉;
(2)将混粉通过干法制粒机进行干法制粒,得到干颗粒;
(3)将干颗粒和硬脂酰富马酸钠混合均匀,压制成片。
优选地,所述的琥珀酸曲格列汀重量份为71.1%,所述的交联羧甲基纤维素钠重量份为5.0%,所述的羟丙基纤维素重量份为3.0%,所述的甘露醇和微晶纤维素的重量比为2:1,所述的硬脂酰富马酸钠重量份为1.0%。
优选地,琥珀酸曲格列汀的粒径≤180μm。
本发明具有以下优点:
(1)制备方法简单、易操作,适合工业化生产。
(2)稳定性好,高温高湿环境下10天,单个最大杂质及总杂质含量基本不变。
(3)片重小,每片约186mg,易于吞咽困难的患者服用。
(4)润滑剂硬脂酰富马酸钠0.1%-5%(优选1%)用量小,崩解速度快,溶出度好。
附图说明
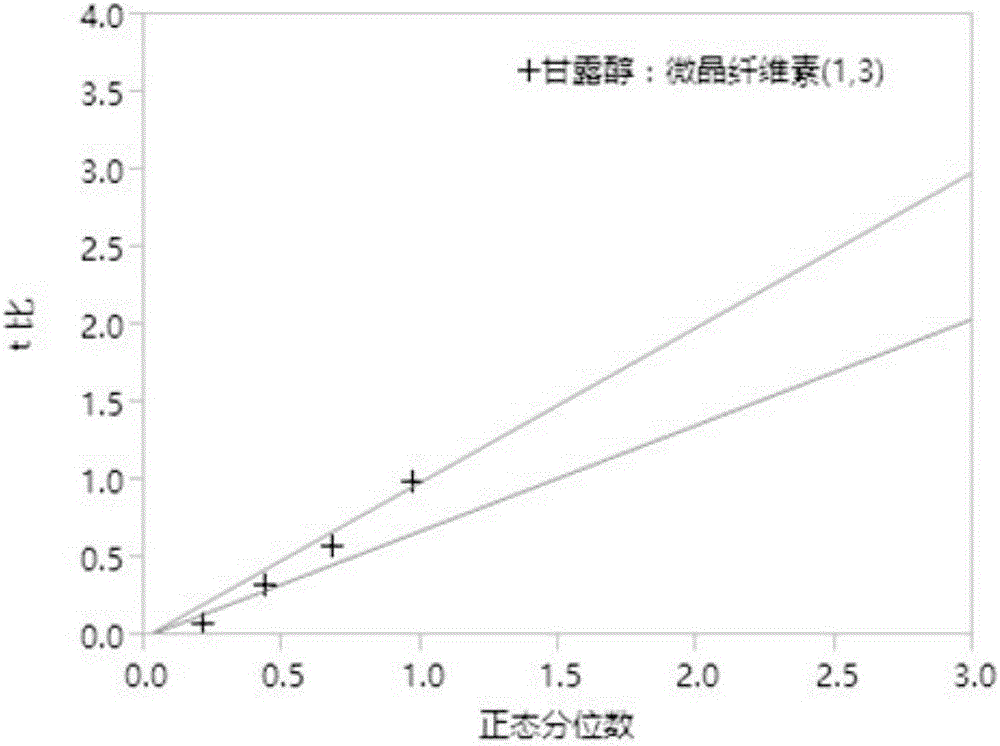
图1为琥珀酸曲格列汀片剂处方筛选溶出度方差分析半正态图。
图2为琥珀酸曲格列汀片剂处方筛选硬度方差分析半正态图。
图3为琥珀酸曲格列汀片剂处方筛选中间体豪斯比方差分析半正态图。
图4为琥珀酸曲格列汀片剂处方筛选构建的设计空间等高线图。
图5为琥珀酸曲格列汀片剂累积溶出度曲线图。
具体实施方式
以下通过实施例形式的具体实施方式,对本发明的上述内容作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下实施例。
实施例1琥珀酸去格列汀片剂处方筛选
本实验是一种基于Screen方法的对琥珀酸曲格列汀片剂处方优化设计,具体如下:
1、曲格列汀原料的风险评估
对曲格列汀原料的属性可能对制剂关键质量属性(CQAs)的影响风险进行评估。将每个属性评估的相对风险以高、中或低排列。高风险属性需要在制剂开发过程中深入研究,从而降低风险评估等级;中风险评估级别需要根据研究的需求,确定接受目前的风险级别或者开展适当的研究以降低风险;低风险级别说明此属性对制剂的CQAs基本无影响,无需要进一步研究。下表1是基于曲格列汀原料的理化性质、生物药剂学性质和制剂属性而言,就原料药属性对曲格列汀片剂开发的初始风险评估级别及判断依据。
表1曲格列汀原料的初始风险评估结果
2、实验设计
通过单因素试验考查不同因素的适用范围,经过实验筛选后,初步确定了制剂中几种变量因素的用量范围,见下表格2-4。实验设计的参考主要包括可控实验因素:琥珀酸曲格列汀原料的粒度(PSD)、甘露醇和微晶纤维素的比例、交联羧甲基纤维素钠的用量、羟丙基纤维素的用量和硬脂酰富马酸钠用量。
此实验设计分二个阶段进行研究,第一个阶段处方主要是评估原料的粒度(PSD)甘露醇和微晶纤维素的比例、交联羧甲基纤维素钠的用量、羟丙基纤维素的用量对制剂CQAs的影响。第二个阶段处方研究设计主要是评估处方中硬脂酰富马酸钠对制剂CQAs的影响。
表2琥珀酸曲格列汀片剂处方变量
表3琥珀酸曲格列汀片剂Screen设计表
表4琥珀酸曲格列汀片剂Screen设计实验结果
3、数据分析
(1)影响琥珀酸曲格列汀片剂(15min)溶出度的显著因素分析
以溶出度数据为响应值,考查四个处方变量因素对其影响的显著性,方差分析(ANOVA)结果如下表5。
表5琥珀酸曲格列汀片剂溶出度方差分析表
如上数据如示,溶出度的曲率效应无意义,因此使用现有数据来拟合数学模型。如图1半正态图和模型的ANOVA结果所示,影响曲格列汀片剂溶出度的显著因素是C(羟丙基纤维素浓度)和D(交联羧甲基纤维素钠浓度);其他处方变量因素对曲格列汀片剂的溶出度影响无显著性差异。
(2)琥珀酸影响曲格列汀片剂硬度的显著因素分析
以片剂硬度数据为响应值,考查四个处方变量因素对其影响的显著性,方差分析(ANOVA)结果如下表6。
表6琥珀酸曲格列汀片剂硬度方差分析表
如上数据如示,片剂硬度的曲率效应无意义,因此使用现有数据来拟合数学模型。如图2半正态图和模型的ANOVA结果所示,影响曲格列汀片剂硬度的较大因素是是B(甘露醇/微晶纤维素比);其他处方变量因素对曲格列汀片剂硬度影响无显著性差异。
(3)影响琥珀酸曲格列汀片剂混合物料豪斯比(HB)的显著因素分析
以HB数据为响应值,考查四个处方变量因素对其影响的显著性,方差分析(ANOVA)结果如下表7。
表7琥珀酸曲格列汀片剂HB方差分析表
如上数据如示,HB的曲率效应无意义,因此使用现有数据来拟合数学模型。如图3半正态图和模型的ANOVA结果所示,影响曲格列汀片剂中间体物料HB的显著性因素是A(API粒径)。其他处方变量因素对曲格列汀片剂中间体物料的HB影响无显著性差异。
对于琥珀酸曲格列汀片剂而言,PSD对于片剂的中间物料流动性有较明显的影响,原料药的PSD越小,中间物料的流动性越差。羟丙基纤维素的浓度对片剂的溶出度影响较大,羟丙基纤维素浓度越大,制剂的溶出度越小;交联羧甲基纤维素钠的浓度对片剂的溶出度影响较大,交联羧甲基纤维素钠浓度越大,制剂的溶出度越大。甘露醇/微晶纤维素(%)的用量对片剂的硬度有显著性影响,本品处方组成甘露醇/微晶纤维素(%)可以选择2:1比例,其他片剂影响因素在控制空间进行系统的研究和选择。
4、公差设计、确定最优处方、构建设计空间、制订控制策略
曲格列汀片剂处方设计的4个影响因素中交联羧甲基纤维素钠用量和羟丙基纤维素用量对产品性能影响最大,需要严格控制两者的用量,否则生产的制剂产品的质量会有较大波动。通过已经建立的DOE模型用于建立处方变量的可接受范围及范围内的最优值:其中PSD的范围确定为API粒径为小于180μm(即过80目筛)。为了容纳可能最大的羟丙基纤维素用量并避免在溶出可能出现在不合格区域边缘,因此选择择5.0%交联羧甲基纤维素钠用于琥珀酸曲格列汀片剂处方用量,此时,羟丙基纤维素浓度2.0%~5.0%均可,选择3.0%羟丙基纤维素用量作为处方浓度。
因此,本发明的控制策略为:工艺生产时必须对最重要的影响因素交联羧甲基纤维素钠和羟丙基纤维素用进行严格控制,交联羧甲基纤维素钠用量可接受范围为3.7%~5.0%,处方用量选择5.0%,羟丙基纤维素用量可接受范围为2.2%~5.0%,处方用量选择3.0%。PSD范围为小于180μm,即过80目筛即可。甘露醇/微晶纤维素(%)的用量可授受范围为3:1~1:1,处方选择2:1浓度。Screen构建的溶出度预测方程为①92.85+826.25×(交联羧甲基纤维素钠-0.04)-506.88×(羟丙基纤维素浓度-0.03)。
实施例2琥珀酸曲格列汀片剂的制备
处方
制备方法:将琥珀酸曲格列汀、交联羧甲基纤维素钠、羟丙基纤维素、甘露醇和微晶纤维素混合均匀后过80目筛备用,通过干法制粒机进行干法制粒,得到干颗粒;将干颗粒和硬脂酰富马酸钠混合均匀,压制成片。
实施例3琥珀酸曲格列汀片剂的稳定性
将实施例2制得的琥珀酸曲格列汀片放置在高温高湿条件下,考察0天和10天的有关物质,结果见表8。
表8琥珀酸曲格列汀片稳定性
实施例4琥珀酸曲格列汀片剂的溶出度
取实施例2制得的琥珀酸曲格列汀片,以0.01mol/L的盐酸溶液1000ml为溶出介质,在溶出时间5、10、15、20、30min取样测定,计算溶出量,结果见表9及附图5。可以看出,在溶出时间10min时,琥珀酸曲格列汀溶出度已达到95%以上。
表9琥珀酸曲格列汀不同取样时间的溶出度测定结果
以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!