一种聚多巴胺包裹血红蛋白氧载体及其制备方法与应用与流程
本发明涉及血红蛋白氧载体类的血液代用品技术领域,特别是涉及一种聚多巴胺包裹血红蛋白氧载体及其制备方法与应用。
背景技术:
输血作为一种生命救治的重要手段,在临床手术、抗灾及战伤救治中应用广泛。但受血源紧张、血液储存期短及血源性疾病传播等原因的影响,传统输血技术愈来愈无法满足在紧急状况下的需求。因此,合成能大规模生产的安全有效的血液代用品一直受到研究者的关注。
能否模拟红细胞的携氧功能是评价血液代用品有效性的重要标准。这一功能是通过红细胞内的血红蛋白和氧气的结合与解离的动态平衡而实现的。血红蛋白能够作为氧载体正是由于血红蛋白的载氧释氧能力能够满足机体在急性失血性休克等条件下的供氧需求。然而脱离了红细胞的无基质血红蛋白由于容易解聚成二聚体,体内循环周期短,直接与血管壁接触导致血管收缩,而无法作为理想的氧载体。因此,为了克服无基质血红蛋白的缺陷,当今血液代用品领域的研究者们致力于将具有良好生物相容性的包材包裹血红蛋白,形成与红细胞类似具有立体结构的复合微囊,这种复合微囊既保持了血红蛋白的功能,又避免了血红蛋白与周围组织及血液中其他成分直接作用,可有效防止血管收缩,避免肾毒性。
近年来,微囊包裹类血红蛋白用作氧载体(也可称为“微囊包裹类血红蛋白氧载体”)的研发已经取得一定进展。例如,研究者们成功地以聚乳酸、聚碳酸酯、聚乙二醇等高分子材料及其嵌段共聚物为包材制得了具备一定载氧功能的微囊状氧载体。然而,这种微囊状氧载体由于囊内缺乏红细胞所含有的还原酶系统,血红蛋白易发生自氧化,从而损害其携氧功能,输注机体后易导致周围细胞及组织的氧化损伤。
目前微囊包裹类血红蛋白氧载体的制备方法主要有复乳法和纳米沉积法。复乳法是将血红蛋白原液分散于含有聚合物包材的有机溶液中,通过高速搅拌得到初乳,将初乳与含有稳定剂的外水相混合后形成复乳,再通过旋蒸或抽提去除复乳中的有机溶剂;在去除有机溶剂的过程中溶于其中的聚合物包材发生凝聚或固化,包裹血红蛋白形成微囊复合物。纳米沉积法是将高分子材料分散于水溶性有机溶剂中作为油相,以加入了一定量表面活性剂的血红蛋白原液为水相,在磁力搅拌下,将油相滴加到水相中形成乳液,再通过旋蒸或抽提去除乳液中的有机溶剂,去除过程中高分子材料沉积于血红蛋白表面,形成纳米微囊。可见,复乳法和纳米沉积法的反应体系都比较复杂,都需通过旋蒸或抽提等繁琐操作去除有机溶剂。
因此,寻找具备一定抗氧化性能的包材包裹血红蛋白,抑制血红蛋白自氧化进程,维持其载氧功能,其制备工艺简单、高效、适合大规模生产,对于血液代用品的研发具有深刻意义。
技术实现要素:
本发明的目的是针对现有技术中存在的技术缺陷,第一方面,提供一种可降低血红蛋白氧化损伤的聚多巴胺包裹血红蛋白氧载体,由聚多巴胺包裹血红蛋白得到,所述氧载体为聚多巴胺包裹血红蛋白形成的纳米微囊。
该氧载体平均粒径分布为6nm-16nm,氧载体的多分散系数PDI为0.15-0.70,氧载体氧饱和度为50%时的氧分压P50值为11mmHg-17mmHg;
其中,氧载体的平均粒径分布优选6.2-15.3nm,更优选6.9nm-11.5nm,最优选7.4nm;氧载体的多分散系数PDI优选0.154-0.664,更优选0.179-0.331,最优选0.243。
第二方面,本发明提供一种制备上述聚多巴胺包裹血红蛋白氧载体的方法,包括以下步骤:
(1)提取血红蛋白,得到血红蛋白原液;
(2)配制多巴胺溶液;
(3)将步骤(1)的血红蛋白原液与步骤(2)的多巴胺溶液混合,进行多巴胺的聚合反应及聚多巴胺包裹血红蛋白的负载反应,得到聚多巴胺包裹血红蛋白氧载体。
步骤(3)血红蛋白原液中血红蛋白与多巴胺的质量比为(2-61):1,优选(2-15):1,更优选(4-13):1,最优选为5:1。
步骤(3)具体为:
在温度为2-6℃下(优选4℃),将步骤(1)得到的血红蛋白原液与步骤(2)得到的多巴胺溶液混合后,加入Tris-HCl缓冲液(1mol/L,pH8.5)反应0.5-24h(优选为2-12h,更优选为2-5h,最优选为3.5h),直至无游离血红蛋白,停止反应,得到聚多巴胺包裹血红蛋白氧载体。
Tris-HCl缓冲液的加入体积为多巴胺溶液体积的2%-4%。
步骤(1)具体为:
将新鲜的牛全血于4℃,以4000rpm的转速离心10min,弃去上清液,经超滤和浓缩得到红细胞,将红细胞置于蒸馏水中低渗裂解得到血红蛋白初产品,通过阴离子交换色谱提取出浓度为24.4mg/ml的血红蛋白原液;
步骤(2)具体为:
将多巴胺溶于水中,制成浓度为0.4mg/ml-12.5mg/ml(优选2.0mg/ml-12.5mg/ml,更优选2.0mg/ml-5.0mg/ml,最优选4.88mg/ml)的多巴胺溶液。
步骤(3)具体为:
在温度为2-6℃下(优选4℃),将步骤(1)得到的血红蛋白原液与步骤(2)得到的多巴胺溶液等体积混合后,向反应体系中加入1mol/L,pH8.5的Tris-HCl缓冲液反应0.5-24h(优选为2-12h,更优选为2-5h,最优选为3.5h),直至检测不到游离血红蛋白时停止反应;多巴胺迅速发生自身氧化聚合,形成聚多巴胺,同时负载于血红蛋白表面,得到黑色的聚多巴胺包裹血红蛋白氧载体。
第三方面,本发明提供一种聚多巴胺包裹血红蛋白氧载体,是由上述方法制备得到。
第四方面,本发明提供上述聚多巴胺包裹血红蛋白氧载体或上述方法制备得到的聚多巴胺包裹血红蛋白氧载体在血液代用品中的应用,将所述氧载体应用在输血过程(创伤、失血、贫血、手术等引起的)中,部分或全部替代红细胞发挥携/放氧功能,其氧饱和度为50%时的氧分压P50在11.00mmHg以上。
与现有技术相比,本发明的有益效果是:
(1)本发明的聚多巴胺包裹血红蛋白氧载体的微囊粒径较小,为纳米级别,分布均匀,体系稳定,无团聚现象。
(2)本发明的聚多巴胺包裹血红蛋白氧载体不会引起红细胞聚集,不引起溶血,不会影响凝血功能,不会造成细胞毒性,具有良好的血液相容性和生物安全性。
(3)本发明的聚多巴胺包裹血红蛋白氧载体不会破坏血红蛋白的化学组成及二级结构,保证了其生理功能的正常发挥。
(4)本发明的聚多巴胺包裹血红蛋白氧载体能够有效地载氧释氧,氧亲和力较高,还兼有较好的抗氧化性能,能够有效抑制血红蛋白的自氧化,可清除各种自由基及红细胞内的活性氧,解决了当前血红蛋白氧载体容易发生氧化损伤等的问题。
(5)本发明的制备工艺简单、耗时短,仅需将血红蛋白浸入多巴胺溶液中,调节pH至弱碱性后多巴胺即能发生自身氧化、聚合并负载于血红蛋白表面形成纳米微囊,避免了有机溶剂的引入与去除,传统方法中的挥发固化、旋转蒸发等繁琐操作,适于大规模生产。
因此,本发明的聚多巴胺包裹血红蛋白氧载体因其简单的合成工艺,完整的化学结构,良好的携氧能力、血液相容性、生物安全性和抗氧化性,具有广泛的血液代用品应用前景,在医药领域可发挥重要作用。
附图说明
图1所示为本发明聚多巴胺包裹血红蛋白氧载体的透射电镜观察结果图;
图2所示为本发明聚多巴胺包裹血红蛋白氧载体的粒径分布图;
图3所示为本发明聚多巴胺包裹血红蛋白氧载体的紫外-可见光谱图;
图4所示为本发明聚多巴胺包裹血红蛋白氧载体的红外光谱图;
图5所示为本发明聚多巴胺包裹血红蛋白氧载体的圆二色光谱图;
图6所示为实施例1聚多巴胺包裹血红蛋白氧载体的红细胞聚集实验结果;
图7所示为实施例2聚多巴胺包裹血红蛋白氧载体的溶血实验结果;
图8所示为实施例3聚多巴胺包裹血红蛋白氧载体的凝血实验结果;
图9所示为实施例4聚多巴胺包裹血红蛋白氧载体的体外细胞毒性实验结果;
图10所示为实施例5聚多巴胺包裹血红蛋白氧载体的氧解离曲线;
图11所示为实施例6聚多巴胺包裹血红蛋白氧载体的铁还原能力实验结果;
图12所示为实施例7聚多巴胺包裹血红蛋白氧载体的高铁血红蛋白还原能力实验结果;
图13A所示为实施例8聚多巴胺包裹血红蛋白氧载体的ABTS自由基清除能力定性实验结果;
图13B所示为实施例8聚多巴胺包裹血红蛋白氧载体的ABTS自由基清除能力定量实验结果;
图14A所示为实施例9聚多巴胺包裹血红蛋白氧载体的DPPH自由基清除能力定性实验结果;
图14B所示为实施例9聚多巴胺包裹血红蛋白氧载体的DPPH自由基清除能力定量实验结果;
图15所示为实施例10聚多巴胺包裹血红蛋白氧载体的红细胞内ROS清除能力荧光成像结果。
具体实施方式
在血液代用品领域,业者通常使用聚乳酸、聚碳酸酯、聚乙二醇等高分子材料及其嵌段共聚物为包材制得具备一定载氧功能的微囊状氧载体,由于其在使用中效果不理想,因此发明人通过大量实验的摸索与研究,从众多的载体材料中选择了具备一定抗氧化性能的包材聚多巴胺。
聚多巴胺目前是广泛用于生物材料表面改性及药物包埋与释放的一种高分子材料。Ruikang Tang等人发现聚多巴胺可以有效地封闭红细胞表面的抗原,避免凝集反应,同时红细胞一般的生理功能,如运输O2和CO2并未受到影响。Yuzhi Wang等人构建了以硅-四氧化三铁为基底的聚多巴胺分子印记涂层,利用硅-四氧化三铁基底表面的与血红蛋白粒径大小相当的介孔结构固定血红蛋白,用来筛选和识别牛血红蛋白。Inkyu Lee等发现120μg的聚多巴胺涂层可以有效地清除85%的DPPH自由基。
总之,聚多巴胺在生物医学领域应用的优势在于:1.具有类似于贻贝黏附蛋白的结构,黏附性能超强,几乎能负载于任何材料的表面;2.制备工艺简单,将多巴胺加入到弱碱性溶液中即能发生自身聚合得到聚多巴胺产物;3.生物相容性好,适于生物材料的负载与改性。
虽然聚多巴胺已应用于多种生物材料表面,但其在血液代用品领域的应用尚未见报道。发明人利用聚多巴胺简单的制备工艺,超强的黏附性能和良好的生物相容性,使得其发挥成为良好的血红蛋白氧载体的潜力。特别地,聚多巴胺具备一定的自由基清除能力,因而能减轻氧载体氧化损伤、血红蛋白自氧化等副作用。
制备本发明聚多巴胺包裹血红蛋白氧载体的方法,包括以下步骤:
(1)、血红蛋白的提取:将新鲜的牛全血于4℃,以4000rpm的转速离心10min。弃去上清液,经超滤和浓缩得到红细胞,将红细胞置于蒸馏水中低渗裂解得到血红蛋白初产品。通过阴离子交换色谱提取出浓度为24.4mg/ml的血红蛋白原液。
(2)、多巴胺溶液的配制:配制0.4mg/ml-12.5mg/ml(优选2.0mg/ml-12.5mg/ml,更优选2.0mg/ml-5.0mg/ml,最优选4.88mg/ml)的多巴胺溶液。
(3)、聚多巴胺的聚合和负载:在温度为2-6℃下(优选4℃),将步骤(1)得到的血红蛋白原液与步骤(2)得到的多巴胺溶液等体积混合后,向反应体系中加入Tris-HCl缓冲液(1mol/L,pH8.5)反应0.5-24h(优选为2-12h,更优选为2-5h,最优选为3.5h),多巴胺迅速发生自身氧化聚合,形成聚多巴胺,同时负载于血红蛋白表面,得到黑色的聚多巴胺包裹血红蛋白的纳米微囊,即聚多巴胺包裹血红蛋白氧载体;Tris-HCl缓冲液的加入体积为多巴胺溶液体积的2%-4%。每隔0.5h通过血气分析仪测定反应体系内游离血红蛋白的含量,当检测不到游离血红蛋白时停止反应,得到悬浮有黑色聚多巴胺包裹血红蛋白氧载体的氧载体溶液(氧载体呈黑色是由包裹在血红蛋白表面的聚多巴胺呈黑色所致,因氧载体微粒尺寸很小,离心难以使其沉降,因此没有进行分离操作)。
以下结合具体实施例,更具体地说明本发明的内容,并对本发明作进一步阐述,但这些实施例绝非对本发明进行限制。
实施例:
按上述方法制备得到一系列聚多巴胺包裹血红蛋白氧载体,见表1;并列出氧载体的平均粒径分布、多分散系数PDI(PDI为反映纳米粒子分散性的指标,其数值越小,表明纳米粒子粒径越集中,分散越均一)和氧载体的P50值。
表1实施例聚多巴胺包裹血红蛋白氧载体的参数
由表1中数据可知,本发明提供的聚多巴胺包裹血红蛋白氧载体平均粒径分布为6nm-16nm,氧载体的多分散系数PDI为0.15-0.70,氧载体的P50值为11mmHg-17mmHg。其中,氧载体的平均粒径分布优选6.2-15.3nm,更优选6.9nm-11.5nm,最优选7.4nm;氧载体的多分散系数PDI优选0.154-0.664,更优选0.179-0.331,最优选0.243。
实验一:物理特征表征
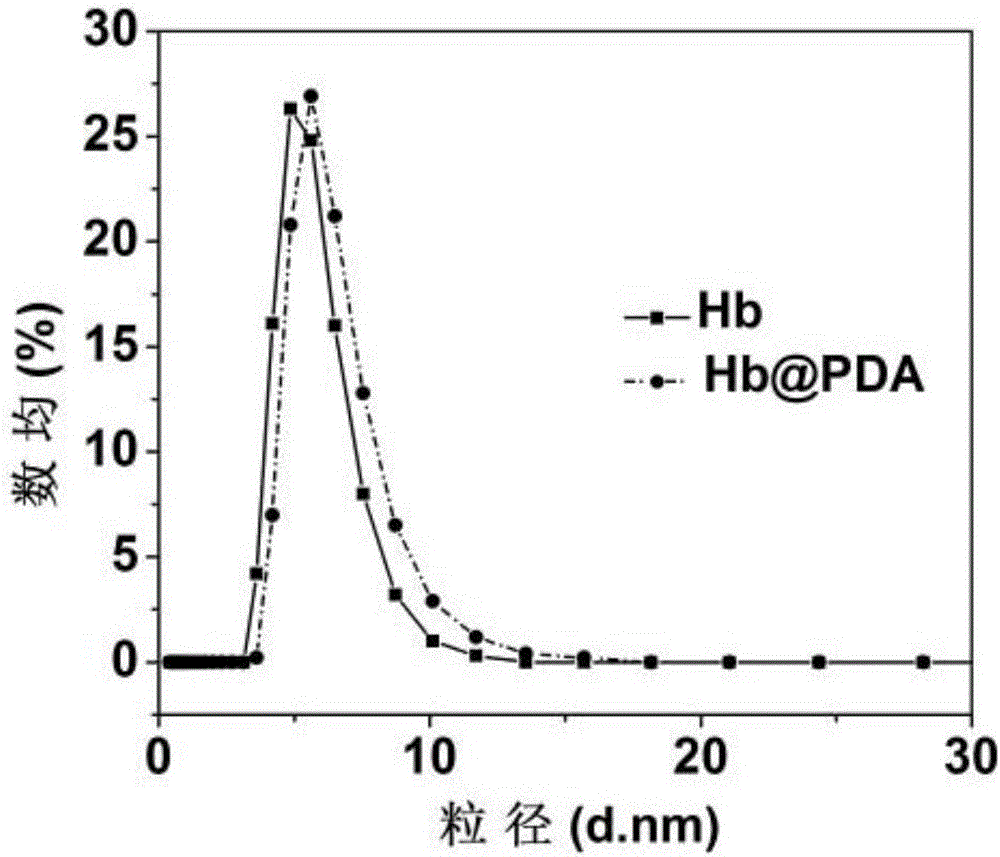
采用透射电镜观察实施例1-10的聚多巴胺包裹血红蛋白氧载体的形貌特征,采用动态光散射测定本发明聚多巴胺包裹血红蛋白氧载体的粒径分布情况。以实施例3的结果为例,氧载体的形貌特征见图1,粒径分布情况见图2(图中Hb是血红蛋白原液(Hemoglobin)的英文简称,Hb@PDA是聚多巴胺包裹血红蛋白氧载体的简称,其它图中也表示此含义)。
图1表明:本发明聚多巴胺包裹血红蛋白氧载体为纳米级的微囊,这些微囊呈均匀分布的球形粒子,体系稳定,无团聚现象。图2表明:本发明聚多巴胺包裹血红蛋白氧载体的粒径分布区间为6-8nm,粒径分布图在7nm处出现一单一、集中的峰,说明氧载体尺寸均一可控。
其它实施例也有类似结果,不再一一赘述。
实验二:化学特征表征
采用分光光度计测定实施例1-10的聚多巴胺包裹血红蛋白氧载体在220-650nm处的紫外-可见光谱,采用红外光谱仪测定本发明聚多巴胺包裹血红蛋白氧载体2000cm-1-500cm-1的红外光谱,分析其化学组成及结构特征。通过圆二色谱(谱带宽度:2nm;波长范围:250–190nm;样品池规格:1cm)分析实施例1-10的聚多巴胺包裹血红蛋白氧载体内血红蛋白二级结构的完整性。以实施例2的结果为例,紫外-可见光谱见图3,红外光谱见图4,圆二色谱图见图5。
图3表明血红蛋白原液(Hb)在414nm、540nm、574nm出现特征峰,聚多巴胺包裹血红蛋白氧载体(Hb@PDA)不仅保留了血红蛋白的特征峰,还在279nm处的存在特征峰,这是聚多巴胺的吸收所致,说明了Hb@PDA中聚多巴胺的存在。
图4表明血红蛋白原液(Hb)在1643cm-1、1528cm-1处有特征吸收,1643cm-1处的特征峰是血红蛋白中的C-O伸缩振动所致,1528cm-1处的特征峰是血红蛋白中的N-H弯曲振动所致;而聚多巴胺包裹血红蛋白氧载体(Hb@PDA)保留了血红蛋白原液的红外光谱特征的同时,在875cm-1和809cm-1处出现了新的特征吸收,875cm-1和809cm-1处的特征峰是聚多巴胺中苯环的5、3取代基的伸缩振动所致。
图3与图4的结果共同表明聚多巴胺成功地负载了血红蛋白,且血红蛋白的结构未发生变化。
图5可以看出聚多巴胺包裹血红蛋白氧载体(Hb@PDA)与血红蛋白原液(Hb)均在194、210和224nm处有特征峰,这是血红蛋白所含有的α螺旋结构所致。用圆二色谱仪测试软件计算得到二者所含有的α螺旋结构的比例较接近,分别为93.1%和94.8%,这说明聚多巴胺包裹血红蛋白氧载体保持了血红蛋白的二级结构。
其它实施例也有类似结果,不再一一赘述。
实验三:血液相容性——红细胞聚集实验
分别将960μl 400μg/mL的聚多巴胺包裹血红蛋白氧载体、960μl 4%琥珀酰明胶(GEL:16000-26600Da,PI 4.5±0.3,购于贝朗医疗有限公司,)和960μl生理盐水与40μl的2%红细胞悬浮液相混合,即为实验组、阳性对照组和阴性对照组。于37℃下孵育1h后,用电镜观察红细胞聚集情况,以实施例1的结果为例,见图6,其中从左至右分别对应实验组、阴性对照组和阳性对照组。
图6可以看出,阳性对照组中可观察到多个红细胞的堆积群,聚集现象明显;而实验组和阴性对照组中,视野下的红细胞均呈均匀的分散状态,未出现聚集现象。说明聚多巴胺包裹血红蛋白氧载体不会引起红细胞的聚集,不改变红细胞的流变特性。
实验四:血液相容性——溶血实验
分别取实施例1-10的浓度分别为200μg/mL、400μg/ml的聚多巴胺包裹血红蛋白氧载体溶液各0.2ml与1ml生理盐水混合孵育1h,随后分别加入0.2ml红细胞悬液,再孵育1h,作为实验组。将0.2ml红细胞悬液与1ml生理盐水的混合液作为阴性对照组,0.2ml红细胞悬液与1ml蒸馏水的混合液作为阳性对照组。然后分别以3000rpm离心10min,弃去沉淀物。分别测定实验组、阴性对照组、阳性对照组离心后的上清液在545nm处的吸光度,记为Dt、D-、D+,溶血率=(Dt-D-)/(D+-D-)×100%,以实施例2的结果为例,见图7。
由图7可知:阴性对照组的溶血率为0,阳性对照组的溶血率为0.95%,而加入了200μg/ml和400μg/ml聚多巴胺包裹血红蛋白氧载体后的红细胞悬液的溶血率仅为0.02%,说明本发明的聚多巴胺包裹血红蛋白氧载体不会引起溶血。
其它实施例也有类似结果,不再一一赘述。
实验五:血液相容性——凝血实验
将1ml贫血小板血浆与50μl 4mg/ml的实施例1-10的聚多巴胺包裹血红蛋白氧载体溶液混合孵育1h,作为实验组;将1ml贫血小板血浆与50μl的生理盐水混合孵育1h,作为阳性对照组;然后测定实验组和对照组的凝血时间,以实施例3的结果为例,见图8。
图8表明:与对照组相比,加入了聚多巴胺包裹血红蛋白氧载体后,血浆的凝血酶原时间(PT)、凝血酶时间(TT)及纤维蛋白原含量(Fbg)均未发生明显变化,说明本发明的聚多巴胺包裹血红蛋白氧载体不会对血小板的凝血功能造成影响。
其它实施例也有类似结果,不再一一赘述。
实验六:生物安全性——细胞毒性检测
将人脐静脉内皮细胞(HUVEC)接种于96孔板中,于37℃、5%CO2条件下预培养24h,分别加入PBS缓冲液(对照组)、浓度分别为0.25mg/ml、0.5mg/ml、1.0mg/ml、2.0mg/ml、3.0mg/ml的实施例1-10的聚多巴胺包裹血红蛋白氧载体聚多巴胺包裹血红蛋白氧载体(具体加样情况见表3,实验组),孵育24h后向各孔中分别加入cck-8溶液(购自碧云天生物技术研究所),再孵育2h,测定各组在450nm处的吸光度值。聚多巴胺包裹血红蛋白氧载体组的测定值记为Dt,PBS组的测定值记为D+,不含HUVEC的孵育体系(空白组)的测定值记为D-。细胞存活率=(Dt-D-/D+-D-)×100%,以实施例4的结果为例,见图9。
表3各组加样的组分及各组分体积
图9表明:与对照组相比,浓度不超过1mg/ml的聚多巴胺包裹血红蛋白氧载体的孵育体系的细胞存活率均未发生变化,说明聚多巴胺包裹血红蛋白氧载体不会造成细胞毒性,具有较好的生物安全性。
其它实施例也有类似结果,不再一一赘述。
实验七:聚多巴胺包裹血红蛋白氧载体的功能评价——携放氧功能
将4mg/ml实施例1-10的聚多巴胺包裹血红蛋白氧载体溶液1.5ml与4ml pH7.4的Hemoscan缓冲液(购自北京凯正生物工程有限责任公司)混匀,控制反应体系的温度为37℃,用血氧分析仪测定反应体系的氧解离曲线及P50(氧饱和度为50%时的氧分压)。采用同样的方法得到血红蛋白原液的氧解离曲线和P50。以实施例5的结果为例,氧解离曲线及P50见图10,其中Hb@PDA表示本发明的氧载体,Hb表示血红蛋白原液。
图10表明:本发明聚多巴胺包裹血红蛋白氧载体与血红蛋白原液的氧解离曲线相似,说明其具备载氧释氧的能力。P50值是血红蛋白氧饱和度达50%时对应的氧分压,P50值越低,氧亲和力越高。聚多巴胺包裹血红蛋白氧载体的P50值为13.86mmHg,血红蛋白原液的P50为25.38mmHg,这说明血红蛋白经聚多巴胺包裹后对氧气的亲和力提高了,更适于局部缺血组织的供氧,避免氧载体未到达需氧组织之前就提前释放氧气,具有更高的生物利用度。
其它实施例也有类似结果,不再一一赘述。
实验八:聚多巴胺包裹血红蛋白氧载体的功能评价——铁还原能力和高铁血红蛋白还原能力
铁还原能力:
铁还原能力的检测原理为:在酸性条件下Fe3+可与TPTZ(2,4,6-三吡啶基三嗪)形成复合物Fe3+-TPTZ,而抗氧化物可将Fe3+-TPTZ还原为蓝色的Fe2+-TPTZ,在593nm测定蓝色的Fe2+-TPTZ的吸光度,从而反映抗氧化物的铁还原能力。
分别将5μl不同浓度实施例1-10的聚多巴胺包裹血红蛋白氧载体溶液、血红蛋白原液和10mM Trolox溶液(Trolox即水溶性维生素E,是公知的抗氧化试剂)与FRAP工作液180μl(即Ferric Reducing Ability of Plasma工作液,由TPTZ溶液15μl、TPTZ稀释液150μl、检测液15μl混合而成,购于碧云天生物技术研究所)混合后孵育5min,分别作为实验组、阴性对照组和阳性对照组,具体加样情况见表4,然后分别测定各组在593nm的吸光度,以实施例6的结果为例,见图11。
表4各组加样情况
图11中右上角的小图表明:本发明聚多巴胺包裹血红蛋白氧载体在593nm处的特征吸收不仅比阴性对照组的血红蛋白原液显著增强,也比阳性对照组显著增强,说明本发明的氧载体不仅具备的铁还原能力,其还原能力比Trolox更强。图11的大图说明:随着聚多巴胺包裹血红蛋白氧载体加入量的增多,593nm处的特征吸收逐渐增强,说明增加氧载体的用量有利于提高其抗氧化效果。
其它实施例也有类似结果,不再一一赘述。
高铁血红蛋白还原能力:
铁还原能力检测表明的是聚多巴胺包裹血红蛋白氧载体对其囊内的血红蛋白的卟啉铁的还原作用,能够抑制其自氧化进程;而高铁血红蛋白还原能力检测表明的是氧载体对周围环境中的高铁血红蛋白的还原作用,从而能够间接提示其对整个机体或输注后的周围组织有一定的减弱氧化损伤的效果,因此还进行了高铁血红蛋白还原能力检测:分别将1mL 4mg/ml实施例1-10的聚多巴胺包裹血红蛋白氧载体溶液与1mL高铁血红蛋白混合作为实验组、将2mL血红蛋白原液作为阳性对照组、2mL高铁血红蛋白作为阴性对照组,三组于室温下混合孵育30min,采用分光光度计测定各组在370-670nm下的紫外-可见光谱。以实施例7的结果为例,见图12,其中右侧的两幅小图是对大图中450-650nm区间的局部放大图。
图12表明:血红蛋白原液在414nm、540nm、574nm处存在特征峰,而高铁血红蛋白在406nm和500nm处存在特征峰。将高铁血红蛋白与聚多巴胺包裹血红蛋白氧载体混合孵育后,与高铁血红蛋白组相比,光谱特征发生以下改变:406nm处的特征峰红移至414nm,更接近血红蛋白原液的光谱特征;500nm处的特征峰消失;出现了540nm和574nm的特征峰。以上改变反映了高铁血红蛋白与氧载体的混合液更接近血红蛋白原液的光谱特征,说明聚多巴胺包裹血红蛋白氧载体具有一定的还原高铁血红蛋白的能力。
血红蛋白的载氧-释氧功能是借助其含有的亚铁离子与氧气结合-释放的动态过程实现的。当血红蛋白发生自氧化时,亚铁离子被氧化为正铁离子,即成为了高铁血红蛋白。而高铁血红蛋白无法与氧气稳定结合,丧失了携氧功能,且血红蛋白自氧化常伴随血红素的降解,导致铁离子释放,造成周围细胞和组织的损伤。本发明中的聚多巴胺包裹血红蛋白氧载体具备的高铁血红蛋白还原能力,即将无法结合氧气的正铁离子还原为可发挥携氧功能的亚铁离子,减少血红蛋白自氧化对其携氧功能的损害。这初步反映了其可还原输注及循环部位的周围环境中的高铁血红蛋白,具有减弱机体氧化应激损伤的意义。
其它实施例也有类似结果,不再一一赘述。
实验九:聚多巴胺包裹血红蛋白氧载体的功能评价——ABTS自由基清除能力
ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)自由基在适当的氧化剂作用下会被氧化成绿色的ABTS+,抗氧化物存在时ABTS+的产生会被抑制,在734nm或405nm测定ABTS+的吸光度即可计算出抗氧化物的总抗氧化能力。分别将10μl实施例1-10的含聚多巴胺包裹血红蛋白氧载体0.3μg、0.7μg、1.0μg、1.4μg、1.7μg的氧载体溶液、血红蛋白原液、Trolox溶液与200μlABTS工作液(由ABTS溶液100μl和氧化剂100μl溶液混合而成,购于碧云天生物技术研究所)混合孵育5min,作为实验组,测定实验组在690-810nm下的紫外-可见光谱。采用PBS缓冲液作阴性对照,按照同上操作进行。记实验组的吸光度为At,阴性对照组的吸光度为A,清除率(%)=(A-At)/A×100%。以实施例8的结果为例,见图13A和图13B,其中,图13A中的三条线分别是Hb、Trolox和氧载体,而图13B中是不同含量的氧载体溶液。
图13A的定性分析结果显示:与血红蛋白原液相比,聚多巴胺包裹血红蛋白氧载体在734nm处的特征吸收显著减弱,说明本发明氧载体能够抑制ABTS+的产生,具有ABTS自由基清除能力;图中还可看出,本发明氧载体在734nm处的特征吸收比Trolox减弱得更多,说明本发明氧载体对ABTS+的抑制效果更显著,具有比Trolox显著增强的ABTS自由基清除能力。图13B的定量分析结果显示:聚多巴胺包裹血红蛋白氧载体加入量为1.7μg时的清除率可达89%,说明聚多巴胺包裹血红蛋白氧载体对ABTS自由基有很好的清除效果。
其它实施例也有类似结果,不再一一赘述。
实验十:聚多巴胺包裹血红蛋白氧载体的功能评价——DPPH自由基清除能力
DPPH(1,1-二苯基-2-苦基肼基自由基)分子中含多个吸电子的-NO2和苯环的大π键,氮自由基能够稳定存在。当DPPH自由基被清除,其最大吸收波长520nm处的吸光度值随之减少。分别将10μl实施例1-10的含聚多巴胺包裹血红蛋白氧载体0.3μg、0.7μg、1.0μg、1.4μg、1.7μg的氧载体溶液、血红蛋白原液和Trolox溶液与200μl DPPH工作液(取DPPH 0.005g溶于约125mL乙醇溶剂中配制而成,购自Sigma-Aldrich公司)混合孵育30min,作为实验组,测定实验组在500-620nm的紫外-可见吸收光谱。采用PBS缓冲液作阴性对照组,按照同上操作进行。记实验组的吸光度为At,阴性对照组的吸光度为A,清除率(%)=(A-At)/A×100%。以实施例9的结果为例,见图14A和图14B,图14A中,三条曲线分别代表血红蛋白原液、聚多巴胺包裹血红蛋白氧载体和Trolox溶液。
图14A的定性分析结果显示:与血红蛋白原液相比,聚多巴胺包裹血红蛋白氧载体在520nm处的特征吸收显著减弱,说明本发明氧载体能够清除DPPH自由基,具有DPPH自由基清除能力;图中还可看出,本发明氧载体在520nm处的特征吸收比Trolox减弱得更多,说明本发明氧载体对DPPH的清除效果更显著,具有比Trolox显著增强的DPPH自由基清除能力。图14B的定量分析结果显示:聚多巴胺包裹血红蛋白氧载体含量为1.7μg时的清除率达49%,说明聚多巴胺包裹血红蛋白氧载体对DPPH自由基有较好的清除效果。
其它实施例也有类似结果,不再一一赘述。
实验十一:聚多巴胺包裹血红蛋白氧载体的功能评价——红细胞内活性氧(ROS)清除能力
DCFH-DA可自由地通过细胞膜,随后水解为DCFH,DCFH可被ROS氧化为具有强荧光的DCF。向5ml红细胞悬液内加入4mg/ml实施例1-10的聚多巴胺包裹血红蛋白氧载体溶液100μl,搅拌分散,2h后加入33μg/ml的双氧水3μl,于37℃孵育1h,孵育过程中每隔0.5h加入1mM DCFH-DA溶液2mL,孵育结束后以1000g离心7min,去除上清后,加入生理盐水复悬红细胞,重复3次,作为实验组。以等量的红细胞悬液为阴性对照组,加入双氧水的红细胞悬液作阳性对照组。采用倒置显微镜得到荧光成像,通过荧光区域面积对各组中的ROS产生量进行定性监测。以实施例10的结果为例,见图15,
图15显示:阴性对照组由于没有加入H2O2不产生ROS,未出现荧光区域,与阴性对照组相比,实验组和阳性对照组可明显检测到荧光成像,与阳性对照组相比,实验组的荧光面积明显变小,光强变弱。结果说明本发明聚多巴胺包裹血红蛋白氧载体有效地抑制了红细胞内活性氧的生成,从而减少活性氧对细胞和组织的攻击,减弱氧化应激损伤。
其它实施例也有类似结果,不再一一赘述。
以上所述仅是本发明的优选实施方式,应当指出的是,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!