奥利司他脂质体及其制备方法和在抗肿瘤药物中的应用与流程
本发明属于生物医药
技术领域:
,具体涉及一种奥利司他脂质体及其制备方法和在抗肿瘤药物中的应用。
背景技术:
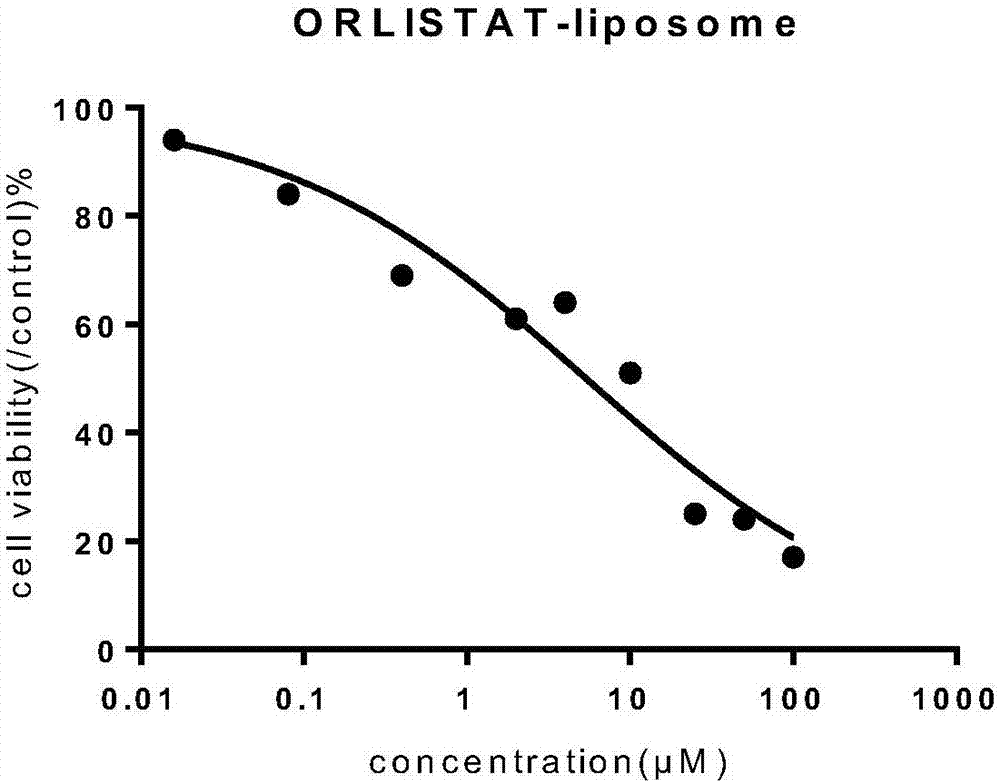
:奥利司他(orlistat)的化学名:n-甲酰-l-亮氨酸(s)-1[(2s,3s)3-己基-4氧基-2-环氧丙基甲基]十二酯,也称四氢脂抑素(thl),是一种半合成的脂抑素衍生物,结构式如下:奥利司他是目前国际公认的一种新型减肥降脂药,市场上销售的商品名称为赛尼可,1998年首次在新西兰上市,当年销售额达1.46亿美。奥利司他是长效和强效的特异性胃肠道脂肪酶抑制剂,常温下为白色或类白色粉末,不溶于水,溶于氯仿,易溶于乙醇,通过与胃和小肠腔内胃脂肪酶和胰脂肪酶的活性丝氨酸部位形成共价键使酶失活。食物中的脂肪不能分解为游离脂肪酸和单酰基甘油,因而脂肪不能被吸收和利用,从而减少人体的热量摄入,控制体重。该药无需通过全身吸收发挥药效。在常用剂量下,脂肪的吸收可被抑制30%。口服后很少吸收,在肠道内可被代谢失活,代谢部位在胃肠道壁,消除半衰期约为14~19小时。约97%的本品随粪便排泄,其中83%以原形排出。临床上奥利司他可应用于肥胖症及高脂血症。一般情况下,一次可口服120mg,一日三次,于餐中或餐后1小时服用。服药2周后体重可开始下降。可连续服用6~12个月,如剂量增大至每日400mg以上时,其作用不再增强。目前奥利司他的专利有奥利司他的制备、提纯、检测和奥利司他用于减肥的药物的开发。申请号为201410249734.3的专利公布了一种奥利司他的制备方法,该专利中降低生产成本和环境污染,具体方法包括发酵液的预处理、滤饼浸提、浓缩、非极性溶剂萃取、浓缩、极性溶剂萃取、冷冻除杂、浓缩、非极性溶剂结晶、氢化、反洗、结晶及重结晶。申请号为201210594357.8的专利公开了一种奥利司他的纯化方法,通过极性溶剂结晶、非极性溶剂结晶两步溶媒精制,经hplc测定,可以获得含量99%以上,最大单杂0.1%以内,符合usp35标准的奥利司他。申请号为201510804600.8的专利公开一种奥利司他的快速检测方法,待测样品经提取、洗涤液、与盐酸羟胺溶液和强碱溶液反应萃取、酸化显色步骤,并根据颜色判断是否含有奥利司他。检测方法操作简便、分析成本低,待测样品经预处理后再与检测剂反应,可以排除相关因素的干扰,更有利于对溶液颜色的观察,对样品中是否有奥利司他做出更准确地判断。申请号为201110370659.2的专利公布了一种含奥利司他的制剂及其制备方法,该制剂含有奥利司他包衣层,所述的制剂是通过将奥利司他熔融液,包衣在空白片或空白小丸表面形成所述的奥利司他包衣层后制备而成。申请号为201310000099.0的专利公开了一种含有奥利司他片剂及其制备方法,该片剂由含二氧化硅的奥利司他磷脂组合物与药用助剂直接压片而成,所述含二氧化硅的奥利司他磷脂组合物中,奥利司他、磷脂和二氧化硅的重量比为1:0.5-1.5:0.5-3。以上都是口服用药,且都是将奥利司他用于减肥和治疗代谢综合征,并没有用于治疗和/或抗肿瘤的奥利司他脂质体的相关报道。因此开发一种新型抗肿瘤药物,对广大肿瘤患者、企业和社会具有巨大的潜在的临床价值和经济效益。技术实现要素:有鉴于此,本发明的目的在于提供一种奥利司他脂质体,改变奥利司他的疏水的性质,并且具有良好的稳定性,能够顺利进入肿瘤细胞内部发挥抗肿瘤作用。本发明的奥利司他脂质体可以用于制备抗肿瘤疾病的药物中,具有很大的潜在的临床价值。为实现上述目的,本发明的技术方案为:一种奥利司他脂质体,包括奥利司他、磷脂、胆固醇和mpeg2000-dppe,其中,磷脂选自大豆卵磷脂和二硬脂酰磷脂酰胆碱。奥利司他水溶性差,且不稳定,导致其体内生物利用度低,不能很好地发挥其药效作用。因此,需要采取必要的技术手段对其进行改良,以改善其水溶性等性质,使其更适合于药用。作为优选,大豆卵磷脂与二硬脂酰磷脂酰胆碱的质量比为4-6:1。作为优选,磷脂与胆固醇的质量比为4-6:1。作为优选,磷脂与mpeg2000-dppe的质量比为13-15:1。作为优选,磷脂与奥利司他的质量比为6-8:1。本发明的目的之二在于提供一种所述的奥利司他脂质体的制备方法,包括如下步骤:按上述比例取大豆卵磷脂、二硬脂酰磷脂酰胆碱、mpeg2000-dppe、胆固醇和奥利司他混合均匀后加入无水乙醇搅拌使其溶解,超声使其混合均匀,将得到的溶液缓慢注入pbs缓冲液中,60℃搅拌,减压除去乙醇,补加pbs适量,用脂质体挤出仪反复挤压通过200nm的膜,制得奥利司他脂质体。本发明的目的之三在于提供一种所述的奥利司他脂质体在制备抗肿瘤疾病的药物中的应用。作为优选,所述肿瘤疾病包括非小细胞肺癌、人乳腺癌、人神经母细胞瘤、肝癌。本发明的目的还在于提供一种抗肿瘤疾病的药物组合物,所述药物组合物包括奥利司他脂质体和药学上可以接受的载体或助剂。本发明的目的还在于提供一种奥利司他注射剂,所述奥利司他注射剂包括所述的奥利司他脂质体和药学上可以接受的载体或助剂。本发明的有益效果在于:1)本发明提供了一种奥利司他脂质体,增加奥利司他的溶解度,提高药物的稳定性,促进药物吸收、减轻药物对机体的刺激,作为奥利司他的载体能可大大改善客体分子的水溶性,以使其适应液体制剂的要求,提高奥利司他的生物利用度,使奥利司他的药用价值得到更好的发挥。2)本发明将奥利司他制备成脂质体,改变了其疏水的性质,以使其适应液体制剂的要求,具有更好的生物安全性,可以用于制备抗肿瘤疾病的药物中,具有很大的潜在的临床价值。附图说明图1为奥利司他药物组中非小细胞肺癌细胞a549的浓度效应曲线。图2为奥利司他脂质体药物组中非小细胞肺癌细胞a549的浓度效应曲线。图3为奥利司他药物组中人乳腺癌细胞mcf7的浓度效应曲线。图4为奥利司他脂质体药物组中人乳腺癌细胞mcf7的浓度效应曲线。图5为奥利司他药物组中人神经母细胞瘤细胞sh-sy5y的浓度效应曲线。图6为奥利司他脂质体药物组中人神经母细胞瘤细胞sh-sy5y的浓度效应曲线。具体实施方式以下将对本发明的优选实施例进行详细描述。优选实施例中未注明具体条件的实验方法,通常按照常规条件,所举实施例是为了更好地对本发明的内容进行说明,但并不是本发明的内容仅限于所举实施例。所以熟悉本领域的技术人员根据上述
发明内容对实施方案进行非本质的改进和调整,仍属于本发明的保护范围。实施例1称取大豆卵磷脂25mg、二硬脂酰磷脂酰胆碱5mg、mpeg2000-dppe2.5mg、胆固醇6mg和奥利司他4mg均匀混合;加入无水乙醇15ml搅拌使其溶解,超声2min使其混合均匀,将得到的溶液缓慢注入20mlpbs缓冲液中,60℃搅拌,减压除去乙醇,补加pbs适量,用脂质体挤出仪反复挤压通过200nm的膜,制得奥利司他脂质体l1。实施例2称取大豆卵磷脂24mg、二硬脂酰磷脂酰胆碱4mg、mpeg2000-dppe2mg、胆固醇7mg和奥利司他4mg均匀混合;加入无水乙醇12ml搅拌使其溶解,超声2min使其混合均匀,将得到的溶液缓慢注入18mlpbs缓冲液中,60℃搅拌,减压除去乙醇,补加pbs适量,用脂质体挤出仪反复挤压通过200nm的膜,制得奥利司他脂质体l2。实施例3称取大豆卵磷脂24mg、二硬脂酰磷脂酰胆碱6mg、mpeg2000-dppe2mg、胆固醇5mg和奥利司他5mg均匀混合;加入无水乙醇12ml搅拌使其溶解,超声2min使其混合均匀,将得到的溶液缓慢注入18mlpbs缓冲液中,60℃搅拌,减压除去乙醇,补加pbs适量,用脂质体挤出仪反复挤压通过200nm的膜,制得奥利司他脂质体l3。实施例4称取大豆卵磷脂30mg、mpeg2000-dppe2.5mg、胆固醇6mg和奥利司他4mg加入无水乙醇15ml搅拌使其溶解,超声2min使其混合均匀,将得到的溶液缓慢注入20mlpbs缓冲液中,60℃搅拌,减压除去乙醇,补加pbs适量,用脂质体挤出仪反复挤压通过200nm的膜,制得奥利司他脂质体l4。实施例5称取大豆卵磷脂25mg、氢化大豆卵磷脂5mg、胆固醇6mg和奥利司他4mg加入无水乙醇15ml搅拌使其溶解,超声2min使其混合均匀,将得到的溶液缓慢注入20mlpbs缓冲液中,60℃搅拌,减压除去乙醇,补加pbs适量,用脂质体挤出仪反复挤压通过200nm的膜,制得奥利司他脂质体l5。实施例6称取大豆卵磷脂25mg、二硬脂酰磷脂酰胆碱5mg、mpeg2000-dppe2.5mg、胆固醇6mg和奥利司他4mg加入无水乙醇15ml搅拌使其溶解,超声2min使其混合均匀,将得到的溶液缓慢注入20mlpbs缓冲液中,60℃搅拌,减压除去乙醇,补加pbs适量,用脂质体挤出仪反复挤压通过200nm的膜,制得奥利司他脂质体l6。实施例7称取大豆卵磷脂25mg、二硬脂酰磷脂酰胆碱5mg、mpeg2000-dppe2.5mg、胆固醇6mg和奥利司他4mg加入无水乙醇15ml搅拌使其溶解,超声2min使其混合均匀,将得到的溶液缓慢注入20mlpbs缓冲液中,60℃搅拌,减压除去乙醇,补加pbs适量,用脂质体挤出仪反复挤压通过200nm的膜,制得奥利司他脂质体l7。实施例8称取大豆卵磷脂24mg、二硬脂酰磷脂酰胆碱8mg、mpeg2000-dppe4mg、胆固醇4mg和奥利司他4mg加入无水乙醇15ml搅拌使其溶解,超声2min使其混合均匀,将得到的溶液缓慢注入20mlpbs缓冲液中,60℃搅拌,减压除去乙醇,补加pbs适量,用脂质体挤出仪反复挤压通过200nm的膜,制得奥利司他脂质体l8。实施例9称取大豆卵磷脂28mg、二硬脂酰磷脂酰胆碱4mg、mpeg2000-dppe4mg、胆固醇6mg和奥利司他4mg加入无水乙醇15ml搅拌使其溶解,超声2min使其混合均匀,将得到的溶液缓慢注入20mlpbs缓冲液中,60℃搅拌,减压除去乙醇,补加pbs适量,用脂质体挤出仪反复挤压通过200nm的膜,制得奥利司他脂质体l9。脂质体包封率的测定取脂质体适量,置于超高速条件下12000rpm离心8min,若有沉淀则反复离心,直至无沉淀出现,取上清液,加入适量的甲醇或添加适当triton水溶液的甲醇破膜,然后经hplc法测定溶液中药物的含量,通过对比离心前后脂质体中药物的含量计算包封率。粒径测定取脂质体混悬液,用注射用水稀释至适宜浓度,用zetasizer测定脂质体的粒径。表1:粒径及包封率l1l2l3l4l5l6l7l8l9粒径(nm)98101105157163182176142151包封率(%)918789576358426451表2:存放稳定性分别取脂质体于4℃保存,于不同时间点测定包封率。t/d010203040506070包封率(%)l19191919090898989包封率(%)l28787868686868685包封率(%)l38989898888888787包封率(%)l56363605446423021包封率(%)l86463524337322821体外抗癌活性通过体外细胞毒性实验,检测奥利司他和本发明制备的奥利司他脂质体对3种常用癌细胞的抗肿瘤活性。阳性对照药:阿霉素。奥利司他药物组:取奥利司他用无水乙醇配置成1000mm的储存液。奥利司他脂质体药物组:本发明实施例1制备的奥利司他脂质体。非小细胞肺癌细胞a549、人乳腺癌细胞mcf7、人神经母细胞瘤细胞sh-sy5y分别在含10%胎牛血清、100μg/ml青霉素,100μg/ml链霉素、0.2%nahco3的dmem培养液中,置于37℃、5%co2培养箱中培养。设实验组和对照组,每组3个复孔,选用阿霉素作为阳性对照组,实验组将奥利司他和奥利司他脂质体设10个不同浓度梯度,浓度分别为:100,50,25,10,4,2,0.4,0.08,0.016,0μm,每个浓度设3个复孔。细胞培养24h后,将培养液换成含不同浓度奥利司他和奥利司他脂质体的培养液,药物作用72h后,采用cck-8测定药物对细胞的毒性作用。最后取实验组、阳性对照组各复孔平均光密度值(opticaldensity,od)计算细胞存活率和抑制率,并以药物浓度为横坐标,细胞增殖抑制率为纵坐标绘制浓度效应曲线,见图1,图2,图3,图4,图5,图6。利用graphpadprism6求回归方程,得出72h50%抑制浓度(50%inhibitingconcentration,ic50)。结果如下(ic50=μm):样品a549mcf7sh-sy5ydox0.700.510.83奥利司他药物组13.517.5717.102奥利司他脂质体药物组5.3783.5163.15最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1