青蒿素B抗神经炎症和治疗神经退行性疾病的用途的制作方法
本发明涉及一种中药成分青蒿素b的新用途,特别是应用青蒿素b在制备抗神经炎症和治疗认知功能障碍的药物中的应用,以及该化合物在阿尔茨海默病、帕金森病、亨廷顿氏病等神经退行性疾病中的应用。
背景技术:
神经退行性疾病(neurodegenerativedisease)是一类慢性、进行性的神经系统疾病,以脑和脊髓中神经元不可控制的丢失和特定蛋白大量的聚集为病理特征,伴随脑功能下降,特别是认知功能和运动功能的下降。它包括最常见的老年痴呆,即阿尔茨海默病(alzheimer'sdisease,ad),以及以静止性震颤为特征的帕金森病(parkinson'sdisease,pd)、以运动缺陷为特征的多发性硬化症(multiplesclerosis,ms)、以进行性肌无力为特征的肌萎缩侧索硬化症(amyotrophiclateralsclerosis,als)等。随着全球人口老龄化及人均寿命延长,急剧升高的慢性病和健康减损水平将成为主要全球公共卫生挑战,神经退行性疾病日益成为人类的健康负担。以ad为例,全世界患者数量预计将由现在的4,400万增加到2050年的13,500万,将给社会和家庭造成巨大负担。
在多种神经退行性疾病的疾病进程中,神经炎症被认为是关键的发病机制。神经炎症以神经胶质细胞的激活为主要特征。炎症可使脑内胶质细胞反复被激活,导致修复机制失调或激活信号持续存在,转变为神经系统疾病中常见的相对难以控制的慢性炎症损伤。同时又会释放大量的神经毒性因子等,增加神经元的氧化应激,从而导致受损脑区神经元的退行性病变。例如,ad患者脑内炎症因子可通过多种通路促进aβ的产生、tau蛋白的磷酸化;继而aβ的聚集又可通过mark信号通路上调tnf-α、inos、il-6mrna的表达,并诱导脑内不同脑区cb2rmrna表达水平上调。另外,aβ可刺激神经胶质细胞激活,释放大量的炎症因子,如tnf-α、tgf-β、il-6和il-1等,诱导突触的变性、神经元的死亡。pd神经炎症的发生主要由于中枢和外周的免疫细胞相互作用,释放促炎细胞因子(tnf-α、il-1β和il-6)放大炎症信号,产生神经毒素直接作用于多巴胺神经元,最终导致多巴胺神经元死亡[]。ms大鼠脑组织血管周围和脑实质有明显的炎性细胞浸润;脊髓血管周围有大量炎性细胞密集环绕,呈“袖套样”改变;脊髓髓鞘大面积脱失,且髓鞘板层松散。正电子发射计算机断层扫描显影显示在als患者的脑中有小胶质细胞的激活。炎症过程并非仅是发展至中晚期出现的继发性反应,而在始发阶段就参与其病理过程。因此,抑制神经炎症的发生与发展对于中枢神经系统疾病的防治具有重要意义。
青蒿素b(arteannuinb,casno.50906-56-4)是从中药青蒿(arterisiaannual.)中提取分离得到的倍半萜内酯类化合物。其化学结构式如下:
中国专利201110388382.6青蒿素b的制备方法及其新用途公开了青蒿素b的制备方法及其用于制备免疫抑制的药物,青蒿素b具有显著的免疫抑制活性,可在制备预防和治疗自身免疫性疾病、炎症性疾病的药物和临床上应用。近代药理学研究表明其具有一定程度的抗疟、抗细菌、抗肿瘤转移、抗真菌和解热活性。但是,迄今为止尚未见将青蒿素b用于治疗神经退行性疾病尤其是治疗老年性痴呆的报道。
技术实现要素:
:
本发明的目的在于提供青蒿素b在抗神经炎症中的应用。
具体包括:
青蒿素b在制备抗神经炎症的药物中的应用。
其中所述神经炎症是脂多糖诱导的神经胶质细胞炎症。
本发明进一步提供青蒿素b在制备治疗神经退行性疾病的药物中的应用。
其中,所述的神经退行性疾病是以学习记忆障碍为特征的。
其中,所述的神经退行性疾病包括阿尔茨海默病,帕金森,亨氏顿氏病。
本发明进一步提供青蒿素b在制备改善空间学习记忆障碍,提高学习记忆的药物中的应用。
其中,空间学习记忆障碍是aβ25-35脑室注射所致的学习记忆障碍。
本发明还提供用青蒿素b作为药物活性成分制备成的药物组合物,本发明的药物组合物,包括青蒿素b,根据需要该组合物还可以加入药物可接受的载体。
本发明的组合物,是单位剂量的药物制剂形式,所述单位剂量形式是指制剂的单位,如片剂的每片,胶囊的每粒胶囊,口服液的每瓶,颗粒剂每袋等。
本发明的组合物其中的有效组分,其在制剂中所占重量百分比可以是0.1-99.9%,其余为药物可接受的载体。
本发明的组合物,通过将上述有效组分和药物可接受的载体混合制备得到。
本发明的组合物,其药物制剂形式可以是任何可药用的剂型,这些剂型包括:片剂、糖衣片剂、薄膜衣片剂、肠溶衣片剂、胶囊剂、硬胶囊剂、软胶囊剂、口服液、口含剂、颗粒剂、冲剂、丸剂、散剂、膏剂、丹剂、混悬剂、粉剂、溶液剂、注射剂、栓剂、软膏剂、硬膏剂、霜剂、喷雾剂、滴剂、贴剂。本发明的制剂,优选的是口服剂型,如:胶囊剂、片剂、口服液、颗粒剂、丸剂、散剂、丹剂、膏剂等。
本发明的组合物,其口服给药的制剂可含有常用的赋形剂,诸如粘合剂、填充剂、稀释剂、压片剂、润滑剂、崩解剂、着色剂、调味剂和湿润剂,必要时可对片剂进行包衣。
适用的填充剂包括纤维素、甘露糖醇、乳糖和其它类似的填充剂。适宜的崩解剂包括淀粉、聚乙烯吡咯烷酮和淀粉衍生物,例如羟基乙酸淀粉钠。适宜的润滑剂包括,例如硬脂酸镁。适宜的药物可接受的湿润剂包括十二烷基硫酸钠。
可通过混合,填充,压片等常用的方法制备固体口服组合物。进行反复混合可使活性物质分布在整个使用大量填充剂的那些组合物中。
口服液体制剂的形式例如可以是水性或油性悬浮液、溶液、乳剂、糖浆剂或酏剂,或者可以是一种在使用前可用水或其它适宜的载体复配的干燥产品。这种液体制剂可含有常规的添加剂,诸如悬浮剂,例如山梨醇、糖浆、甲基纤维素、明胶、羟乙基纤维素、羧甲基纤维素、硬脂酸铝凝胶或氢化食用脂肪,乳化剂,例如卵磷脂、脱水山梨醇一油酸酯或阿拉伯胶;非水性载体(它们可以包括食用油),例如杏仁油、分馏椰子油、诸如甘油的酯的油性酯、丙二醇或乙醇;防腐剂,例如对羟基苯甲酯或对羟基苯甲酸丙酯或山梨酸,并且如果需要,可含有常规的香味剂或着色剂。
对于注射剂,制备的液体单位剂型含有本发明的活性物质和无菌载体。根据载体和浓度,可以将此化合物悬浮或者溶解。溶液的制备通常是通过将活性物质溶解在一种载体中,在将其装入一种适宜的小瓶或安瓿前过滤消毒,然后密封。辅料例如一种局部麻醉剂、防腐剂和缓冲剂也可以溶解在这种载体中。为了提高其稳定性,可在装入小瓶以后将这种组合物冰冻,并在真空下将水除去。
本发明的组合物,在制备成药剂时可选择性的加入适合的药物可接受的载体,所述药物可接受的载体选自:甘露醇、山梨醇、焦亚硫酸钠、亚硫酸氢钠、硫代硫酸钠、盐酸半胱氨酸、巯基乙酸、蛋氨酸、维生素c、edta二钠、edta钙钠,一价碱金属的碳酸盐、醋酸盐、磷酸盐或其水溶液、盐酸、醋酸、硫酸、磷酸、氨基酸、氯化钠、氯化钾、乳酸钠、木糖醇、麦芽糖、葡萄糖、果糖、右旋糖苷、甘氨酸、淀粉、蔗糖、乳糖、甘露糖醇、硅衍生物、纤维素及其衍生物、藻酸盐、明胶、聚乙烯吡咯烷酮、甘油、土温80、琼脂、碳酸钙、碳酸氢钙、表面活性剂、聚乙二醇、环糊精、β-环糊精、磷脂类材料、高岭土、滑石粉、硬脂酸钙、硬脂酸镁等。
本发明的组合物在使用时根据病人的情况确定用法用量,可每日服三次,每次1-20剂,如:1-20袋或粒或片。
附图说明:
图1青蒿素b对bv-2细胞毒性
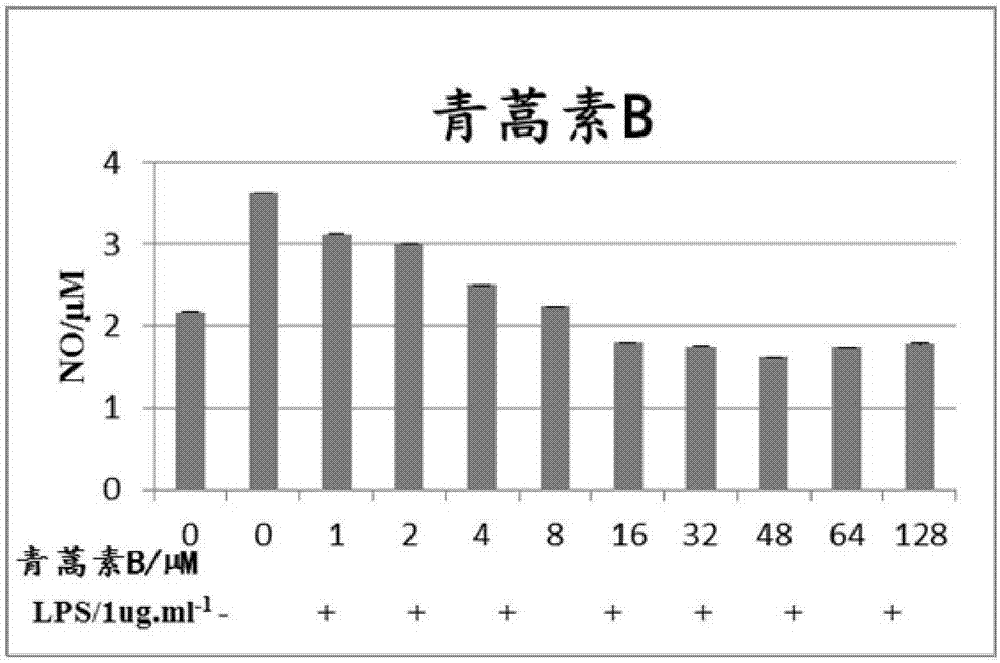
图2青蒿素b对lps诱导的bv-2细胞分泌no的影响
图3青蒿素b对il-1β、il-6、tnf-α、myd88、nf-κb基因水平变化的影响
图4青蒿素b对aβ脑室注射模型小鼠水迷宫定位航行实验中潜伏期的影响
图5青蒿素b对aβ脑室注射模型小鼠水迷宫定位航行实验中总游程的影响
图6青蒿素b对aβ脑室注射模型小鼠水迷宫探索实验中穿台次数的影响
图7青蒿素b对aβ脑室注射模型小鼠水迷宫探索实验中目标象限游程的影响
图8青蒿素b对aβ脑室注射模型小鼠避暗实验中潜伏期的影响
图9青蒿素b对aβ脑室注射模型小鼠避暗实验中错误次数的影响
具体实施方案:
以下通过实施例进一步说明本发明。
实验例1:青蒿素b抗lps诱导的bv-2细胞神经炎症的作用研究
实验方法:
(1)体外bv2细胞:所用bv2细胞购自中国医学科学院基础医学研究所细胞资源中心,培养条件为dmem/f12培养液(加10%进口胎牛血清、100x的非必需氨基酸、青霉素100u·ml-1和链霉素100u·ml-1),37℃、5%co2条件下培养。
(2)srb法检测细胞毒性:
取对数生长期的bv2细胞进行铺板,将细胞消化后计数,按2*10^5个/ml的密度接种于96孔板中,每孔100μl。待4小时细胞贴壁后加入不同浓度的中药有效成分,继续培养24小时。取出培养板,轻轻加入50ultca溶液固定,静置10min后转到4℃条件下放置1h。倒掉固定液,去离子水洗5遍,室温晾干。每孔加入100ulsrb染色,静置10min后用1%醋酸洗5遍,室温晾干。每孔加入150ultris碱溶液震荡溶解,于波长490nm下检测其od值,根据吸光度值计算细胞存活率。
(3)griess试剂法检测no含量:
取对数生长期的bv2细胞进行铺板,将细胞消化后计数,按2*10^5个/ml的密度接种于96孔板中,每孔100μl。待细胞贴壁后,分为正常对照组、lps模型组、lps和药物处理组,加入相应溶液,每孔共200μl。培养24h后取上清进行检测。96孔板中分别加入样品和标准品50μl,再加入griess试剂a50μl,37℃放置10min,加入griess试剂b50μl,37℃放置10min,于酶标仪540nm处测定od值。以nano2作为标准品,绘制标准曲线。
(4)elisa检测细胞因子:
取对数生长期的bv2细胞进行铺板,将细胞消化后计数,按2*10^5个/ml的密度接种于12孔板中,每孔1ml。待细胞贴壁后,分为正常对照组、lps模型组、lps和药物处理组,加入相应溶液。培养24h后取细胞培养液上清,4℃、5000r/min离心10min,收集培养液上清。具体操作按照elisa试剂盒说明书进行。
(5)实时荧光定量pcr检测mrna水平变化:
取对数生长期的bv2细胞进行铺板,将细胞消化后计数,按2*10^5个/ml的密度接种于6孔板中,每孔2ml。培养过夜后吸去旧培养液,药物组加入药物溶液1ml,空白对照组和模型组加培养液1ml,预孵育2h后模型组和药物组各孔加入lps溶液1ml,空白对照组加入培养液1ml。继续培养6h后加入trizolz进行裂解细胞,提取总rna后进行反转录,再进行q-pcr进行dna扩增,检测il-1β、il-6、tnf-α、myd88、nf-κb基因水平变化。
实验结果:见图1-3
实验例2:青蒿素b对aβ脑室注射拟ad模型小鼠学习记忆的影响研究
实验方法:
(1)脑立体定位注射:用立体定位方法在大鼠脑内注入10ulaβ(ug/ul),建立急性脑内炎症模型。大鼠用10%水合氯醛350mg/kg腹腔注射麻醉,然后把大鼠置于脑立体定位仪上,固定头部。剃去大鼠头顶的毛,常规酒精消毒,剪幵头皮,暴露顶骨,参照大鼠脑立体定位图谱,在顶骨上钻两个小孔。海马区的具体定位为:以前卤为零点,中线两侧由后向前距前卤点4mm,两侧距中线2.8mm,硬膜下3.1mm。即于前卤后4mm,中线两侧旁开2.8mm,为穿刺点。用牙钻钻开颅骨,用微量注射器剌破硬膜,垂直进针达硬膜下3.1mm,即为海马ca1区。乙酰葛根素组和组用微量注射器向海马区内缓慢注射lps,双侧海马各2.5ul,每侧海马的注射时间超过20分钟,留针5min以保证溶液充分弥散,两次注射间隔10分钟。缓慢拔出微量注射器,封闭钻孔,在颅骨表面洒少许青霉素粉,然后缝合皮肤,络合碘消毒。
(2)行为学观察:水迷宫由一不锈钢圆形水池和一可移动位置的平台组成,直径为100cm,水深30cm。先在水池内注入清水,然后加入少许墨汁使水变成不透明,水温控制在(22±2)℃。水池被分为4个相同的象限,每个象限的池壁上方贴有不同形状的标志作为参照物,平台位于某个象限的中间,水面高出平台2cm。测试共6天,分别测定:(1)定位航行实验:实验第1~4天,每天分上午和下午两个时间段,每个时间段训2次,分别将小鼠从两个象限入水测试,记录其逃避潜伏期(从入水至找到安全平台的时间),测试时限定为70s。若小鼠在70s内尚未找到平台,则将小鼠拿到平台上并使它在上面停留30s;若小鼠70s内找到平台,也让其在平台上停留30s。水池上空通过摄像机与监视器和计算机连接,采用水迷宫检测软件系统自动跟踪小鼠游泳轨迹。(2)空间搜索实验:实验第5天,撤除平台,小鼠在原平台象限的对侧象限入水,记录其原平台所在象限的游泳距离占总距离的百分比(%)、时间百分比(%)。(3)可视平台实验:实验第6天,使水池内平台高出水面2cm,在平台对侧象限放入小鼠,在小鼠可视情况下记录其逃避潜伏期,以此排除小鼠视力对寻找平台的影响。
(3)形态学观察:制作组织切片,对切片进行免疫荧光和免疫组化检测,观察胶质细胞增生和神经元的丢失情况;并对海马组织进行高尔基染色,观察神经元突触形态的改变。
(4)免疫学检测:注射lps12小时之后给予腹腔注射1%戊巴比妥麻醉,彻底麻醉后取脑,置液氮罐中保存。采用elisa技术对炎症因子il-6和tnf-a进行检测,采用免疫印迹技术检测myd88、nf-κb蛋白水平。具体步骤同上。
实验结果:见图4-9。
- 还没有人留言评论。精彩留言会获得点赞!
- SeZn7MT3的组成、制备方法及其在防治阿尔茨海默症中的应用与流程
- 纤维支架材料、其制备方法、及亚甲蓝负载量的调节方法与流程
- 大驳骨在制备预防和/或治疗神经退行性疾病的药物中的应用及药物的制造方法与工艺
- 花叶假杜鹃在制备预防和/或治疗神经退行性疾病的药物中的应用及药物的制造方法与工艺
- 大脑内稳态调节蛋白的组成、制备方法及其在防治阿尔茨海默症中的应用与流程
- 一种药物组合物及其制备方法和在制备防治神经退行性疾病的药物中的应用与流程
- 片层碳‑四氧化三铁复合体在抑制Aβ聚集中的应用的制造方法与工艺
- 一种干细胞球切割收集装置及干细胞球的切割分离传代方法与流程
- 一种具有改善记忆功效的多肽及其分离制备方法和应用与制造工艺
- 治疗或预防神经退行性病症的组合物和方法与制造工艺
- SeZn7MT3的组成、制备方法及其在防治阿尔茨海默症中的应用与流程
- 纤维支架材料、其制备方法、及亚甲蓝负载量的调节方法与流程
- 大驳骨在制备预防和/或治疗神经退行性疾病的药物中的应用及药物的制造方法与工艺
- 花叶假杜鹃在制备预防和/或治疗神经退行性疾病的药物中的应用及药物的制造方法与工艺
- 大脑内稳态调节蛋白的组成、制备方法及其在防治阿尔茨海默症中的应用与流程
- 一种药物组合物及其制备方法和在制备防治神经退行性疾病的药物中的应用与流程
- 片层碳‑四氧化三铁复合体在抑制Aβ聚集中的应用的制造方法与工艺
- 一种干细胞球切割收集装置及干细胞球的切割分离传代方法与流程
- 一类抗氧化超短肽及其应用的制造方法与工艺
- 一种具有改善记忆功效的多肽及其分离制备方法和应用与制造工艺