一种基于3D打印的降解可控骨组织工程支架及制备方法与流程
本发明属于生物医学材料技术领域,具体涉及生物一种基于3D打印的降解可控骨组织工程支架及制备方法。
背景技术:
骨缺损修复材料一直是生物材料领域的研究热点之一。骨组织修复材料作为一种特殊的生物材料,具有功能上的特殊要求:负载力学性能、生物相容性、骨传导性及骨诱导性。近年来由于可降解人工骨组织工程修复材料具有诸多优点,使其逐渐成为骨修复材料发展的方向。生物活性磷酸钙陶瓷含有CaO和P2O5两种成分,它们是构成人体骨组织的重要无机物质,植入人体后,其表面同人体组织可通过化学键的结合达到生物相容,是理想的骨修复材料。磷酸钙陶瓷材料主要包括羟基磷灰石(HA)和磷酸三钙(TCP)。羟基磷灰石(hydroxyapatite,HA)的化学式为Ca10(PO4)6(OH)2,是空间群为P63/m的六方晶系的结晶结构,晶格参数a=b=0.942/nm、c=0.6875nm,Ca/P元素比为1.67。HA在组成和结构与人骨和牙齿的无机质十分相似,但在体内的溶解速度较慢。TCP的成分与HA相比,其Ca、P元素比不同,其中β-TCP应用最广泛。β-TCP属于三方晶系,晶格常数理论密度为3.07g/cm3。空间群为R3C,钙磷原子比为1.5,是磷酸钙的一种高温相。β-TCP在水溶液和体液中的溶解度是HA的10~15倍,能缓慢被降解吸收。此过程中,磷酸钙陶瓷的降解为新骨形成提供更丰富的Ca、P,促进新骨组织生成,并逐步替换新骨组织。磷酸钙陶瓷支架在体内的降解速率和新骨的生长速率相匹配才能保证支架在体内的力学性能和新骨的正常生长,但是目前针对这类问题还没有一种很好的解决办法,这也是人工骨生物材料临床应用需要要解决的一大难题。
磷酸钙生物材料诱导成骨的作用受其组成及结构影响,通常TCP/HA双相多孔陶瓷比HA多孔陶瓷易于诱导成骨。物理特性如材料的孔隙率、孔径、孔隙分布及其是否贯通,以及机械性能等,对其骨诱导性影响也很大。Yuan等(YuanHP,et,al.J Mater Sci,Mater Med,2001;12(1)∶7)选择不同材料组成的磷酸钙陶瓷进行动物实验,认为具有相互贯通的大孔,并在大孔上有丰富的数微米至数十微米的微孔的陶瓷骨诱导性好。因此,可精准设计制造的微孔结构对磷酸钙陶瓷的骨诱导性起着关键的调控作用,虽然目前有很多工艺可以制造出多孔磷酸钙陶瓷,但传统的工艺方法无法保障微孔结构的精确设计制造,更不能对不同材料进行组合装配,无法实现降解速度的有效调控。
因此,提供一种可降解的骨组织工程支架,能保证微孔结构的精确设计制造,实现不同降解性能材料的组合装配,从而实现对植入体降解速度的有效调控,成为了本领域技术人员亟待解决的问题。
技术实现要素:
本发明解决的技术问题是:提供一种基于3D打印的降解可控骨组织工程支架,解决现有技术中骨缺损修复材料无法保障微孔结构的精确设计制造,不能对不同材料进行组合装配,无法实现对植入体降解速度的有效调控的问题。
本发明还提供了该基于3D打印的降解可控的骨组织工程支架的制备方法。
本发明采用的技术方案如下:
本发明所述的一种基于3D打印的降解可控骨组织工程支架,所述支架为多孔结构,孔隙率为60%~95%,孔壁支撑材料丝径为100μm~800μm,所述支架由同一种墨水打印而成,或者是由至少两种不同降解速率的墨水经不同的打印喷头打印而成。
进一步地,所述支架具有互相贯通的大孔,所述大孔内壁上富集有毛细微孔。
进一步地,所述大孔的孔径为50μm~1600μm,所述毛细微孔的孔径为500nm~10μm。
进一步地,所述支架为同一种原料配置的墨水打印而成时,其原料的总质量按100%计,包括以下组分:双相磷酸钙粉料40~60wt.%,水20~50wt.%,乙醇5~10wt.%,聚乙烯醇3~5wt.%,戊醇2~5wt.%;
所述支架为两种不同降解速率的墨水经不同的打印喷头打印时,每一种墨水的原料总质量按100%计,均包括单一钙粉料40~60wt.%,水50~20wt.%,乙醇5~10wt.%,聚乙烯醇3~5wt.%,戊醇2~5wt.%;所述单一钙粉料选自羟基磷灰石、磷酸三钙中的任意一种。
进一步地,所述双相磷酸钙粉料的质量按100%计,包括10~90wt%的羟基磷灰石和10~90wt%的磷酸三钙。
进一步地,所述羟基磷灰石和磷酸三钙的粉体粒径均为50nm~100μm。
本发明所述的一种基于3D打印的降解可控骨组织工程支架的制备方法,具体包括以下步骤:
步骤1:配制3D打印的墨水:按比例称取墨水原料的各组分,配制成同一种墨水含不同的原料质量配比,或者几种不同的墨水;
步骤2:3D打印:先通过建模软件中建立模型,然后结合分层软件对所建模型进行分层切片处理,并设置内部支撑的打印材料丝径、相邻喷丝的间距、以及相邻层的喷丝相交的角度,将设计好的三维模型输入三维喷印打印机中,并将打印墨水原料加入到三维打印机中,进行层层叠加打印精确成型目标胚体;
步骤3:将所述胚体煅烧,即得。
进一步地,步骤1中,配制几种不同的墨水时,每一种墨水对应一个打印喷头,通过不同的打印喷头打印,实现不同原料在所述支架的3D空间上面的材料间插打印组装或是梯度设计打印。
进一步地,所述打印速度为2~6mm/s。
进一步地,步骤3中,将所述胚体放入马弗炉中煅烧,以5℃/min的速率升温至600℃,在600℃保温2小时,随后以5℃/min升温到1100℃并在1100℃保温2小时,最后随炉冷却。
与现有技术相比,本发明具有以下有益效果:
本发明工艺简单,操作简便,能保证微孔结构的精确设计制造,实现对材料降解速度的有效调控。
本发明工艺简单,操作简便,通过3D打印能实现具有不同降解速率的原材料在三维空间上的任意组合装配,实现对植入体降解速度的有效调控。本发明通过将不同降解速度特性的原材料混合配置成为打印墨水,通过控制原材料组分比例可实现最终产品的降解速度控制;通过控制打印孔隙,特别是打印出来的每一条喷丝线的直径大小,可实现植入体降解速度的控制;通过双喷头,或是多喷头,可以实现不同组分原材料在支架3D空间上面的材料组装或是梯度设计打印,实现支架不同部位的降解速度控制。
本发明的骨组织工程支架材料具有相互连通的大孔和微小的毛细微孔结构,大孔有利于组织的长入和血管生长,微孔有利于营养物质交互、体液流通、成骨细胞在材料表面粘附、生长和分化。
本发明使用了三维打印(3D)快速成型技术,无多余切削废料产生,材料利用率大大优于传统减材制造工艺,具有较好经济效益。
本发明的工程支架的制备工艺过程中,无化学反应及有机溶剂参与,避免了有毒、有害物质对生物材料的污染。
本发明的工程支架具有良好的结构完整性和外形定制能力,可根据患者骨组织缺损修复需求,加工成各种形状,满足患者个性化医疗需求。
附图说明
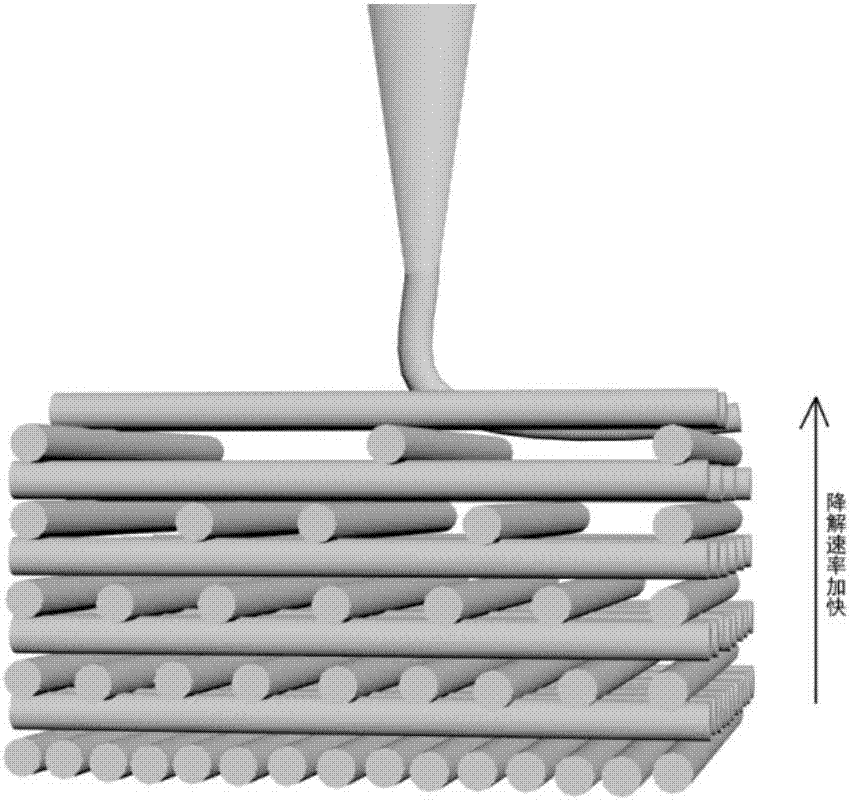
图1为实施例1中采用不同的原料配置墨水控制骨组织工程支架的降解行为示意图。
图2为采用不同的孔结构设计控制支架的降解行为示意图。
图3为采用不同的墨水原料,经不同喷头间插打印控制支架降解行为示意图。
图4为本发明实施例1中降解可控骨组织工程支架的显微孔结构SEM图,其中(a)为大孔SEM图,(b)为毛细微孔SEM图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,下面结合实施例,对本发明进行进一步详细说明。应当理解,此处的具体实施例仅用以解释本发明,并不用于限定本发明。本发明降解可控的骨组织工程支架用于修复人体硬骨组织的缺损,本发明的降解可控骨组织工程支架所采用的孔结构设计及材料组分配比不限于本发明所述方案。
实施例1-7为采用不同的原料配置墨水控制支架的降解行为:
实施例1
本实施例提供了降解可控骨组织工程支架的制备,具体为:
取羟基磷灰石(HA)作为原料1,磷酸三钙粉末(β-TCP)作为原料2,将原料1与原料2按质量比60:40的比例混合均匀,得到混合粉体。取聚乙烯醇10g,加水90ml溶解,配制成聚乙烯醇溶液。将20ml聚乙烯醇溶液均匀混入32.5g的混合粉体中,一边搅拌一边加入7ml的去离子水和6ml无水乙醇,直至搅拌均匀,得到打印墨水原料。其中,羟基磷灰石和磷酸三钙的粉体粒径均为50nm~100μm。
在建模软件中,建立10mm×10mm×3mm立方体,然后结合分层软件对所建模型进行分层切片处理,设置内部支撑的打印材料丝径为400μm,相邻喷丝的间距为800μm,相邻层的喷丝相交的角度为90°。将设计的三维模型转换为STL格式,输入三维喷印打印机中,设置打印速度为2mm/s,并将打印墨水原料加入到三维打印机中,进行层层叠加打印精确成型目标胚体。
最后将胚体放入马弗炉中煅烧,以5℃/min的速率升温至600℃,在600℃保温2小时,随后以5℃/min升温到1100℃并在1100℃保温2小时,最后随炉冷却,得到孔隙率为74.4%,孔径为400±20μm的双相磷酸钙陶瓷骨组织工程支架,支架的降解速度高于纯羟基磷灰石(HA)原料打印的支架,但是低于由纯磷酸三钙(β-TCP)打印的支架,这是因为混匀原料1和2之后,打印墨水降解速度体现出一种折中效应。
实施例2
本实施例提供了降解可控骨组织工程支架的制备。本实施例中支架的建模及烧结过程同实施例1,不同之处在于采用与实施例1中不同的配料方式进行3D打印墨水原料的配置,具体为:
取聚乙烯醇10g,加水90ml溶解,配制成聚乙烯醇溶液。将20ml聚乙烯醇溶液均匀加入32.5g的羟基磷灰石(HA)中,一边搅拌一边加入7ml的去离子水和6ml无水乙醇,直至搅拌均匀,得到打印墨水原料。其中,羟基磷灰石粉体粒径均为50nm~100μm。
然后以实施例1的模型3D打印及烧结成瓷,得到HA陶瓷骨组织工程支架。本实施例中支架的降解速度低于实施例1中的降解速度,这是因为本原料HA的降解速度低于实施例1中的混合材料。
实施例3
本实施例提供了降解可控骨组织工程支架的制备。本实施例中支架的建模及烧结过程同实施例1,不同之处在于采用与实施例1中不同的配料方式进行3D打印墨水原料的配置,具体为:
取聚乙烯醇10g,加水90ml溶解,配制成聚乙烯醇溶液。将20ml聚乙烯醇溶液均匀加入32.5g的磷酸三钙(β-TCP)中,一边搅拌一边加入7ml的去离子水和6ml无水乙醇,直至搅拌均匀,得到打印墨水原料。其中磷酸三钙的粉体粒径均为50nm~100μm。
然后以实施例1的模型3D打印及烧结成瓷,得到β-TCP陶瓷骨组织工程支架。本实施例中支架的降解速度高于实施例1中的降解速度,这是因为本原料β-TCP的降解速度高于实施例1中的混合材料。
实施例4
本实施例提供了降解可控骨组织工程支架的制备,与实施例1相比,本实施例中羟基磷灰石和磷酸三钙的质量比为50:50,其余条件均相同,最后得到孔隙率为74.4%,孔径为400±20μm的双相磷酸钙陶瓷骨组织工程支架。
支架的体内降解速率为实施例4>实施例1。其原因是支架植入体内的降解速率受打印墨水材料组分的影响,提高打印墨水材料中具有较高降解速率的β-TCP,可以控制提高最终打印支架材料的降解速率。
实施例5
本实施例提供了降解可控骨组织工程支架的制备,与实施例1相比,本实施例中羟基磷灰石(HA)和磷酸三钙(β-TCP)的质量比为40:60,其余条件均相同,最后得到孔隙率为74.4%,孔径为400±20μm的双相磷酸钙陶瓷骨组织工程支架。
支架的体内降解速率为实施例5>实施例4。其原因是支架植入体内的降解速率受打印墨水材料组分的影响,提高打印墨水材料中具有较高降解速率的β-TCP,可以控制提高最终打印支架材料的降解速率。
实施例6
本实施例与实施例1相比,打印墨水的配置不同,其余条件均相同。
打印墨水的取羟基磷灰石(HA)作为原料1,磷酸三钙粉末(β-TCP)作为原料2,将原料1与原料2按质量比60:40的比例混合均匀,得到混合粉体。其中,羟基磷灰石和磷酸三钙的粉体粒径均为50nm~100μm。
打印墨水原料总质量按100%计,混合粉体为60wt.%,水20wt.%,乙醇10wt.%,聚乙烯醇5wt.%,戊醇5wt.%;将上述组分混合均匀,即得打印墨水。
本实施例中支架的降解速度与实施例1中支架的降解速度无明显差异。
实施例7
本实施例与实施例1相比,打印墨水的配置不同,其余条件均相同。
打印墨水的取羟基磷灰石(HA)作为原料1,磷酸三钙粉末(β-TCP)作为原料2,将原料1与原料2按质量比60:40的比例混合均匀,得到混合粉体。其中,羟基磷灰石和磷酸三钙的粉体粒径均为50nm~100μm。
打印墨水原料总质量按100%计,混合粉体为40wt.%,水50wt.%,乙醇5wt.%,聚乙烯醇5wt.%;将上述组分混合均匀,即得打印墨水。
本实施例中支架的降解速度与实施例1中支架的降解速度无明显差异。
实施例8-10为采用不同的孔结构设计控制支架的降解行为的实施例:
实施例8
本实施例提供了降解可控骨组织工程支架的制备,具体为:
以实施例1中配料方式进行3D打印墨水原料的配置。
在建模软件中,建立10mm×10mm×3mm立方体,然后结合分层软件对所建模型进行分层处理,设置内部支撑的细丝直径为300μm,相邻两条丝的距离为800μm,相邻层的细丝相交的角度为90°。
后续的其余步骤同实施例1,最终得到孔隙率为80%,孔径为500±20μm的双相磷酸钙陶瓷骨组织工程支架。
本实施例支架的体内降解速率将高于实施例1中的双相磷酸钙骨组织工程支架,因为具有较小直径的内部微孔结构支撑具有更快的降解速率。
实施例9
本实施例提供了降解可控骨组织工程支架的制备,具体为:
以实施例1中配料方式进行3D打印墨水原料的配置。
在建模软件中,建立10mm×10mm×3mm立方体,然后结合分层软件对所建模型进行分层处理,设置内部支撑的细丝直径为300μm,相邻两条丝的距离为1000μm,相邻层的细丝相交的角度为90°。
后续的其余步骤同实施例1,得到孔隙率为82%,孔径为700±20μm的双相磷酸钙陶瓷骨组织工程支架。
支架的体内降解速率为实施例7>实施例6>实施例1。其中降解可控原理如图2所示,由于支架植入体内的降解速率受材料微孔结构的影响,支撑材料的直径越细、孔间距越大,其降解速度越快,反之进行孔结构设计打印则可控制其降解速度减缓。
实施例10
本实施例提供了降解可控骨组织工程支架的制备,具体为:
以实施例1中配料方式进行3D打印墨水原料的配置。
在建模软件中,建立10mm×10mm×3mm立方体,然后结合分层软件对所建模型进行分层处理,设置内部支撑的细丝直径为250μm,相邻两条丝的距离为800μm,相邻层的细丝相交的角度为90°。设置打印速度为5mm/s,后续的其余步骤同实施例1,得到孔隙率为85%,孔径为500±20μm的双相磷酸钙陶瓷骨组织工程支架。
支架的体内降解速率为实施例8>实施例7>实施例6>实施例1。其中降解可控原理如图2所示,由于支架植入体内的降解速率受材料微孔结构的影响,支撑材料的直径越细、孔间距越大,其降解速度越快,反之进行孔结构设计打印则可控制其降解速度减缓。
实施例11-13为采用不同的墨水原料,经不同喷头间插打印控制支架降解行为的实施例:
实施例11
本实施例提供了降解可控骨组织工程支架的制备,软件建模及陶瓷烧结过程均如同实施例1,不同之处在于采用双喷头梯度打印具有不同降解速率的墨水材料。具体为:
取聚乙烯醇10g,加水90ml溶解,配制成聚乙烯醇溶液。
打印墨水1的配制:取羟基磷灰石(HA)32.5g,加入20ml聚乙烯醇溶液,一边搅拌一边加入7ml的去离子水和6ml无水乙醇,直至搅拌均匀,得到打印墨水1。
打印墨水2的配制:取磷酸三钙粉末(β-TCP)32.5g,加入20ml聚乙烯醇溶液,一边搅拌一边加入7ml的去离子水和6ml无水乙醇,直至搅拌均匀,得到打印墨水2。
本实施例中采用打印墨水1由喷头1控制,打印墨水2由喷头2控制,打印支架为如图3所示的梯度降解速率支架,其中支架的上部降解速度大于支架底部,这是因为支架上部采用了降解速率较快的β-TCP墨水打印。
实施例12
本实施例提供了降解可控骨组织工程支架的制备,具体为:
以实施例11中配料方式进行3D打印墨水原料的配置,得到2种不同的打印墨水,软件建模及陶瓷烧结过程均如同实施例1,不同之处在于采用双喷头梯度打印结构设置不同。
本实施例中,打印墨水1由喷头1控制,打印墨水2由喷头2控制。支架中间层间隔材料交替打印时,喷头1控制打印2行,间插有喷头2打印间插1行,即喷头1:喷头2打印数目占比为2:1,打印支架最终体现出中间双喷头间插打印层具有比实施例9中略低的降解速度,实施例10<实施例9,这是因为该层中的具有较缓降解速率的HA材料占比高于实施例9。
实施例13
本实施例提供了降解可控骨组织工程支架的制备,具体为:
以实施例11中配料方式进行3D打印墨水原料的配置,得到2种不同的打印墨水,软件建模及陶瓷烧结过程均如同实施例1,不同之处在于采用双喷头梯度打印结构设置不同,软件建模及陶瓷烧结过程均如同实施例1。
本实施例中,打印墨水1由喷头1控制,打印墨水2由喷头2控制。支架中间层间隔材料交替打印时,喷头1控制打印1行,间插有喷头2打印间插2行,即喷头1:喷头2打印数目占比为1:2,打印支架最终体现出中间双喷头间插打印层具有比实施例9中略高的降解速度,降解速度为实施例11>实施例9>实施例10,这是因为该层中的具有较缓降解速率的HA材料占比低于实施例9。
上述实施例仅为本发明的优选实施方式之一,不应当用于限制本发明的保护范围,但凡在本发明的主体设计思想和精神上作出的毫无实质意义的改动或润色,其所解决的技术问题仍然与本发明一致的,均应当包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!