一种水合淫羊藿素纳米粒及其制备方法和应用与流程
本发明涉及医药技术领域,具体涉及一种水合淫羊藿素纳米粒及其制备方法和应用。
背景技术:
水合淫羊藿素(hydrousicaritin,hict,式a),分子式c21h22o7,分子量386.4,是从淫羊藿中分离得到的黄酮类化合物,与脱水淫羊藿素(式b)化学结构相似,具体结构如下:
然而,与大量文献对脱水淫羊藿素的活性进行报道不同,目前为止只有少数文献对hict的活性进行了研究。据报道,在肿瘤周围隔天注射10mg/kg的hict的二甲基亚砜(dmso)溶液,可以显著抑制肾癌的生长(li,s.,etal.,icaritininhibitsjak/stat3signalingandgrowthofrenalcellcarcinoma.plosone,2013,8.);腹腔内注射30mg/kg的hict/dmso溶液(每周5次),可以通过抑制促炎细胞因子有效地推迟前列腺癌的进展并显著增加小鼠存活率(hu,j.,etal.,2016.anovelanticanceragenticaritininhibitedproinflammatorycytokinesintrampmice.inturolnephrol,48,1649-55.)。
但是,同许多黄酮类化合物一样,hict水溶性差,从而导致其生物利用度低,难以给药。现有文献的给药方式主要是hict/dmso溶液,但是以dmso为溶剂的药物溶液,可以用于动物实验,而不能口服或注射应用于人体和临床;即便在用于动物实验的情况下,由于hict/dmso溶液进入消化道被消化液稀释、腹腔注射被腹腔液稀释或静脉注射被血液稀释后,可能会析出药物结晶等,所得的实验结果也仅具有参考价值,这极大地限制了hict的体内研究和进一步的临床应用。
技术实现要素:
本发明的目的在于提供一种水合淫羊藿素纳米粒,本发明提供的水合淫羊藿素纳米粒稳定性好,且具有优异的抗肿瘤效果,能够用于制备抗肿瘤药物。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种水合淫羊藿素纳米粒,包括水合淫羊藿素和稳定剂,所述稳定剂包括聚乙二醇-聚乳酸、甲氧基聚乙二醇-聚乳酸、聚乙二醇-聚己内酯、甲氧基聚乙二醇-聚己内酯、维生素e-甲氧基聚乙二醇琥珀酸酯、甲氧基聚乙二醇磷脂、人血清白蛋白、大豆卵磷脂、苄泽58、油酸钠、油酸和泊洛沙姆中的一种或几种。
优选地,所述泊洛沙姆包括泊洛沙姆p188、泊洛沙姆p407、泊洛沙姆p124、泊洛沙姆p237和泊洛沙姆p338中的一种或几种。
优选地,所述水合淫羊藿素和稳定剂的质量比为1:(0.02~10)。
优选地,所述水合淫羊藿素纳米粒的粒径为10~1000nm。
本发明提供了上述技术方案所述水合淫羊藿素纳米粒的制备方法,包括以下步骤:
将水合淫羊藿素、稳定剂、有机溶剂和水混合,得到前驱体溶液;
去除所述前驱体溶液中的有机溶剂,得到水合淫羊藿素纳米粒。
优选地,去除所述前驱体溶液中的有机溶剂后还包括均质,所述均质的压力为300~2000bar,均质的次数为1~30次。
优选地,所述前驱体溶液中水合淫羊藿素的浓度为0.01~100mg/ml;有机溶剂和水的体积比为1:(1~100)。
优选地,所述有机溶剂为第一有机溶剂,或者为第一有机溶剂和第二有机溶剂的混合物;所述第一有机溶剂包括甲醇、乙醇、丙酮、二甲基亚砜和n,n-二甲基甲酰胺中的一种或几种,所述第二有机溶剂包括乙酸乙酯、二氯甲烷和三氯甲烷中的一种或几种。
本发明提供了上述技术方案所述水合淫羊藿素纳米粒或上述技术方案所述制备方法制备得到的水合淫羊藿素纳米粒在制备抗肿瘤、抗炎、抗氧化、心脑血管保护或神经保护药物中的应用。
优选地,所述药物中水合淫羊藿素纳米粒的含量为5~95%。
本发明提供了一种水合淫羊藿素纳米粒,包括水合淫羊藿素和稳定剂,所述稳定剂包括聚乙二醇-聚乳酸、甲氧基聚乙二醇-聚乳酸、聚乙二醇-聚己内酯、甲氧基聚乙二醇-聚己内酯、维生素e-甲氧基聚乙二醇琥珀酸酯、甲氧基聚乙二醇磷脂、人血清白蛋白、大豆卵磷脂、苄泽58、油酸钠、油酸和泊洛沙姆中的一种或几种。本发明采用所述种类的稳定剂使水不溶的水合淫羊藿素药物以纳米大小的微粒形式能够均匀分散在水相中,解决了其难溶、难给药的问题,能提高其生物利用度,以所述水合淫羊藿素纳米粒为基础,可通过现代制剂工艺进一步制备成临床上常见的多种剂型,从而满足多种临床用药需要。同时,所述稳定剂能够改善水合淫羊藿素的生物活性,进一步提高其生物利用度。
附图说明
图1为实施例1制备的hict-nps的粒径分布图;
图2为实施例1制备的hict-nps的透射电镜形貌图;
图3为实施例1制备的hict-nps冻干粉、维生素e-mpeg1000琥珀酸酯、hict原料药以及hict原料药与维生素e-mpeg1000琥珀酸酯的物理混合物的x射线衍射图谱;
图4为实施例1制备的hict-nps冻干粉、维生素e-mpeg1000琥珀酸酯、hict原料药以及hict原料药与维生素e-mpeg1000琥珀酸酯的物理混合物的差示扫描量热图谱;
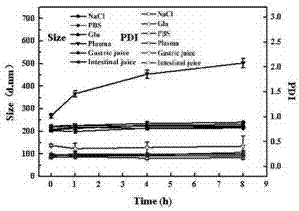
图5为实施例1制备的hict-nps与各种生理介质37℃孵育8h过程中粒径和pdi变化图;
图6为实施例1中不同hict浓度条件下的溶血率对比图;
图7为实施例1制备的hict-nps在含0.5%吐温80的pbs缓冲溶液中的体外释放行为曲线;
图8为实施例1制备的hict-nps和hict-dmso溶液给药48h后对不同细胞的细胞毒性图;
图9为实施例1制备的dir-hict-nps的粒径分布图;
图10为实施例1制备的dir-hict-nps给药12h后在mcf-7荷瘤小鼠主要脏器中的分布情况对比图;
图11为实施例1制备的hict-nps对mcf-7荷瘤裸鼠药效学实验中小鼠肿瘤体积随时间变化曲线;
图12为实施例1制备的hict-nps对mcf-7荷瘤裸鼠药效学实验中小鼠体重随时间变化曲线;
图13为实施例1制备的hict-nps对mcf-7荷瘤裸鼠药效学实验结束后对各组小鼠解剖所得的肿瘤组织实物图;
图14为实施例1制备的hict-nps不同给药剂量下小鼠体重随时间变化曲线。
具体实施方式
本发明提供了一种水合淫羊藿素纳米粒,包括水合淫羊藿素和稳定剂,所述稳定剂包括聚乙二醇-聚乳酸、甲氧基聚乙二醇-聚乳酸、聚乙二醇-聚己内酯、甲氧基聚乙二醇-聚己内酯、维生素e-甲氧基聚乙二醇琥珀酸酯、甲氧基聚乙二醇磷脂、人血清白蛋白、大豆卵磷脂、苄泽58、油酸钠、油酸和泊洛沙姆中的一种或几种。本发明采用所述种类的稳定剂使水不溶的水合淫羊藿素药物以纳米大小的微粒形式能够均匀分散在水相中,解决了其难溶、难给药的问题,能提高其生物利用度,以所述水合淫羊藿素纳米粒为基础,可通过现代制剂工艺进一步制备成临床上常见的多种剂型,从而满足多种临床用药需要。同时,所述稳定剂能够改善水合淫羊藿素的生物活性,进一步提高其生物利用度。
在本发明中,所述聚乙二醇-聚乳酸(peg-pla)或甲氧基聚乙二醇-聚乳酸(mpeg-pla)中,pla片段的分子量独立地优选为800~20000,进一步优选为1000~5000,更进一步优选为2000;peg或mpeg片段的分子量优选为800~20000,进一步优选为1000~5000,更进一步优选为2000。在本发明的实施例中,具体是采用mpeg2000-pla2000、mpeg5000-pla5000、mpeg5000-pla2000或mpeg5000-pla5000。
在本发明中,所述聚乙二醇-聚己内酯(peg-pcl)或甲氧基聚乙二醇-聚己内酯(mpeg-pcl)中,pcl片段的分子量独立地优选为800~20000,进一步优选为1000~5000,更进一步优选为2000;peg或mpeg片段的分子量优选为800~20000,进一步优选为1000~5000,更进一步优选为2000。在本发明的实施例中,具体是采用mpeg2000-pcl2000或mpeg5000-pcl5000。
在本发明中,所述维生素e-甲氧基聚乙二醇琥珀酸酯(维生素e-mpeg琥珀酸酯)中,mpeg片段的分子量优选为500~10000,进一步优选为1000~5000,更进一步优选为1000~2000。在本发明的实施例中,具体是采用维生素e-mpeg2000琥珀酸酯或维生素e-mpeg2000琥珀酸酯。
在本发明中,所述甲氧基聚乙二醇磷脂(mpeg-dspe)中,mpeg片段的分子量优选为500~10000,进一步优选为1000~5000,更进一步优选为2000。在本发明的实施例中,具体是采用mpeg2000-dspe。
在本发明中,所述泊洛沙姆优选包括泊洛沙姆p188、泊洛沙姆p407、泊洛沙姆p124、泊洛沙姆p237和泊洛沙姆p338中的一种或几种。
在本发明中,所述水合淫羊藿素和稳定剂的质量比优选为1:(0.02~10),更优选为1:(0.1~8),进一步优选为1:(0.1~6),最优选为1:(0.1~1)。
在本发明中,所述水合淫羊藿素纳米粒的粒径优选为10~1000nm,更优选为50~800nm,进一步优选为100~600nm,最优选为100~300nm。
本发明提供了上述技术方案所述水合淫羊藿素纳米粒的制备方法,包括以下步骤:
将水合淫羊藿素、稳定剂、有机溶剂和水混合,得到前驱体溶液;
去除所述前驱体溶液中的有机溶剂,得到水合淫羊藿素纳米粒。
本发明将水合淫羊藿素、稳定剂、有机溶剂和水混合,得到前驱体溶液。在本发明中,所述前驱体溶液中水合淫羊藿素的浓度优选为0.01~100mg/ml,更优选为0.1~50mg/ml,最优选为1~30mg/ml。在本发明中,所述有机溶剂优选为第一有机溶剂,或者为第一有机溶剂和第二有机溶剂的混合物;所述第一有机溶剂优选包括甲醇、乙醇、丙酮、二甲基亚砜和n,n-二甲基甲酰胺中的一种或几种,所述第二有机溶剂优选包括乙酸乙酯、二氯甲烷和三氯甲烷中的一种或几种。在本发明中,所述有机溶剂更优选为二甲基亚砜、n,n-二甲基甲酰胺、甲醇-丙酮体系、乙醇-丙酮体系、乙醇-三氯甲烷-丙酮体系或甲醇-三氯甲烷-丙酮体系;当所述有机溶剂为上述具体种类有机溶剂的混合物时,本发明对于各组分的含量没有特殊的限定,采用任意配比均可。在本发明中,所述有机溶剂和水的体积比优选为1:(2~100),更优选为1:(2~20),最优选为1:(3~10)。
本发明优选根据所述稳定剂的水溶性,将所述稳定剂分为水溶性稳定剂和水不溶性稳定剂;所述水溶性稳定剂优选包括人血清白蛋白、苄泽58、油酸钠、油酸或泊洛沙姆,所述水不溶性稳定剂优选包括甲氧基聚乙二醇-聚乳酸、甲氧基聚乙二醇-聚己内酯、维生素e-甲氧基聚乙二醇琥珀酸酯、甲氧基聚乙二醇磷脂或大豆卵磷脂。
本发明优选根据所述稳定剂的水溶性选择各物料的混合方式,具体的,当所述稳定剂为一种或几种水溶性稳定剂时,本发明优选将所述水溶性稳定剂溶于水中得到水相,将水合淫羊藿素溶于有机溶剂中得到有机相,将所述有机相加入到所述水相中,得到前驱体溶液;当所述稳定剂为一种或几种水不溶性稳定剂时,本发明优选将所述水不溶性稳定剂和水合淫羊藿素溶于有机溶剂中得到有机相,将所述有机相加入到水中,得到前驱体溶液;当所述稳定剂为一种或几种水溶性稳定剂和一种或几种水不溶性稳定剂的混合物时,本发明优选将所述水溶性稳定剂溶于水中得到水相,将水不溶性稳定剂和水合淫羊藿素溶于有机溶剂中得到有机相,将所述有机相加入到所述水相中,得到前驱体溶液。
本发明对于所述有机相的加入方式和加入速率没有特殊的限定,采用本领域技术人员熟知的滴加方式和加入速率即可,可逐滴加入,也可通过蠕动泵连续注入。在本发明中,所述有机相的加入过程优选在超声或搅拌的条件下进行;本发明对于所述超声和搅拌没有特殊的限定,采用本领域技术人员熟知的超声和搅拌的技术方案即可。在本发明中,所述超声的频率优选为200~300hz,更优选为250hz;温度优选为12~60℃,更优选为25~40℃;时间优选为1~60min,更优选为10~30min。在本发明中,所述搅拌的转速优选为50~2000rpm,更优选为200~1000rpm;温度优选为0~80℃,更优选为15~40℃;时间优选为1~180min,更优选为5~120min,最优选为5~30min。
得到前驱体溶液后,本发明去除所述前驱体溶液中的有机溶剂,得到水合淫羊藿素纳米粒(hictnanoparticles,hict-nps)。本发明对于去除所述前驱体溶液中有机溶剂的方法没有特殊的限定,采用本领域技术人员熟知的去除有机溶剂的技术方案即可,具体如离心或减压旋转蒸发。在本发明中,当采用离心的方式去除有机溶剂时,所述前驱体溶液中的水也会一并去除,离心后所得沉淀即为水合淫羊藿素纳米粒,可以直接分散到相应体系中进行使用;当采用减压旋转蒸发的方式去除有机溶剂时,所述前驱体溶液中的水不会去除,所得分散体系中包括水合淫羊藿素纳米粒和水,本发明优选不将所述水合淫羊藿素纳米粒进一步分离,直接以所述分散体系的形式进行使用或进一步处理,具体的处理方式在后续详述。
在本发明中,去除所述前驱体溶液中的有机溶剂后优选还包括均质。在本发明中,所述均质的温度优选为4~80℃,更优选为15~50℃,最优选为20~35℃;在本发明的实施例中,具体是在室温下进行所述均质。在本发明中,所述均质的压力优选为300~2000bar,更优选为500~1500bar,最优选为800~1500bar;均质的次数优选为1~30次,更优选为5~25次,最优选为5~10次。在本发明中,当采用离心的方式去除有机溶剂时,所述前驱体溶液中的水也会一并去除,本发明优选将离心后所得沉淀与水混合后再进行均质;当采用减压旋转蒸发的方式去除有机溶剂时,所述前驱体溶液中的水不会去除,本发明优选将减压旋转蒸发后所得剩余物进行均质。
本发明优选根据所需水合淫羊藿素纳米粒的粒径大小,选择是否需要均质以及均质的具体条件。在本发明中,当体系中水合淫羊藿素浓度较低时,单位体积内药物分子的量较少,分子之间发生碰撞聚集的概率急剧减少,进而使得水合淫羊藿素纳米粒能够以更小的粒径分散在分散介质当中,故而不用再次采用高压均质。在本发明中,当体系中水合淫羊藿素浓度较高时,则需要通过均质减小合淫羊藿素纳米粒的粒径,具体的,在均质初始阶段,伴随着空穴效应在单位体积内产生的高速剪切力,大小不均的水合淫羊藿素纳米粒会被剪切成大小均一的纳米粒;但是当粒径降到一定范围后,纳米粒的自由能变大,这时再次增加均质次数,会促进粒子之间的碰撞,反而使得粒子之间又重新聚合,造成粒径升高。采用本发明提供的上述均质条件,能够保证水合淫羊藿素纳米粒具有合适的粒径范围。
在本发明中,所述均质完成后,所得分散体系中包括水合淫羊藿素纳米粒和水;本发明优选不将所述水合淫羊藿素纳米粒进一步分离,直接以所述分散体系的形式进行使用或进一步处理,具体的处理方式在后续详述。
本发明提供了上述技术方案所述水合淫羊藿素纳米粒或上述技术方案所述制备方法制备得到的水合淫羊藿素纳米粒在制备抗肿瘤、抗炎、抗氧化、心脑血管保护或神经保护药物中的应用,优选为在制备抗肿瘤药物中的应用。
在本发明中,所述药物中水合淫羊藿素纳米粒的含量优选为5~95%,更优选为10~80%,进一步优选为50~75%;其中,所述水合淫羊藿素纳米粒的含量以水合淫羊藿素的质量计。本发明对于所述药物的剂型没有特殊的限定,采用本领域技术人员熟知的剂型即可。在本发明中,所述药物的剂型由所述有机溶剂和稳定剂的种类决定,具体的,如以dmso为溶剂、以维生素e-mpeg1000琥珀酸酯为稳定剂制备的水合淫羊藿素纳米粒适合口服给药、注射给药(包括静脉注射给药)和外用,以丙酮-三氯甲烷-乙醇体系(有机溶剂为丙酮、三氯甲烷和乙醇,稳定剂为上述技术方案所述任意稳定剂)、丙酮-乙醇体系(有机溶剂为丙酮和乙醇,稳定剂为上述技术方案所述任意稳定剂)、丙酮-甲醇体系(有机溶剂为丙酮和甲醇,稳定剂为上述技术方案所述任意稳定剂)制备的水合淫羊藿素纳米粒适合口服给药、注射给药(包括静脉注射给药)和外用。
在本发明中,所述药物的剂型优选包括固体剂型、半固体剂型、液体剂型或气体剂型,更优选包括但不限于片剂、丸剂、糖锭剂、胶囊剂、栓剂、乳膏剂、软膏剂、气雾剂、散剂、乳剂、混悬剂、糖浆剂、注射剂或其它适于经直肠、鼻内、肺部、阴道内、外部(局部)、口服或肠胃外(包括皮下、植入、静脉内和肌内)给药的药物剂型,最优选为注射剂或混悬剂。
在本发明中,所述注射剂中优选包括水相分散介质,所述水相分散介质优选为用高浓度的氯化钠、葡萄糖或磷酸缓冲液调成生理盐水(0.9%氯化钠)、5%葡萄糖或磷酸缓冲液(pbs溶液)生理等渗体系,供静脉注射用;口服给药时可不必调等渗。
在本发明中,当所述水合淫羊藿素纳米粒在水分散介质中使用时,具体是将上述技术方案所述均质后得到的分散体系直接使用,即所述均质完成后,无需将所得分散体系中水和水合淫羊藿素纳米粒分离,直接将所述分散体系与其它所需水分散介质混合后使用。
为了便于长时间储存,本发明优选将所述水合淫羊藿素纳米粒与冻干保护剂混合后进行冷冻干燥备用,待使用前根据实际需要加水性介质振荡,即可重新分散成水合淫羊藿素纳米粒;在本发明中,具体是将上述技术方案所述均质后得到的分散体系与冻干保护剂混合后进行冷冻干燥。本发明对于所述冻干保护剂的种类没有特殊的限定,采用本领域技术人员熟知的冻干保护剂即可,具体如聚乙烯吡咯烷酮(pvp)、peg、乳糖、葡萄糖、海藻糖和甘露醇中的一种或几种。本发明对于所述冻干保护剂的使用量没有特殊的限定,采用本领域技术人员熟知的使用量即可,在本发明中,所述水合淫羊藿素纳米粒的质量以所述水合淫羊藿素的质量计,所述水合淫羊藿素纳米粒的质量与冻干保护剂的用量比优选为1:(0.2~10),更优选为1:(1~5)。
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
以下实施例中,若如特殊说明,所述hict-nps的浓度或者是含有hict-nps的分散体系中hict-nps的浓度,均是以hict的浓度计。
实施例1
将20mghict、20mg维生素e-mpeg1000琥珀酸酯溶于1mldmso作为有机相;1000r/min磁力搅拌条件下将所述有机相滴加到10ml水中,13000r/min离心20min,沉淀用10ml去离子水超声分散20min,2000bar均质10次,得到水合淫羊藿素纳米粒(hict-nps)。
1、对所述hict-nps进行表征,具体如下:
(1)粒径、多分散性指数(pdi)、zeta电位考察
采用zetasizernanozs型粒度仪,通过动态光散射(dynamiclightscattering,dls)原理,在25℃条件下测定所述hict-nps的粒径分布及zeta电位,每份样品平行测定3次。
图1为所述hict-nps的粒径分布图(n=3,mean±sd),结果显示,平均粒径为(201.7±1.3)nm,pdi为0.17±0.07,表明所述hict-nps的粒径分布较集中;zeta电位为(-22.9±0.6)mv,较高的电位值表明样品具有良好的物理稳定性。
(2)载药量测定
将hict-nps冻干成固体粉末,精密称取所得冻干粉(质量记为w),并加入9倍体积(9ml/g)的甲醇(体积记为v)溶解,13000r/min离心10min,取上清进液相测hict浓度(浓度记为c),平行3次实验,按下式计算载药量:
载药量=c·v/w×100%
结果显示,hict-nps平均载药量为(41.08±0.19)%,载药量是评价药物制剂质量优劣的重要参数,较高的载药量降低了使用大量辅料的安全隐患,提高了药物制剂的安全性。
(3)透射电镜观察
将hict-nps稀释到浓度为100μg/ml,取6.0μl滴到300目铜网上,静置5min,用滤纸吸干多余液体,室温放置10min后,滴加6.0μl质量浓度为2%的醋酸铀于铜网上染色90s,用滤纸吸去多余液体,室温自然晾干,透射电镜下加速电压为120kv观察hict-nps的形态和大小。
图2为所述hict-nps的透射电镜形貌图,结果显示,所述hict-nps的粒径分布均匀,呈球形,粒径大约在150nm左右,比动态光散射法测得的粒径略小,原因是透射电镜中检测的是干燥之后hict-nps的粒径,而动态光散射法检测的是hict-nps的水化半径,所以检测方法针对对象的差异导致两种方法检测结果不一致。
(4)x射线衍射分析
将hict-nps冻干成固体粉末,然后将所得冻干粉与维生素e-mpeg1000琥珀酸酯、hict原料药、hict原料药和维生素e-mpeg1000琥珀酸酯的物理混合物(1:1,w/w)于dx-2700x射线衍射仪下分析x衍射图谱;检测参数为100ma、40kv,扫描范围2θ为3~80°。
图3为所述hict-nps冻干粉、维生素e-mpeg1000琥珀酸酯、hict原料药以及hict原料药与维生素e-mpeg1000琥珀酸酯的物理混合物的x射线衍射图谱,结果显示,hict原料药呈现明显的晶型衍射峰,表明hict原料药以晶型态存在,hict-nps冻干粉的衍射图谱与物理混合物和hict原料药有所差异,说明在制备hict-nps的过程中可能有部分hict的晶型发生改变。
(5)差示扫描量热分析
采用q200型差示扫描量热仪对hict-nps冻干粉、hict原料药、维生素e-mpeg1000琥珀酸酯、hict原料药和维生素e-mpeg1000琥珀酸酯的物理混合物(1:1,w/w)进行差示量热分析,操作如下:精密称取8mg样品于标准铝盘中,密封后在氮气保护环境下按照10℃·min-1的速率,在0~500℃范围内进行分析。
图4为所述hict-nps冻干粉、维生素e-mpeg1000琥珀酸酯、hict原料药以及hict原料药与维生素e-mpeg1000琥珀酸酯的物理混合物的差示扫描量热图谱,结果显示,hict原料药和物理混合物在240℃处出现熔点峰,这是hict的熔点;然而,hict-nps冻干粉表现出两个熔点峰,分别在164.7℃和210.5℃,表明制备过程中hict的晶型发生改变,与xrd结果一致。
(6)hict-nps生理介质稳定性考察
配制人工胃液:含1%胃蛋白酶的1mol/l的稀盐酸;
配制人工肠液:含1%胰蛋白酶的ph值为6.8的pbs(0.01m)缓冲液。
将制备的hict-nps分别与质量浓度为1.8%的nacl溶液、10%的葡萄糖和二倍浓度的pbs缓冲液(0.02m)等体积混合,与血浆、人工胃液和人工肠液按1:4(v/v)混合,37℃孵育8h,特定时间点测水合淫羊藿素纳米粒的粒径,每个样品重复3次。
图5为所述hict-nps与各种生理介质37℃孵育8h过程中粒径和pdi变化图(mean±sd,n=3),结果显示,37℃孵育8h,在生理盐水、pbs缓冲液、等渗葡萄糖中hict-nps的粒径几乎不变,可以稳定存在;同时,在与人工胃液和人工肠液的孵育过程中,未出现聚沉和明显的粒径增大,表明hict-nps满足灌胃给药的需求;在与血浆混合孵育8h后,hict-nps的粒径增大至500nm左右,但是未观察到明显的聚沉现象并且状态澄清,表明hict-nps可以相对稳定地存在于血浆中。综上,hict-nps在各种生理介质中的稳定性良好。
(7)hict-nps溶血性考察
新鲜配制4%红细胞悬浮液:将现取的老鼠血液5000rpm离心5min,弃去上清,用生理盐水反复洗涤沉淀至上清澄清,将底部的红细胞用生理盐水稀释至4%的体积浓度,得到4%红细胞悬浮液备用。
将所述4%红细胞悬浮液与去离子水按照体积比1:1混合,作为阳性对照组;将所述4%红细胞悬浮液与生理盐水按照体积比1:1混合,作为阴性对照组;将所述4%红细胞悬浮液与等渗的不同浓度的hict-nps按照体积比1:1混合,作为实验组;不同浓度的hict-nps与去离子水按照体积比1:1混合,作为对照组。将各组混合液37℃孵育4h,5000rpm离心5min,取上清测定光密度(od)值,按下式计算溶血率:
溶血率=(od实验组-od对照组-od阴性对照)/(od阳性对照-od阴性对照)×100%
图6为不同hict浓度条件下的溶血率对比图(mean±sd,n=3),结果显示,hict-nps浓度为1mg/ml和2mg/ml时,不存在溶血现象;浓度为4mg/ml时,溶血率仅为1%;当浓度达到6mg/ml时,溶血率达到9%。而溶血率低于5%时,静脉注射给药视为安全。综上,静脉注射低浓度hict-nps是安全的,当需要静脉注射高浓度hict-nps时,须降低注射速度以确保安全性。
2、hict-nps体外释放行为考察
将4mlhict-nps(200μg/ml)和hict粗粉混悬液(即hict原料药分散于去离子水中)分别加入到截留分子量为20kda的即用型透析袋中,置于1l含0.5%吐温80的pbs缓冲溶液中进行释放,释放温度为37℃,转速100r/min,平行实验3份;于不同时间点取50μl释放内液,同时补充相应体积的释放介质,每24h更换一次释放外液;向取出的释放内液中加入450μl甲醇并混匀,13000r/min离心20min,上清液用hplc测定药物浓度,计算累计释放率。
图7为所述hict-nps在含0.5%吐温80的pbs缓冲溶液中的体外释放行为曲线,结果显示,hict-nps前2h药物释放了9.15%,这可能是由于少量的hict吸附在水合淫羊藿素纳米粒的表面所导致;之后,hict-nps稳定持续释放至144h,累积释放率为77.5%,呈现一级释放模式。然而,在144h的释放过程中,hict粗粉混悬液未检测到药物释放。hict-nps相比于hict粗粉混悬液大大促进了药物的释放,原因在于hict-nps粒径小,有更小的扩散层厚度,比表面积大,与释放介质的接触面积增大,使其溶出速率显著加快;另外,hict-nps中hict以亚稳状态存在,产生更大的内能,增强分子运动,从而加快药物释放。
3、mtt法评价所述hict-nps体外细胞毒性
(1)细胞培养
mcf-7细胞株:dmem培养基(含10%胎牛血清,100单位/ml的青霉素和链霉素),透气、37℃、5%co2培养。
mda-mb-453细胞株:l15培养基(含10%胎牛血清,100单位/ml的青霉素和链霉素),封口、37℃、5%co2培养。
4t1细胞株:rpmi1640培养基(含10%胎牛血清,100单位/ml的青霉素和链霉素),透气、37℃、5%co2培养。
plc/prf/5和hepg2细胞株:mem培养基(含10%胎牛血清,100单位/ml的青霉素和链霉素),透气、37℃、5%co2培养。
huvec细胞株:f12培养基(含10%胎牛血清,100单位/ml的青霉素和链霉素),透气、37℃、5%co2培养。
(2)mtt实验
将对数生长期mcf-7、mda-mb-453、4t1、plc/prf/5、hepg2、huvec细胞以8000个/孔接种于96孔板,37℃、5%co2培养24h后,弃去培养基。分别加入150μl的hict-nps和150μl的hict-dmso溶液,每个样品的药物设不同的浓度(用含1%双抗的培养基稀释),作为实验组;对照组加入相同体积的含1%双抗的培养基。继续培养48h后,每孔加入5mg/ml的mtt溶液20μl,孵育4h。弃去上清液,每孔加入150μldmso,于微孔板振荡器上振荡10min,使结晶物溶解均匀,用酶标仪检测od值(测定波长为570nm),按照下式计算细胞存活率:
细胞存活率=od值实验组/od值对照组×100%
通过graphpadprism5软件计算细胞的ic50值,使用ibmspssstatistics19软件分析统计学差异。
图8为所述hict-nps和hict-dmso溶液给药48h后对不同细胞的细胞毒性图(mean±sd,*p<0.05;**p<0.01;***p<0.001),结果显示,hict-nps和hict-dmso溶液抑制细胞的增殖,并且呈现剂量依赖性。对于癌细胞,hict-nps较hict-dmso溶液呈现更强的抑制作用;对于人脐静脉内皮细胞,hict-nps和hict-dmso溶液的抑制作用相当(ic50分别为41.84±8.97μg/ml和59.26±11.62μg/ml,p>0.05),表明将hict制备成纳米粒后可显著提高其对肿瘤细胞的细胞毒性。
表1hict-nps和hict-dmso溶液对不同细胞的ic50值(mean±sd)
*p<0.05;***p<0.001(相对hict-dmso溶液)
表1为所述hict-nps和hict-dmso溶液对不同细胞的ic50值(mean±sd),由表1可知,hict-nps对于肿瘤细胞的细胞毒性较hict-dmso溶液提高2.5~21倍,这可能是因为肿瘤细胞对于hict-nps具有非特异性吸附,并且可以通过内吞作用促进hict-nps的内在化,从而增加对药物的摄取,提高其细胞毒性。
在考察的肿瘤细胞中,mct-7(人乳腺癌细胞)对hict-nps最敏感(ic50=2.24±0.54μg/ml),故首选mcf-7细胞作为后续体内研究模型。
4、所述hict-nps在mcf-7荷瘤裸鼠体内组织分布实验
(1)dir标记的水合淫羊藿素纳米粒的制备
将20mghict、20mg维生素e-mpeg1000琥珀酸酯和0.5mgdir溶解于1mldmso中作为有机相;250hz超声频率条件下将所述有机相滴加到10ml水中,13000r/min离心20min,所得沉淀与10ml去离子水混合,2000bar均质10次,得到dir标记的水合淫羊藿素纳米粒(dir-hict-nps)。
采用zetasizernanozs型粒度仪,通过动态光散射(dynamiclightscattering,dls)原理,在25℃条件下测定所述dir-hict-nps的粒径分布及zeta电位,每份样品平行测定3次。
图9为所述dir-hict-nps的粒径分布图(n=3,mean±sd),结果显示,平均粒径为(317.2±8.2)nm,pdi为0.22±0.05,dir-hict-nps粒径分布为单峰且较集中;zeta电位为(-14.3±0.3)mv,标记后的水合淫羊藿素纳米粒表面电位值有所增大。
(2)mcf-7荷瘤小鼠模型建立
于体外培养mcf-7细胞至对数生长期,用胰酶将贴壁细胞消化,用无菌pbs调整细胞悬浮液浓度至6×107个/ml。皮下接种0.2ml所述细胞悬浮液于nu/nu裸鼠(6周龄,雌性)右侧腋下,定期测量肿瘤体积(v=ab2/2;a为长边,b为短边)。
(3)给药
筛选出肿瘤体积达到500mm3的荷瘤小鼠,单次尾静脉注射dir-hict-nps(剂量为20mg/kg,n=7),于24h处死动物,解剖主要脏器荧光拍照。
图10为dir-hict-nps给药12h后在mcf-7荷瘤小鼠主要脏器中的分布情况对比图(n=7),从左至右依次为肿瘤、心、肝、脾、肺、肾和脑,结果显示,荧光强度主要集中在肝,其次是脾和肿瘤,在肺、肾和脑中无分布。这一结果提示在用药时注意其对肝和脾的毒性。考虑到hict-nps对人肝癌细胞plc/prf/5和hepg2也具有较强的生长抑制作用,这一结果也显示hict-nps在肝癌治疗中具有潜在的应用效果。
5、hict-nps对mcf-7荷瘤裸鼠药效学实验
(1)mcf-7荷瘤小鼠模型建立
于体外培养mcf-7细胞至对数生长期,用胰酶将贴壁细胞消化,用无菌pbs调整细胞悬浮液浓度至6×107个/ml。皮下接种0.2ml上述细胞悬浮液于nu/nu裸鼠(6周龄,雌性)右侧腋下,待肿瘤体积达到100mm3左右时,筛选肿瘤大小相对一致的49只小鼠进行实验。
(2)实验分组和给药
将筛选出来的荷瘤小鼠随机分成7组,每组7只,除正常饮食外,按照以下分组,静脉注射(i.v.)每2天给药一次,灌胃(i.g.)每天给药,实验时长12天。
1)hict-nps10mg/kg,i.v.
2)hict-nps20mg/kg,i.v.
3)hict-nps40mg/kg,i.v.
4)hict-nps40mg/kg,i.g.
5)freehict40mg/kg,i.g.(hict分散于0.5%羧甲基纤维素钠溶液中)
6)阳性对照(广谱抗癌药市售紫杉醇(ptx)注射液8mg/kg,i.v.)
7)阴性对照(生理盐水(saline)0.2ml/只,i.v.)
(3)药效学考察指标
每天观察小鼠有无异常及死亡情况;每两天测一次每组小鼠的体重和肿瘤体积(v=ab2/2;a为长边,b为短边)。给药第12天脱颈椎处死小鼠,解剖小鼠获取各组肿瘤并按下式计算抑瘤率:
抑瘤率=(1-给药组瘤重/生理盐水组瘤重)×100%
图11为小鼠肿瘤体积随时间变化曲线,图12为小鼠体重随时间变化曲线,图13为实验结束后对各组小鼠解剖所得的肿瘤组织实物图。表2为hict-nps对mcf-7荷瘤鼠肿瘤抑制效果数据。如图11所示,生理盐水组小鼠肿瘤在实验结束时达到700mm3,然而,hict-nps和ptx给药组的小鼠肿瘤体积相对较小。hict-nps(40mg/kg)灌胃组小鼠的肿瘤体积较freehict(40mg/kg)灌胃组的小(分别为(46.87±15.06)%和(33.27±12.07)%),表明将hict制备成纳米粒后可提高其体内抗肿瘤药效(分别为(46.87±15.06)%和(33.27±12.07)%)。原因可能有以下几点:首先hict-nps在胃肠道中比较稳定,纳米级别的粒径增加药物的表面积,提高药物溶出度;其次由于纳米粒特殊的生物粘附性,使其在肠道中滞留,增加了纳米粒与药物吸收部位的接触时间,从而提高药物的生物利用度。
由于生物利用度的提高和epr(enhancedpermeationandretention,肿瘤组织血管对纳米大小颗粒的高通透和高滞留)效应,静脉注射给药显著提高了hict-nps的抗肿瘤药效,静脉注射10mg/kg的hict-nps比灌胃40mg/kg的hict-nps或者freehict的抑瘤效果还要好(分别为50.98±12.14、46.87±15.06、33.27±12.07),表明对于抗肿瘤应用,静脉注射给药比灌胃更有效。
根据表2中肿瘤重量和抑制率数据分析,静脉注射hict-nps对mcf-7的抑瘤作用呈现一定的剂量依赖性(10mg/kg为50.98%、20mg/kg为60.70%、40mg/kg为72.18%)。静脉注射高剂量的hict-nps抑瘤率甚至比阳性药(ptx,8mg/kgi.v.)还要高(分别为72.18±6.03%和64.47±3.12%,p>0.05),表明hict-nps具有与紫杉醇相当的抗肿瘤效果。
小鼠体重变化在药效学实验过程中一定程度上能够反映药物的毒副作用。由图12可知,生理盐水组、hict给药组小鼠的体重均没有下降甚至有所增长,而ptx组小鼠体重呈现下降趋势,这表明hict-nps相对高的安全性。
表2hict-nps对mcf-7荷瘤鼠肿瘤抑制效果数据
a无意义数据
*p<0.05;**p<0.01;***p<0.001(相对hict-nps40mg/kgi.v.)
(4)肝脾指数考察
实验结束时,将40mg/kghict-nps(i.v.)、40mg/kghict-nps(i.g.)、40mg/kgfreehict(i.g.)、8mg/kgptx(i.v.)、生理盐水五组小鼠解剖出肝脏、脾脏并称重,按下式计算各组小鼠的肝、脾指数,以考察肝、脾损伤情况:
肝指数=肝重/体重
脾指数=脾重/体重
上述体内组织分布结果表明hict-nps主要分布在肝脏和脾脏,考察小鼠肝指数和脾指数可进一步判断hict-nps对小鼠肝脏、脾脏的损伤程度,以用于毒副作用的初步评价。表3为不同给药组小鼠肝指数和脾指数,结果表明,各组小鼠的肝指数、脾指数与生理盐水组比较均无显著性差异,表明各给药组小鼠的肝和脾未产生严重损伤。
表3不同给药组小鼠肝指数和脾指数(mean±sd,n=7)
6、所述hict-nps静脉注射的急性毒性研究
将50只昆明小鼠随机分为6组,每组10只,雌雄各半,给药前12h禁食不禁水。给药组动物按剂量:360mg/kg、400mg/kg、440mg/kg、480mg/kg和520mg/kg尾静脉注射hict-nps0.2ml,观察单次给药14d内动物中毒反应及死亡情况,记录中毒反应症状及出现时间、死亡时间和体重变化。
表4为单次注射不同剂量hict-nps14d后小鼠存活情况,结果显示,给药剂量为hict-nps360mg/kg及更高时,小鼠在0.5h之内即出现中毒反应症状,闭目、静卧。给药剂量为400mg/kg时,2只雄性小鼠在0.5h内死亡;给药剂量为440mg/kg时,1只雌性小鼠在0.5h内死亡;其他给药剂量(包括480mg/kg和520mg/kg)小鼠出现中毒反应,但均未出现死亡。中间剂量小鼠出现个别死亡,分析结果可能是小鼠个体差异造成。
表4单次注射不同剂量hict-nps14d后小鼠存活情况(i.v.,n=10)
体重变化能够从一定程度上反应受试药物的毒性情况。图14为hict-nps不同给药剂量下小鼠体重随时间变化曲线(mean±sd,n=10),结果显示,各组小鼠体重呈现相同的增长趋势,表明所给剂量均在小鼠耐受范围内。尾静脉注射hict-nps520mg/kg,小鼠存活率100%;据报道,紫杉醇注射液的ld50为41mg/kg(高磊等,紫杉醇纳米晶体药物动力学及急性毒性研究(英文),2012年中国药学大会暨第十二届中国药师周论文集)。说明在体内抗肿瘤药效相当的情况下,hict-nps较市售紫杉醇注射液有更小的毒性和更宽的治疗窗,是一种具有应用前景的抗肿瘤药物。
实施例2
在不同条件下制备系列hict-nps,并对粒径、pdi和zeta电位进行考察,具体如下:
制备例1
取5mg泊洛沙姆p188溶于5ml纯水中作为水相,取5mg水合淫羊藿素溶于1mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到所述水相中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质20次,测得平均粒径为169.9nm,pdi值为0.178,表面电位为-15.2mv。
制备例2
取5mg泊洛沙姆p188溶于5ml纯水中作为水相,取5mg水合淫羊藿素溶于0.2mldmso中作为有机相,1000r/min磁力搅拌条件下将所述有机相滴加到所述水相中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质10次,测得平均粒径135.0nm,pdi值0.209,表面电位-16.2mv。
制备例3
取5mg人血清白蛋白溶于5ml纯水中作为水相,取5mg水合淫羊藿素溶于1mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到所述水相中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质20次,测得平均粒径184.2nm,pdi值0.183,表面电位-7.41mv。
制备例4
取5mg大豆卵磷脂和5mg水合淫羊藿素溶于1mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到5ml纯水中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质20次,测得平均粒径216.0nm,pdi值0.172,表面电位-18.9mv。
制备例5
取5mg大豆卵磷脂和5mg水合淫羊藿素溶于0.5mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到5ml纯水中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质10次,测得平均粒径237.1nm,pdi值0.146,表面电位-14.4mv。
制备例6
取5mgmpeg2000-pla2000和5mg水合淫羊藿素溶于1mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到5ml纯水中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质20次,测得平均粒径208.9nm,pdi值0.201,表面电位-17.9mv。
制备例7
取5mgmpeg2000-pla2000和5mg水合淫羊藿素溶于0.5mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到5ml纯水中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质10次,测得平均粒径265.3nm,pdi值0.184,表面电位-6.15mv。
将制备例7所得hict-nps放置于室温条件下,在不同时间测定所述hict-nps的粒径、pdi值和表面电位的变化情况,结果如表6所示。由表6可知,所述hict-nps在室温放置一个月仍然很稳定。
表6hict-nps在室温放置过程中粒径、pdi值和表面电位的变化数据
制备例8
取5mgmpeg2000-pcl2000和5mg水合淫羊藿素溶于0.5mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到5ml纯水中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质10次,测得平均粒径263.2nm,pdi值0.132,表面电位-8.43mv。
制备例9
取5mgmpeg2000-dspe和5mg水合淫羊藿素溶于1mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到5ml纯水中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质20次,测得平均粒径平均176.9nm,pdi值0.199,表面电位-18.0mv。
制备例10
取10mgmpeg2000-dspe和10mg水合淫羊藿素溶于0.5mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到5ml纯水中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质10次,测得平均粒径213.0nm,pdi值0.198,表面电位-20.4mv。
将制备例10所得hict-nps放置于室温条件下,在不同时间测定粒径、pdi值和表面电位的变化情况,结果如表7所示。由表7可知,所述hict-nps在室温放置一个月仍然很稳定。
表7hict-nps在室温放置过程中粒径、pdi值和表面电位的变化数据
制备例11
取5mgmpeg2000-dspe和5mg水合淫羊藿素溶于0.5mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到5ml纯水中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质10次,测得平均粒径193.8nm,pdi值0.128,表面电位-23.8mv;24小时后再测,平均粒径212.9nm,pdi值0.208,表面电位-21.8mv。
取5ml所述hict-nps平均分成5份,每份1ml,前四份分别加入冻干保护剂10mg葡萄糖、10mgpvp、10mgpeg2000和10mg甘露醇后冻干,最后一份不添加任何物质直接冻干;将所得冻干粉分别加入1ml水复溶,手动震荡摇匀,分别进行粒径、pdi和zeta电位测定,如表8所示,结果显示,1%的pvp保护效果较好(10mg/ml)。
表8冻干保护剂作用下hict-nps的稳定性数据
制备例12
取5mgmpeg2000-pla2000和5mg水合淫羊藿素溶于0.5mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到5ml纯水中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质10次,测得平均粒径236.1nm,pdi值0.176,表面电位-22.5mv;24小时后再测,平均粒径238.7nm,pdi值0.120,表面电位-24.4mv。
取5ml所述hict-nps平均分成5份,每份1ml,前四份分别加入保护剂10mg葡萄糖、10mgpvp、10mgpeg2000和10mg甘露醇后冻干,最后一份不添加任何物质直接冻干;将所得冻干粉分别加入1ml水复溶,手动震荡摇匀,分别进行粒径、pdi和zeta电位测定,如表9所示,结果显示,1%的pvp保护效果较好(10mg/ml)。
表9保护剂作用下hict-nps的稳定性数据
制备例13
取5mg苄泽58溶于5ml纯水中作为水相,取5mgpcl2000-mpeg2000和5mg水合淫羊藿素溶于0.3mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到所述水相中,13000r/min离心20min,沉淀用5ml纯水超声分散20min,测得平均粒径566.6nm,pdi值0.315,表面电位-11.1mv;2000bar均质10次,测得平均粒径214.3nm,pdi值0.060,表面电位-11.1mv。
将制备的hict-nps用浓氯化钠溶液调整成等渗生理盐水后于37℃孵育3h后,测得平均粒径254.6nm,pdi值0.187,表面电位-13.9mv;孵育12h后,测得平均粒径302.4nm,pdi值0.225,表面电位-8.20mv,没有肉眼可见的变化,显示所述hict-nps在生理盐水中稳定。
制备例14
取5mg油酸钠溶于5ml纯水中作为水相,取5mg水合淫羊藿素溶于0.5mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到所述水相中,13000r/min离心20min,沉淀用5ml纯水超声分散20min,2000bar均质20次,测得平均粒径237.8nm,pdi值0.079,表面电位-19.9mv。
将制备的hict-nps用浓氯化钠溶液调整成等渗生理盐水后于37℃孵育12h后,测得平均粒径246nm,pdi值0.086,表面电位-16.8mv,没有肉眼可见的变化,显示所述hict-nps在生理盐水中稳定。
制备例15
取5mg油酸钠溶于5ml纯水中作为水相,取5mg水合淫羊藿素溶于0.2mldmso中,1000r/min磁力搅拌条件下将所述有机相滴加到所述水相中,13000r/min离心20min,沉淀用5ml纯水超声分散20min,测得平均粒径972.8nm,pdi值0.530,表面电位-45.8mv;2000bar均质10次,测得平均粒径270.5nm,pdi值0.183,表面电位-55.8mv。
将制备的hict-nps用浓氯化钠溶液调整成等渗生理盐水后于37℃孵育12h后,测得平均粒径279.4nm,pdi值0.223,表面电位-70.5mv,没有肉眼可见的变化,显示所述hict-nps在生理盐水中稳定。
制备例16
取5mg油酸钠溶于5ml纯水中作为水相,取5mg水合淫羊藿素溶于0.2mldmso中,250hz超声频率条件下将所述有机相滴加到所述水相中,13000r/min离心20min,沉淀用5ml纯水超声分散20min,测得平均粒径516.6nm,pdi值0.280,表面电位-35.1mv;2000bar均质10次,测得平均粒径208.6nm,pdi值0.250,表面电位-49.9mv。
将制备的hict-nps用浓氯化钠溶液调整成等渗生理盐水后于37℃孵育3h后,测得平均粒径247.2nm,pdi值0.238,表面电位-23.1mv;37℃孵育12h后,测得平均粒径254.8nm,pdi值0315,表面电位-15.8mv,没有肉眼可见的变化,显示所述hict-nps在生理盐水中稳定。
制备例17
取5mg油酸钠溶于5ml纯水中作为水相,取4mg水合淫羊藿素溶于0.4mldmso中,250hz超声频率条件下将所述有机相滴加到所述水相中,13000r/min离心20min,沉淀用5ml纯水超声分散20min,测得平均粒径465.9nm,pdi值0.324,表面电位-25.9mv;2000bar均质10次,测得平均粒径177.1nm,pdi值0.166,表面电位-20.0mv;室温放置120h后,测得平均粒径184.1nm,pdi值0.191,表面电位-22.0mv。
将室温放置120h后的hict-nps用浓氯化钠溶液调整成等渗生理盐水后于37℃孵育,在不同时间点分别进行粒径、pdi和zeta电位测定,如表10所示,结果显示,在生理盐水中,所述hict-nps中水合淫羊藿素纳米粒的粒径稳定,说明所述hict-nps可以调整成生理盐水分散介质,用于静脉注射或输液给药。
表10生理盐水作用下hict-nps的稳定性数据
制备例18
取4mg油酸钠溶于4ml纯水中作为水相,取4mgdspe-mpeg2000和4mg水合淫羊藿素溶于0.7ml混合溶剂(按体积比,丙酮:三氯甲烷:乙醇=4:1:2)中作为有机相,250hz超声频率条件下将所述有机相滴加到所述水相中,减压旋转蒸发除去有机溶剂,剩余物用5ml纯水超声分散20min,测得平均粒径424.4nm,pdi值0.213,表面电位-38.1mv;2000bar均质10次,测得287.7nm,pdi值0.198;2000bar均质20次,测得262.2nm,pdi值0.250,表面电位-36.3mv。
制备例19
取5mg油酸溶于5ml纯水中作为水相,取5mg水合淫羊藿素溶于0.2mldmso中,1000r/min磁力搅拌条件下将所述有机相滴加到所述水相中,13000r/min离心10min,沉淀用5ml纯水超声分散10min,2000bar均质10次,测得平均粒径196.0nm,pdi值0.197,表面电位-23.4mv。
将制备的hict-nps用浓氯化钠溶液调整成等渗生理盐水后于37℃孵育6h后,测得平均粒径225.6nm,pdi值0.199,表面电位-23.4mv,没有肉眼可见的变化,显示所述hict-nps在生理盐水中稳定。
制备例20
取4mg油酸钠和4mg油酸溶于4ml纯水中作为水相,取8mg大豆卵磷脂和4mg水合淫羊藿素溶于0.4mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到所述水相中,13000r/min离心10min,沉淀用4ml纯水超声分散20min,测得平均粒径382.6nm,pdi值0.170,表面电位-22.5mv;2000bar均质10次,测得平均粒径255.2nm,pdi值0.146,表面电位-20.5mv。
将制备的hict-nps用浓氯化钠溶液调整成等渗生理盐水后于37℃孵育6h后,测得平均粒径225.6nm,pdi值0.199,表面电位-20.9mv,没有肉眼可见的变化,显示所述hict-nps在生理盐水中稳定。
制备例21
取5mg油酸钠溶于5ml纯水中作为水相,取5mgmpeg2000-dspe和5mg水合淫羊藿素溶于0.8ml混合溶剂(按体积比,丙酮:三氯甲烷:乙醇=4:1:2)中作为有机相,600r/min磁力搅拌条件下将所述有机相滴加到所述水相中,旋转蒸发除去有机溶剂,剩余物用5ml纯水超声分散20min,测得平均粒径629.9nm,pdi值0.325,表面电位-93.8mv;2000bar均质10次,测得平均粒径408.3nm,pdi值0.311,表面电位-73.8mv。
将制备的hict-nps分别在生理盐水、5%葡萄糖、pbs溶液中于37℃孵育9h后,然后进行粒径、pdi和zeta电位测定,如表11所示,结果显示,所述hict-nps在以上各介质中均具有较好的稳定性。
表11不同介质作用下hict-nps的稳定性数据
制备例22
取5mg油酸钠溶于5ml纯水中作为水相,取5mgmpeg2000-dspe和5mg水合淫羊藿素溶于0.8ml混合溶剂(按体积比,丙酮:三氯甲烷:乙醇=4:1:2)中作为有机相,250hz超声频率条件下将所述有机相滴加到所述水相中,旋转蒸发除去有机溶剂,剩余物用5ml纯水超声分散20min,测得平均粒径672.5nm,pdi值0.278,表面电位-82.4mv;2000bar均质10次,测得平均粒径293.9nm,pdi值0.245,表面电位-89.6mv;2000bar再均质10次,测得平均粒径255.3nm,pdi值0.230,表面电位-65.6mv。
将制备的hict-nps分别在生理盐水、5%葡萄糖、pbs溶液、大鼠血浆、人工胃液、人工肠液中于37℃孵育不同时间,然后分别进行粒径、pdi和zeta电位测定,如表12所示,结果显示,所述hict-nps在以上各介质中均具有较好的稳定性。
表12不同介质作用下hict-nps的稳定性数据
取1ml所述hict-nps分别加入冻干保护剂10mg葡萄糖或10mg乳糖后冻干,将所得冻干粉分别加入1ml水复溶,手动振荡摇匀,分别进行粒径、pdi和zeta电位测定,如表13所示,结果显示以1%pvp或1%乳糖作为冻干保护剂,hict-nps冻干后容易重新分散,且粒径增加不大。
表13冻干保护剂作用下hict-nps的稳定性数据
制备例23
取4mg维生素e-mpeg1000琥珀酸酯和4mg水合淫羊藿素溶于0.7ml混合溶剂(按体积比,丙酮:三氯甲烷:乙醇=4:1:2)中作为有机相,250hz超声频率条件下将所述有机相滴加到4ml纯水中,旋转蒸发除去有机溶剂,剩余物用4ml纯水超声分散20min,2000bar均质10次,测得平均粒径284.8nm,pdi值0.238,表面电位-22.8mv。
将制备的hict-nps分别在生理盐水、5%葡萄糖、pbs溶液、人工胃液、人工肠液中于37℃孵育10h后,分别进行粒径、pdi和zeta电位测定,如表14所示,结果显示,所述hict-nps在以上各介质中均具有较好的稳定性。
表14不同介质作用下hict-nps的稳定性数据
制备例24
取4mg泊洛沙姆p188溶于4ml纯水中作为水相,取4mg水合淫羊藿素溶于0.6ml混合溶剂(按体积比,丙酮:乙醇=2:1)中作为有机相,250hz超声频率条件下将所述有机相滴加到所述水相中,旋转蒸发除去有机溶剂,剩余物用4ml纯水超声分散20min,测得平均粒径535.7nm,pdi值0.210,表面电位-11.5mv;2000bar均质10次,测得平均粒径264.9nm,pdi值0.189,表面电位-21.2mv。
制备例25
取5mg油酸钠溶于5ml纯水中作为水相,取5mgmpeg2000-dspe和5mg水合淫羊藿素溶于0.8ml混合溶剂(按体积比,丙酮:乙醇=2:1)中作为有机相,250hz超声频率条件下将所述有机相滴加到所述水相中,旋转蒸发除去有机溶剂,剩余物用5ml纯水超声分散20min,测得平均粒径410.9nm,pdi值0.077,表面电位-36.4mv;均质10次,测得平均粒径232.8nm,pdi值0.172,表面电位-31.6mv。
将制备的hict-nps分别在生理盐水、5%葡萄糖、pbs溶液、人工胃液、人工肠液中于37℃孵育11h后,分别进行粒径、pdi和zeta电位测定,如表15所示,结果显示,所述hict-nps在以上各介质中均具有较好的稳定性。
表15不同介质作用下hict-nps的稳定性数据
制备例26
取2mgmpeg2000-dspe和8mg水合淫羊藿素溶于0.8ml混合溶剂(按体积比,丙酮:乙醇=2:1)中作为有机相,250hz超声频率条件下将所述有机相滴加到2ml纯水中,旋转蒸发除去有机溶剂,剩余物用2ml纯水超声分散20min,测得平均粒径870.0nm,pdi值0.148,表面电位-22.9mv;均质10次,测得平均粒径315.1nm,pdi值0.124,表面电位-20.8mv。
将制备的hict-nps分别在生理盐水、5%葡萄糖、pbs溶液、大鼠血浆、人工胃液、人工肠液中于37℃孵育不同时间后,分别进行粒径、pdi和zeta电位测定,如表16所示,结果显示,所述hict-nps在以上各介质中均具有较好的稳定性。
表16不同介质作用下hict-nps的稳定性数据
制备例27
取4mgmpeg2000-dspe和16mg水合淫羊藿素溶于1.6ml混合溶剂(按体积比,丙酮:乙醇=2:1)中作为有机相,1500rpm磁力搅拌条件下将所述有机相滴加到4ml纯水中,旋转蒸发除去有机溶剂,剩余物用2ml纯水超声分散20min,测得平均粒径547.9nm,pdi值0.141,表面电位-31.8mv;均质10次,测得平均粒径259.8nm,pdi值0.157,表面电位-40.9mv。
将制备的hict-nps分别在生理盐水、5%葡萄糖、pbs溶液、大鼠血浆、人工胃液、人工肠液中于37℃孵育不同时间后,分别进行粒径、pdi和zeta电位测定,如表17所示,结果显示,所述hict-nps在以上各介质中均具有较好的稳定性。
表17不同介质作用下hict-nps的稳定性数据
制备例28
取1mgmpeg2000-dspe和8mg水合淫羊藿素溶于0.8ml混合溶剂(按体积比,丙酮:乙醇=2:1)中作为有机相,250hz超声频率条件下将所述有机相滴加到2ml纯水中,旋转蒸发除去有机溶剂,剩余物用2ml纯水超声分散20min,测得平均粒径548.1nm,pdi值0.198,表面电位-17.5mv;均质10次,测得平均粒径260.6nm,pdi值0.193,表面电位-33.0mv。
将制备的hict-nps分别在生理盐水、5%葡萄糖、pbs溶液、大鼠血浆、人工胃液、人工肠液中于37℃孵育不同时间后,分别进行粒径、pdi和zeta电位测定,如表18所示,结果显示,所述hict-nps在以上各介质中均具有较好的稳定性。
表18不同介质作用下hict-nps的稳定性数据
制备例29
取4mg维生素e-mpeg1000琥珀酸酯和8mg水合淫羊藿素溶于0.8ml混合溶剂(按体积比,丙酮:乙醇=2:1)中作为有机相,250hz超声频率条件下将所述有机相滴加到4ml纯水中,旋转蒸发除去有机溶剂,剩余物用4ml纯水超声分散20min,测得平均粒径568.6nm,pdi值0.146,表面电位-8.97mv;均质10次,测得平均粒径316.0nm,pdi值0.113,表面电位-27.0mv。
将制备的hict-nps分别在生理盐水、5%葡萄糖、pbs溶液、人工胃液、人工肠液中于37℃孵育16h后,分别进行粒径、pdi和zeta电位测定,如表19所示,结果显示,所述hict-nps在以上各介质中均具有较好的稳定性。
表19不同介质作用下hict-nps的稳定性数据
制备例30
取2mg维生素e-mpeg1000琥珀酸酯和8mg水合淫羊藿素溶于0.8ml混合溶剂(按体积比,丙酮:乙醇=2:1)中作为有机相,250hz超声频率条件下将所述有机相滴加到2ml纯水中,旋转蒸发除去有机溶剂,剩余物用2ml纯水超声分散20min,测得平均粒径695.1nm,pdi值0.334,表面电位-1.37mv;均质10次,测得平均粒径351.1nm,pdi值0.192,表面电位-17.6mv。
将制备的hict-nps分别在生理盐水、5%葡萄糖、pbs溶液、大鼠血浆、人工胃液、人工肠液中于37℃孵育不同时间后,分别进行粒径、pdi和zeta电位测定,如表20所示,结果显示,所述hict-nps在以上各介质中均具有较好的稳定性。
表20不同介质作用下hict-nps的稳定性数据
制备例31
取3mg油酸钠溶于3ml纯水中作为水相,取3mg维生素e-mpeg1000琥珀酸酯和9mg水合淫羊藿素溶于0.8ml混合溶剂(按体积比,丙酮:乙醇=2:1)中作为有机相,在500r/min磁力搅拌条件下将所述有机相滴加到所述水相中,旋转蒸发除去有机溶剂,剩余物用3ml纯水超声分散20min,1800bar均质10次。
按照制备例30考察所得hict-nps的稳定性,结果如表21和表22所示。由表21和表22可知,所述hict-nps在各介质中均具有较好的稳定性,满足口服和静脉注射对于纳米粒粒径的要求。
表21hict-nps不同时间点在各生理介质中的粒径(nm)数据
表22hict-nps不同时间点在各生理介质中的pdi数据
将所制备的hict-nps不加任何冻干保护剂直接冻干,然后加入同样体积的去离子水分散,测定粒径和电位,结果显示(表23),本制备例制备的hict-nps可直接冻干(无需保护剂),然后加入水性分散介质轻摇即可恢复到原来的粒径。
表23hict-nps无冻干保护剂冻干情况
制备例32
取3mgmpeg2000-dspe和9mg水合淫羊藿素溶于0.8ml混合溶剂(按体积比,丙酮:乙醇=2:1)中作为有机相,在500r/min磁力搅拌条件下将所述有机相滴加到3ml纯水中,旋转蒸发除去有机溶剂,剩余物用3ml纯水超声分散20min,1800bar均质10次。
按照制备例30考察所得hict-nps的稳定性,结果如表24和表25所示。由表24和表25可知,所述hict-nps在生理盐水、5%葡萄糖和人工胃液中都均具有较好的稳定性,在pbs和人工肠液中粒径有所增大,但也都在纳米范围内,满足口服和静脉注射对于纳米粒粒径的要求。
表24hict-nps不同时间点在各生理介质中的粒径(nm)数据
表25hict-nps不同时间点在各生理介质中的pdi数据
取hict-nps三份(每份2ml),分别加入冻干保护剂20mg油酸钠、20mgpvp、20mg泊洛沙姆p188后冻干;将所得冻干粉分别加入2ml去离子水,轻轻震荡摇匀,测定粒径、pdi和zeta电位。结果如表26所示,1%油酸钠、1%pvp和1%泊洛沙姆p188均能够对本制备例的hict-nps起到很好的冻干保护作用。
表26hict-nps冻干保护情况
制备例33
取1.2mg维生素e-mpeg1000琥珀酸酯和1.2mg水合淫羊藿素溶于1.2ml混合溶剂中(按体积比,丙酮:乙醇=2:1)中,之后用混合溶剂稀释到水合淫羊藿素的浓度为0.01mg/ml,得到油相;在500r/min磁力搅拌条件下,取0.5ml所述油相滴加到5ml纯水中,旋转蒸发除去有机溶剂直接得到纳米粒,测得平均粒径127.0±2.4nm;pdi值0.164±0.04;表面电位-19.0±0.12mv。
制备例34
取6mg维生素e-mpeg1000琥珀酸酯和6mg水合淫羊藿素溶于0.06mldmso中作为油相,在500r/min磁力搅拌条件下将所述油相滴入到6ml纯水中,13000r/min转速下离心10min,弃上清液,沉淀加6ml纯水分散,1800bar高压均质10次,测得平均粒径240.0±3.4nm,pdi值0.145±0.025,表面电位-24.1±3.43mv。
制备例35
取3mgmpeg2000-dspe和9mg水合淫羊藿素溶于加入0.8ml混合溶剂(按体积比,丙酮:乙醇=2:1)中作为油相,另取3mg油酸钠溶于3ml水中作为水相,在磁力搅拌500r/min条件下,将所述油相滴入到所述水相中,旋转蒸发除去有机溶剂,测得平均粒径为1263nm,1800bar高压均质10次,平均粒径降为240.4nm;合计均质20次后,平均粒径为268.4nm。
按照制备例30考察所得hict-nps的稳定性,结果如表27所示,所制备的hict-nps在各介质中均具有较好的稳定性,满足口服和静脉注射对于纳米粒粒径的要求。
表27hict-nps纳米粒平均粒径及生理介质稳定情况
制备例36
取5mgmpeg5000-pla5000和5mg水合淫羊藿素溶于0.5mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到5ml纯水中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质10次,测得平均粒径369.1nm,pdi值0.265,表面电位-8.33mv。
制备例37
取5mgmpeg5000-pla2000和5mg水合淫羊藿素溶于0.5mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到5ml纯水中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质10次,测得平均粒径214.6nm,pdi值0.167,表面电位-9.87mv。
制备例38
取5mgmpeg5000-pla5000和5mg水合淫羊藿素溶于0.5mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到5ml纯水中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质10次,测得平均粒径369.1nm,pdi值0.265,表面电位-8.33mv。
制备例39
取5mgmpeg10000-pla10000和5mg水合淫羊藿素溶于0.5mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到5ml纯水中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质10次,测得平均粒径359.4nm,pdi值0.258,表面电位-8.12mv。
制备例40
取5mgmpeg5000-pcl5000和5mg水合淫羊藿素溶于0.5mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到5ml纯水中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质10次,测得平均粒径396.2nm,pdi值0.314,表面电位-7.83mv。
制备例41
取5mgmpeg5000-pcl2000和5mg水合淫羊藿素溶于0.5mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到5ml纯水中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质10次,测得平均粒径197.8nm,pdi值0.185,表面电位-8.25mv。
制备例42
取5mgmpeg10000-pcl10000和5mg水合淫羊藿素溶于0.5mldmso中作为有机相,250hz超声频率条件下将所述有机相滴加到5ml纯水中,13000r/min离心20min,沉淀用5ml纯水超声分散10min,2000bar均质10次,测得平均粒径278.8nm,pdi值0.214,表面电位-8.87mv。
制备例43
将20mghict、20mg维生素e-mpeg2000琥珀酸酯溶于1mldmso作为有机相;1000r/min磁力搅拌条件下将所述有机相滴加到10ml水中,13000r/min离心20min,沉淀用10ml去离子水超声分散20min,2000bar均质10次,得到水合淫羊藿素纳米粒,测得平均粒径213.6nm,pdi值0.197,表面电位-7.56mv。
实施例3
按照实施例1中方法对制备例2~43所得hict-nps的溶血情况进行考察,结果显示:制备例2~43所得hict-nps的溶血率较低,其中,制备例1~12、23、26~30、32~43中的hict-nps在浓度为4mg/ml时,溶血率均低于3%,体内静脉给药时所需的浓度完全不溶血,满足静脉注射的条件;制备例14~22、24、25、31中的hict-nps在浓度≤4mg/ml时,溶血率均低于5%,制备例13中的hict-nps在浓度≤1mg/ml时,溶血率低于5%,均能满足静脉注射给药对溶血性的要求。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!