酰胺类生物碱在制备肿瘤化疗药物增敏剂中的应用及抗肿瘤药物组合物的制作方法
本发明属于酰胺类生物碱的应用领域,具体涉及胡椒的茎中的酰胺类生物碱化合物1-7在制备肿瘤化疗药物增敏剂中的应用及抗肿瘤药物组合物。
背景技术:
干扰肿瘤细胞微管蛋白功能的药物包括:紫杉醇,长春新碱,秋水仙碱,鬼臼毒素等。紫杉醇是wani等人于1971年从红豆杉中分离得到的天然抗肿瘤化合物。其作用机制主要是通过与癌细胞中的微管蛋白结合,抑制微管解聚,导致细胞在有丝分裂时不能形成纺锤体和纺锤丝,使细胞停止于g2/m期,抑制细胞分裂和增殖,从而起到杀灭癌细胞的作用。长春新碱是从夹竹桃科植物长春花中提取的引哚类生物碱,与微管蛋白亲和力高,从而抑制微管蛋白聚合,影响纺锤体微管的形成,使细胞有丝分裂停滞于m期,最终诱导细胞调亡。他们的治疗效果都非常良好,且抗瘤谱广,是临床上用于治疗宫颈癌、肺癌、前列腺癌、胃癌、乳腺癌和卵巢癌的一线用药。然而,随着化疗药物的使用,病人会产生耐药性,这也是临床化疗失败的主要原因,同时制约着抗微管蛋白药物的临床使用与发展。
抗微管蛋白药物的耐药机制主要有:细胞膜表面的p糖蛋白的高表达致使药物泵出细胞外;抗凋亡基因如bcl-2的表达升高,促凋亡基因如bax的降低,致使癌细胞产生多药耐药并且对化疗药诱导的凋亡耐受;微管蛋白与药物结合位点的基因突变致使药物与微管的结合能力降低;此外,还有肿瘤微环境的改变以及癌细胞周期的变化等等。尽管紫杉醇,长春新碱等药物的耐药机制研究较多,但目前仍未解决耐药的问题。因此,寻找具有逆转抗微管蛋白药物耐药作用的化合物,具有极为重要的意义。
技术实现要素:
本发明所要解决的技术问题是,为了克服现有技术中抗肿瘤药物治疗的不足及化疗的耐药的问题,提供从胡椒(pipernigrum)的茎中分离出的一系列酰胺类生物碱在制备增加干扰肿瘤细胞微管蛋白功能的药物的敏感性、逆转肿瘤细胞耐药性的药物中的应用,作为肿瘤耐药逆转剂具有高效低毒的优势。为有效治疗肿瘤提供新的途径和手段。
本发明通过以下的技术方案来实现:
第一方面,提供从胡椒(pipernigrum)的茎中分离出的酰胺类生物碱化合物1-7中的任意一种在制备抗肿瘤化疗药物增敏剂中的应用,所述化合物1-7的化学结构式如下:
化合物1:nigramideb.
化合物2:该化合物为新化合物pipernigramidea
化合物3:chabamidei.
化合物4:nigramidem.
化合物5:nigramidec.
化合物6:该化合物为新化合物pipernigramideb.
化合物7:该结构为新天然产物。
优选地,所述化疗药物是干扰肿瘤细胞微管蛋白功能的药物。
优选地,所述干扰肿瘤细胞微管蛋白功能的药物是紫杉醇或长春新碱。
优选地,所述的肿瘤为宫颈癌、子宫内膜癌、卵巢癌、肺癌、胃癌、肝癌、结肠直肠癌、皮肤癌、肾癌、食道癌。
优选地,所述的肿瘤为对所述化疗药物产生耐药性。优选为对紫杉醇耐药的宫颈癌。
第二方面,提供一种药物组合物,包括化疗药物和增敏剂,所述增敏剂为酰胺类生物碱化合物1-7中的任意一种。
优选地,所述化疗药物是干扰肿瘤细胞微管蛋白功能的药物。
优选地,所述干扰肿瘤细胞微管蛋白功能的药物是紫杉醇或长春新碱。
优选地,所述的肿瘤为宫颈癌、子宫内膜癌、卵巢癌、肺癌、胃癌、肝癌、结肠直肠癌、皮肤癌、肾癌、食道癌。
优选地,所述的肿瘤为对所述化疗药物产生耐药性。优选为对紫杉醇耐药的宫颈癌。
第三方面,提供上述药物组合物在制备抗肿瘤的药物中的应用。
第四方面,提供一种从胡椒的茎中分离出的酰胺类生物碱化合物,其结构式
根据本发明所揭示的上述酰胺类生物碱作为干扰肿瘤细胞微管蛋白功能的药物的增敏剂的用途以及可显著增强紫杉醇、长春新碱对肿瘤细胞增殖的抑制作用和可显著增强紫杉醇诱导的肿瘤细胞凋亡以及降低p-akt促进肿瘤细胞凋亡增加化疗药的敏感性的作用;与化疗药物联合用药时,能够克服肿瘤对化疗药物产生的耐药性,显著增强化疗药物对耐药肿瘤细胞的疗效,可以将上述酰胺生物碱应用于肿瘤化疗过程,从而明显促进不同肿瘤细胞对化疗药物的药物敏感性,因而能减少化疗药物的剂量,并减轻化疗药物对人体正常细胞的毒副作用。为有效治疗肿瘤提供新的途径和手段。
附图说明
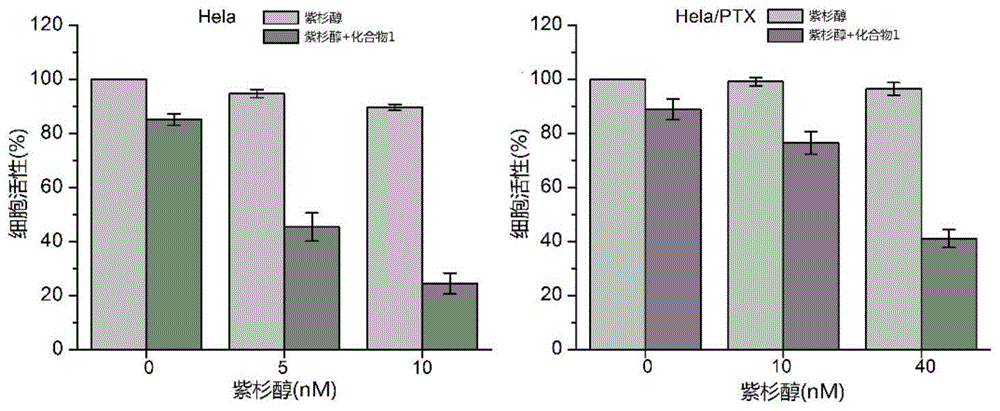
图1.化合物1(10μm)及紫杉醇联用对宫颈癌细胞(hela)及紫杉醇耐药细胞(hela/ptx)的协同及增敏作用。
图2.化合物2(10μm)及紫杉醇联用对宫颈癌细胞(hela)及紫杉醇耐药细胞(hela/ptx)的协同及增敏作用。
图3.化合物3(10μm)及紫杉醇联用对宫颈癌细胞(hela)及紫杉醇耐药细胞(hela/ptx)的协同及增敏作用。
图4.化合物4(10μm)及紫杉醇联用对宫颈癌细胞(hela)及紫杉醇耐药细胞(hela/ptx)的协同及增敏作用。
图5.化合物5(10μm)及紫杉醇联用对宫颈癌细胞(hela)及紫杉醇耐药细胞(hela/ptx)的协同及增敏作用。
图6.化合物6(10μm)及紫杉醇联用对宫颈癌细胞(hela)及紫杉醇耐药细胞(hela/ptx)的协同及增敏作用。
图7.化合物7(10μm)及紫杉醇联用对宫颈癌细胞(hela)及紫杉醇耐药细胞(hela/ptx)的协同及增敏作用。
图8.化合物1(10μm)及长春新碱(vincristine,vcr)联用对宫颈癌细胞(hela)的协同作用。
图9.化合物2(10μm)及长春新碱(vincristine,vcr)联用对宫颈癌细胞(hela)的协同作用。
图10.化合物3(10μm)及长春新碱(vincristine,vcr)联用对宫颈癌细胞(hela)的协同作用。
图11.化合物4(10μm)及长春新碱(vincristine,vcr)联用对宫颈癌细胞(hela)的协同作用。
图12.化合物5(10μm)及长春新碱(vincristine,vcr)联用对宫颈癌细胞(hela)的协同作用。
图13.化合物6(10μm)及长春新碱(vincristine,vcr)联用对宫颈癌细胞(hela)的协同作用。
图14.化合物7(10μm)及长春新碱(vincristine,vcr)联用对宫颈癌细胞(hela)的协同作用。
图15.化合物1(10μm)及紫杉醇处理hela/ptx细胞后,hoechst33258染色检测细胞凋亡。
图16.化合物1(10μm)及紫杉醇联用对hela/ptx细胞p-akt的影响。
图17.化合物1(10μm)及紫杉醇联用对卵巢癌细胞(skov-3)协同及增敏作用。
图18.化合物2(10μm)及紫杉醇联用对卵巢癌细胞(skov-3)协同及增敏作用。
图19.化合物1(10μm)及紫杉醇联用对肺癌细胞(a549)协同及增敏作用。
图20.化合物2(10μm)及紫杉醇联用对肺癌细胞(a549)协同及增敏作用。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
以下是实施例中人宫颈癌细胞株hela、人卵巢癌细胞株skov-3及人肺癌细胞株a549由中国典型培养物保藏中心提供。
宫颈癌紫杉醇耐药细胞hela/ptx的诱导:取适当浓度hela细胞铺于6孔板中,待第二天细胞长至80%后,加入初始浓度为5nm的紫杉醇诱导细胞5h后传代。后续的细胞传代培养时培养基中均含有紫杉醇。约1周后,细胞完全耐受5nm紫杉醇,培养基中的紫杉醇浓度提高至10nm。待细胞完全耐受该浓度后,继续增加紫杉醇诱导浓度直至hela细胞可以在终浓度为300nm的紫杉醇中正常传代,冻存与复苏。紫杉醇的具体诱导浓度梯度为5,10,20,40,60,80,100,150,200,300nm,诱导5个月。平时培养时加入终浓度为300nm的紫杉醇维持细胞耐药性,实验前使用不含药物的培养基培养传代2次【参考文献:pengx,gongf,cheny,etal.autophagypromotespaclitaxelresistanceofcervicalcancercells:involvementofwarburgeffectactivatedhypoxia-inducedfactor1-α-mediatedsignaling[j].celldeathanddisease,2014,5(8):e1367.】。
【实施例1】化合物1-7的分离及提取
胡椒茎粉碎后,用95%乙醇提取3次,回收乙醇,所得浸膏采用大孔树脂、硅胶分离,tlc检测,合并相同组分,共得到5个组分。组分1经过反复的凝胶色谱和正反相硅胶柱色谱分离得到化合物1及3-5、高效液相色谱分离得到化合物2,组分2经过反复的凝胶色谱和正反相硅胶柱色谱得到化合物7、高效液相色谱分离得到化合物6。化合物2为新化合物,其nmr数据见表1;化合物6为新化合物、化合物7为新天然产物,其13cnmr见表2。
表1.1h(400mhz)nmr[δ,mult(jinhz)]and13cnmr(100mhz)spectroscopicdataforcompound2incdcl3.
表2.13cnmr(100mhz)spectroscopicdataforcompounds6and7incdcl3.
【实施例2】化合物1-7对宫颈癌细胞(hela)及紫杉醇耐药细胞(hela/ptx)的协同及增敏作用:
采用二聚酰胺化合物、紫杉醇或长春新碱及二者联合作用,处理对数生长期的hela及hela/ptx细胞72小时后,每孔加入20μlmtt(5mg/ml)溶液,继续培养4小时,去上清,每孔加入100μldmso,用酶标仪在570nm测定od值。化合物1-7与紫杉醇或长春新碱联用的作用效果见图1-14。化合物1-7单独使用时,如图1-14中紫杉醇或长春新碱浓度为0,即仅有酰胺类化合物时,对细胞的活性的影响很小(细胞活性降低约10%左右),化合物1-7联用化疗药时均有增加紫杉醇、长春新碱作用效果的作用。
【实施例3】化合物1与紫杉醇合用对hela/ptx细胞形态的影响及增加细胞凋亡
本发明采用hoechst33258染色法,在荧光显微镜下观察化合物1与紫杉醇联用后,对细胞形态的影响,药物作用24小时后,处理并拍照。图15结果显示,化合物1(10μm)与紫杉醇(10、40nm)单独处理组的细胞形态没有明显变化,染色体在细胞中分布较均匀。相比之下,化合物1与紫杉醇(10、40nm)联合作用后的细胞出现明显碎裂,染色体浓缩、出现大量的凋亡小体。
【实施例4】化合物1与紫杉醇合用对hela/taxol中akt的影响
人紫杉醇耐药细胞株hela/taxol细胞,接种于6孔板中,孵育24小时让细胞贴壁伸展。加入药物作用24小时后,消化并收集细胞,每组样品加入120μl的ripa裂解液裂解30min,然后4℃15000r/min离心15min,取上清液至干净离心管中。采用bca法检测蛋白含量,然后加入上样缓冲液并煮沸5min。将蛋白样品用12%的sds-page电泳后,转至pvdf膜上。pvdf膜用5%脱脂奶粉封闭过夜,接着依次孵育一抗与二抗。最后用ecl化学发光法显色并使用凝胶成像仪拍照成像。akt与细胞存活密切相关,降低磷酸化akt,可以降低细胞活性。图16结果显示,10μm化合物1单独使用对p-akt没有影响,但与不同浓度紫杉醇联用处理组的细胞,其磷酸化蛋白p-akt明显降低,表示联用增敏效果与降低p-akt有关。
【实施例5】酰胺化合物与紫杉醇联用对卵巢癌细胞的协同及增敏作用
采用化合物1或化合物2、紫杉醇及二者联合作用,处理对数生长期的卵巢癌细胞(skov-3)72小时后,每孔加入20μlmtt(5mg/ml)溶液,继续培养4小时,去上清,每孔加入100μldmso,用酶标仪在570nm测定od值。化合物1、2及分别与紫杉醇联用的作用效果见图17及18。化合物1及2均有增加紫杉醇对skov-3细胞作用效果的作用。
【实施例6】酰胺化合物与紫杉醇联用对肺癌细胞的协同及增敏作用
采用化合物1或化合物2、紫杉醇及二者联合作用,处理对数生长期的肺癌细胞(a549)72小时后,每孔加入20μlmtt(5mg/ml)溶液,继续培养4小时,去上清,每孔加入100μldmso,用酶标仪在570nm测定od值。化合物1、2及分别与紫杉醇联用的作用效果见图19及20。化合物1及2均有增加紫杉醇对a549细胞作用效果的作用。
- 还没有人留言评论。精彩留言会获得点赞!