靶向肺腺癌肿瘤的细胞膜仿生纳米探针及其应用的制作方法
本发明属于医学影像学领域,具体涉及靶向肺腺癌肿瘤的细胞膜仿生纳米探针及其在肺癌肿瘤成像及治疗中应用。
背景技术:
肺癌是目前我国死亡率第一的恶性肿瘤,发展更为全面和精密的诊断技术是攻克肺癌的关键之一。磁共振成像(mri)是目前在临床中应用最为成熟的影像技术之一,它能提供全身器官及肿瘤的三维解剖式结构信息,但靶向性差、灵敏度低。而光学显像技术则具有相当高的灵敏度,然而通常由于光散射而导致空间分辨率较低,很难精确定位。光声成像特别适合用于观察肿瘤血管微结构,然而由于选用能量比较温和的激光器作为光源,其成像范围相对较小。因此将mri与荧光成像、光声成像结合,既能提供高分辨率的结构组织学信息,同时又能实现高灵敏的功能学显像。
目前1h-mri广泛用于诊断和研究中,传统的1h-mri通常使用造影剂来改变目标组织中水质子的弛豫效率,从而增强目标组织与周围组织质子弛豫率差别,提高1h-mri成像分辨率。但由于人体内存在大量h2o以及一些其他内源性物质的背景信号干扰,造成其灵敏度降低。在各种生物标记的特异性成像方法中,19f-mri拥有巨大的应用潜力。19f原子核拥有100%天然丰度,磁旋比为40.08mhz/t,与1h核非常接近(42.58mhz/t),灵敏度也达到1h的83%。最重要的是,活体中几乎不存在19f的背景信号,只有极微量的氟以固体形式存在于人体骨骼和牙齿中,t2时间非常短,远低于19f-mri的检测限。另外,由于19f核本身就是成像核素,所以其成像过程不需要引入额外的金属离子作为造影剂。综上所述19f是一种具有高灵敏度、对比度的磁共振探针信号基元,用19f-mri进行生物分子影像学研究可获得传统1h-mri无法获得的一些信息。
为了增加诊疗分子探针在肿瘤区域的富集,制备长循环、高靶向的纳米载体至关重要。纳米颗粒表面可以通过修饰功能基团,如叶酸、多肽等,实现目标组织的主动靶向,然而功能基团的引入往往使制备过程复杂化,并存在免疫原性等问题。近期发展出来的一种纳米仿生医学受到越来越多的关注,通过提取肿瘤细胞膜修饰纳米颗粒,利用肿瘤细胞膜表面一些天然的黏附因子和相关功能蛋白,使得它应用在生物体内具备低免疫原性和高同源靶向的功能,结合纳米核心颗粒的高度选择性,可以合成多功能的仿生纳米颗粒。
技术实现要素:
为解决上述现有技术存在的问题,本发明的目的之一在于提供一种靶向肺腺癌肿瘤的细胞膜仿生纳米探针及其制备方法;本发明的目的之二在于提供所述的细胞膜仿生纳米探针在对肺癌进行19f核磁共振/荧光/光声三模态成像及光热治疗中的应用。
实现本发明上述目的所采用的技术方案为:
靶向肺腺癌肿瘤的细胞膜仿生纳米探针,由肺腺癌细胞膜、聚乳酸-羟基乙酸共聚物、全氟化碳、吲哚菁绿制备而成,制备方法如下:
(1)将肺腺癌细胞膜溶液与dspe-peg2000混合,用220-400nm的滤膜挤压,获得dspe-peg2000修饰的肺腺癌细胞膜囊泡;
(2)将聚乳酸-羟基乙酸共聚物溶于二氯甲烷,依次加入吲哚菁绿、助溶剂甲醇、全氟化碳、聚乙烯醇,超声破碎混合均匀后,去除二氯甲烷,离心去上清,洗涤沉淀,获得聚乳酸-羟基乙酸共聚物包裹的全氟化碳并负载吲哚菁绿的纳米颗粒;所述的全氟化碳为全氟-15冠-5醚(pfce)、全氟聚醚(pfpe)或全氟溴辛烷(pfob);
(3)将dspe-peg2000修饰的肺腺癌细胞膜囊泡与上述步骤制得的纳米颗粒混合溶于水中,依次通过800nm、400nm过滤膜挤压,制得靶向肺腺癌肿瘤的细胞膜仿生纳米探针。
进一步地,上述制备方法中dspe-peg2000修饰的肺腺癌细胞膜囊泡与纳米颗粒按照质量比1:1-4:1混合。
进一步地,上述方法制得的聚乳酸-羟基乙酸共聚物包裹的全氟化碳并负载吲哚菁绿的纳米颗粒粒径为80-100nm。
靶向肺腺癌肿瘤的细胞膜仿生纳米探针在肺腺癌肿瘤成像中的应用,包括磁共振成像、荧光成像及光声成像,也可以用于制备治疗或预防肺腺癌肿瘤药物,利用肺腺癌细胞膜表面天然的黏附因子和相关功能蛋白,使其应用在活体对同源肿瘤具有同源靶向性,增强该诊疗纳米探针在肿瘤的富集,还可利用吲哚菁绿的强近红外光吸收能力用于肺癌的光热治疗。
与现有技术相比,本发明的优点和有益效果在于:
本发明提供了一种用肺腺癌细胞膜修饰的仿生纳米探针,由dspe-peg2000修饰的肺腺癌细胞膜囊泡、聚乳酸-羟基乙酸共聚物、全氟化碳、吲哚菁绿制备而成。全氟化碳因为具有多个磁等价氟原子,应用于活体能产生强的19f-mri信号,但它具有强疏水性,利用聚合物plga将其包裹,增强水溶性,同时负载近红外荧光染料吲哚菁绿,可用于荧光成像、光声成像以及光热治疗,纳米粒粒径约100nm。接着用肺腺癌细胞膜包裹pp@icgnps纳米粒,最终形成核壳结构体系,细胞膜厚约9nm,该体系利用肺腺癌细胞膜表面一些天然的黏附因子和相关功能蛋白,使得它应用在生物体内对同源肺癌肿瘤具有高的靶向性,能将19f-mri和近红外荧光成像探针尽可能多的富集在肺癌肿瘤区域,以达到对肺腺癌进行早期诊断和光热治疗的目的。
附图说明
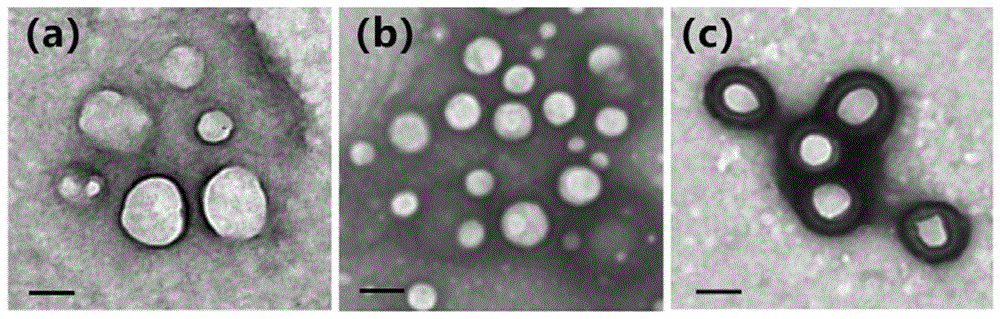
图1为透射电子显微镜结果,标尺为100nm。(a)a549细胞膜囊泡,(b)plga包裹pfce纳米颗粒,(c)细胞膜包裹pfce聚合物纳米颗粒。
图2为am-pp@icgnps水溶液的荧光和核磁性能研究。(a)紫外吸收光谱;(b)荧光光谱;(c)19f-nmr谱,以cf3so3na作为内标。
图3为am-pp@icgnps尾静脉注射肿瘤裸鼠体内的荧光成像(fi)和光声成像(pa)。
图4为am-pp@icgnps尾静脉注射肿瘤裸鼠体内的19f核磁共振成像。(a)活体1h-mri和19f-mri;(b)解剖肿瘤组织,搅碎制得组织悬液,进行19f-nmr测试,以cf3so3na作为内标;(c)活体肿瘤部位19f-mri信号强度与核磁管外标样品信号强度比值。
图5为am-pp@icgnps尾静脉注射后对裸鼠肿瘤的光热治疗效果。(a)肿瘤裸鼠分别尾静脉注射am-pp@icgnps、pp@icgnps、icg和pbs,24h后对肿瘤部位进行激光照射(波长765nm,光功率密度为0.4w/cm2),用近红外热像仪检测不同时间节点肿瘤的温度变化;(b)各组裸鼠肿瘤光热效应;(c)各组裸鼠治疗前后肿瘤变化图片;(d)各组裸鼠治疗期间肿瘤体积变化;(e)各组裸鼠治疗期间体重随时间变化。
具体实施方式
下面将结合附图,对本发明的优选实施例进行详细的描述。
具体实施方式中所采用的主要试剂及材料说明如下:
聚乳酸-羟基乙酸共聚物(plga,丙交酯:异交酯=50:50,mw=7000-17000)购自sigma-aldrich;吲哚菁绿(icg,98%)、全氟-15冠-5醚(pfce,98%)、聚乙烯醇(pva,99%,mw=30000-70000da)均购自tci;dspe-peg2000购自avanti(usa);a549细胞购自中科院上海细胞库。
实施例1:肺腺癌细胞膜包裹全氟化碳聚合物纳米探针的制备及表征
(1)肺腺癌细胞膜的提取:收集肺腺癌a549细胞,加入20mmtris-hcl低渗缓冲液(含10mmkcl,2mmmgcl2,每1ml缓冲液加入10μl100mm不含edta的蛋白酶抑制剂),置于冰上处理2-4h,再超声破碎,接着离心3000×g,5min保留上清,上清再离心20000×g,30min弃去沉淀,上清继续离心100000×g,1h沉淀即为质膜,用20mmtris-hcl缓冲液洗涤一次,最后获得纯化的肺腺癌细胞膜。
(2)肺腺癌细胞膜修饰dspe-peg2000:称取a549细胞膜1mg重悬于pbs缓冲液中,加入20μgdspe-peg2000,用220nm滤膜反复挤压,获得修饰了dspe-peg2000的肺腺癌细胞膜囊泡。
(3)聚乳酸-羟基乙酸共聚物(plga)包裹全氟化碳纳米颗粒(ppnps)并负载荧光分子吲哚菁绿(icg):将10mgplga溶于0.5ml二氯甲烷,加入1mg吲哚菁绿(icg),同时加入50μl甲醇作为助溶剂,加入100μl全氟15-冠5-醚(pfce),再加入5ml5%的聚乙烯醇(pva)水溶液,超声破碎混合均匀后,溶液置于室温搅拌12h挥发掉二氯甲烷,再离心14000rpm,15min,弃去上清,沉淀用水洗3次,即获得plga包裹的全氟化碳并负载icg的纳米颗粒(pp@icgnps)。
(4)肺腺癌细胞膜包裹pp@icgnps的制备(am-pp@icgnps):将dspe-peg2000修饰的a549细胞膜与pp@icgnps按质量比4:1混合溶于水中,依次通过800nm、400nm过滤膜反复挤压,即获得细胞膜仿生纳米颗粒(am-pp@icgnps)。
(5)用透射电镜(tem)观察纳米粒的外观形态,具体如下:分别将样品溶于水,超声分散均匀,滴一滴样品溶液于铜网上,用滤纸吸去多余液体,干燥后再滴一滴1%磷钨酸于铜网上,室温干燥5-10min后吸去多余液体,待样品干燥后置于透射电镜下观察。结果如图1所示,纳米粒经负染后,可观察到提取的a549细胞膜呈不规则囊泡结构(图1a);裸露的pp@icgnps呈球形,均匀分散,平均粒径为100nm(图1b);被a549细胞膜包裹后,纳米粒具有明显的核壳结构,细胞膜厚约9nm(图1c)。
实施例2:肺腺癌细胞膜仿生纳米探针的核磁、光学性能测试
(1)plga包裹pfce并负载吲哚菁绿纳米粒(pp@icgnps)的制备:制备方法同实施例1步骤(3)。
(2)肺腺癌细胞膜包裹pp@icg纳米粒的制备(am-pp@icgnps):制备方法同实施例1步骤(1-4)。
(3)am-pp@icgnps纳米颗粒的光学性能测试:将am-pp@icgnps溶于纯水中,超声分散均匀,取600μl溶液放入微量比色皿中,进行紫外吸收和荧光光谱测试,测试波长范围在600-900nm。结果显示,am-pp@icgnps在782nm处有明显的紫外吸收,该波长为icg荧光小分子的特征吸收,说明icg被成功负载于ppnps中(图2a)。荧光光谱显示am-pp@icgnps最大激发波长为760nm,最大发射波长为810nm(图2b)。
(4)am-pp@icgnps纳米探针的核磁性能测试:将am-pp@icgnps溶于纯水中,超声分散均匀,取250μl溶液放入5mm核磁管中,同时加入250μl50mm三氟甲磺酸钠(cf3so3na)水溶液作为内标,最后加入50μl重水(d2o)。将核磁管置于500mhz核磁共振谱仪中测试,19f-nmr谱结果显示在-78.6ppm和-91.8ppm处出现两个信号(图2c),已知-78.6ppm化学位移处的信号来自内标cf3so3na,因此-91.8ppm处的信号即为am-pp@icgnps,说明疏水的pfce被成功包裹在细胞膜仿生纳米探针中,并具有强的19f-nmr信号,可进一步用于肺腺癌肿瘤的特异性19f-mri成像。
实施例3:am-pp@icgnps对肺腺癌肿瘤的体内靶向性测试
(1)裸鼠的a549肿瘤造模:人肺腺癌a549细胞置于含10%胎牛血清及1%双抗(青霉素100u/ml,链霉素100μg/ml)的mem培养基中,在co2含量为5%、相对湿度90%的37℃培养箱中进行常规传代培养。当细胞处于对数生长期时,用0.25%胰蛋白酶消化2~5min,弃去胰酶,加入无菌pbs,吹打制成细胞悬液。将所得a549细胞悬液于1000r/min离心3min后,弃去上层清液,离心管底部的细胞用无菌pbs重新吹打分散,使其浓度约为2×107/ml。在每只成年雌性balb/c裸鼠的右后腿皮下注射200μl细胞悬液,经2~4周培养后,即可长成肿瘤。
(2)活体荧光成像(fi)实验:本实验以a549肿瘤裸鼠为模型,当肿瘤直径约为1cm时,将造模裸鼠随机分为2组,腹腔注射1%戊巴比妥钠麻醉裸鼠,分别尾静脉注射am-pp@icgnps和pp@icgnps(icg含量为0.2mg/ml)200μl,在不同时间段用活体生物荧光成像技术(激发滤光片745nm,发射滤光片800nm)检测纳米颗粒在体内的分布。实验结果如图4所示,在0h,am-pp@icgnps和pp@icgnps均大量聚集在肝脏区域;在4h,两组裸鼠中荧光信号在肝和脾均有较强荧光;在12h,实验组am-pp@icgnps在肿瘤区域出现明显荧光信号,而对照组pp@icgnps没有;在24h,随着纳米颗粒的代谢,最终可观察在肝脏和肿瘤区域大量富集am-pp@icgnps,而裸露的pp@icg纳米颗粒主要富集在肝脏,肿瘤区域富集不明显;在48h,纳米颗粒进一步代谢,am-pp@icgnps在肝和肿瘤中的荧光信号均减弱。
(3)活体光声成像(pa)实验:本实验以a549肿瘤裸鼠为模型,当肿瘤直径约为1cm时,将造模裸鼠随机分为2组,腹腔注射1%戊巴比妥钠麻醉裸鼠,分别尾静脉注射am-pp@icgnps和pp@icgnps(icg含量为0.2mg/ml)200μl,在不同时间段用msot小动物多光谱断层扫描仪检测纳米颗粒在肿瘤血管的分布。实验结果如图4所示,注射后0-24h,am-pp@icgnps尾静脉注射裸鼠肿瘤血管icg信号逐渐增强,而对照组pp@icgnps富集在肿瘤区域的信号相对较弱;48h时,裸鼠肿瘤血管内的icg信号均相对24h的信号强度有所降低。
综上所述,本发明基于肺腺癌细胞膜对同源细胞的靶向性,设计并应用膜挤压法制备了一种具有靶向肺腺癌肿瘤的核/壳结构的纳米材料,不仅将具有强疏水性的全氟化碳包裹在内,同时可以负载近红外荧光染料icg。尾静脉注射该细胞膜仿生纳米探针(am-pp@icgnps),通过测试不同时间段的活体荧光成像和肿瘤血管光声成像,实验结果证明相对于裸露的pp@icgnps,细胞膜仿生的am-pp@icgnps对同源肺腺癌肿瘤表现出更强的靶向性,能将诊疗探针选择性运送到肺腺癌肿瘤,24h时在肿瘤部位富集最多,对肺腺癌的预前诊断具有重要意义。
实施例4:am-pp@icgnps对肺腺癌肿瘤的19f-mri测试
(1)裸鼠的a549肿瘤造模:制备方法同实施例3步骤(1)。
(2)活体19f-mri实验:本实验以a549肿瘤裸鼠为模型,当肿瘤直径约为1cm时,将造模裸鼠随机分为2组,分别尾静脉注射am-pp@icgnps和pp@icgnps(通过内标法测定19f浓度为2.5mol/l,200ul),24h后腹腔注射1%戊巴比妥钠麻醉裸鼠,用400mhz布鲁克生物核磁共振成像系统对裸鼠进行测试。1h-mri测试采用弛豫增强快速采集(rare)序列,具体参数如下:累加次数=4,重复时间(tr)=6381ms,回波时间(te)=56ms,扫描视野(fov)=30mm×30mm,切片厚度(si)=1.5mm,矩阵大小=256×256,采样时间=3min24s。19f-mri测试采用弛豫增强快速采集(rare)序列,具体参数如下:累加次数=1024,重复时间(tr)=2500ms,回波时间(te)=3ms,扫描视野(fov)=37mm×37mm,切片厚度(si)=1.5mm,矩阵大小=32×32,采样时间=2h50min。同时将pp@icgnps水溶液(19f浓度cf=200mm)放入5mm核磁管中,将核磁管放在裸鼠身体一侧,作为外标。
实验结果如图5a所示,1h-mri可以清晰的显示裸鼠器官组织结构,将19f-mri结果与1h-mri重合,可以定位肿瘤部位的19f-mri信号,通过测试两组裸鼠肿瘤部位和外标的19f-mri信号强度比值,实验结果如图5c所示,实验组am-pp@icgnps富集肿瘤的信号强度为对照组pp@icgnps的2.4倍。可以看出,细胞膜仿生am-pp@icgnps能通过主动靶向更多的进入肺腺癌肿瘤中,19f-mri具有较高的灵敏度和实用性,达到了肿瘤可视化成像效果。
(3)体外肿瘤组织19f-nmr测试:肿瘤裸鼠分别尾静脉注射am-pp@icgnps和pp@icgnps24h后,进行安乐死处理,解剖出肿瘤组织,称重,加入纯水,搅碎肿瘤组织配成组织悬液,调节质量浓度为140mg/ml,将各组的肿瘤组织悬液取250μl放入5mm核磁管中,同时加入250μl1mm三氟甲磺酸钠(cf3so3na)水溶液作为内标,加入50μl重水,接着将样品置于500mhz核磁共振谱仪中测试,19f-nmr谱结果显示在-78.6ppm和-91.8ppm处出现两个信号(图5b),已知-78.6ppm化学位移处的信号来自内标cf3so3na,因此-91.8ppm处的信号即为肿瘤组织悬液中的pfce纳米颗粒,对-78.6ppm和-91.8ppm处的信号进行积分,可以看出am-pp@icgnps注射组的肿瘤组织中19f含量为对照组的2.47倍,实验结果与体内19f-mri实验相符,进一步说明细胞膜仿生am-pp@icgnps成功通过同源靶向作用富集在肺腺癌肿瘤部位,实现19f-mri的高灵敏探测。
实施例5:am-pp@icgnps对肺腺癌肿瘤的活体光热治疗效果
(1)活体肿瘤光热效应:裸鼠的a549肿瘤造模制备方法同实施例3步骤
(1),当肿瘤生长至直径约4mm时,将造模裸鼠随机分为4组,分别尾静脉注射200μlam-pp@icgnps复合探针溶液(实验组),pp@icgnps溶液和icg水溶液(对照组),以及pbs缓冲液(空白对照组),icg浓度为0.5mg/ml,24h后腹腔注射1%戊巴比妥钠麻醉裸鼠,让各组裸鼠肿瘤完全暴露在激光(波长765nm,光功率密度为0.4w/cm2)下照射15min,期间用近红外热像仪检测不同时间节点肿瘤部位的温度变化。对应的温度变化过程如图5a所示,当照射时间为3min时,各纳米探针富集肿瘤升温基本能达到一个稳定值,随时间增加温度几乎不再变化,其中实验组细胞膜仿生am-pp@icgnps探针注射的肿瘤温度能从27℃升高到48.4℃(图5b),而对照组pp@icgnps和icg探针注射的肿瘤温度分别只能升到41.2℃和39.6℃,空白对照组注射pbs肿瘤温度受激光的作用能升到37.5℃。该实验结果说明细胞膜仿生am-pp@icgnps探针能通过同源靶向作用富集在肿瘤部位,并在激光照射下能产生明显光热效应,可用于肿瘤的光热治疗。
(2)活体光热治疗:将a549肿瘤造模裸鼠随机分为4组,每组6只,注射给药和激光照射方法同实施例5步骤(1),分别在第1、6、12天共进行三次注射给药,每次给药结束后测量裸鼠体重以及肿瘤体积的大小,观察周期一共为18天,从而得到肿瘤光热治疗结果。实验结果如图5c所示,对照组肿瘤均有明显突出及增长,其中pbs注射裸鼠肿瘤体积增长6倍,icg注射裸鼠肿瘤体积增长5.5倍,pp@icgnps注射裸鼠肿瘤体积增长4倍,而实验组细胞膜仿生am-pp@icgnps探针注射的肿瘤缩小到原来的0.8倍,说明am-pp@icgnps探针具有高效光热效应和抑制肿瘤生长效果。另外,通过检测治疗周期内裸鼠的体重,从图5d可见,各组裸鼠体重持续增加,辅助说明该纳米材料对裸鼠没有明显的毒性作用。
- 还没有人留言评论。精彩留言会获得点赞!