氢化镁制氢助剂的应用、氢化镁制氢混合试剂以及氢化镁制氢方法与流程
本发明属于氢化镁制氢技术领域,具体涉及一种氢化镁制氢助剂的应用、氢化镁制氢混合试剂以及氢化镁制氢方法。
背景技术:
随着燃料电池在车载及轻便电源领域的迅猛发展,作为燃料电池最佳燃料的氢源愈加受到重视并大力研发,其中,基于活性金属及其氢化物的水解制氢技术,近年来引起了国内外同行的广泛关注。
在众多的制氢储氢材料中,mgh2具有高储氢密度、资源丰富、再生工艺成熟等优点被视为应用前景光明的水解制氢材料,可作为便捷式燃料电池提供氢源。氢化镁(mgh2)在常温下可与水反应产生氢气,并放出大量的热能,其化学反应方程式如下。
mgh2+2h2o→mg(oh)2+2h2,产氢6.4wt.%,δh=-268kj/mol(eq.1)
该反应是放热反应,理论上在没有催化剂的条件下,反应也能进行。实际上在反应的初始阶段,mgh2能迅速发生水解,但是随着反应的进行,生成的难溶于水的产物mg(oh)2会形成钝化层包覆住未反应的mgh2颗粒(图),会严重破坏水解反应的持续性,致使反应速率和转化率不高。lukashev认为mgh2的水解反应分为两个部分,第一部分反应较迅速,其控制因素主要是mgh2颗粒的晶粒尺寸和比表面积。在第二部分,由于mg(oh)2钝化层的形成阻碍了反应的继续进行,所以其控制环节主要是水通过钝化层的扩散率。
为了解决mg(oh)2钝化层的阻碍作用从而提高mgh2水解制氢的制氢效率和反应速率,目前采用的主要方法有球磨原料、改变水溶液成分、贵金属或氢化物掺杂等方法。
球磨可以有效地细化mgh2的颗粒,增加材料的表面积,同时在机械力的作用下,颗粒内部以产生大量缺陷的方式将机械能以化学能的形式储存起来,使球磨后镁基材料处于一种高能活性状态。grosjean等研究球磨对mgh2水解性能的改性发现,当球磨时间从0h增加至10h时,mgh2的比表面积由原先的1.1先提高至12.2m2g-1,之后又降至7.8m2g-1,而水解测试结果也验证了材料的比表面积与水解性能存在着一定联系。在简单球磨的基础上长时间球磨获得纳米晶进一步提高改性效果。尽管球磨可以提升mgh2的反应活性,但对于纯mgh2而言,这种方法提高的转化率均不超过30%,改性幅度并不理想。
改变水溶液成分则多使用酸性溶液作为添加剂,而酸性溶液的加入会增加装置的复杂程度,且酸性物质在高温容易分解或者生成杂质气体,降低氢气的纯度。
采用贵金属作为催化剂会在一定程度上增加制氢成本,并且氢化物的不稳定性也容易造成混合体系具有较高的危险性,不易于保存、运输和使用。
针对以上问题,有人提出了利用氢化镁和水蒸气的气固反应来制备氢气,但是,此法虽提高了mgh2水解制氢的制氢效率和反应速率,但是需要额外增加的供电装置长时间工作才能维持水蒸气的供给,从而达到体系的稳定放氢的阶段,这些加热器大多为高功率的装置,长时间工作耗电量大。因此,如何能在较短时间内使mgh2与水蒸气快速启动活化,是其能否在工业化中大批量应用所亟待解决的问题。
在氢化镁的实际应用中,存在着反应动力学和热力学性能较差、放氢速度慢等问题;其中氢化镁的水解反应过程中存在的副产物mg(oh)2难溶于水,而且容易很包覆未反应的氢化镁颗粒,从而严重破坏了水解反应的持续性,致使反应速率和转化率均较低。
专利us7951349b2介绍了利用水蒸气-氢化物反应产氢发电的燃料电池,但是,此法是通过电加热的方式产生水蒸气从而维持氢化物的长时间和高转化率的放氢,因而需要大量的电能维持反应的进行,这无疑极大的降低了氢化镁产氢燃料电池的应用效率。
技术实现要素:
为解决现有技术的不足,本发明提供了一种氢化镁制氢助剂、氢化镁制氢混合试剂以及氢化镁制氢方法。
本发明所提供的技术方案如下:
一种氢化镁制氢助剂的应用,以氢化镁制氢助剂中的任意一种或多种的混合作为氢化镁制氢的助剂,其中:所述氢化镁制氢助剂为溶解焓小于零的物质。
基于上述技术方案,溶解焓小于零的物质在溶解过程中会产生大量的溶解热,提高了局部水温,活化局部反应,促进了mgh2/h2o反应加速进行。
具体的,所述氢化镁制氢助剂为溶解焓小于零的盐。
基于上述技术方案,溶解焓小于零的盐这一类氢化镁制氢助剂在溶解过程中会产生大量的溶解热,提高了局部水温,活化局部反应。这些都促进了mgh2/h2o反应加速进行。
具体的,所述氢化镁制氢助剂为溶解焓小于零的碱金属氢氧化物。
基于上述技术方案,碱金属氢氧化物这一类氢化镁制氢助剂在溶解过程中会产生大量的溶解热,提高了局部水温,活化局部反应。这些都促进了mgh2/h2o反应加速进行。
进一步的,各所述盐具有可对mg(oh)2进行点腐蚀的阴离子。
基于上述技术方案,一方面,氢化镁制氢助剂在溶解过程中会产生大量的溶解热,提高了局部水温,活化局部反应。另一方面水解产生的阴离子可以取代mg(oh)2中的oh-造成点蚀,破坏mg(oh)2钝化膜的致密性,使得水可以持续进入到mgh2颗粒表面,从而提升反应的持续性,加速反应进程。
进一步的,各所述盐的阴离子为硫酸根离子或氯离子。
基于上述技术方案,一方面氢化镁制氢助剂在溶解过程中会产生大量的溶解热,提高了局部水温,活化局部反应。另一方面水解产生的cl-/so42-可以取代mg(oh)2中的oh-造成点蚀,破坏mg(oh)2钝化膜的致密性,使得水可以持续进入到mgh2颗粒表面,从而提升反应的持续性,加速反应进程。
具体的,各所述盐的阳离子为铝离子、钙离子、铜离子、铁离子、亚铁离子、镁离子或锌离子。
具体的,各所述碱金属氢氧化物的阳离子为钠离子、钾离子或锂离子。
优选的,各所述盐的溶解焓小于-20kj/mol-1。
优选的,所述氢化镁制氢助剂还包括硼氢化钠,硼氢化钠与氢化镁制氢助剂的重量百分比为0~30%(包括端值30%和端值0%)。
上述技术方案添加硼氢化钠,一方面硼氢化钠作为良好的储氢材料可以水解制备氢气,另一方面,其在氢化镁水解制氢过程中与制氢助剂相互作用,可有效提高制氢效率。
本发明还提供了一种氢化镁制氢混合制剂,包括重量百分比为0~20%(包括端值20%,但不包括端值0%)的氢化镁制氢的助剂和mgh2,所述氢化镁制氢的助剂选自氢化镁制氢助剂中的任意一种或多种的混合,其中:所述氢化镁制氢助剂为溶解焓小于零的物质。
基于上述技术方案,溶解焓小于零的物质在溶解过程中会产生大量的溶解热,提高了局部水温,活化局部反应,促进了mgh2/h2o反应加速进行。
具体的,所述氢化镁制氢助剂为溶解焓小于零的盐。
基于上述技术方案,溶解焓小于零的盐这一类氢化镁制氢助剂在溶解过程中会产生大量的溶解热,提高了局部水温,活化局部反应。这些都促进了mgh2/h2o反应加速进行。
具体的,所述氢化镁制氢助剂为溶解焓小于零的碱金属氢氧化物。
基于上述技术方案,碱金属氢氧化物这一类氢化镁制氢助剂在溶解过程中会产生大量的溶解热,提高了局部水温,活化局部反应。这些都促进了mgh2/h2o反应加速进行。
进一步的,各所述盐具有可对mg(oh)2进行点腐蚀的阴离子。
基于上述技术方案,一方面,氢化镁制氢助剂在溶解过程中会产生大量的溶解热,提高了局部水温,活化局部反应。另一方面水解产生的阴离子可以取代mg(oh)2中的oh-造成点蚀,破坏mg(oh)2钝化膜的致密性,使得水可以持续进入到mgh2颗粒表面,从而提升反应的持续性,加速反应进程。
进一步的,各所述盐的阴离子为硫酸根离子或氯离子。
基于上述技术方案,一方面氢化镁制氢助剂在溶解过程中会产生大量的溶解热,提高了局部水温,活化局部反应。另一方面水解产生的cl-/so42-可以取代mg(oh)2中的oh-造成点蚀,破坏mg(oh)2钝化膜的致密性,使得水可以持续进入到mgh2颗粒表面,从而提升反应的持续性,加速反应进程。
具体的,各所述盐的阳离子为铝离子、钙离子、铜离子、铁离子、亚铁离子、镁离子或锌离子。
具体的,各所述碱金属氢氧化物的阳离子为钠离子、钾离子或锂离子。
优选的,各所述盐的溶解焓小于-20kj/mol-1。
优选的,所述氢化镁制氢助剂还包括硼氢化钠,硼氢化钠与氢化镁制氢助剂的重量百分比为0~30%(包括端值0%和30%)。
上述技术方案添加硼氢化钠,一方面硼氢化钠作为良好的储氢材料可以水解制备氢气。另一方面,硼氢化钠的电子结构与mgh2相互作用,使得mgh2易与h2o发生水解反应,并与溶解焓小于零的助剂协同作用,提高mgh2的水解制氢率。
本发明还提供了一种氢化镁制氢的方法,包括以下步骤:采用本发明所提供的氢化镁制氢混合制剂制氢。
上述技术方案采用本发明所提供的氢化镁制氢助剂,这些物质一方面在溶解过程中会产生大量的溶解热,提高了局部水温,活化局部反应。同时水解过程会降低溶液的ph值,这些都促进了mgh2/h2o反应加速进行。另一方面水解产生的cl-/so42-可以取代mg(oh)2中的oh-造成点蚀,破坏mg(oh)2钝化膜的致密性,使得水可以持续进入到mgh2颗粒表面,从而提升反应的持续性,加速反应进程。
具体的,在水蒸气的气氛条件下制氢,或者,在液态水中制氢,或者,在醇的水溶液中制氢。
优选的,在液态水中制氢,或者是在5wt%-55wt%乙醇水溶液中制氢,或者是在20wt%-60wt%的丙三醇水溶液中制氢,
基于上述技术方案中,可以避免水蒸气制氢所需要的加热气化步骤,从而节约了能量,扩大了氢化镁制氢的应用范围。
本发明所采用的方法工艺流程简单,成本低廉,启动时间短,氢气制备效率高,环保无污染,易于批量生产。
附图说明
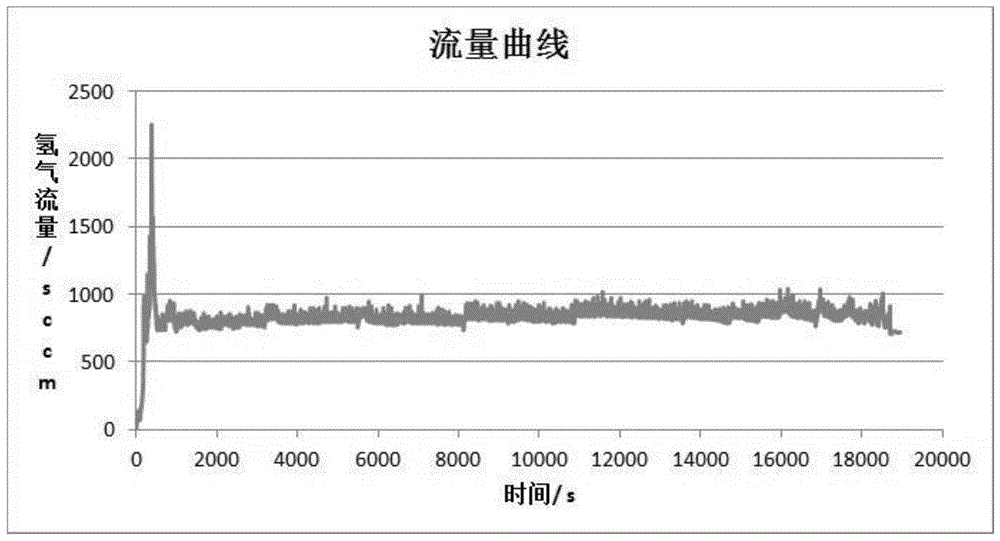
图1是本发明实施例1的氢化镁快速启动实验放氢流量曲线图。
图2是本发明实施例1的反应过程中的放氢率曲线。
具体实施方式
以下对本发明的原理和特征进行描述,所举实施例只用于解释本发明,并非用于限定本发明的范围。
实施例1
1)、在氮气保护的手套箱中,按质量比将氢化镁:x粉末=1:0.15混合,随后将其机械搅拌,混合均匀,制备成反应粉a。
2)、将反应粉a置于反应容器中,待液态水通入反应粉a中液态水,开始制氢反应。
3)、x粉末的成分为alcl3。
制氢反应开始后,在1min内即可收集到氢气,待反应结束后,经氢气收集后计算可知,制氢效率为90%以上。
图1为本实施例所制备氢化镁快速启动实验放氢曲线,结合图1并考虑到管路延迟导致的系统误差,开始打水后1min左右就已经可以大量而且稳定的收集氢气,反应迅速。
图2为反应过程中的放氢率曲线,到反应最后放氢率为93.8%,氢气转换率高。放氢率的计算方法为:理论产氢量/实际产氢量×100%。
实施例2
1)、在氮气保护的手套箱中,按质量比将氢化镁:x粉末=1:0.2混合,随后将其机械搅拌,均匀混合,制备成反应粉a。
2)、将反应粉a置于反应容器中,待反应粉a与水蒸气接触后,开始制氢反应。
3)、x粉末的成分为cacl2。
制氢反应开始后,在2min内即可收集到氢气,待反应结束后,经氢气收集后计算可知,制氢效率在88%以上。
实施例3
1)、在氮气保护的手套箱中,按质量比将氢化镁:x粉末=1:0.3混合,,随后将其机械搅拌,均匀混合,制备成反应粉a。
2)、将反应粉a置于反应容器中,待反应粉a与液体水接触后,开始制氢反应。
3)、x粉末的成分为cuso4。
制氢反应开始后,在1min内即可收集到氢气,待反应结束后,经氢气收集后计算可知,制氢效率在90%以上。
实施例4
1)、在氮气保护的手套箱中,按质量比将氢化镁:x粉末=1:0.08,随后将其机械搅拌,均匀混合,制备成反应粉a。
2)、将反应粉a置于反应容器中,待反应粉a与液态水接触后,开始制氢反应。
3)、x粉末的成分为fecl2。
制氢反应开始后,在1min内即可收集到氢气,待反应结束后,经氢气收集后计算可知,制氢效率在90%以上。
实施例5
1)、在氮气保护的手套箱中,按质量比将氢化镁:x粉末=1:0.06,随后将其机械搅拌,均匀混合,制备成反应粉a。
2)、将反应粉a置于反应容器中,待反应粉a与液态水接触后,开始制氢反应。
3)、x粉末的成分为fecl3。
制氢反应开始后,在1min内即可收集到氢气,待反应结束后,经氢气收集后计算可知,制氢效率在90%以上。
实施例6
1)、在氮气保护的手套箱中,按质量比将氢化镁:x粉末=1:0.25,随后将其机械搅拌,均匀混合,制备成反应粉a。
2)、将反应粉a置于反应容器中,待反应粉a与水蒸气接触后,开始制氢反应。
3)、x粉末的成分为feso4。
制氢反应开始后,在1min内即可收集到氢气,待反应结束后,经氢气收集后计算可知,制氢效率在89%以上。
实施例7
1)、在氮气保护的手套箱中,按质量比将氢化镁:x粉末=1:0.25,随后将其机械搅拌,均匀混合,制备成反应粉a。
2)、将反应粉a置于反应容器中,待反应粉a与液态水接触后,开始制氢反应。
3)、x粉末的成分为alcl3。
制氢反应开始后,在1min内即可收集到氢气,待反应结束后,经氢气收集后计算可知,制氢效率在90%以上。
实施例8
1)、在氮气保护的手套箱中,按质量比将氢化镁:x粉末=1:0.09,随后将其机械搅拌,均匀混合,制备成反应粉a。
2)、将反应粉a置于反应容器中,待反应粉a与水蒸气接触后,开始制氢反应。
3)、x粉末的成分为mgso4。
制氢反应开始后,在1min内即可收集到氢气,待反应结束后,经氢气收集后计算可知,制氢效率在87%以上。
实施例9
1)、在氮气保护的手套箱中,按质量比将氢化镁:x粉末=1:0.11,随后将其机械搅拌,均匀混合,制备成反应粉a。
2)、将反应粉a置于反应容器中,待反应粉a与水蒸气接触后,开始制氢反应。
3)、x粉末的成分为zncl2。
制氢反应开始后,在1min内即可收集到氢气,待反应结束后,经氢气收集后计算可知,制氢效率在90%以上。
实施例10
1)、在氮气保护的手套箱中,按质量比将氢化镁:x粉末=1:0.07,随后将其机械搅拌,均匀混合,制备成反应粉a。
2)、将反应粉a置于反应容器中,待反应粉a与水蒸气接触后,开始制氢反应。
3)、x粉末的成分为znso4。
制氢反应开始后,在1min内即可收集到氢气,待反应结束后,经氢气收集后计算可知,制氢效率在85%以上。
实施例11
1)、在氮气保护的手套箱中,按质量比将氢化镁:x粉末=1:0.05,随后将其机械搅拌,均匀混合,制备成反应粉a。
2)、将反应粉a置于反应容器中,待反应粉a与液态水接触后,开始制氢反应。
3)、x粉末的成分为naoh。
制氢反应开始后,在1min内即可收集到氢气,待反应结束后,经氢气收集后计算可知,制氢效率在90%以上。
实施例12
1)、在氮气保护的手套箱中,按质量比将氢化镁:x粉末=1:0.08,随后将其机械搅拌,均匀混合,制备成反应粉a。
2)、将反应粉a置于反应容器中,待反应粉a与液态水接触后,开始制氢反应。
3)、x粉末的成分为koh。
制氢反应开始后,在1min内即可收集到氢气,待反应结束后,经氢气收集后计算可知,制氢效率在90%以上。
实施例13
1)、在氮气保护的手套箱中,按质量比将氢化镁:x粉末=1:0.24,随后将其机械搅拌,均匀混合,制备成反应粉a。
2)、将反应粉a置于反应容器中,待反应粉a与水蒸气接触后,开始制氢反应。
3)、x粉末的成分为lioh。
制氢反应开始后,在1min内即可收集到氢气,待反应结束后,经氢气收集后计算可知,制氢效率在88%以上。
实施例14
1)、在氮气保护的手套箱中,按质量比将氢化镁:x粉末:硼氢化钠=1:0.07:0.0084,随后将其机械搅拌,均匀混合,制备成反应粉a。
2)、将反应粉a置于反应容器中,待反应粉a与水蒸气接触后,开始制氢反应。
3)、x粉末的成分为znso4。
制氢反应开始后,在1min内即可收集到氢气,待反应结束后,经氢气收集后计算可知,制氢效率在90%以上。
实施例15
1)、在氮气保护的手套箱中,按质量比将氢化镁:x粉末=1:0.05,随后将其机械搅拌,均匀混合,制备成反应粉a。
2)、将反应粉a置于反应容器中,待反应粉a与重量百分比23wt%乙醇-77wt%水溶液接触后,开始制氢反应。
3)、x粉末的成分为naoh。
制氢反应开始后,在1min内即可收集到氢气,待反应结束后,经氢气收集后计算可知,制氢效率在90%以上。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!