抗BLyS抗体的制作方法
本发明属于生物医药领域,涉及抗BLyS抗体及其应用,所述抗BLyS抗体能够与B淋巴细胞刺激因子结合并且能够抑制B淋巴细胞刺激因子与其受体BR3-Fc结合。进一步涉及与MHCII因子亲和力低的人源化抗BLyS抗体及其应用。
背景技术:
系统性红斑狼疮(systemiclupuserythematosus,SLE)是一种累及全身多个系统如皮肤、关节、心脏、肺、肾、血液以及大脑的弥慢性进行性、常以缓解和复发交替出现的自身免疫性疾病。系统性红斑狼疮主要影响非洲-加勒比人、亚洲人和西班牙裔人,而高加索人(白种人)受其影响的程度则较小。美国狼疮基金会认为,保守预测系统性红斑狼疮在美国影响到30万人。而Datamonitor公司估计,仅在中国、印度和墨西哥三国就有220万系统性红斑狼疮患者,其中中国系统性红斑狼疮患者超过100万,为全球之最。由于系统性红斑狼疮初期症状比较隐蔽,因此实际病患人数可能远大于目前估计。由此可见临床在系统性红斑狼疮的诊断和治疗方面均存在极大的客观需求。系统性红斑狼疮的成因复杂且不明确,并非单一因素引起,可能与遗传、环境、性激素及免疫等多种因素有关。目前,世界科学界公认的系统性红斑狼疮的病因是由于在细胞水平上,自反应B细胞在外周组织中存在时间过长,产生人体自身抗原而造成自身免疫。所以如果可以抑制早期B细胞的生长增殖,则可以治疗红斑狼疮疾病。B淋巴细胞刺激因子(BLymphocyteStimulator,BLyS),又称Tall-1(TNFandApolrelatedleukocyteexpressedligand1)、BAFF(BcellactivatingfactorbelongingtotheTNFfamily)、THANK(TNFhomologuesthatactivateapoptosis,NF-κBandJNK),属肿瘤坏死因子(TNF)家族,是由舒红兵等人于1999年首先发现并克隆的一种新的细胞因子。BLyS作为一种B淋巴细胞的共刺激因子,在anti-IgM和IL-4存在下,它可以专一刺激B细胞增殖和分化,在体液免疫中起着极其重要作用;而其在体内的过量表达又与自身免疫性疾病密切相关。体外实验表明,在用IgM预活化B细胞后,BLyS能诱导其大量增殖并分泌大量IgM和IgA,但是,对于静息期间B细胞,这种刺激作用却不明显(3)。进一步的研究表明,BLyS主要作用于前B淋巴细胞、未成熟B淋巴细胞、激活淋巴细胞,而对浆细胞、淋巴多功能干细胞没有作用。同大多数细胞因子相同,BLyS主要是通过B细胞表面受体而刺激下游信号传导。多个研究小组证实与BLyS结合的受体是:B细胞活化因子受体(BR3、BLySreceptor3或BAFF-R)、穿膜蛋白活化物(transmembraneactivator–1andcalciummodulatorandcyclophilinligand–interactor,TACI)和B细胞成熟抗原(BcellmaturationAntigen,BCMA)。这种特异性决定了BLyS是针对B细胞抗体介导的自身免疫疾病和淋巴癌中一个很好的标靶。抗BLyS的治疗性抗体在体内和体外已经被证明可以有效抑制B细胞生长、IgA和IgM分泌从而达到治疗系统性红斑狼疮的效果(EdwardsBM等,Theremarkableflexibilityofthehumanantibodyrepertoire;isolationofoveronethousanddifferentantibodiestoasingleprotein,BLyS.JMolBiol.2003Nov14;334(1):103-18;BakerKP等,GenerationandcharacterizationofLymphoStat-B,ahumanmonoclonalantibodythatantagonizesthebioactivitiesofBlymphocytestimulator.ArthritisRheum.2003Nov;48(11):3253-65)。美国人类基因组公司开发的抗BLyS抗体Benlysta成为过去60年来世界首个治疗红斑狼疮的新型药物。Benlysta只针对BLyS刺激的B细胞,与化疗药物相比,大大降低了治疗过程中的副作用,因此为系统性红斑狼疮患者提供了一个安全有效的治疗方法。近年来针对BLyS的靶向治疗研究与临床应用迅速发展,除美国人类基因组公司外,其他公司均是采用在BLyS或其受体基础上改造的融合蛋白。美国基因泰克(Genentech)公司开发了BR3-FC药物、Zymogenetics公司开发了TACI-FC药物、安晋(AMGEN)公司开发了多肽-FC药物。与Benlysta相比,它们的特异性差,结合力弱,疗效相对较差,毒性较强。这三种药物均停止或终止在临床实验二期。所以,抗BLyS的抗体药物才是针对此靶点的有效药物方法。
技术实现要素:
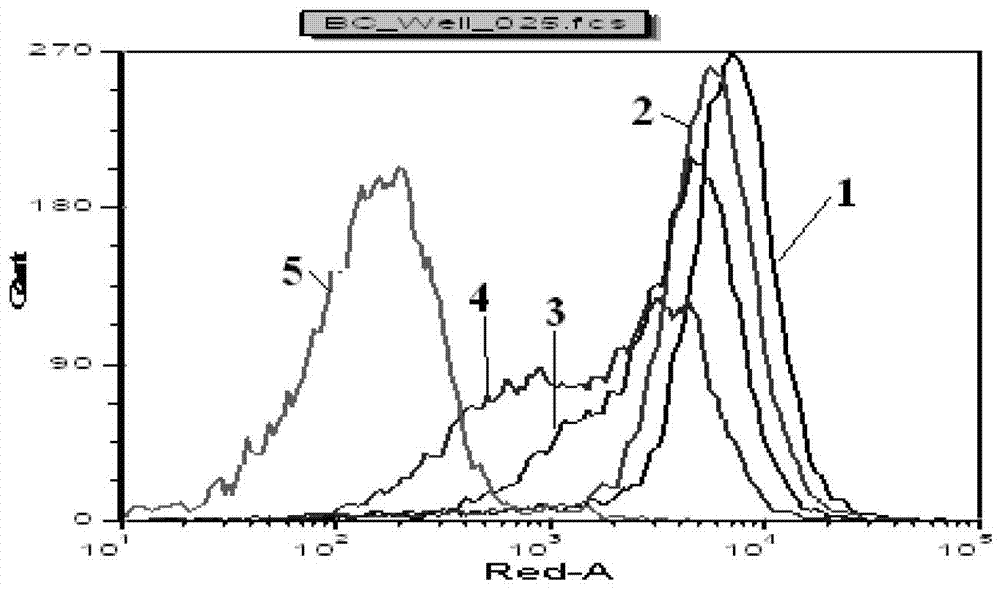
有鉴于此,本发明的目的在于提供抗BLyS抗体,所述抗体能够与B淋巴细胞刺激因子结合并且能够抑制B淋巴细胞刺激因子与其受体BR3-Fc的结合。为实现本发明的目的,本发明采用如下技术方案:本发明通过基因工程技术,提取人外周血RNA,以人外周血RNA外周血RNA为模板反转录获得人BLyS的cDNA,然后以人BLyS的cDNA为模板分别扩增获得人的BLyS基因片段,克隆到真核表达系统中转染宿主细胞表达并纯化获得人的BLyS纯化蛋白。以人的BLyS纯化蛋白为抗原免疫小鼠获得2000株不同单克隆杂交瘤细胞,通过酶标反应,共选出211株分泌的抗体可结合BLyS蛋白的克隆。在这211株杂交瘤细胞中,通过检测与BJAB上BLyS受体结合能力获得5株分泌的抗体可以不同能力的抑制生物素标记的BLyS与BJAB上BLyS受体结合的单克隆杂交瘤细胞,分别命名为1D12、2B10、2G3、5A5和13G8。用ELISA对所获得的5个单克隆杂交瘤细胞株分泌的抗体进行免疫学特性进行鉴定,结果显示本发明筛选得到的克隆杂交瘤细胞株分泌的抗体均特异性针对BLyS,而对其他TNF家族抗原如TNF-α、TNF-β,则没有反应性。进一步的,本发明提取各杂交瘤细胞RNA反转录获得cDNA,然后以cDNA为模板扩增各杂交瘤细胞所对应的可变区DNA序列,测序后利用www.expasy.ch对所得的序列进行系列分析,根据推导的氨基酸序列进行Kabat分类分析,确定各杂交瘤细胞分泌的抗体的轻链和重链的FR区和CDR区。其中,其轻链CDR1、CDR2和CDR3以及重链CDR1、CDR2和CDR3的氨基酸序列选自以下各组中的一组:其中,在一个实施方案中,所述单克隆杂交瘤细胞1D12分泌的抗BLyS抗体,含有SEQIDNO.31所示氨基酸序列的轻链可变区和SEQIDNO.32所示的氨基酸序列重链可变区,命名为单克隆抗体1D12。在一个实施方案中,所述单克隆杂交瘤细胞2B10分泌的抗BLyS抗体,含有SEQIDNO.33所示氨基酸序列的轻链可变区和SEQIDNO.34所示的氨基酸序列重链可变区,命名为单克隆抗体2B10。在一个实施方案中,所述单克隆杂交瘤细胞2G3分泌的抗BLyS抗体,含有SEQIDNO.35所示氨基酸序列的轻链可变区和SEQIDNO.36所示的氨基酸序列重链可变区,命名为单克隆抗体2G3。在一个实施方案中,所述单克隆杂交瘤细胞5A5分泌的抗BLyS抗体,含有SEQIDNO.37所示氨基酸序列的轻链可变区和SEQIDNO.38所示的氨基酸序列重链可变区,命名为单克隆抗体5A5。在另一个实施方案中,所述单克隆杂交瘤细胞13G8分泌的抗BLyS抗体,含有SEQIDNO.39所示氨基酸序列的轻链可变区和SEQIDNO.40所示的氨基酸序列重链可变区,命名为单克隆抗体13G8。当然,在不影响抗体活性的前提下,本领域技术人员根据上述SEQIDNO.31~40所示的氨基酸序列进行各种取代、添加和/或一个或几个氨基酸获得具有同等功能的氨基酸序列,它们都被视为包括在本发明保护的范围内。如在可变区将具有类似性质的氨基酸进行替换。然而,给予治疗性抗体的最大隐患是人体对外源抗体蛋白所引起的免疫应答,而产生抗抗体反应(AAR)。鼠源抗体作为外源蛋白,反复刺激人体,可引起超敏反应,被称为人抗鼠抗体反应(HAMA)。因此鼠源抗体在体内可能被抗抗体中和,进而被快速清除,甚至导致严重的过敏反应而致死。另外鼠源单克隆抗体缺乏人抗体具有的免疫效应功能,如ADCC和CDC作用,而使疗效不佳。因此为了进一步减低免疫原性,本发明将制备得到的鼠源抗体人源化,获得人源化抗BLyS抗体,其轻链可变区的氨基酸序列和重链可变区的氨基酸序列选自以下各组中的一组:I:SEQIDNO.41和SEQIDNO.42所示的氨基酸序列;II:SEQIDNO.43和SEQIDNO.44所示的氨基酸序列;III:SEQIDNO.45和SEQIDNO.46所示的氨基酸序列;IV:SEQIDNO.47和SEQIDNO.48所示的氨基酸序列;本发明所述人源化抗BLyS抗体不仅能够与B淋巴细胞刺激因子结合抑制B淋巴细胞刺激因子与其受体BR3-Fc的结合,而且与MHCII因子亲和力低,从而在保证亲和力的前提下,使免疫应答减低到最小。本发明所述人源化抗BLyS抗体还含有人类轻链恒定区和重链恒定区,且所述轻链可变区及重链可变区分别连接至人类轻链恒定区和重链恒定区。即所述人源化抗BLyS抗体含有完整的轻链和完整的重链,其中所述完整的轻链由抗BLyS抗体所含有的轻链可变区与人类轻链恒定区连接而成,所述完整的重链由抗BLyS抗体所含有的重链可变区与人类重链恒定区连接而成。优选的,所述人类轻链恒定区为人类轻链κ恒定区。优选的,所述人类重链恒定区为人类重链Fc片段。其中,所述人类轻链κ恒定区和人类重链Fc片段,均来源于健康人B淋巴细胞。通过基因工程技术,重叠延伸PCR连接可变区和恒定区得到完整的人源化抗BLyS抗体的轻链和重链。本发明还提供了编码本发明所述抗BLyS抗体或人源化抗BLyS抗体的DNA分子。由于密码子的简并性,可以存在很多种能够编码本发明所述的抗体的DNA分子。在一个实施方案中,本发明提供了编码具有SEQIDNO.31所示的氨基酸序列的轻链可变区的DNA分子,其核苷酸序列如SEQIDNO.49。在一个实施方案中,本发明提供了编码具有SEQIDNO.32所示的氨基酸序列的重链可变区的DNA分子,其核苷酸序列如SEQIDNO.50。在一个实施方案中,本发明提供了编码具有SEQIDNO.33所示的氨基酸序列的轻链可变区的DNA分子,其核苷酸序列如SEQIDNO.51。在一个实施方案中,本发明提供了编码具有SEQIDNO.34所示的氨基酸序列的重链可变区的DNA分子,其核苷酸序列如SEQIDNO.52。在一个实施方案中,本发明提供了编码具有SEQIDNO.35所示的氨基酸序列的轻链可变区的DNA分子,其核苷酸序列如SEQIDNO.53。在一个实施方案中,本发明提供了编码具有SEQIDNO.36所示的氨基酸序列的重链可变区的DNA分子,其核苷酸序列如SEQIDNO.54。在一个实施方案中,本发明提供了编码具有SEQIDNO.37所示的氨基酸序列的轻链可变区的DNA分子,其核苷酸序列如SEQIDNO.55。在一个实施方案中,本发明提供了编码具有SEQIDNO.38所示的氨基酸序列的重链可变区的DNA分子,其核苷酸序列如SEQIDNO.56。在一个实施方案中,本发明提供了编码具有SEQIDNO.39所示的氨基酸序列的轻链可变区的DNA分子,其核苷酸序列如SEQIDNO.57。在一个实施方案中,本发明提供了编码具有SEQIDNO.40所示的氨基酸序列的重链可变区的DNA分子,其核苷酸序列如SEQIDNO.58。进一步的,本领域技术人员可以将编码本发明所述抗BLyS抗体的DNA分子克隆到载体中,进而转化宿主细胞。因此,本发明还提供了一种重组DNA载体,其含有编码本发明所述抗BLyS抗体的DNA分子。优选的,所述重组DNA载体是一种表达载体,本领域技术人员将所述抗体的DNA分子克隆到表达载体中,转化宿主细胞,通过诱导表达获得单链抗体。在一个实施方案中,本发明所述重组DNA载体含有编码本发明所述人源化抗BLyS抗体的DNA分子。编码的人源化抗BLyS抗体的DNA分子可被重组构建用于哺乳动物转录表达的载体,本发明的表达载体含有编码的人源抗BLyS单克隆抗体的重链和轻链可变区和恒定区的DNA序列。然而,也可有分别构建两种表达载体,一种含有重量可变区和恒定区,另一种是含有轻链可变区和恒定区的,一同转染哺乳动物。表达载体进一步含有启动子和编码分泌信号肽的DNA序列,以及至少一种用于筛选的抗药基因。所用方法包括DNA合成技术和体外重组技术。本发明还提供了一种宿主细胞,其含有本发明所述的重组DNA载体。本发明所述宿主细胞可以为其为原核宿主细胞、真核宿主细胞或噬菌体。其中,所述原核宿主细胞可以为大肠杆菌、枯草杆菌、链霉菌或奇异变形菌等。所述真核宿主细胞,可以为如巴斯德毕赤酵母、酿酒酵母、裂殖酵母、木霉等真菌,如草地粘虫等昆虫细胞,如烟草等植物细胞,如BHK细胞、CHO细胞、COS细胞、骨髓瘤细胞等哺乳动物细胞。在一些实施方案中,本发明所述宿主优选为哺乳动物细胞,更优选的是BHK细胞、CHO细胞、NSO细胞或COS细胞。采用体外细胞学实验测定了本发明所述人源化抗BLyS抗体的免疫中和活性,结果显示本发明所述人源化抗BLyS抗体可以不同程度的抑制B细胞增殖,因此本发明还提供了所述抗BLyS抗体或人源化抗BLyS抗体在制备预防和/或治疗B细胞增殖过量引起的疾病的药物中的应用。所述B细胞增殖过量引起的疾病为系统性红斑狼疮、类风湿性关节炎、强制性关节炎或B细胞淋巴癌。本发明还提供了一种药物制剂,由有效剂量的本发明所述任意一种抗BLyS抗体或人源化抗BLyS抗体和药学上可接受的辅料组成。所述药物制剂可以通过常规方法用本发明所述抗BLyS抗体或人源化抗BLyS抗体中的任意一种与一种或多种药学上可接受的辅料混合制成药物制剂。其中“药学上可接受的辅料”是指一种或多种本领域技术人员公知的有机或无机、天然或合成的、与抗体联合可促进其稳定和临床应用的载体。合适的载体包括本领域技术人员已知到药学上可接受的无菌盐水及含水或无水等渗无菌液和无菌混悬液。本发明所述有效剂量和使用方法取决于诸多因素,包括患者的年龄、体重、性别、自然健康状况、营养状况、化合物的活性强度、给药时间、代谢速率、病程严重程度以及诊治医师的主观判断。本领域的技术人员根据上述因素可以容易地决定有效剂量和使用方法。附图说明图1示实施例1SDS-PAGE检测图,其中泳道A为本发明所述重组质粒表达的蛋白,泳道B空白载体重组质粒,泳道C为蛋白分子量Marker;图2示实施例2不同浓度生物素标记his-hBLyS重组蛋白与BJAB细胞结合的流式细胞图,其中线条1为200ng/mL生物素标记his-hBLyS重组蛋白组,线条2为100ng/mL生物素标记his-hBLyS重组蛋白组,线条3为50ng/mL生物素标记his-hBLyS重组蛋白组,线条4为25ng/mL生物素标记his-hBLyS重组蛋白组,线条5为不含生物素标记his-hBLyS重组蛋白仅含有SA-APC组;图3示实施例3免疫小鼠的血清与BJAB细胞结合的流式细胞图;图4示实施例4单克隆杂交瘤细胞分泌的抗体与BJAB细胞上BLyS受体结合的流式细胞图,其中线条1为负对照IgG组,线条2为不含生物素标记his-hBLyS重组蛋白仅含有SA-APC组,线条3为单克隆杂交瘤细胞3H9,线条4为单克隆杂交瘤细胞13G8;图5示实施例4单克隆杂交瘤细胞分泌的抗体与BJAB细胞上BLyS受体结合的流式细胞图,其中线1条为负对照IgG组,线条2为单克隆杂交瘤细胞1D12组,线条3为单克隆杂交瘤细胞2B10,线条4为单克隆杂交瘤细胞2G3;图6示实施例4单克隆杂交瘤细胞分泌的抗体与BJAB细胞上BLyS受体结合的流式细胞图,其中线条1为负对照IgG组,线条2为单克隆杂交瘤细胞5A5组,线条3为单克隆杂交瘤细胞1D7组,线条4为单克隆杂交瘤细胞4D3组;图7示实施例4单克隆杂交瘤细胞1D12、2B10、2G3、5A5和13G8分泌的抗体与his-hBLyS重组蛋白和肿瘤坏死因子(TNF)家族蛋白酶联免疫吸附试验结果图;图8示实施例9人源化抗BLyS抗体体外抑制B细胞增殖结果图,其中横坐标为人源化抗BLyS抗体浓度,纵坐标为荧光值。具体实施方式本发明实施例公开了抗BLyS抗体及其应用。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的产品已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法进行改动或适当变更与组合,来实现和应用本发明技术。为了进一步理解本发明,下面结合实施例对本发明提供进行详细说明。实施例1:人BLyS基因的克隆与表达分离健康人外周血,以商用RNA试剂盒(Qiagen公司)提取总RNA并纯化。以纯化的总RNA为模板,进行逆转录合成cDNA第一链cDNA反应体系如下:加入灭菌蒸馏水补足体系总量20μL。反应条件为:30℃10min,42℃30min,99℃5min,4℃5min。反应结束后冰浴5min。根据人的BLyS的全长DNA序列,设计合成克隆分泌型BLyS引物P1和P2,以逆转录合成的cDNA为模板,以上游引物P1和下游引物P2进行PCR扩增。其中P1和P2为的核苷酸序列如下:P1:5’tacgaagcttgcatcatcatcatcatcatggcggcggctccggcggcggctccccgttcagggtccagaagaa;P2:5’cgacgtcgactcacagcagtttcaatgcaccaaaaaatgtgacatc。PCR扩增反应体系为:加入灭菌蒸馏水补足体系总量50μL。PCR反应程序为:将PCR扩增产物凝胶电泳回收,用SalI和HindIII双酶切,克隆到pCDNA3.1真核表达质粒系统,以空白载体转化质粒作对照,转染293T细胞(中国典型培养物保藏中心)3天后,收集培养基上清液,所得上清通过His亲和层析纯化得到his-hBLyS纯化蛋白,SDS-PAGE检测,结果见图1。由图1结果可见,本发明所述重组质粒有蛋白表达,但是空白载体重组质粒却没有明显蛋白表达条带。本发明所述重组质粒蛋白大小约为23Kb,与根据人BLyS氨基酸序列推断的分子量23Kb接近。实施例2:检测与BJAB细胞上受体结合的能力1、生物素标记his-hBLyS重组蛋白将实施例1纯化得到his-hBLyS重组蛋白与溶解于DMSO中的生物素-xx-NHS按ng/mL计以1:4的重量体积比混合,室温放置1小时,将反应混合物通过凝胶柱,分离生物素标记的his-hBLyS和游离生物素。2、生物素标记his-hBLyS重组蛋白与BJAB细胞结合将分离得到的生物素标记的his-hBLyS重组蛋白分为25ng/mL、50ng/mL、100ng/mL和200ng/mL四个不同浓度组,分别与1×106的伯基特淋巴瘤细胞(BJAB)细胞混合,在4摄氏度孵育15分钟,PBS洗涤3次,加入straptavidinallophycocyanin(SA-APC)使其终浓度为0.2μg/mL,在4℃孵育20分钟。以PBS洗涤3次后上细胞流式仪检测,检测结果见图2。由图2结果可见,生物素标记的重组人BLyS蛋白在不同浓度下均可以和BJAB细胞结合。实施例3:免疫小鼠将实施例1纯化得到his-hBLyS重组蛋白作为抗原与等量免疫佐剂(福氏佐剂)混合,取4只6周大雌性FVB小鼠,其中3只进行免疫,另一只进行对照模拟实验。在初次免疫以后,每一周进行一次加强免疫。在最后一针加强免疫前,从免疫的小鼠心脏取血,将其血清中与生物素标记的his-hBLyS重组蛋白(浓度50ng/mL)混合并在室温孵育20分钟。然后将混合物与BJAB细胞在4℃孵育15分钟,以生理盐水洗脱3次后,加入0.2μg/mL的straptavidinallophycocyanin并在4℃孵育15分钟。以生理盐水洗脱3次后,将样品上流式细胞仪检测所免疫小鼠的血清其是否可以抑制BLyS和其受体BR3-Fc结合,结果见图3。由图3结果可见三只免疫小鼠中小鼠1所取得血清可有效抑制生物素标记的his-hBLyS重组蛋白与BJAB细胞结合,所以选取小鼠1作为后续实验个体,进行下一步融合实验。实施例4:细胞融合与单克隆杂交瘤细胞筛选在最后一针加强免疫后,取小鼠大腿根处淋巴结,在生理盐水中碾磨后取富含B细胞的悬浮液,按常规方法电转与骨髓瘤细胞SP2/0融合。将融合细胞分配于96孔盘,在含有HAT的RPMI-1640完全培养基中置于5%CO2、37℃条件下培养。在不同单克隆杂交瘤细胞中,通过酶标反应,筛选出211个分泌的抗体可结合BLyS蛋白的克隆。将可结合BLyS蛋白的211个克隆产生的抗体分别与生物素标记的his-hBLyS重组蛋白混合室温孵育20分钟。然后将混合物与BJAB细胞在4℃孵育15分钟,以生理盐水洗脱3次后,加入0.2μg/mL的straptavidinallophycocyanin并在4℃孵育15分钟。以生理盐水洗脱3次后,将样品上流式细胞仪检测以筛选可以抑制生物素标记的his-hBLyS重组蛋白和BJAB细胞结合的单克隆杂交瘤细胞。结果共有11个单克隆杂交瘤细胞分泌的抗体可以不同程度的抑制生物素标记的his-hBLyS重组蛋白与BJAB上BLyS受体结合,如表1所示,其中命名为1D12、2B10、2G3、5A5和13G8的单克隆杂交瘤细胞分泌的抗体比3H9,1D7,4D3的单克隆杂交瘤细胞分泌的抗体有更强的抑制力。1D12、2B10、2G3、5A5和13G8的检测结果见图4-6。表1抑制生物素标记的his-hBLyS重组蛋白与BJAB上BLyS受体结合的细胞分泌的抗体亚型克隆亚型11D12IgG2b/kappa22B10IgG2b/kappa32G3IgG2a/kappa45A5IgG3/kappa513G8IgG2a/kappa61D7IgG2a/kappa72A9IgG1/kappa84D3IgG2a/kappa95E5IgG3/kappa105F4IgG1/kappa115H5IgG2b/kappa实施例5:检验与其它肿瘤坏死因子(TNF)家族蛋白的结合为进一步检验候选抗体的结合特异性,分别在96孔酶标板加入上1μg/mL的his-hBLyS重组蛋白、肿瘤坏死因子-α(TNF-α)、肿瘤坏死因子(TNF-β)和BSA,在0.05MPH9.0的碳酸盐包被缓冲液中,4℃静置过夜。次日,弃去孔内溶液,用洗涤缓冲液洗3次。然后加入含有3%BSA的PBS溶液封闭20分钟。用洗涤缓冲液洗3次后加入100μL稀释后的1D12、2B10、2G3、5A5和13G8单克隆杂交瘤细胞分泌的抗体,室温孵育1小时后用洗涤缓冲液冲洗3次,用洗涤缓冲液以1:10000倍稀释辣根过氧化物酶(HorseradishPeroxidase,HRP)交联羊抗小鼠抗体,室温孵育1小时,经洗涤缓冲液冲洗3次后,加入50μL3,3',5,5'-四甲基联苯胺(3,3',5,5'-Tetramethylbenzidine,TMB)底物溶液显色,室温反应10分钟后,以25μL0.5M的硫酸溶液终止反应并在450nm处读出吸光度,统计结果见图7。由图7结果可见,1D12、2B10、2G3、5A5和13G8单克隆杂交瘤细胞分泌的抗体均识别结合BLyS,但它们均不识别TNF-α或者TNF-β。实施例6:单克隆杂交瘤细胞分泌的抗体可变区序列的确定将筛选获得的单克隆杂交瘤细胞1D12、2B10、2G3、5A5和13G8进行培养,1000rpm离心收集细胞,按实施例1所述方法提取的各杂交瘤细胞RNA反转录合成cDNA第一链。以合成cDNA第一链为模板扩增杂交瘤细胞所对应的可变区DNA序列。扩增反应中所使用的引物序列如下:重链扩增所需引物:引物1:5’atgg(ag)atg(cg)agctg(tg)gt(ca)at(cg)ctctt;引物2:5’ggggatatccaccatg(ag)acttcggg(tc)tgagct(tg)ggtttt;引物3:5’gggtatatccaccatggctgtcttggggctgctcttct;轻链扩增所需引物:引物1:5’atggagacagacacactcctgctat;引物2:5’atggattttcaagtgcagattticag;引物3:5’atggag(ta)caca(gt)(ta)ctcaggtcttt(ga)ta;引物4:5’atg(gt)cccoat)(ga)ctcag(ct)t(ct)ct(tg)gt;扩增反应体系为加入灭菌蒸馏水补足体系总量50μL。PCR反应程序为:将PCR扩增产物凝胶电泳回收,送生物公司测序,测序后利用www.expasy.ch对所得的序列进行系列分析,其轻链可变区和重链可变区氨基酸序列如表2所示,根据推导的氨基酸序列进行Kabat分类分析,确定1D12、2B10、2G3、5A5和13G8各杂交瘤细胞轻链和重链的FR区和CDR区,其中,1D12、2B10、2G3、5A5和13G8各杂交瘤细胞轻链可变区的氨基酸序列和重链可变区的氨基酸序列见表2:表2抗BLyS抗体轻链可变区和重链可变区氨基酸序列轻链可变区氨基酸序列重链可变区氨基酸序列1D12SEQIDNO.31SEQIDNO.322B10SEQIDNO.33SEQIDNO.342G3SEQIDNO.35SEQIDNO.365A5SEQIDNO.37SEQIDNO.3813G8SEQIDNO.39SEQIDNO.40实施例7:抗BLyS抗体的人源化根据各杂交瘤细胞分泌的抗体的可变区序列,进行人源化改造。人源化改造过程主要涉及以下几个关键步骤:A、把各杂交瘤细胞分泌的抗体的基因序列与人胚胎系抗体基因序列进行比对,找出同源性高的序列;B、根据insilicon分析考察HLA-DR亲和性,选出亲和力低的人胚胎系框架序列;C、利用计算机模拟技术,应用分子对接分析可变区及其周边的框架氨基酸序列,考察其空间立体结合方式。通过计算静电力,范德华力,亲疏水性和熵值,分析各杂交瘤细胞分泌的抗体基因序列中可能与BLyS作用以及维护空间构架的关键氨基酸个体,将其嫁接回已经选择的人胚胎系基因框架。在其基础上,获得4个不同人源化抗BLyS抗体,其轻链可变区和重链可变区序列如表3所示。表3人源化抗BLyS抗体轻链可变区和重链可变区序列实施例8:人源化抗BLyS抗体表达载体的构建用上游引物VH5和下游引物VH3从人血细胞中扩增重链恒定区Fc片段,用上游引物VL5和下游引物VL3从人血细胞中扩增轻链k恒定区,并在重链引入XhoI和AgeI酶切位点,轻链片段引入SmaI和DraIII酶切位点。联入pCDNA3.1质粒,并经测序确定正确克隆。后续的实验材料均由此系列质粒转染细胞后,提存获得。其中VH5、VH3、VL5和VL3的核苷酸序列如下:VH5:5’gcggaattc(c/g)aggtg(a/c)agct(g/t)ca(c/g)(c/g)a(a/g)tc(a/t)gg;VH3:5’accgccggatccaccaccgcccgagccaccgccacctgcggagacgatgacc(a/g)tggtccc;VL5:5’ggtggtggatccggcggtggcggttccgacattgtgatgacccagtctcca;VL3:5’ggatacagttggtgcagcctcgagctaccgttt。制备得到四个人源化抗体,分别命名为BLyS-I、BLyS-II、BLyS-III和BLyS-IV。实施例9:人源化抗BLyS抗体体外抑制B细胞增殖将CD19标记的MACS磁珠从人外周血中提取B细胞,以100000/孔接种于96孔盘中培养。完全培养基中加入重组BLyS(10ng/mL),Fab片段羊抗人IgM(4μg/mL)以刺激B细胞生长。在此培养基础上,加入不同浓度的实施例8制备得到的不同人源化抗BLyS抗体,培养6天以后,用Promega公司出品的CelltiterGlo测试B细胞数量。依据荧光计数所读数值(RLU),统计结果见图8。由图8结果可见,实施例8制备的四个抗体人源化抗BLyS抗体BLyS-I、BLyS-II、BLyS-III和BLyS-IV均可在不同程度上抑制B细胞增长。以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1