一种荧光素酶互补量子点生物传感器及其构建方法及其应用与流程
本发明属于生物传感技术领域,涉及一种荧光素酶互补量子点生物传感器及其构建方法及其应用。
背景技术:
国民经济的高速发展极大提升了国民对健康的关注。为在获得高标准健康的同时实现健康的低成本,亟需开发新型的诊断技术或药物筛选方法。生物发光是指在酶的催化下,多种生物体自身可产生发光的现象。相比于一般的荧光检测方法,它不需要激发光源,发光完全依赖于荧光素的氧化过程,因此具有更高的信噪比。基于此,近年来快速发展出一种生物发光能量共振转移(BRET)的分析方法。该方法将具有生物发光能力的生物体作为能量供体,具有可激发发光能力的材料作为能量受体,当生物发光的发射光光谱与材料的吸收光光谱重叠且二者距离小于10纳米时,生物发光能量以非辐射共振的方式转移到材料上使其发光。量子点(QD)是一种半导体纳米材料,因其具有量子产率高、激发光谱宽、发射波长可调、发射峰窄而对称等优异的发光性质,适用于多组分生物标记物的荧光检测。QD可以用单一光源激发,区别于其他荧光染料,如异硫氰酸荧光素(FITC)或罗丹明(Rhodamine),克服传统多色荧光检测中对多种光源的依赖,因此作为理想的能量受体在能量转移分析方法中得到了广泛的应用。2006年,斯坦福大学首次将海肾荧光素酶(renillaluciferase)分子偶联到QD表面实现了“自发光量子点”,将其应用于活体荧光成像,并开发了基于此原理用于检测蛋白酶活性的量子生物传感器。然而,海肾荧光素酶修饰的量子点在培养基、全血,血清等生物介质内的稳定性差,大大制约了此类生物传感器的广泛应用,因此,对海肾荧光素酶与量子点的偶联方式进行改良、制备性能更优越且结构更稳定的新型荧光素酶成为研究的新热点。荧光素酶在有氧气的环境下催化底物氧化,使其发光。发射波长范围为400~600nm,发射峰高在450~500nm,很适合与发射波长范围在为550~750nm的QD组成BRET配对。荧光素酶可视为两部分相连的蛋白质片段组成。这两部分片段具有与完整的荧光素酶相同的发射光谱特性,但其各自的催化发光强度分别只有完整荧光素酶的1/50和1/100。此催化发光能力的差异是以荧光素酶片段互补来控制生物发光及在保持低背景辐射下向量子点能量转移的重要基础。荧光素酶互补技术已被广范应用于分析细胞内蛋白质之间的相互作用。这项技术以荧光素酶的生物发光为检测的基础,无需外部激发光源,可与待分析的蛋白质直接在细胞内合成融合蛋白,近十年得到了长足的发展,成为分子生物学与细胞生物学领域的重要分析方法。荧光素酶分为氨基端片段和羧基端片段两部分,可分别与待考察的两种蛋白质通过DNA重组技术融合表达得到。以此分开表达的荧光素酶片段不足以形成一个稳定的催化结构,只具备极为微弱的生物发光催化能力。但当融合在片段上的蛋白质之间发生相互作用时,诱导荧光素酶片段会结构互补,重建荧光素酶的高效生物发光催化活性,产生较强的生物发光。如,将荧光素酶互补片段分别与ProteinA片段形成融合蛋白,当对应的抗体结合抗原时,会拉近融合在ProteinA上的荧光素酶互补片段之间的距离,诱导互补形成完整的荧光素酶继而催化生物发光。荧光素酶互补技术虽已被证明具有可转化为免疫检测用生物传感器的潜力,但目前的研究仅是直接检测荧光素酶介导的生物发光,基于一次发光原理,并未能实现多组分检测。能够充分结合荧光素酶互补技术与量子点生物传感器的光学优势,以此实现多组分高灵敏检测的均相检测方法目前尚未有报道。
技术实现要素:
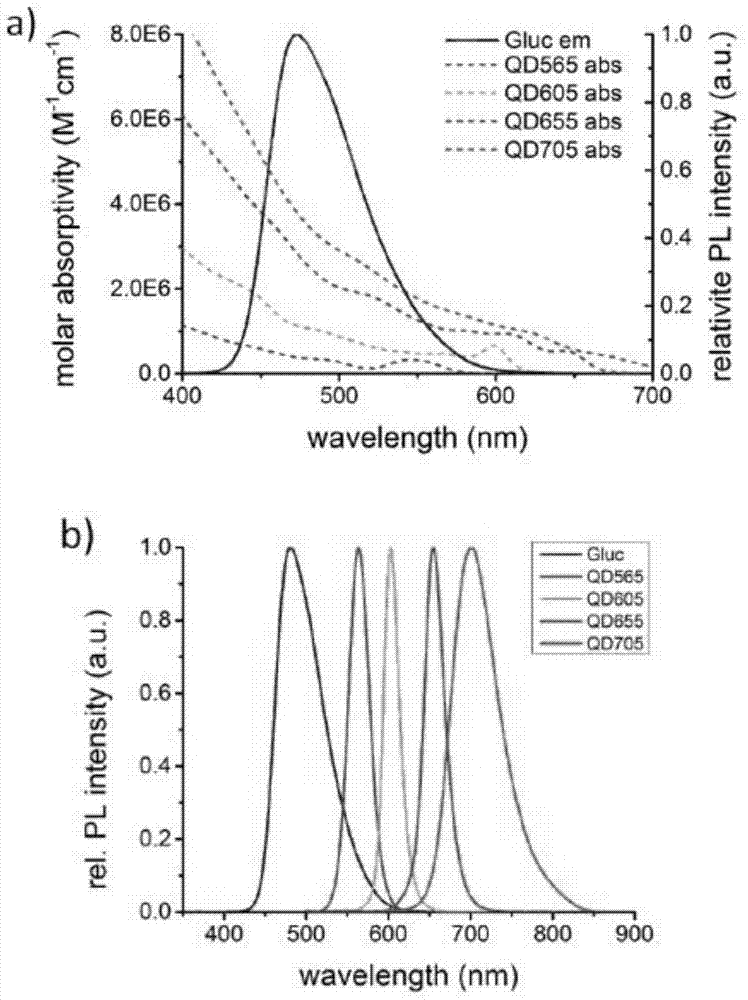
针对上述现有技术的状况,本发明结合荧光素酶互补技术与量子点传感器光学性能上的优点,通过在量子点表面诱导实现荧光素酶的两个片段互补结合重建其催化功能,建立新型高灵敏度生物传感器模型,并应用于多种生物标记物的高灵敏快速均相检测中。对此,本发明提供了一种荧光素酶互补量子点生物传感器,包括量子点、荧光素酶氨基端片段、荧光素酶羧基端片段、可特异识别待测物的探针和底物;所述荧光素酶氨基端片段和荧光素酶羧基端片段为同一荧光素酶的两个互补片段,所述量子点的表面与两个互补的片段中至少一个荧光素酶片段连接;所述底物为可与所述荧光素酶发生生物发光反应的物质,所述量子点与荧光素酶片段互补形成的荧光素酶的最远距离小于50nm;所述量子点的发射波长为400~750nm。本发明依据的原理是:采用双分子荧光互补技术,将荧光素酶在特定位点分开,分别形成不能催化发光或只能催化发微弱荧光的N端和C端两个荧光素酶片段(多肽),如图1所示,即N片段(N-fragment)和C片段(C-fragment),这两个荧光素酶片段在细胞内共表达或体外混合时,不能自发地组装成完整的荧光素酶,只催化产生微弱的荧光甚至不能产生荧光;而当这两个荧光素酶片段在外源相互作用下互相靠近结构互补时,可重新构建成完整的具有催化活性的荧光素酶,从而恢复催化生物发光特性。荧光素酶催化发光发射光谱与量子点较宽的激发光谱存在广泛的重叠,如图2所示;若量子点的表面连接有荧光素酶片段,当荧光素酶片段结构互补,形成完整荧光素酶催化发光时,可通过能量转移使得量子点在不需要激发光源的情况下发出荧光,被激发的量子点发射光谱图如图2所示,从而构建出基于荧光素酶片段互补与量子点能量转移的生物传感器,如图3所示。此技术方案的生物传感器性能优异且结构稳定性高,解决了现有技术中直接用完整荧光素酶修饰的量子点传感器在培养基、全血或血清等生物介质内稳定性差的问题。作为本发明的进一步改进,所述荧光素酶氨基端片段和荧光素酶羧基端片段为同一荧光素酶在loop点分成的两个互补片段。采用此技术方案,在荧光素酶的loop点分成的两个互补片段,基本不具有催化生物发光的能力,而在外源相互作用下互相靠近互补后,则可重新构建成完整的具有催化活性的荧光素酶,其催化发光特性强。作为本发明的进一步改进,所述荧光素酶包括Gaussia荧光素酶、海肾荧光素酶、海萤荧光素酶或萤火虫荧光素酶中至少一种。采用此技术方案,这些荧光素酶互补片段与完整的荧光素酶的催化发光能力有很大的差异,采用此荧光素酶构建的生物传感器灵敏度高。作为本发明的进一步改进,所述荧光素酶为海肾荧光素酶,所述荧光素酶氨基端片段与荧光素酶羧基端片段为海肾荧光素酶在L110点和P111点之间或G229点和K230点之间分成两个互补的片段。采用此技术方案,选择海肾荧光素酶,并在L110点和P111点之间或G229点和K230点之间分成的两个互补片段,基本不发光,而在外源相互作用下,两个互补片段互相靠近互补,重新构建成完整的海肾荧光素酶时,恢复强催化发光特性,使得采用此荧光素酶构建的生物传感器具有很高的灵敏度。作为本发明的进一步改进,所述荧光素酶为Gaussia荧光素酶,所述荧光素酶氨基端片段与荧光素酶羧基端片段为Gaussia荧光素酶在G93和E94位点之间分开形成的两个互补片段。采用此技术方案,选择Gaussia荧光素酶,并在G93和E94位点之间分开形成的两个互补片段,基本不催化发光,而在外源相互作用下,两个互补片段互相靠近互补,重新构建成完整的Gaussia荧光素酶时,恢复其催化发光特性,使得采用此荧光素酶构建的生物传感器具有很高的灵敏度。作为本发明的进一步改进,所述底物包括腔肠素、荧光素或海萤荧光素中至少一种。采用此技术方案的底物,可被其相对应的具有催化活性的荧光素酶催化发光,当荧光素酶催化底物发光时,通过能量转移使得量子点发出荧光。作为本发明的进一步改进,所述量子点包括水溶性CdSe/ZnS量子点、CdTe量子点、CdTe/CdS量子点、CdTe/CdS/ZnS量子点、ZnTe量子点、InP/ZnS量子点或ZnSe量子点中至少一种。采用此技术方案的量子点产率较高,且其激发谱与互补的荧光素酶的发射谱有大范围重叠,荧光素酶催化发光时,转移给量子点的能量损耗小,采用此技术方案的量子点构建的生物传感器灵敏度高。作为本发明的进一步改进,所述可特异识别待测物的探针为抗体、配体、核酸或多肽链中至少一种。本发明还提供了一种荧光素酶互补量子点生物传感器的构建方法,采用以下步骤:步骤1:制备荧光素酶氨基端片段和荧光素酶羧基端片段;步骤2:将步骤1得到的两个荧光素酶互补片段其中任意一个连接到量子点的表面,得到表面连接有荧光素酶片段的量子点;步骤3:向步骤2得到的表面连接有荧光素酶片段的量子点的分散液中,加入与量子点表面连接的荧光素酶片段互补的另一荧光素酶互补片段及可特异识别待测物的探针;步骤4:加入底物,得到荧光素酶互补量子点生物传感器系统,检测体系中的生物发光强度与量子点荧光强度。本发明还提供了另外一种荧光素酶互补量子点生物传感器的构建方法,采用以下步骤:步骤(1):制备荧光素酶氨基端片段和荧光素酶羧基端片段;步骤(2):将荧光素酶氨基端片段和荧光素酶羧基端片段分别连接到量子点的表面,得到表面连接有荧光素酶片段的量子点;步骤(3):向步骤(2)得到的表面连接有荧光素酶片段的量子点的分散液中加入可特异识别待测物的探针;步骤(4):加入底物,得到荧光素酶互补量子点生物传感器系统,检测体系中的生物发光强度与量子点荧光强度。根据荧光素酶互补量子点生物传感器的特性,本发明提供了以上两种荧光素酶互补量子点生物传感器的构建方法,步骤简单,易于操作,便于批量化制备。作为对本发明构建方法的进一步改进,所述荧光素酶氨基端片段和荧光素酶羧基端片段采用分子克隆技术制备,具有如下分步骤:分步骤1):荧光素酶氨基端片段和荧光素酶羧基端片段的克隆;分步骤2):荧光素酶氨基端片段和荧光素酶羧基端片段的表达及纯化。采用常用的分子克隆技术制备荧光素酶氨基端片段和荧光素酶羧基端片段,方法简单,成本低,效率高。作为对本发明构建方法的进一步改进,所述分子克隆技术制备中是采用原核或哺乳动物之一作为表达载体。作为对本发明构建方法的进一步改进,所述表面连接有荧光素酶片段的量子点,是采用如下分步骤得到的:A.使荧光素酶互补片段上带有官能团,所述官能团为组氨酸标签、组氨酸标签、生物素、氨基(或羧基)、叠氮基团等中一种;B.对量子点表面进行修饰,使其表面连接有至少一种以上的特异性识别待测物的分子;C.步骤A和步骤B得到的物质充分混合,反应。采用此技术方案将荧光素酶片段连接到量子点的表面,先使荧光素酶片段上带有可与量子点表面进行偶联的官能团,如组氨酸标签、生物素、氨基(或羧基)或叠氮基团等,通过进一步对量子点表面进行修饰,使互补片段上的可反应官能团与量子点表面丰富的对应反应官能团作用,此时,荧光素酶互补片段与完整的荧光素酶的催化发光能力的差异,最多可达100倍,使荧光素酶互补片段互补时可极大地抑制背景生物发光。利用待测生物标记物对荧光素酶片段互补的影响,通过量子点的荧光强度对体系中待测物的浓度进行定量定量检测。作为对本发明构建方法的进一步改进,还包括对所述生物传感器的系统溶液进行冻干处理,得到冻干粉末。本发明还提供了一种荧光素酶互补量子点生物传感器的应用,所述荧光素酶互补量子点生物传感器应用于均相检测中,用于多组分目标待测物的靶向检测与定量检测,主要用于多组分目标待测物的浓度检测。此技术方案利用荧光素酶互补片段与完整的荧光素酶的催化发光能力的差异(最多可达100倍),通过荧光素酶互补在实现均相检测时,可极大地抑制背景生物发光,并利用目标待测物的生物标记物对荧光素酶片段互补的影响,通过检测量子点的荧光强度实现对体系中目标待测物的浓度进行定量检测。本发明中的生物传感器,不仅可直接对体系中能够影响荧光素酶互补的生物标记物进行定量检测,也可通过在量子点表面偶联不同的生物分子,如DNA、RNA、核酸类似物、蛋白、抗体、多肽等,利用生物分子诱导荧光素酶片段的互补,实现对多种生物标记物的靶向检测。本技术方案提供的一种荧光素酶互补量子点的生物传感器于均相检测中的应用,其特点如下:1.不需要激发光源,通过生物的自身发光提供能量,大大减少可能由发射光源带来的背景干扰;2.荧光素酶互补片段与完整的荧光素酶的发光能力的差异(多达100倍),使通过荧光素酶互补在实现均检测时,可极大地抑制背景生物发光,减少干扰;3.水溶性量子点表面丰富的官能团可提供多种途径实现荧光素酶的连接;4.只有真正形成结构互补的荧光素酶才能催化底物发光,提供转移能量,在同等条件下与传统的生物发光免疫传感器相比持续发光时间长、信号稳定,满足多组分检测或高通量药物筛选所须长检测时间的需要。作为对上述应用的进一步改进,所述目标待测物为核酸、蛋白、细菌、病毒或重金属离子中至少一种。作为对上述应用的进一步改进,所述应用采用如下步骤实施:A)针对检测对象构建生物传感体系;B)绘制目标待测物的标准浓度工作曲线;C)将含有步骤B)中所述目标待测物的待测样品加入到A中,混合、反应;D)检测反应体系光信号强度;计算荧光强度与生物发光强度比值,结合标准浓度曲线,得到样品中目标待测物的浓度。此技术方案可实现多种生物标记物的均相高灵敏快速检测,其优点主要为:(1)通过与量子点的偶联,诱导荧光素酶片段互补,重建荧光素酶催化生物发光的能力;(2)利用将生物发光能量共振转移给量子点的策略,实现量子点发光,以量子点荧光信号为检测依据;(3)利用多色量子点的不同荧光发射波长实现均相多组分检测。作为对上述应用的进一步改进,所述绘制待检测物的工作曲线的步骤为:将底物与已知浓度的标准待测物加入生物传感体系中反应,检测光信号,计算荧光强度与生物发光强度比值;采用不同浓度的待检测物重复上述步骤,得到各自浓度下荧光强度与生物发光强度比值,绘制待测物的标准浓度工作曲线。与现有技术相比,本发明的有益效果为:本发明结合荧光素酶互补技术与量子点传感器在光学性能上的优点,提供了一种荧光素酶互补量子点生物传感器的构建方法,所述生物传感器通过实现荧光素酶氨基端片段和羧基端片段在量子点表面诱导互补结合,重建荧光素酶的催化生物发光功能,构建得到新型高灵敏度生物传感器,其性能优异,结构稳定,易于使用。以此为基础,所述荧光素酶互补量子点生物传感器可应用于均相检测中目标待测物的靶向检测及定量。在进行上述检测时,不需要额外荧光的激发光源,通过生物的自身发光就能够提供能量,大大减少可能由发射光源带来的背景干扰;水溶性量子点表面丰富的官能团可提供多种途径实现荧光素酶的固定,在同等条件下与传统的生物发光免疫传感器相比持续发光时间长、信号稳定,满足多组分检测或高通量药物筛选所须长检测时间的需要。附图说明图1是Rluc8荧光素酶互补片段的结构示意图;图2是Gaussia荧光素酶发射光谱与量子点激发光谱的重叠光谱图a),及由此被激发的量子点的发射光谱图b);图3为本发明构建的一种荧光素酶互补量子点生物传感器的结构示意图;图4为本发明构建的一种荧光素酶互补量子点生物传感器用于MMP-9剪切酶的检测示意图;图5为利用本发明构建的荧光素酶互补量子点生物传感器,采用夹心法检测生物标记物的示意图;图6为本发明的荧光素酶互补量子点生物传感器用于检测MMP-9(Matrixmetallopeptidase-9,基质金属蛋白酶-9)剪切酶浓度的线性拟合工作曲线图。具体实施方式下面对本发明的具体实施方式作进一步的说明。本发明一种荧光素酶互补量子点生物传感器的构建采用以下步骤:1.制备荧光素酶氨基端片段和荧光素酶羧基端片段;(1)荧光素酶段氨基端片段和荧光素酶羧基端片段的克隆,以下以海肾荧光素酶(renillaluciferase)为例进行说明:通过筛选renilla荧光素酶合适的插入位点,最终选择在L110和P111之间插入外源片段,即形成N片段Rluc8-N(1~110aa)和C片段Rluc8-C(111~311aa),如图1所示。Rluc8荧光素酶可以在大肠杆菌种高效表达,首先通过在Rluc8-N片段的C端和Rluc8-C片段的N端分别引入6×Histag的组氨酸标签,并在组氨酸标签和2个片段之间分别引入不同长度的具有疏水性和一定伸展性的柔性肽链;然后,通过设计PCR引物引入相应的组氨酸标签和柔性肽链基因片段,并在引物5’端引入NcoI和SalI酶切位点,经过多轮PCR分别获得新的目的片段Rluc8-N和Rluc8-C,获得的目的酶切采用NcoI和SalI双酶切获得具有粘性末端的基因片段;利用T4DNA连接酶将具有该粘性末端的基因片段与具有同样粘性末端的大肠杆菌表达载体pBAD在16℃下孵育连接,随后通过42℃热处理转化到感受态细胞DH5α,经37℃培养复苏并涂布到含有氨苄青霉素的LB(Lysogenybroth,蛋白胨1%,酵母提取物0.5%,氯化钠1%)平板进行筛选,挑取菌落进行菌落PCR和双酶切鉴定阳性克隆,筛选到的阳性菌株经培养后提取质粒,进行基因测序鉴定;最后将测序鉴定正确的质粒热处理转化到BL21大肠杆菌表达菌株,并进行甘油菌保种冻存以备用。(2)荧光素酶段氨基端片段和荧光素酶羧基端片段的表达及纯化将冻存的甘油菌接种到含有氨苄青霉素的LB液体培养基中37℃,225rpm培养过夜活化菌株,按1:100的比例将活化的菌液接种到新鲜的含有氨苄青霉素的LB液体培养基中培养至OD600(600nm处紫外吸收值)达到0.4~0.6,即培养至菌种的对数生长期,然后加入0.2%的诱导剂L-阿拉伯糖在30℃下诱导Rluc8荧光素酶的高速表达,继续摇床培养3小时。于4℃,10000rpm离心10min收集菌体并弃去上清LB培养基,加入pH为7.4、浓度为50mM~300mM的PBS(磷酸盐缓冲液)悬浮菌体,利用超声波破碎菌体,4℃,10000rpm离心20min分离去除不溶性蛋白,获得上清可溶性蛋白。利用Ni柱中的填料硫酸镍与组氨酸融合蛋白能特异性结合的原理去除杂蛋白,再用咪唑溶液的竞争性结合到Ni柱填料,将组氨酸融合蛋白从柱子上洗脱下来,得到的蛋白经透析去除咪唑,得到目的蛋白Rluc8互补片段蛋白。(3)荧光素酶片段在量子点上的固定将含有一种荧光素酶片段的溶液与含有浓度为2~200μMNi2+的缓冲溶液充分混合,逐滴加入带有羧基的pH为7.5的水溶性量子点分散液中,充分混合,于室温下反应30min~2h;之后将反应混合溶液在12000rpm下超滤纯化1~3次,每次5min,得到表面偶联上荧光素酶片段的量子点。(4)生物传感器的构建向表面偶联有荧光素酶片段的量子点的分散液中加入另一荧光素酶片段分散液、可特异识别待测物的探针及目标待测物,然后加入浓度为0.1~10μg/μL的腔肠素,立即通过酶标仪对体系中的生物发光强度与量子点荧光强度进行读取,以两者的比值为所构建的生物传感器的检测指标。本发明中的生物传感器,不仅可直接对体系中能够影响荧光素酶互补的生物标记物进行定量检测,也可通过在量子点表面偶联不同的生物分子,如DNA、RNA、核酸类似物、蛋白、抗体、多肽等,利用生物分子诱导荧光素酶片段的互补,从而实现对多种生物标记物的靶向检测。所述的量子点是现有的技术产品,发光波长在400~700nm,量子产率在20%左右。所述的量子点包括水溶性CdSe/ZnS量子点、CdTe量子点、CdTe/CdS量子点、CdTe/CdS/ZnS量子点、ZnTe量子点或ZnSe量子点。所述目标待测物包括但不限于核酸、蛋白、细菌、病毒或重金属离子中至少一种。下面对本发明的较优的实施例作进一步的详细说明。实施例1:1.Rluc8荧光素酶互补片段的克隆、互补片段的表达及纯化(1)荧光素酶可通过密码子优化其编译的基因在大肠杆菌内高量表达。对于小于30个氨基酸的多肽连接子直接通过把对应基因片段嵌入到引物的方法一步导入;对于35到50个氨基酸较长的多肽连接子则通过重叠延伸聚合酶链反应(overlappingPCR)在编译Rluc8荧光素酶及互补片段的基因导入多肽连接子的基因片段。(2)利用PCR过程中导入的NcoI和Sal1剪切序列,通过对应的剪切酶同时处理,得到具有粘性末端的基因片段。(3)利用T4DNA连接酶把该粘性末端基因与具有同样z粘性末端的大肠杆菌表达载体(pBAD)相连接,随后通过热休克转化于DH5α(Inouemethodpreparedheatshotcompetentcell),并在氨苄青霉素筛选以获取抗生素抵抗性的菌落。(4)对菌落进行液体LB培养基(包含氨苄青霉素)培养并提取质粒,通过基因测序找到序列100%一致的菌落。(5)热休克转化于Top10大肠杆菌菌株。将该菌株接种于LB液体培养基(含100μg/mL氨苄青霉素),震荡培养(30℃,225rpm)在达到OD600值达到0.4-0.6左右时加入约0.2%的L-阿拉伯糖引发荧光素酶片段的高速表达,继续摇床培养3小时。4℃,10000rpm离心10min收集菌体去除上清LB培养基,加入pH为7.4、浓度为50mM~300mM的PBS(磷酸盐缓冲液)充分悬浮菌体,利用超声波破碎菌体,4℃,10000rpm离心20min分离得到上清可溶性蛋白,最后通过组氨酸标签与Ni柱的亲和层析分离纯化上清液去除杂蛋白,透析除咪唑,得到荧光素酶片段。(6)在其中一个互补片段内的多肽连接子内预嵌入MMP-9剪切序列。(7)利用荧光分光光度计表征荧光素酶及其片段的发射光谱,荧光素酶浓度对发光强度的影响。2.基于能量转移的荧光素酶互补量子点传感器的构建:利用组氨酸标签在含有丰富羧基的水溶性羧基量子点表面自组装的特性,将荧光素酶互补片段与含有100μMNi2+的缓冲溶液充分混合,滴加入量子点的分散液中反应30分钟至2小时,诱导实现两部分互补荧光素酶在量子点表面实现互补结合,如图4所示。3.绘制检测MMP-9剪切酶的工作曲线将腔肠素与已知浓度的MMP-9加入传感器体系,反应一段时间,观察量子点荧光信号的变化,通过对荧光强度与生物发光强度比值的测量,绘制检测MMP-9浓度工作曲线,如图6所示。4.检测MMP-9剪切酶的浓度将底物与待测样品加入传感器体系中,反应一段时间,观察量子点荧光信号的变化,通过对荧光强度与生物发光强度比值的测量,结合工作曲线计算得到目标MMP-9的浓度,工作曲线如图6所示。实施例2:1、Gluc1荧光素酶互补片段的克隆、互补片段的表达及纯化(1)在Gluc1-N片段的C端引入组氨酸标签(6×Histag)和N端引入一个天然的二硫键肽链SEP-Tag(基因序列为:GDDD–GDDD–GDDD或GDDD-GDDD),同时在Gluc1-C片段的N端引入组氨酸标签和C端引入SEP-Tag,并在引入的组氨酸标签和2个片段之间分别引入不同长度的具有疏水性和一定伸展性的柔性肽链GGGS。(2)利用PCR过程中导入的NdeI和NcoI剪切序列,通过对应的剪切酶同时处理,得到具有粘性末端的基因片段。(3)利用T4DNA连接酶将具有该粘性末端的基因片段与具有同样粘性末端的大肠杆菌表达载体PET28a在16℃下孵育连接过夜,随后通过42℃热处理转化到感受态细胞DH5α,经37℃培养复苏并涂布到含有氨苄青霉素的LB平板进行筛选,挑取菌落进行菌落PCR和双酶切鉴定阳性克隆。(4)对菌落进行液体LB培养基(包含氨苄青霉素)培养并提取质粒,通过基因测序找到序列100%一致的菌落。(5)测序鉴定正确的质粒热处理转化到BL21(DE3)大肠杆菌表达菌株,并进行甘油菌保种冻存以备用。将冻存的甘油菌接种到含有氨苄青霉素的LB液体培养基中37℃,225rpm培养过夜活化菌株,其次按1:100的比例将活化的菌液接种到新鲜的含有氨苄青霉素的LB液体培养基中培养至OD600达到0.4~0.6,即到达菌种的对数生长期,然后加入1mM的诱导剂异丙基-β-D-1-硫代半乳糖苷(IPTG)在25℃下诱导Gluc1荧光素酶的高速表达。4℃下离心收菌,弃去上清LB培养基,加入一定量的pH为7.4的PBS缓冲液悬浮菌体,利用超声波破碎菌体,离心分离去除不溶性蛋白,获得上清可溶性蛋白。Gluc1利用Ni柱中的填料硫酸镍与组氨酸融合蛋白能特异性结合的原理去除杂蛋白,再用咪唑溶液的竞争性结合到Ni柱填料,将组氨酸融合蛋白从柱子上洗脱下来,得到的蛋白经透析去除咪唑得到目的蛋白。2.单克隆抗体免疫夹心诱导荧光素酶互补量子生物点传感器的构建(1)量子点由荧光素酶的羧基端片段Cluc、链霉亲和素(avidin)同时修饰形成Cluc-QD-SA复合物;(2)量子点表面上的avidin与生物素化的抗体A进一步偶联,修饰得到具有免疫特性的量子点传感器;(3)抗体B通过氨基-羧基的缩合反应,与荧光素酶的氨基片段形成化学偶联,得到抗体B-荧光素酶片段复合物;(4)向体系内同时加入量子点传感器、抗体B-荧光素酶片段复合物、一定浓度的待测抗原和腔肠素,使得两种单抗在对应抗原存在的情况下,形成免疫夹心,诱导Nluc与固定在量子点上的邻近Cluc形成互补,重建荧光素酶催化生物发光作用,如图5所示,所述待测抗原为目标待测物。3.绘制检测抗原的工作曲线体系反应一段时间,观察量子点荧光信号的变化,通过对荧光强度与生物发光强度比值的测量,绘制检测抗原浓度的工作曲线。4.检测抗原的浓度将上述过程中步骤2的(4)中一定浓度的待测抗原用实际样品替代加入到步骤2的(4)中的体系溶液中,反应一段时间后,观察量子点荧光信号的变化,通过对荧光强度与生物发光强度比值的测量,结合工作曲线,计算得到实际样品待测抗原的浓度。以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 基于量子点的CA15‑3免疫层析试纸条的制备方法与制造工艺
- 肌红蛋白荧光免疫层析试纸条用活化荧光乳胶微球及应用的制造方法与工艺
- 铁蛋白荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 全程C‑反应蛋白荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 一种微流控芯片上基于荧光量子点磁性富集并分离结核分枝杆菌TB的方法及装置与制造工艺
- 25‑羟基维生素D荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 25‑羟基维生素D3荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 降钙素原荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 一种改变量子点荧光色的方法与制造工艺
- 一种基于荧光免疫层析技术的定量检测计算方法与制造工艺