一种新型抗菌肽Mytichitin‑A在毕赤酵母中的高效制备的制作方法
本发明涉及抗菌肽mytichitin-a首次通过基因工程的方法成功表达于毕赤酵母中且具有较强抑菌活性,属于生物技术领域。
背景技术:
抗菌肽是在诱导条件下,由机体细胞产生的用于对抗外源性致病菌的一种活性多肽。近些年,对抗菌肽的研究越来越多,不仅仅因为其在杀灭细菌和真菌、抗病毒、抗肿瘤等多方面的作用,更因为其在人体内易消化、无毒副作用、热稳定性好、无药物残留、不易产生耐药性等诸多优点,使其被世界公认为最具潜力的抗生素和食品防腐保鲜剂替代品,具备巨大的开发潜力。mytichitin-a是从厚壳贻贝(mytiluscoruscus)的血清中分离纯化得到,是一种十分典型的阳离子抗菌肽,由55个氨基酸残基构成,分子量为6261.55da,包含三对二硫键,同源的抗菌肽结构域分析结果显示,其序列中第17到第55个氨基酸残基构成了几丁质结合结构域。研究发现,抗菌肽mytichitin-a对革兰氏阳性菌有明显的抑菌活性,特别是对金黄色葡萄球菌极其敏感。这使得mytichitin-a在食品、农业、医药上都具有巨大应用潜力。
毕赤酵母(pichiapastoris)作为一种新的酵母表达系统被人们发现。由于毕赤酵母与酿酒酵母的分子及遗传操作方式相似,并且毕赤酵母表达外源蛋白的水平比酿酒酵母高出好多倍,这使得毕赤酵母成为目前应用最广泛的表达外源蛋白的真核表达系统。这个新的表达系统有很多优点1、产生的蛋白来源于自身的非常少,且培养毕赤酵母的培养基只含有少量的蛋白,这使得分泌的外源蛋白成为酵母培养液中蛋白的主要组成部分,可作为蛋白纯化的第一步。2、毕赤酵母拥有可严格调控的乙醇氧化酶基因启动子,这是目前启动能力最强的启动子之一,能够以甲醇作为唯一碳源,驱动外源基因在毕赤酵母中表达。3、整合到毕赤酵母基因组上的外源基因,随着染色体的复制而复制,可稳定遗传。4、ph适应范围广,可通过调节培养基的ph值来抑制蛋白水解酶的活性,从而降低蛋白酶对目的蛋白的水解。
以毕赤酵母为表达载体,利用甲醇进行诱导表达,首次获得了抗菌肽mytichitin-a的高表达菌株,并经抑菌试验实验,确定其对致病菌金黄色葡萄球菌有很强的抑菌作用。经检索本发明在国内外未见公开报道,在国内外未见公开使用。
技术实现要素:
本发明的目的之一是提供一种新型重组抗菌肽mytichitin-a在毕赤酵母中高效制备的方法。技术方案概述如下:以毕赤酵母为宿主细胞,将新型抗菌肽mytichitin-a的基因序列插入到ppiczαa载体,并成功转入毕赤酵母gs115中,利用甲醇就行诱导表达,对表达产物进行纯化及活性鉴定。终产品是新型重组抗菌肽mytichitin-a的高表达菌株,发酵液上清中抗菌肽产量达45.5μg/ml。所制备重组抗菌肽对多种病原菌均具有抑菌活性,对金黄色葡萄球菌的抑菌效果格外突出。
本发明的另一目的是提供一种新型重组抗菌肽mytichitin-a,其氨基酸序列如seqidno.1所示。
进一步地,本发明还提供一种包含上述重组抗菌肽mytichitin-a的克隆载体、表达载体或宿主细胞。
更进一步地,所述克隆载体为puc19,所述表达载体为ppiczαa,所述宿主细胞为毕赤酵母gs115。
所述新型重组抗菌肽mytichitin-a在毕赤酵母中高效制备的方法,具体包括如下步骤:
(1)按照seqidno:2合成抗菌肽mytichitin-a目的基因并插入到载体puc19,获得重组质粒puc-mytichitin-a,采用表达载体ppiczαa以及ecori和kpni两个限制性酶切位点,构建重组质粒ppiczα-mytichitin-a;
(2)通过电转化的方法,将saci酶线性化的重组质粒ppiczαa-mytichitin-a转入毕赤酵母gs115细胞,构建基因工程重组菌;
(3)筛选ppiczαa-mytichitin-a的阳性克隆子进行诱导表达,获得存在于酵母发酵液上清中的目的蛋白。
进一步的,采用ppiczαa这一外分泌型表达载体,载体上有可严格调控的乙醇氧化酶基因(aox1)启动子及α-因子分泌信号(α-factor),促进外源蛋白分泌表达。
进一步地,诱导表达的条件为,当用bmgy培养基培养ppiczαa-mytichitin-a阳性克隆子的od值为6.0-8.0时,换成bmmy培养基,并用甲醇进行诱导表达。
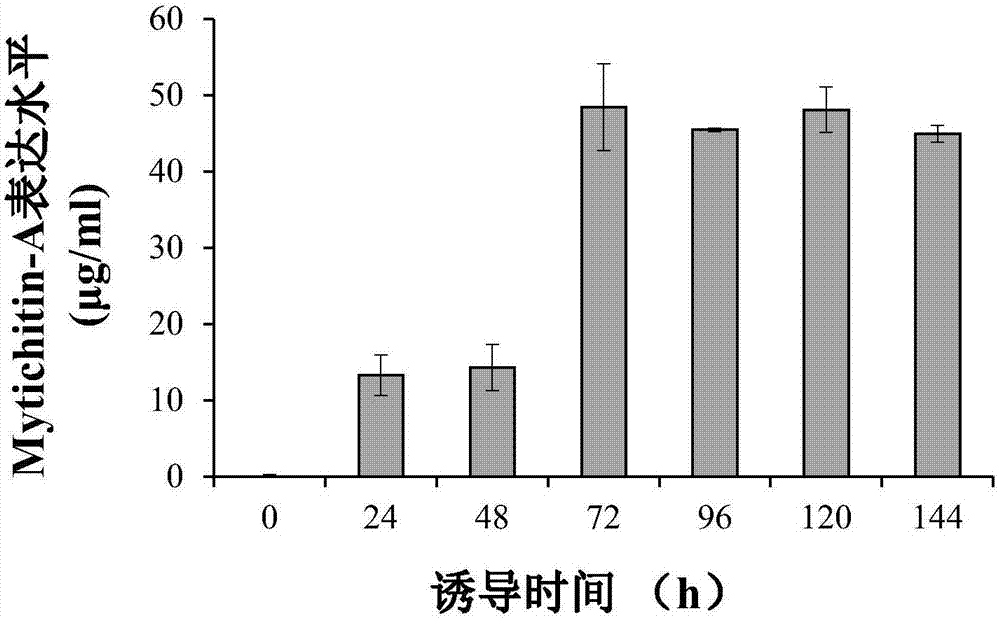
更进一步地,经1.0%甲醇诱导96h,目的蛋白产量达45.5μg/ml。
进一步地,对目的蛋白进行纯化,纯化方法为一步镍柱亲和纯化,分别用20、40、60mm低浓度咪唑进行梯度漂洗去除杂蛋白,500mm高浓度咪唑进行洗脱。纯化后每毫升可获得目的蛋白为18.2μg,且纯度达97.8%。
进一步地,最小抑制浓度(mic)测定中,金黄色葡萄球菌mic为30.7μg/ml,枯草芽孢杆菌151-1mic为48.0μg/ml。
本发明的有益效果在于:作为一种新型抗菌肽,在毕赤酵母系统中成功高效表达。在活性鉴定中,发现其对多种菌具有抑菌作用,其中对致病菌金黄色葡萄球菌的作用极其突出,mic仅30.7μg/ml。金黄色葡萄球菌是人类的一种重要病原菌,可引起许多严重感染。其广泛存在于空气,水,土壤中,很容易污染食品。鉴于此抗菌肽mytichitin-a在医药、食品中均具有广阔的市场前景。
附图说明
图1为重组抗菌肽mytichitin-a的表达、纯化、活性鉴定的技术路线图。
图2为重组抗菌肽mytichitin-a在144h发酵周期内(1.0%甲醇诱导)的表达水平结果。
图3为重组抗菌肽mytichitin-a对金黄色葡萄球菌的抑菌结果,其中1号为阴性对照,2号为阳性对照(庆大霉素50μg/ml),3号为抗菌肽mytichitin-a(30μg/ml),4号为抗菌肽mytichitin-a(10μg/ml)。
具体实施方式
下面通过具体的实施方案叙述本发明。除非特别说明,本发明中所用的技术手段均为本领域技术人员所公知的方法。另外,实施方案应理解为说明性的,而非限制本发明的范围,本发明的实质和范围仅由权利要求书所限定。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对这些实施方案中的物料成分和用量进行的各种改变或改动也属于本发明的保护范围。
实施例1:
表达载体的构建——于目的基因mytichitin-a的5'端加上6×his标签、肠激酶基因序列、ecori酶切位点及起始密码子;3'引入终止密码子、kpni酶切位点,按照seqidno:2进行全基因合成,插入到载体puc19,获得重组质粒puc-mytichitin-a。对重组puc-mytichitin-a及ppiczαa空载体分别进行双酶切(ecori、kpni),37℃,3h。酶切体系为10×buffer1μl,puc-mytichitin-a/ppiczαa1.5μg,ecori0.8μl,kpni0.8μl,总体系10μl;回收连接,目的基因mytichitin-a片段和载体ppiczαa片段室温连接2h或者4℃过夜连接,连接体系为:ppiczαa20ng,mytichitin-a8ng,t4连接酶0.8μl,总体系10μl。成功构建ppiczα-mytichitin-a重组质粒。重组质粒ppiczα-mytichitin-a转化至大肠杆菌感受态细胞,进行扩增。利用限制性内切酶ecori和kpni进行双酶切验证。验证正确株进行测序分析,以期获得序列正确重组质粒ppiczα-mytichitin-a。
重组质粒转入毕赤酵母gs115中——将重组质粒用saci酶线性化酶切,酶切体系为:10×buffer10μl;saci酶2μl;ppiczα-mytichitin-a1μg;ddh2o补至总体积100μl,37℃,2h。用dna产物纯化试剂盒进行纯化。将线性化质粒(1-2μg)电转化入gs115感受态细胞。电转参数:电转杯2mm,电压1500kv,电容25μf,电阻200ω。涂至含有zeocin(100μg/ml)的ypds板,30℃恒温箱培育2-3d至单菌落长出。
重组酵母ppiczα-mytichitin-a/gs115的pcr鉴定——在ypds板上挑取6-10个长势较好的的阳性克隆于30μl0.2%的sds中,沸水浴10min,12000g离心10min,置于冰上备用。pcr验证体系为10×buffer2μl,mgcl2(25mm)1.2μl,dntps(2.5mm)2μl,上引(5mm)0.5μl,下引(5mm)0.5μl,25%tritonx-1000.8μl,模板1μl,dna聚合酶0.4μl,无菌水补至总体系20ul;pcr反应条件为:95℃8min,95℃45s,57℃30s、57℃30s、72℃40s、72℃10min(35个循环),16℃90min,凝胶电泳验证,以期获得阳性克隆菌株。
重组酵母的诱导表达——参考jinetal.(2006)、lietal.(2005)和tangetal.(2012)中的方法进行。挑取pcr鉴定成功的阳性克隆于5mlbmgy培养基中,30℃220rpm培养24h,之后按5%的接种量转接50ml(250ml摇瓶)bmgy培养基,30℃220rpm/min培养至od600=4.0-6.0。待od600到达6.0-8.0时,换bmmy培养基。先3000g离心5min,弃去培养基,用无菌水洗一次菌体,再用bmmy培养基重悬菌体,置于28℃220rpm/min摇床上诱导表达。每24h取一次样,并加入过滤膜除菌的100%甲醇,使其终浓度分别为0.5%、1%、1.5%、2%,连续培养144h。将诱导前和每24h取的样品跑tricine-sds-page蛋白电泳,检测目的蛋白是否表达。以期获得最佳诱导时间、浓度的高表达菌株。最优选的诱导表达条件为,1.0%甲醇诱导96h,目的蛋白产量达45.5μg/ml。
重组抗菌肽mytichitin-a的活性鉴定——参考fanetal.(2010)中的琼脂扩散法进行。分别挑取受试菌单菌落于5ml的lb液体培养基中,37℃摇床培养过夜,至菌体密度约为105cfu/ml。取200μl稀释后的菌液均匀涂布于lb平板上,用直径为6mm的金属打孔器在平板合适的位置打孔。每孔滴加50μl的待测样品。并设置阴性对照为同体积空载ppiczαa转化的gs115培养后上清,阳性对照为amp+(25μg/ml)。培养过夜后观察并测量抑菌圈的直径。
重组抗菌肽mytichitin-a的镍柱亲和纯化——将1%甲醇诱导、第96h酵母培养液12000g,4℃离心20min,过0.45μm滤膜。用超滤管将酵母上清液置换到结合缓冲液(20mm磷酸盐,300mm氯化钠,10mm咪唑,ph7.4)。将蛋白样品加入ni柱,置于4℃,水平摇床结合过夜。用漂洗液1(20mm磷酸盐,300mm氯化钠,20mm咪唑,ph7.4)、漂洗液2(20mm磷酸盐,300mm氯化钠,40mm咪唑,ph7.4),漂洗液3(20mm磷酸盐,300mm氯化钠,60mm咪唑,ph7.4)进行梯度漂洗,去除杂蛋白。用1ml高咪唑浓度洗脱液洗脱(20mm磷酸盐,300mm氯化钠,500mm咪唑,ph7.4),洗脱5次。后用tricine-sds-page及银染对目的蛋白进行验证分析。一步镍柱亲和纯化后每毫升可获得目的蛋白为18.2μg,且纯度达97.8%。
最小抑制浓度mic的测定——参考zhaoetal.(2015)中的方法进行。将受试菌首先分别挑于lb液体培养基中37℃摇床培养4-6h后,稀释受试菌至浓度为2-5×107cfu/ml待用。然后将抗菌肽干粉用不同体积的pbs将其稀释到不同的浓度后,各取20μl不同稀释浓度的样品加入96孔板中,再向每孔中各加入100μl稀释好的受试菌液。阴性对照中加入100μllb培养基并补以20μl的pbs,阳性对照为100μl的菌液再补以20μl的pbs。全部加完后将该96孔板封好37℃摇床培养约12-16h。取出96孔板,使用酶标仪检测加样孔中od600值情况,并与每种菌的阳性对照和阴性对照对比,加抗菌肽组的od600值与阴性对照无明显变化的样品浓度即为最小抑菌浓度的mic值。结果显示,金黄色葡萄球菌mic为30.7μg/ml,枯草芽孢杆菌151-1mic为48.0μg/ml。
本发明不仅首次构建了ppiczαa-mytichitin-a载体,提供了新型抗菌肽在毕赤酵母中成功高效表达的方法,还发现了抗菌肽mytichitin-a对金黄色葡萄球菌的强抑菌活性。金黄色葡萄球菌是一种危害人类非常强的病原菌,可引起许多严重感染。美国疾病控制中心报告,由金黄色葡萄球菌引起的感染占第二位,仅次于大肠杆菌且金黄色葡萄球菌肠毒素也是个世界性卫生问题,在美国由金黄色葡萄球菌肠毒素引起的食物中毒占整个细菌性食物中毒的33%,加拿大则更多,占45%,中国每年发生的此类中毒事件也非常多。因此,对金黄色葡萄球菌的强抑菌活性的抗菌肽mytichitin-a在医药、食品中着实具有广阔的应用前景。
本文虽然已经给出了本发明的一些实施例,但是本领域的技术人员应当理解,在不脱离本发明精神的情况下,可以对本发明的实施例进行改变。上述实施例只是实例性的,不应以本文的实施例作为本发明权利范围的限定。
sequencelisting
<110>天津科技大学
<120>一种新型抗菌肽mytichitin-a在毕赤酵母中的高效制备
<160>2
<170>patentinversion3.5
<210>1
<211>73
<212>prt
<213>人工合成
<400>1
glualaglualagluphemethishishishishishisaspaspasp
151015
asplysthrvallyscysglymetasnglylysmetprocyslyshis
202530
glyalaphetyrthraspthrcysasplysasnvalphetyrargcys
354045
valtrpglyargprovallyslysalacysglyargglyleuvaltrp
505560
asnproargglyphecysasptyrala
6570
<210>2
<211>216
<212>dna
<213>人工合成
<400>2
gaattcatgcatcatcatcatcatcacgatgacgatgacaagaccgttaaatgtggtatg60
aatggtaaaatgccgtgtaaacatggtgcattttataccgatacctgtgataaaaatgtt120
ttttatcgttgtgtttggggtcgtccggttaaaaaagcatgtggtcgtggtctggtttgg180
aatccgcgtggtttttgtgattatgcatgaggtacc216
- 还没有人留言评论。精彩留言会获得点赞!