一种调控植物蛋白酶体活性的方法与流程
本发明属于植物学和基因工程领域,更具体地,本发明涉及调节植物蛋白酶体活性基因及其应用。
背景技术:
新蛋白的合成和已有蛋白的降解控制着植物生命周期中的所有过程,每周约有50%的蛋白通过这种合成-降解循环进行更新。科学家们很早就开始对控制蛋白合成的转录和翻译过程的机制进行研究,但直到近来才开始认识到蛋白质降解的重要性。蛋白降解可有效降解细胞内不正常的蛋白从而产生自由的氨基酸供植物的生长发育及更新。
泛素-蛋白酶体降解体系是已知的最重要的蛋白降解体系,在动植物发育过程中起重要的调控作用,aaronciechanover,avramhershko和irwinrose也因发现泛素调节的蛋白质降解过程而获得了2004年诺贝尔化学奖。现在已发现该降解体系基本涉及到植物生命活动的每个方面,包括抵抗逆境和疾病、激素信号调控、细胞周期控制、胚胎发育及光形态建成等。
鉴于蛋白酶体降解体系的重要作用,通过调节植物蛋白酶体活性对于植物的发育,抵抗逆境和疾病、激素信号调控、细胞周期控制、胚胎发育及光形态建成等具有重要的意义。
因此,本领域需要对蛋白酶体降解体系的调控基因进行更为深入的研究,定位到可以调控植物蛋白酶体功能的基因。
技术实现要素:
本发明的目的在于提供一种调节植物蛋白酶体活性的基因及其应用。
在本发明的第一方面,提供一种调节植物蛋白酶体活性或激素信号的方法,所述方法包括:调节植物中ptre1蛋白的表达。
在本发明的一个优选例中,所述的植物是双子叶植物;较佳地,所述的 植物包括但不限于:十字花科植物,禾本科植物,茄科植物,大戟科植物。
在本发明的另一优选例中,所述十字花科植物包括:拟南芥;或者
所述的禾本科植物包括:水稻、小麦、玉米;或者
所述的茄科植物包括:马铃薯、西红柿;或者
所述的大戟科植物包括:木薯、甘薯。
在本发明的另一优选例中,所述的ptre1蛋白选自下组:
(a)如seqidno:3氨基酸序列的蛋白;
(b)将seqidno:3氨基酸序列经过一个或多个(如1-30个;较佳地1-20个;更佳地1-10个;如5个,3个)氨基酸残基的取代、缺失或添加而形成的,且具有(a)蛋白功能的由(a)衍生的蛋白;或
(c)与(a)限定的蛋白序列有80%以上(较佳地90%以上,如95%,98%,99%或更高)同源性且具有(a)蛋白功能的由(a)衍生的蛋白。
在本发明的另一优选例中,所述方法包括:上调或下调表达植物中ptre1蛋白的表达;从而:
减弱植物体内蛋白酶体活性或者促进植物蛋白酶体活性;
减弱或促进相关激素信号强度。
在本发明的另一优选例中,所述方法包括:上调植物中ptre1蛋白的表达,从而:
促进26s蛋白酶体活性,抑制20s蛋白酶体活性;
上调iaa1、iaa2、iaa3、iaa4、iaa5或iaa6的表达水平,或下调iaa7、iaa17或iaa19的表达水平;或
减弱植物对脱落酸的响应的敏感度。
在本发明的另一优选例中,所述方法包括:下调植物中ptre1蛋白的表达,从而:
抑制26s蛋白酶体活性,促进20s蛋白酶体活性;
下调iaa1、iaa2、iaa3、iaa4、iaa5或iaa6的表达水平,或上调iaa7或iaa17的表达水平;或
促进(或者,上调)植物对脱落酸的响应的敏感度,下调植物对生长素的敏感度,或上调(或者,促进)植物对油菜素内酯的敏感度。
在本发明的另一优选例中,所述上调植物中ptre1蛋白的表达包括:
将ptre1蛋白的编码序列转入植物细胞、组织、器官或种子,从而上调植物中蛋白酶体活性。
在本发明的另一优选例中,所述下调植物中ptre1蛋白的表达包括:下调或敲除植物中ptre1基因,或下调植物中ptre1蛋白的表达或活性。
在本发明的另一方面,提供一种ptre1蛋白或其编码基因用途,用于调节(包括上调或下调)植物蛋白酶体活性或激素信号。
在本发明的一个优选例中,,所述的植物是双子叶植物;较佳地,所述的植物包括但不限于:十字花科植物,禾本科植物,茄科植物,大戟科植物。较佳地,所述十字花科植物包括:拟南芥;或者
所述的禾本科植物包括:水稻、小麦、玉米;或者
所述的茄科植物包括:马铃薯、西红柿;或者
所述的大戟科植物包括:木薯、甘薯。
在本发明的另一方面,提供一种ptre1蛋白或其编码基因用途,用于作为鉴定植物蛋白酶体活性强度或激素信号强弱的分子标记。
在本发明的一个优选例中,若经检测植物组织中ptre1蛋白表达高于一个特定值,则相对而言,所述植物的蛋白酶体活性增强;若经检测植物组织中ptre1蛋白表达低于一个特定值,则相对而言,所述植物的蛋白酶体活性减弱。其中,除非另外说明,所述的“特定值”是指植物中ptre1蛋白表达量的平均值。
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
图1为ptre1体外调控蛋白酶体活性结果。ptre1可以促进26s蛋白酶体活性,抑制20s蛋白酶体活性。
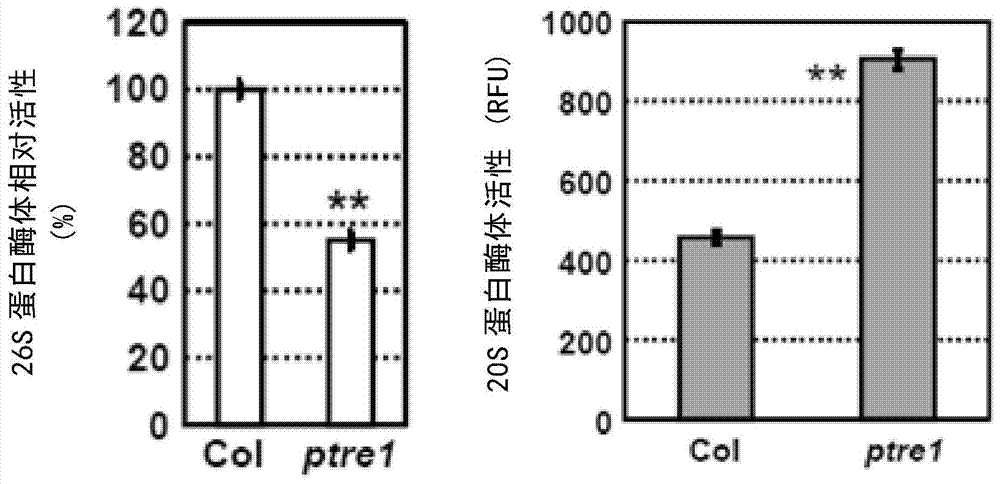
图2为ptre1体内调控蛋白酶体活性结果。ptre1突变体中26s蛋白酶体活性下调(左图),20s蛋白酶体活性上调(右图)。
图3为ptre1调控生长素信号蛋白aux/iaa结果。ptre1及ptre1过量材料中aux/iaa蛋白积累情况。
图4为ptre1调控生长素信号基因aux/iaa结果。ptre1及ptre1过量材料中aux/iaa基因表达情况。
图5为ptre1对激素响应的敏感度表型分析。包括脱落酸(上图),油菜素内酯(下左图),生长素(下右图)。
具体实施方式
本发明人经过深入的研究,发现一个新的ptre1蛋白酶体调控基因,ptre1基因可以调节植物蛋白酶体活性,从而实现植物品种改良,还可以将ptre1基因应用于植物的培育中,选育出合适蛋白酶体活性强度的品种。
如本文所用,如本文所用,所述的“植物(作物)”包括农作物、花卉植物、或林业植物等。所述的植物可以是:双子叶植物、单子叶植物、或裸子植物。所述的“植物”包括:十字花科植物,禾本科植物、茄科植物、大戟科植物等。比如,可以包括但不限于:水稻、小麦、玉米、马铃薯、木薯等。较佳的,所述的植物是十字花科植物。
本发明所述的ptre1蛋白还包括ptre1蛋白的片段、衍生物和类似物。如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持本发明的ptre1蛋白相同的生物学功能或活性的蛋白。本发明的蛋白片段、衍生物或类似物可以是(i)有一个或多个(如1-30个;较佳地1-20个;更佳地1-10个;如5个,3个)保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的蛋白,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的,或(ii)在一个或多个(如1-30个;较佳地1-20个;更佳地1-10个;如5个,3个)氨基酸残基中具有取代基团的蛋白,或(iii)附加的氨基酸序列融合到此蛋白序列而形成的蛋白等。根据本文的定义这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。
任何一种ptre1蛋白的生物活性片段都可以应用到本发明中。在这里,ptre1蛋白的生物活性片段的含义是指作为一种蛋白,其仍然能保持全长的 ptre1蛋白的全部或部分功能。通常情况下,所述的生物活性片段至少保持50%的全长ptre1蛋白的活性。在更优选的条件下,所述活性片段能够保持全长ptre1蛋白的60%、70%、80%、90%、95%、99%、或100%的活性。
在本发明中,术语“ptre1蛋白”指具有ptre1蛋白活性的seqidno:3序列的蛋白。该术语还包括具有与ptre1蛋白相同功能的、seqidno:3序列的变异形式。这些变异形式包括(但并不限于):若干个(如1-30个;较佳地1-20个;更佳地1-10个;如5个,3个)氨基酸的缺失、插入和/或取代,以及在c末端和/或n末端添加或缺失一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在c末端和/或n末端添加或缺失一个或数个氨基酸通常也不会改变蛋白质的功能。该术语还包括ptre1蛋白的活性片段和活性衍生物。
编码ptre1蛋白或其保守性变异蛋白的多核苷酸序列(编码序列)也可以应用到本发明中。编码成熟ptre1蛋白的编码区序列可以与seqidno:1或seqidno:2所示的序列基本上相同或者是简并的变异体。如本文所用,“简并的变异体”在本发明中是指编码具有seqidno:3的蛋白质,但与seqidno:1或seqidno:2所示的编码区序列有差别的核酸序列。
术语“编码基因”可以是包括编码所述蛋白的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
上述多核苷酸的变异体也是可用的,其编码与本发明有相同的氨基酸序列的蛋白或蛋白的片段、类似物和衍生物。此多核苷酸的变异体可以是天然发生的等位变异体或非天然发生的变异体。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码的蛋白的功能。
应理解,虽然本发明的ptre1基因优选获自十字花科植物,但是获自其它植物的与该ptre1基因高度同源(如具有80%以上,如85%、90%、95%、甚至98%序列相同性)的其它基因也在本发明考虑的范围之内。比对序列相同性的方法和工具也是本领域周知的,例如blast。
本发明的ptre1蛋白的编码序列通常可以用pcr扩增法、重组法或人 工合成的方法获得。对于pcr扩增法,可根据本发明所公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cdna库或按本领域技术人员已知的常规方法所制备的cdna库作为模板,扩增而得有关序列。此外,还可用人工合成的方法来合成有关序列。
包含所述编码序列的载体,以及用所述的载体或ptre1蛋白编码序列经基因工程产生的宿主细胞也包括在本发明中。本领域的技术人员熟知的方法能用于构建含ptre1蛋白编码序列和合适的转录/翻译控制信号的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的序列可有效连接到表达载体中的适当启动子上,以指导mrna合成。包含上述的适当编码序列以及适当启动子或者控制序列的载体,可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
宿主细胞通常是植物细胞。转化植物一般可使用农杆菌转化或基因枪转化等方法,例如叶盘法、幼胚转化法等;优选的是农杆菌法。对于转化的植物细胞、组织或器官可以用常规方法再生成植株,从而获得相对于野生型而言性状发生改变的植物。
蛋白酶体是在真核生物普遍存在的一种巨型蛋白质复合物。本发明人发现,ptre1蛋白参与了对于植物体内蛋白酶体的调控作用。同时,ptre1还参与了对生长素信号因子的调控作用,能够调节植物体内多种生长素的高低。
脱落酸(abscisicacid,aba)是一种抑制生长的植物激素,因能促使叶子脱落而得名,广泛分布于高等植物。除促使叶子脱落外尚有其他作用,如使芽进入休眠状态、促使马铃薯形成块茎等。本发明人发现,上调植物中ptre1蛋白的表达可以减弱植物对脱落酸的响应的敏感度;下调植物中ptre1蛋白的表达可以增强植物对脱落酸的响应的敏感度。
此外,ptre1还参与了对植物中生长素、油菜素内酯的调节作用。
因此,ptre1可用于制备具有所需的蛋白酶体活性强度或具有所需生长素信号因子强度的转基因植物。
基于本发明人的新发现,本发明提供了所述的ptre1蛋白或其编码基因的用途,用于调节(包括上调或下调)植物蛋白酶体活性或激素信号。在一种方式下,过表达正义ptre1蛋白可以促进26s蛋白酶体活性,抑制20s蛋白酶 体活性;上调iaa1、iaa2、iaa3、iaa4、iaa5或iaa6的表达水平,或下调iaa7、iaa17或iaa19的表达水平;或减弱植物对脱落酸的响应的敏感度。在另一种方式下,下调ptre1基因(或基因片段)后可抑制26s蛋白酶体活性,促进20s蛋白酶体活性;下调iaa1、iaa2、iaa3、iaa4、iaa5或iaa6的表达水平,或上调iaa7或iaa17的表达水平;或促进植物对脱落酸的响应的敏感度。因此,可基于ptre1蛋白对于植物性状的影响作用来改变植物,从而达到根据实际生产需要改良植物品质的目的。
本发明还涉及ptre1蛋白或其编码基因的上调剂或下调剂(如反义的ptre1基因或如mirna)及其用途。由于ptre1的上调剂或下调剂可调节ptre1的表达和/或调节ptre1的活性等,因此,所述的ptre1的上调剂或下调剂也可通过对ptre1的影响来调节植物性状,从而达到改良植物的目的。
任何可调节ptre1蛋白的活性、调节ptre1蛋白的稳定性、促进或抑制ptre1蛋白的表达、延长或减少ptre1蛋白有效作用时间、或促进或降低ptre1基因的转录和翻译的物质均可用于本发明,作为可用于调节植物蛋白酶体活性或激素信号的有效物质。
本发明还涉及一种改良植物的方法,该方法包括调节所述植物中ptre1蛋白的表达。
在得知了所述的ptre1蛋白的用途后,可以采用本领域人员熟知的多种方法来调节所述的ptre1蛋白的表达。比如可通过一定的途径将携带ptre1编码基因的表达单位(比如表达载体或病毒等)递送到靶点上,并使之表达活性的ptre1蛋白。此外,也可以采用本领域人员熟知的多种方法来降低ptre1蛋白的表达或使之缺失表达,比如将携带反义ptre1基因的表达单位(比如表达载体或病毒等)递送到靶点上,使得细胞或植物组织不表达或降低表达ptre1蛋白;或将ptre1基因进行敲除。
作为本发明的一种实施方式,将ptre1蛋白的编码基因通过常规的方法克隆到适当的载体中,将所述的带有外源基因的重组载体导入到可表达所述ptre1蛋白的植物细胞中,使所述的植物细胞表达ptre1蛋白。可通过将所述植物细胞再生成植物,获得过量表达ptre1蛋白的植物。优选的,利用农杆菌转化法将ptre1蛋白的编码基因或反义基因转入植物中。
如本文所用,所述的正向连接是指:ptre1的编码基因与表达载体的连接是正义的连接,即编码基因按照5’→3’的方向连接于载体上。通常,ptre1的编码基因位于表达载体中启动子的下游,也即启动子的3’端下游连接该编码基因的5’端。所述的编码基因是可操作性地连接到表达载体上的。所述的“操作性连接”或“可操作地连于”指这样一种状况,即线性dna序列的某些部分能够调节或控制同一线性dna序列其它部分的活性。例如,如果启动子控制序列的转录,那么它就是可操作地连于编码序列。
如本文所用,所述的反向连接是指:ptre1的编码基因与表达载体的连接是反义的连接,即编码基因按照3’→5’的方向连接连接于载体上。通常,ptre1的编码基因位于表达载体中启动子的下游,也即启动子的3’端下游连接该编码基因的3’端。
可采用任何适当的常规手段,包括试剂、温度、压力条件等来实施所述的方法。其它增加ptre1表达的方法是本领域周知的。例如,可通过用强启动子驱动从而增强ptre1的表达。或者通过增强子来增强该ptre1基因的表达。适用于本发明方法的强启动子包括但不限于:35s启动子、水稻、玉米的ubi启动子等。
此外,本发明还涉及利用ptre1蛋白或其编码基因作为一种基因转化植株后代的追踪标记。本发明还涉及利用ptre1蛋白或其编码基因作为一种分子标记,通过检测植物中ptre1蛋白的表达情况,鉴定植物的蛋白酶体活性情况或植物对激素信号的敏感度等。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述的较佳实施方法与材料仅作示范之用。
实施例1、ptre1基因的分离及在体内和体外对蛋白酶体活性的调控
1、ptre1基因的表达、分离纯化
以拟南芥col的cdna为模板,用引物ptre128a5’和ptre128a3’扩增出全长的ptre1编码区,然后通过ncoi和xhoi酶切连接到pet-28a载体中,构建成pet-28a-ptre1表达载体用于ptre1蛋白表达。
ptre128a5’序列:catgccatggcgaattctcagacgg(seqidno:4);
ptre128a3’序列:ccgctcgagtataaaatctgaaccgccgg(seqidno:5)。
蛋白的表达和纯化方法如下:将构建的pet-28a-ptre1表达载体转入大肠杆菌蛋白表达菌株rosetta(de3)中,筛选阳性克隆后挑取单克隆接入含有相应抗性的2ml的lb液体培养基中,37℃过夜培养;将过夜培养的菌液按1/100的比例接种到30ml含相应抗性的lb液体培养基中,37℃、220rpm振荡培养至od600约0.6;加入终浓度为1mm的iptg(isopropyl-b-d-thiogalactoside),继续在37℃、220rpm振荡培养1-3小时,以诱导重组蛋白的表达;收集不同培养时间的细菌用于重组蛋白诱导表达的鉴定。诱导细菌重悬在裂解缓冲液(50mmnah2po4,300mmnacl和10mm,ph8.0)中,用超声法(10s,间隔10s,至悬浮液呈清)破碎后鉴定诱导表达情况。成功诱导且正确表达的菌株重新进行较大量(100ml)的诱导。
用ni-ntaagarose(qiagen)按照其操作手册描写的步骤进行非变性条件下纯化。
2、体外蛋白酶体活性测定
ptre1蛋白酶体活性用20s蛋白酶体活性分析试剂盒鉴定(millipore)。非变性条件下纯化的ptre1蛋白、20s蛋白酶体、蛋白酶体降解底物suc-llvy-amc(succinyl-leu-leu-val-tyr-7-amido-4-methylcoumarin)(购自bostonbiochem公司)根据试剂盒操作手册在反应缓冲液37℃反应105分钟。lactacystin作为系统正对照。反应之后立刻用1.9ml的ddh2o稀释并终止反应,然后用380nmexcitation/460nmemission检测反应产生的自由amc(perkinelmerls55fluorescencespectrometer)。
ptre1体外调控蛋白酶体活性结果如图1,可见ptre1可以促进26s蛋 白酶体活性,抑制20s蛋白酶体活性。
3、体内蛋白酶体活性检测
拟南芥ptre1突变体的建立:为了研究ptre1的生理功能,本发明人检索了拟南芥t-dna插入突变体库(http://signal.salk.edu/cgi-bin/tdnaexpress),得到一个可能的t-dna插入突变体salk_034353。经种子扩繁、筛选及鉴定,证明插入位置在第一个内含子上。后代群体约300株经t-dna插入验证,发现在含t-dna插入杂合的植株成苗中,除果荚中胚胎发育异常外其他生长发育状态和野生型没有明显差异,但t-dna插入纯合植株的发育明显异常。
用于鉴定突变体的引物如下:
lba1:tggttcacgtagtgggccatcg(seqidno:6);
ptre1-rp:aacgtaggcccaaatttgatc(seqidno:7);
ptre1-lp:ctccacaaaacgaagttccac(seqidno:8)。
拟南芥的突变体、野生型(col)材料中的蛋白酶体活性分析,利用suc-llvy-amc作为底物,拟南芥的全蛋白提取物作为样品。植物材料液氮研磨后用抽提缓冲液(50mmtris-hclph7.5,150mmnacl,1mmedtaph7.5,0.1%tritonx-100)提取,4℃,12000rpm离心15分钟,取上清,再次离心后取上清即为全蛋白提取物。然后用bradford方法定量后用于蛋白酶体活性分析。37℃反应120分钟。
结果如图2,可见ptre1突变体中26s蛋白酶体活性下调,20s蛋白酶体活性上调。
综上结果,本发明发现,ptre1基因可以调控植物蛋白酶体活性。
实施例2、制备ptre1基因过量表达的转基因植物
植物转基因载体构建方法如下:根据ptre1基因的编码区设计引物ptre15’和ptre13’,以全长ptre1cdna为模板扩增出全长的ptre1编码区,经ncoi和spei酶切后连接到pcambia1302载体(自带gfp)中,构建成1302-ptre1双元表达载体(可以表达35s驱动的ptre1-gfp(p35s::ptre1-gfp))。
ptre15’序列:catgccatggcgaattctcagacggtga(seqidno: 9);
ptre13’序列:ggactagttataaaatctgaaccgccg(seqidno:10)。
转化植物方法具体如下:根据cloughandbent(1998)的floraldipping方法进行拟南芥转化。取生长一个月左右的植株,去除已经开放的花朵和结实的果荚,转化前一天浇足水。将含有转基因载体的农杆菌gv3101于28℃培养过夜至od600≈2.0,4500rpm离心10min,菌体沉淀悬浮于新鲜配制的转化液中,至终浓度od600≈0.8。转化时将拟南芥地上部分浸泡于菌液中30-40s,确保全部花苞都被浸没。用吸水纸吸去多余的液体,将植物平放并用保鲜膜保持湿度,避光过夜。第二天将植物取出,竖直并转移到正常条件下生长收种。
采用上述方法,获得ptre1基因过量表达的转基因拟南芥。
实施例3、ptre1基因对生长素信号因子aux/iaa蛋白及基因的调控
本实施例中,检测ptre1突变体和ptre1基因过量表达转基因植物材料中aux/iaa蛋白降解及aux/iaa基因表达发生变化情况。
iaa7-luc载体的构建:以拟南芥col材料的cdna为模板,通过引物iaa7-1:acgcgtcgacatgatcggccaacttatgaa(seqidno:11)和iaa7-2:gactagtccagatctgttcttgcagtactt(seqidno:12)扩增iaa7基因,然后连入p35s::iaa-luc载体。
iaa17-luc载体和iaa19-luc载体的构建方法基本同iaa7-luc载体,相关引物如下:
iaa17-1:acgcgtcgacatgatgggcagtgtcgagct(seqidno:13),
iaa17-2:gactagtccagctctgctcttgcacttctc(seqidno:14);
iaa19-1:acgcgtcgacatggagaaggaaggactcgg(seqidno:15),
iaa19-2:gactagtccctcgtctactcctctaggctg(seqidno:16)。
p35s::iaa-luc的构建方法如下:以原始载体pa7为骨架,使用酶切位点spei及bamhi将gfp替换为luc即可,使用引物如下:
gactagtgatggaagacgccaaaaacata(seqidno:17);及
cgggatccttacaatttggactttccgcc(seqidno:18)。
pubi10::gus的方法如下:以原始载体pa7为骨架,使用酶切位点sali及xbai将gfp替换为gus即可,使用引物如下:
acgcgtcgacatgttacgtcctgtagaa(seqidno:19);及
gctctagatcattgtttgcctccctgctg(seqidno:20)。
检测aux/iaa蛋白变化的方法如下:转化iaa(iaa7,iaa17或iaa19)-luc载体到原生质体中,是用3-4周的拟南芥材料叶片获得大量原生质体,转化p35s::iaa-luc(30μg)和pubi10::gus(6μg,作为实验内参)到300μl原生质体中,孵育12小时在22℃。之后取出20μl裂解液和100μllucassay混合,使用酶标仪进行测量数值分析。
ptre1调控生长素信号蛋白aux/iaa结果见结果图3。可见ptre1突变体中iaa7、iaa17的蛋白水平显著高于野生型;ptre1基因过量表达转基因植物中iaa1、iaa17和iaa19的蛋白水平均显著低于野生型和ptre1突变体。ptre1增多,促进了上述iaa的降解,表现出这些iaa量减少,所以是一个促进的作用(iaa减少代表正调控)。因此,在植物中ptre1基因对生长素信号因子aux/iaa蛋白的表达具有正调控作用。
检测aux/iaa基因变化的方法如下:使用trizol试剂提取三种拟南芥材料的rna,通过toyobo逆转录试剂盒获得相关cdna,使用bio-rad实时荧光定量pcr仪器检测相关aux/iaa基因的表达情况。
荧光定量pcr引物如下:
iaa1正向:accgaccaacatccaatctc(seqidno:21),
反向:tggacggagctccatatctc(seqidno:22);
iaa2正向:atcaccaaccaacatccagtc(seqidno:23),
反向:tggacggagctccatatctc(seqidno:24);
iaa3正向:caacccaagcacagacagag(seqidno:25),
反向:tgattggatgctcattggtg(seqidno:26);
iaa4正向:caacaatctgagcctttggag(seqidno:27),
反向:attgggattaccagggacag(seqidno:28);
iaa5正向:tccaaggaacatttcccaag(seqidno:29),
反向:ccggagaaagaacagtctcg(seqidno:30);
iaa6正向:aactgttgctcgaaccaagg(seqidno:31),
反向:actgccggttgtgaagagtc(seqidno:32)。
ptre1调控生长素信号基因aux/iaa结果如图4。可见,与野生型col相比,拟南芥ptre1突变体中iaa1、iaa2、iaa3、iaa4、iaa5、iaa6的基因表达均显著性下降,而ptre1过表达转基因植株中,iaa1、iaa2、iaa3的基因表达有显著性提高。
综上,ptre1突变体和ptre1基因过量表达转基因植物中aux/iaa蛋白降解及aux/iaa基因表达发生变化。
实施例4、ptre1突变体对生长素,油菜素内酯及脱落酸的敏感度响应
本实施例中,测定ptre1突变体对生长素,油菜素内酯及脱落酸的敏感度响应发生变化。
生长素处理是使用含有不同浓度(0~1000nm)的2,4-d(2,4-二氯苯氧乙酸)的ms培养基,上面播种未萌发的拟南芥种子,竖直生长7天后测量相关根长变化情况。
油菜素内酯处理是使用不同浓度(0~100nm)的油菜素内酯ms培养基,上面播种未萌发的种子,暗下竖直生长7天后测量相关下胚轴变化情况。
脱落酸处理是使用不同浓度(0.2~1um)的脱落酸ms培养基,上面播种未萌发的种子,水平生长7天后观察相关材料生长情况。
实验结果见图5。由结果可见,ptre1蛋白的过表达减弱植物对脱落酸的响应的敏感度;ptre1突变体(即下调ptre1表达的植物)对激素油菜素内酯和脱落酸超敏感,对生长素的敏感度下降。
综上可见,ptre1突变体对生长素,油菜素内酯及脱落酸的敏感度响应发生变化。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- OTUD5的单克隆抗体制备及其在癌症治疗中的用途的制造方法与工艺
- 一种胱氨酸蛋白酶抑制剂C测定试剂盒的制造方法与工艺
- 氮氧化物作为新型组蛋白去乙酰化酶抑制剂的抗肿瘤应用的制造方法与工艺
- 一种硼替佐米水溶性药用组合物及其制备方法和用途与制造工艺
- 初级癌症疗法后使用的含硼蛋白酶体抑制剂的制造方法与工艺
- 斯氏副柔线虫半胱氨酸蛋白酶抑制剂Pj_CPI基因克隆、重组表达方法及应用与制造工艺
- 一种制备自噬小体型瘤苗的培养基添加剂及其制备方法与制造工艺
- 一种高产脯氨酸蛋白酶的黑曲霉菌株的制造方法与工艺
- N-萘烷基取代的含氮杂环衍生物、制备方法及其抗肿瘤用途与制造工艺
- 作为BET蛋白抑制剂的1H‑吡咯并[2,3‑c]吡啶‑7(6H)‑酮和吡唑并[3,4‑c]吡啶‑7(6H)‑酮的制造方法与工艺
- 一种制备自噬小体型瘤苗的培养基添加剂及其制备方法与制造工艺
- N-萘烷基取代的含氮杂环衍生物、制备方法及其抗肿瘤用途与制造工艺
- 作为BET蛋白抑制剂的1H‑吡咯并[2,3‑c]吡啶‑7(6H)‑酮和吡唑并[3,4‑c]吡啶‑7(6H)‑酮的制造方法与工艺
- 一种人肿瘤抑制蛋白变体及其应用的制造方法与工艺
- 一种人肿瘤抑制蛋白变体及其应用的制造方法与工艺
- G蛋白信号调节因子6及其抑制剂在治疗脂肪肝和Ⅱ型糖尿病中的功能和应用的制造方法与工艺
- 蛋白酶体抑制剂在制备降低动物脂含量或脂储积能力产品中的应用的制造方法与工艺
- GINS2基因或蛋白的抑制剂在制备抗肿瘤药物中的应用的制造方法与工艺
- ZNF383蛋白在制备抑制p53蛋白活性的产品中的应用的制造方法与工艺
- 蛋白酶体抑制剂MLN9708的合成方法与制造工艺