吲唑化合物及其制备方法与流程
本发明涉及通式1的新的吲唑化合物及其制备方法。本发明特别涉及新的吲唑化合物、其衍生物及其合成方法。本发明还涉及通式1的新的吲唑用于治疗糖尿病、糖尿病并发症、代谢紊乱、心血管功能障碍(包括高血压)、自身免疫和炎症相关的病症或在脂肪酸和葡萄糖途径之间存在葡萄糖处理受损(impairedglucosedisposal)和能量消耗不平衡之疾病的用途,并且还涉及包含它们的药物组合物。
背景技术:
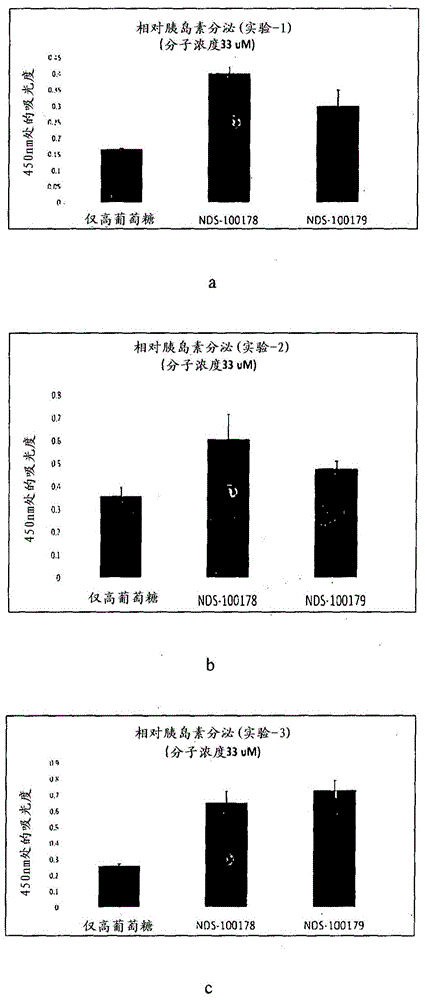
:和现有技术2型糖尿病(Type2diabetesmellitus,T2DM)是最常见、慢性且威胁生命的疾病之一。每年,T2DM的患病率在全世界范围内不断提高,并且最近,世界卫生组织(WorldHealthOrganization,WHO)预测,到2030年,诊断为T2DM的患者人数将超过3.66亿。T2DM的临床特征在于由于胰岛素分泌不足、胰岛素抵抗或这二者引起的血糖水平升高。US2004/0009976A1公开了式(A1)的化合物:及其用于治疗II型糖尿病和在哺乳动物中刺激胰岛素分泌的用途。US2003/0109550A1公开了式A2的化合物,其中,B是5或6元饱和或不饱和杂环,其中所述杂环任选地被R1、R2和R12取代;X选自N和C;Y和Z独立地选自:N、CH、CR3、S和O;R3选自:经取代或未经取代的脒、烷基氨基、氨基烷基、CONHR7、NH2、NHCOR6和CH2NHCOR6。EP0418845B1公开了新的吡唑衍生物、其制备方法和包含所述吡唑衍生物的药物组合物。其提供了式A3的化合物:其中,R1是可被选自以下的取代基取代的芳基:40低级烷基、卤素、低级烷氧基、低级烷硫基、低级烷基亚磺酰基、低级烷基磺酰基、羟基、低级烷基磺酰氧基、硝基、氨基、低级烷基氨基、酰氨基和低级烷基-(酰基)氨基;或杂环基;R2是氢;被氨基、低级烷基氨基、卤素或酰氧基取代的甲基;酰基;45酰氨基;氰基;卤素;低级烷硫基;低级烷基亚磺酰基;或杂环基;并且R3是被以下取代基取代的芳基:低级烷基、低级烷硫基、低级烷基亚磺酰基、卤素、氨基、低级烷基氨基、酰氨基、低级烷基(酰基)氨基、低级烷氧基、氰基、羟基或酰基;或者是可被低级烷硫基、低级烷基亚磺酰基或50低级烷基磺酰基取代的杂环基。US4,436,913公开了1H-吲唑和2H-吲唑衍生物及其酸加成盐以及含有这些降血压的式A4之1H-吲唑和2H吲唑衍生物及其酸加成盐的药物,其中R1可位于式I中的氮原子上的1位或2位。基团R1、R2和R3代表氢或常见的低级分子基团。R基团是2-咪唑啉基氨基或3,4,5,6-四氢嘧啶基氨基,其中这些基团还可以以其互变异构形式存在。这些基团还可以在R1基团中的芳基中,在这种情况下,R基团还可以是卤素原子。当R1基团同时为芳基或芳烷基时,R可仅代表1H吲唑衍生物的4位或7位中的杂环仲胺基或叔胺基之一。US6,878,735B2公开了式A5的咪唑啉,其中R1是任选经取代的芳基,R2选自:烷基、酰基、芳基、芳烷基、含有5至14个环成员的杂芳基和含5至12个环成员的杂环基;R3是任选经取代的芳基,R4是任选经取代的芳烷基,并且R5选自氢和烷基,所有这些是任选经取代的。US7,541,376B2提供了具有优异的JNK抑制作用的新的1H-吲唑化合物。更具体地,它提供了式A6所示化合物、其盐或其水合物,其中R1是C6-C14芳族环状烃基等;R2、R4和R5各自独立地表示氢原子、卤原子、氰基等;L是单键或C1-C6亚烷基等;X是单键或者-CO-NH-或-NH-CO-等所示基团;Y是C3-C8环烷基、C6-C14芳族环状烃基或5元至14元芳族杂环基等。US2011/0034441A1公开了式A7的化合物,其中R1、R2、R4、R5、R6、R7和R8独立地选自:H、C1-9烷基、卤素、-CF3、-(C1-9烷基)n碳环基R12、-(C1-9烷基)n杂环基R12、-(C1-9烷基)n芳基R12、-(C1-9烷基)n杂芳基R12、-(C1-9烷基)nOR9、-(C1-9烷基)nSR9、-(C1-9烷基)nS(=O)R10、-(C1-9烷基)nSO2R9、-(C1-9烷基)nN(R9)S(=O)R10、-(C1-9烷基)nN(R9)SO2R9、-(C1-9烷基)nSO2N(R9)2、-(C1-9烷基)nN(R9)2、-(C1-9烷基)nN(R9)C(=A)N(R9)2、-(C1-9烷基)nNR9C(=O)OR9、-(C1-9烷基)nC(=A)N(R9)2、-(C1-9烷基)nN(R9)C(=A)R9、-(C1-9烷基)nOC(=O)N(R9)2、-NO2、-CN、-(C1-9烷基)nCO2R9和-(C1-9烷基)nC(=A)R9。US2002/0161022A1公开了式A8的化合物,其中R1是经取代或未经取代的烷基、芳基、杂芳基、碳环、杂环等;R2是经取代或未经取代的烷基、芳基、杂芳基、碳环、杂环等。WO2011057959公开了式A9的化合物或其可药用盐,其中,R1、R2、R3彼此独立地是氢、卤素、低级烷基或烷氧基;R4是氢、未经取代的低级烷基,或被一至四个独立地选自甲基、(=O)和-COOH的取代基所取代的低级烷基;X是CH或N;并且Y是氢或-NH2。此外,其涉及化合物A9或其可药用盐用于治疗或预防代谢性疾病和病症的用途。EuropeanJournalofPharmaceuticalSciences20(2003)201-208中,F.Saczewski等的题为“2-(4,5-Dihydro-1H-imidazol-2-yl)indazole(indazim)derivativesasselectiveI2imidazolinereceptorligands”的文章报道了合成一系列不同取代的2-(4,5-二氢-1H-咪唑-2-基)吲唑和2-(4,5-二氢-1H-咪唑-2-基)-4,5,6,7-四氢吲唑。此外,其报道了4-氯-2-(4,5-二氢-1H-咪唑-2-基)吲唑(3f,4-Cl-indazim)在咪唑啉I2受体上显示出良好的亲和力并且在这种类型的咪唑啉配体之间在α-2-肾上腺素受体上显示出前所未有的低亲和力。ChemCommun(Camb).2010Nov28;46(44):8407-9中,YuhuiLoh的题为“Click”synthesisofsmallmolecule-peptideconjugatesfororganelle-specificdeliveryandinhibitionoflysosomalcysteineproteases”的文章报道用于合成小分子抑制剂-肽缀合物以实现细胞器特异性递送的点击化学法。其还提供了一种方法,其中使用N-甲基吗啉(N-methylmorpholine,NMM)氯甲酸异丁酯(isobutylchloroformate,ISCF)和甲基肼盐将COOH基团转化为CONNH2ME。OrganicMechanisms,2010,第321至338页中的文章“CarboxylicCompounds,Nitriles,andTheirInterconversion”报道了用形成三氟乙酸F3C-CO2H的试剂经三氟乙酸酐介导新戊酸酰胺(A)脱水成新戊酸腈(B)。Bioorganic&MedicinalChemistry15(2007)6782-6795中,RajeshH.Bahekar、MukulR.Jain、PradipA.Jadav、VijayM.Prajapati、DipamN.Patel、ArunA.Gupta、AjaySharma、RobbyTom、DebduttaBandyopadhya、HoneyModi和PankajR.Patel的题为“Synthesisandantidiabeticactivityof2,5-disubstituted-3-imidazol-2-yl-pyrrolo[2,3-b]pyridinesandthieno[2,3-b]pyridines”的文章报道了在120℃下使用乙二胺、P2S5经5小时将腈转化为咪唑啉。基于胰岛素抵抗的致病作用的定义(TrendsinPharm.Sci.21,259-2652000),在糖尿病治疗中使用的药物属于以下治疗剂类别:胰岛素、磺酰脲类、二甲双胍、α-糖苷酶抑制剂(阿卡波糖)和噻唑烷二酮类(曲格列酮)。胰岛素是最知名的药物,并且其被认为是糖尿病治疗中的参考药物。但是,胰岛素治疗具有以下缺点:药物仅通过肠胃外途径施用,必须不断地控制血糖水平,可能会发生局部变态反应,胰岛素抵抗迫使随着时间有意义地提高药物剂量,局部耐受性差。另外,另一些治疗方法不是没有缺点,有时甚至更显著。例如磺酰脲类,其单独施用或与胰岛素或与其他口服降血糖药物组合施用时可引起低血糖。单独使用或与磺酰脲组合使用的二甲双胍在有肾病和肝疾病时忌用,并能诱发乳酸酸中毒状态。阿卡波糖单独使用或与磺酰脲组合使用时用于降低餐后血糖水平,但其常常在胃肠系统水平上诱导副作用。仅与胰岛素组合使用的曲格列酮可诱导肝毒性作用。因此,迫切需要开发一些新的可试图保留对膳食摄取的正常生理响应的用于血糖控制的治疗方法。一种这样的方法是基于胰岛素促分泌剂(secretagogue)的开发,所述胰岛素促分泌剂在基础血糖水平下不会引起葡萄糖分泌,但仅显示葡萄糖依赖性胰岛素释放。考虑到现有技术中存在的问题以及对新药物(其显示出葡萄糖依赖性胰岛素释放,克服了治疗糖尿病或糖尿病相关并发症的副作用)盼望已久的需求,发明人已经提出了本发明。本发明公开了新的吲唑化合物、其衍生物及其合成方法。所述化合物对1型和2型糖尿病和相关并发症(如糖尿病性神经病、糖尿病视网膜病和由于葡萄糖血液水平持续波动而导致的多种血管疾病)显示出抗糖尿病活性。发明目的本发明的主要目的是提供通式1的新的吲唑化合物。本发明的另一个目的是提供合成式1化合物的方法。本发明的又一个目的是提供用于治疗糖尿病、糖尿病相关并发症和高血压的化合物的药物组合物。本发明的又一个目的是提供通式1的新的吲唑用于治疗糖尿病、糖尿病并发症、代谢紊乱、心血管功能障碍(包括高血压)、自身免疫和炎症相关的病症或者在脂肪酸和葡萄糖途径和相关的甘油三酯水平之间存在葡萄糖处理受损和能量消耗不平衡之疾病的用途。发明概述因此,本发明提供了式1的吲唑化合物,其中:R1是氢或烷基或芳基或杂芳基;R2是H或卤素;R3、R4、R5和R6独立地为氢或烷基、芳基、杂芳基;选自R3、R4、R5和R6的任意两个相邻基团可形成可另外含有杂原子的3至8元环;及其类似物、位置异构体、立体异构体、衍生物和可药用盐。在本发明的一个实施方案中,式1的吲唑化合物由下述化合物表示:a.5-氯-3-(4,5-二氢-1H-咪唑-2-基)-1H-吲唑;b.5-氯-3-(4,5-二氢-1H-咪唑-2-基)-1-甲基-3a,7a-二氢-1H-吲唑;c.5-氯-3-(3a,4,5,6,7,7a-六氢-1H-苯并[d]咪唑-2-基)-1H-吲唑;d.5-氯-3-(4,5-二氢-1H-咪唑-2-基)-1-乙基-1H-吲唑;e.1-苄基-5-氯-3-(4,5-二氢-1H-咪唑-2-基)-1H-吲唑;f.3-(4,5-二氢-1H-咪唑-2-基)-1H-吲唑;g.3-(4,5-二氢-1H-咪唑-2-基)-1-甲基-1H-吲唑;h.3-(3a,4,5,6,7,7a-六氢-1H-苯并[d]咪唑-2-基)-1H-吲唑。在本发明的一个实施方案中,式的吲唑化合物的制备方法,其中所述方法包括以下步骤:i.将5-氯靛红(5-chloroisatin)(1)转化为5-氯吲唑3-羧酸(2);ii.在氩气下,用氯甲酸异丁酯和N-甲基吗啉处理化合物5-氯吲唑3-羧酸(2),随后与氨水反应以得到5-氯-1H-吲唑-3-甲酰胺(3);iii.用吡啶和三氟乙酸酐处理化合物5-氯-1H-吲唑-3-甲酰胺(3)以得到氰基化合物(4);iv.在选自丙酮的溶剂中,使氰基化合物(4)与碳酸钾和烷基卤反应以得到经取代的吲唑甲腈;v.在P2S5的存在下,使经取代的吲唑甲腈与二胺反应以得到通式1化合物。在本发明的另一个实施方案中,步骤(iv)中所使用的烷基卤选自乙基溴、甲基碘、苄基溴。在本发明的另一个实施方案中,步骤(v)中所使用的二胺选自1,2-环己二胺、乙二胺。在本发明的另一个实施方案中,药物制剂,其包含作为活性成分的式1化合物或其类似物、位置异构体、立体异构体、衍生物和可药用盐,以及一种或更多种可药用载体、稀释剂或赋形剂。在本发明的另一个实施方案中,式1的吲唑化合物可用于治疗糖尿病、糖尿病并发症、代谢紊乱、心血管功能障碍或其中存在葡萄糖处理受损、甘油三酯水平改变或β-细胞功能降低的相关疾病。在本发明的另一个实施方案中,式1的吲唑化合物,其中其以治疗有效量的式1化合物或其类似物、位置异构体、立体异构体、衍生物和可药用盐施用于哺乳动物。附图简述图1:描述了在不同的三天中NDS100178和NDS100179的胰岛素分泌能力。图2:描述了NDS100178和NDS100179的葡萄糖依赖性活性。图3:描述了在低浓度下NDS100178和NDS100179的促胰岛素活性。图4:描述了a)口服葡萄糖耐量试验:在NDS100179的存在下C57BL小鼠中的血糖的降低;b)口服葡萄糖耐量试验:C57BL小鼠中总AUC(葡萄糖)中NDS100179剂量依赖性%变化。图5:描了a)人胰岛中GSIS提高;b)C57BL小鼠中GSIS提高;c)MIN6细胞中GSIS提高。图6:描述了a)经NDS100179处理的db/db小鼠中的血糖控制;b)经NDS100179处理的db/db小鼠中的葡萄糖耐量;c)对照或经NDS100179处理的db/db小鼠中的体重测量。图7:对照或经NDS100179处理的db/db小鼠中的甘油三酯测量;b)对照或经NDS100179处理的db/db小鼠中的β-细胞功能测量。图8:描述了HepG2细胞中的葡萄糖摄取。图9:描述了C57BL/6JRccHsd小鼠中NDS100179的PK。图10:描述了C57BL/6JRccHsd小鼠中的口服葡萄糖耐量试验。发明详述本发明涉及通式1的新的吲唑化合物及其制备方法。本发明提供了通式1的吲唑化合物及其类似物、位置异构体、立体异构体、衍生物和可药用盐的新化合物及其类似物、位置异构体、立体异构体、衍生物及其可药用盐。其中:R1是氢或烷基或芳基或杂芳基;R2是H或卤素;R3、R4、R5和R6独立地为氢或烷基、芳基、杂芳基;选自R3、R4、R5和R6的任意两个相邻基团可形成可另外含有杂原子的3至8元环。在一个优选的实施方案中,本发明提供了选自以下的式1化合物:5-氯-3-(4,5-二氢-1H-咪唑-2-基)-1H-吲唑(NDS100178);5-氯-3-(4,5-二氢-1H-咪唑-2-基)-1-甲基-3a,7a-二氢-1H-吲唑(7,NDS100179);5-氯-3-(3a,4,5,6,7,7a-六氢-1H-苯并[d]咪唑-2-基)-1H-吲唑(8,NDS100281);5-氯-3-(4,5-二氢-1H-咪唑-2-基)-1-乙基-1H-吲唑(10,NDS100282);1-苄基-5-氯-3-(4,5-二氢-1H-咪唑-2-基)-1H-吲唑(12,NDS100283);3-(4,5-二氢-1H-咪唑-2-基)-1H-吲唑(16,NDS100277);3-(4,5-二氢-1H-咪唑-2-基)-1-甲基-1H-吲唑18(NDS100278);3-(3a,4,5,6,7,7a-六氢-1H-苯并[d]咪唑-2-基)-1H-吲唑(19,NDS100279)。在另一个实施方案中,本发明提供了由式II的靛红化合物制备通式1的新化合物的方法,其中R2是H或卤素;包括以下步骤:将式(II)的靛红化合物转化为羧酸;用氯甲酸异丁酯和N-甲基吗啉处理步骤(a)的羧酸化合物,随后与氨水反应以得到酰胺;用吡啶和三氟乙酸酐处理步骤(b)的酰胺化合物以提供氰基化合物;在P2S5的存在下,使步骤(c)的氰基化合物与二胺反应以得到期望的式(1)化合物。在一个优选的实施方案中,本发明提供了用于制备式5的新化合物的方法,其包括:将5-氯靛红(1)转化为5-氯吲唑3-羧酸(2);将步骤(a)的化合物(2)转化为酰胺(3);用吡啶和三氟乙酸酐处理步骤(b)的酰胺3以提供氰基化合物(4);在P2S5的存在下,使步骤(c)的化合物(4)与乙二胺反应以得到化合物(5)。方案1中描述了化合物5的制备方法。方案1:方案:1在另一个优选的实施方案中,本发明提供了用于制备式7的新化合物的方法,所述方法包括:将5-氯靛红(1)转化为5-氯吲唑3-羧酸(2);将步骤(a)的化合物(2)转化为酰胺(3);用吡啶和三氟乙酸酐处理步骤(b)的酰胺3以提供氰基化合物(4);将步骤(c)的化合物(4)甲基化以得到化合物(6),在P2S5存在下,使步骤(c)的化合物(6)与乙二胺反应以得到化合物(7)。方案2中描述了用于制备化合物7的方法:(方案:2)本发明中公开的方法具有高的产率和选择性,并且是商业可行的。在本发明的一个方面,式1化合物可具有对1型和2型糖尿病以及相关并发症(如糖尿病性神经病、糖尿病视网膜病和由于血糖和甘油三酯水平持续波动导致的多种心血管疾病)的抗糖尿病活性。在本发明的一个方面,研究了式1化合物的促胰岛素活性。式1化合物在0.1μg/ml至10μg/ml的范围内表现出促胰岛素活性。式1化合物表现出浓度依赖性促胰岛素活性。在另一个方面,将式1化合物的促胰岛素活性与US20040009976的现有技术化合物的活性相比较,并将结果列于表1中。与现有技术中公开的那些相比,式1化合物表现出增强的促胰岛素活性。在又一个方面,本发明人在多种模型中研究了葡萄糖浓度依赖性胰岛素分泌或葡萄糖刺激的胰岛素分泌(GSIS)。在人胰岛、C57BL小鼠和MIN6细胞中进行了这项研究。式1化合物诱导GSIS,并且通过参考图5可明显看出这点。试验还证实,本发明的化合物的GSIS作用不依赖于生物系统及其构成。此外,在研究中,在糖尿病动物模型(db/db小鼠)中的OGTT测试中,当用式1化合物处理动物30天时,所述化合物对逐渐增高的禁食血糖水平提供了优异的控制并改善了葡萄糖耐受性。这提供了式1化合物的抗糖尿病特性的直接指示(图6a和6b)。另外,在经化合物处理的动物中更好地保留/恢复β-细胞功能,证实了所述化合物的额外益处(图6c)。在又一个发现中,在糖尿病动物模型(db/db小鼠)中,当用式1化合物处理动物30天时,所述化合物降低了甘油三酯水平(图7)。低的甘油三酯水平与改善的心脏健康相关并且化合物提供了显著的治疗心脑血管的益处。参考图8,研究了在所述化合物存在下HepG2细胞的葡萄糖摄取。HepG2细胞的葡萄糖摄取代表研究肝细胞的葡萄糖摄取的模型。提高的葡萄糖摄取的特征在于改善的胰岛素敏感性,并且可刺激葡萄糖摄取并改善胰岛素敏感性的化合物可用于2型糖尿病的控制,因为它们通过降低来自循环系统的葡萄糖最终有益于维持葡萄糖稳态。可以明显看出,化合物提高了HepG2细胞中的葡萄糖摄取,因此表示化合物可有助于维持葡萄糖稳态和控制2型糖尿病。在又一个方面,本发明人提出了式1化合物的作用机理。通过咪唑啉受体工作,化合物提高细胞中的甘油二酯和下游的花生四烯酸。花生四烯酸代谢物参与胰岛素胞吐作用。本发明人已建立了一项抑制LTA4H的新发现,即可维持细胞中花生四烯酸库、可提高胰岛素分泌的酶。NDS100178抑制LTA4H(IC50<500nM),而对于来自专利US20040009976的化合物5-氯-2-甲基-3-(4,5-二氢-1-H-咪唑-2-基)-1H-吲哚的实施例6之LTA4H靶标的IC50大于10uM。在又一个实施方案中,提供了药物组合物,其包含式(I)的化合物,或立体异构体,或酯或其可药用盐以及可药用载体、稀释剂或赋形剂。本发明的药物组合物可通过将本发明的化合物与适当的可药用载体、稀释剂或赋形剂相组合来制备,并且可配制成固体、半固体、液体或气体形式的制剂,例如片剂、胶囊剂、散剂、颗粒剂、软膏剂、溶液剂、注射剂、凝胶剂和微球剂(microsphere)。在再一个实施方案中,本发明涉及向患有所述疾病的对象施用“有效量”的“本发明的组合物”。因此,可使用任何量、任何形式的药物组合物通过任何有效的治疗疾病的施用途径来施用式1化合物、含有所述式1化合物的药物组合物。施用这种药物组合物的典型途径包括但不限于:经口、经表面、经皮、吸入、肠胃外、舌下、口含、经直肠、经阴道和鼻内。配制本发明的药物组合物以使向患者施用该组合物时,包含在其中的活性成分是可生物利用的。将向对象或患者施用的组合物可采取一个或更多个剂量单位的形式。剂型也可以制备为持续、控制、修饰和即时的剂型。总之,可以认为:式1化合物通过诱导GSIS、控制血糖浓度使其与对象的体重和施用的浓度成比例、降低甘油三酯和恢复/保留β-细胞功能以改善心血管安全性特性,为糖尿病患者和患有其并发症的对象提供了新的替代选择。以下的实施例是通过说明实际实施中本发明的工作而给出,并且不应被解释为以任何方式限制本发明的范围。实施例实施例:15-氯-3-(4,5-二氢-1H-咪唑-2-基)-1H-吲唑(NDS100178):5-氯-1H-吲唑-3-甲酰胺(3):在氩气下在0℃下,向5-氯吲唑3-羧酸12(0.8g,4.0mmol)的无水THF(20mL)溶液中添加氯甲酸异丁酯(0.64mL,4.9mmol)和N-甲基吗啉(0.7mL,6.1mmol),并将混合物搅拌2小时。然后向该混合物中添加10mL的NH3水溶液,并且将混合物在25℃下搅拌1小时。在减压下除去THF,通过布氏漏斗过滤得到固体,用乙醚洗涤固体并在真空下干燥以得到作为浅黄色固体的标题化合物3(0.5g,63%)。IRυmax(膜):cm-12925,2854,1463;1HNMR(200MHz,DMSO-d6):δ8.14(d,J=1.6Hz,1H),7.80(bs,1H),7.66(d,J=8.9Hz,1H),7.45-7.39(m,2H);MS:218(M+Na)+.5-氯-1H-吲唑-3-甲腈(4):将5-氯-1H-吲唑-3-甲酰胺3(0.60g,3.0mmol)溶解于吡啶(6mL)和无水二氯甲烷(6mL)中。添加三氟乙酸酐(1.0mL,7.7mmol),并将反应在25℃下搅拌10分钟。将反应混合物在真空中浓缩,并将残余物置于乙酸乙酯中,然后用水、饱和碳酸氢钠和盐水洗涤。将有机相经硫酸钠干燥,过滤并浓缩以得到作为浅黄色固体的标题化合物5-氯-1H-吲唑-3-甲腈4(0.5g,92%)。IRυmax(膜):cm-12233;1HNMR(200MHz,CDCl3):δ8.03(d,J=9.1Hz,1H),7.96(d,J=1.8Hz,1H),7.75(dd,J=9.1,1.8Hz,1H).5-氯-3-(4,5-二氢-1H-咪唑-2-基)-1H-吲唑(5,NDS100178):将5-氯-1H-吲唑-3-甲腈4(0.2g,1.1mmol)、乙二胺(EDA,4mL)和P2S5(0.1g,0.4mmol)的混合物在120℃下加热5小时。将反应混合物倒入冰中得到固体,通过布氏漏斗过滤,用乙醚洗涤,并在真空下干燥以得到作为灰白色固体的5-氯-3-(4,5-二氢-1H-咪唑-2-基)-1H-吲唑化合物5NDS100178(0.12g,49%)。Mp=248-249℃;1HNMR(200MHz,DMSO-d6):δ8.19(s,1H),7.63(d,J=8.9Hz,1H),7.36(d,J=8.9Hz,1H),3.66(bs,4H);MS:221(M+H)+.实施例:25-氯-3-(4,5-二氢-1H-咪唑-2-基)-2-甲基-2H-吲唑(NDS100179)5-氯-1-甲基-1H-吲唑-3-甲腈(6):将碳酸钾(0.23g;1.6mmol)和甲基碘(0.1mL;1.6mmol)添加到5-氯-1H-吲唑-3-甲腈4(0.1g;0.5mmol)在丙酮(10mL)中的混悬液中。将反应混合物在65℃下加热4小时,冷却并过滤。在减压下将滤液浓缩,并通过柱色谱(硅胶100-200目,3∶7乙酸乙酯∶石油醚)纯化以得到作为白色固体的5-氯-1-甲基-1H-吲唑-3-甲腈6(0.8g,75%)。Mp=154-155℃;1HNMR(200MHz,DMSO-d6):δ8.03(d,J=1.9Hz,1H),7.96(d,J=8.9Hz,1H),7.63(dd,J=8.9,1.9Hz,1H),4.20(s,3H).5-氯-3-(4,5-二氢-1H-咪唑-2-基)-1-甲基-3a,7a-二氢-1H-吲唑(7,NDS100179):将5-氯-1-甲基-1H-吲唑-3-甲腈6(0.1g,1.0mmol)、EDA(4mL)和P2S5(0.046g,0.4mmol)的混合物在120℃下加热5小时。将反应混合物倒入冰中得到固体,通过布氏漏斗过滤,用乙醚洗涤,并在真空下干燥以得到作为白色固体的化合物7(NDS100179)(0.060g,50%)。Mp=174-175℃;1HNMR(200MHz,DMSO-d6):δ8.21(d,J=2.0Hz,1H),7.77(d,J=8.8Hz,1H),7.47(dd,J=8.8,2.0Hz,1H),6.84(bs,1H),4.11(s,3H),3.62(bs,4H).13CNMR(100MHz,DMSO-d6)δ=160.1,139.6,132.0,128.2,127.2,122.4,120.1,111.2,35.2;MS;235(M+H)+.实施例:35-氯-3-(3a,4,5,6,7,7a-六氢-1H-苯并[d]咪唑-2-基)-1H-吲唑8(NDS100281):将5-氯-1H-吲唑-3-甲腈4(0.1g,0.5mmol)、1,2-环己烷二胺(2mL)和P2S5(0.05g,0.2mmol)的混合物在120℃下加热5小时。将反应混合物倒入冰中得到固体,通过布氏漏斗过滤,用乙醚洗涤,并在真空下干燥以得到作为浅黄色固体的5-氯-3-(3a,4,5,6,7,7a-六氢-1H-苯并[d]咪唑-2-基)-1H-吲唑NDS100281(60mg,40%)。1HNMR(200MHz,CD3OD)δ=8.08(d,J=1.6Hz,1H),7.51(d,J=8.8Hz,1H),7.23(dd,J=2.0,8.9Hz,1H),3.89(t,J=3.6Hz,2H),1.88-1.29(m,2H);MS;275(M+H)+.实施例:45-氯-1-乙基3a,7a-二氢-1H-吲唑-3-甲腈(9):将碳酸钾(0.28g;1.8mmol)和乙基溴(0.2mL;1.8mmol)添加到5-氯-1H-吲唑-3-甲腈4(0.12g;0.6mmol)在丙酮(10mL)中的混悬液中。将反应混合物在65℃下加热4小时,冷却并过滤。在减压下将滤液浓缩并通过柱色谱(硅胶100-200目,2∶8乙酸乙酯∶石油醚)纯化以得到作为浅黄色固体的9(0.13g,94%)。1HNMR(200MHz,CDCl3):δ=7.82(t,J=1.1Hz,1H),7.47(s,2H),4.49(d,J=7.2Hz,2H),1.57(t,J=7.3Hz,4H);MS;206(M+H)+.5-氯-3-(4,5-二氢-1H-咪唑-2-基)-1-乙基-1H-吲唑(10)NDS100282:将9(150mg,0.7mmol)、EDA(4mL)和P2S5(0.065g,0.3mmol)的混合物在120℃下加热5小时。将反应混合物倒入冰中得到固体,通过布氏漏斗过滤,用乙醚洗涤,并在真空下干燥以得到作为灰白色固体的(10)NDS100282(0.11g,60%)。1HNMR(400MHz,CD3OD)δ=8.12(s,1H),7.68(d,J=9.0Hz,1H),7.44(dd,J=2.0,9.0Hz,1H),4.53(q,J=7.3Hz,2H),3.95(s,4H),1.58-1.46(m,3H);13CNMR(100MHz,CD3OD)δ=159.9,138.8,130.4,128.7,127.4,122.4,119.7,111.5,44.5,13.6;MS;249(M+H)+.实施例:51-苄基-5-氯-3a,7a-二氢-1H-吲唑-3-甲腈(11):将碳酸钾(0.35g;2.5mmol)和苄基溴(0.3mL;2.5mmol)添加到5-氯-1H-吲唑-3-甲腈4(0.15g;0.8mmol)在丙酮(10mL)中的混悬液中。将反应混合物在65℃下加热4小时,冷却并过滤。在减压下将滤液浓缩并通过柱色谱(硅胶100-200目,2∶8乙酸乙酯∶石油醚)纯化以得到作为浅黄色固体的(11)(0.18g,80%)。1HNMR(200MHz,CDCl3):δ=7.83(t,J=1.2Hz,1H),7.41-7.29(m,5H),7.25-7.19(m,2H),5.64(s,2H);MS;268(M+H)+.1-苄基-5-氯-3-(4,5-二氢-1H-咪唑-2-基)-1H-吲唑12(NDS100283):将1-苄基-5-氯-3a,7a-二氢-1H-吲唑-3-甲腈11(160mg,0.6mmol)、EDA(4mL)和P2S5(0.053g,0.2mmol)在120下加热5小时。将反应混合物倒入冰中得到固体,通过布氏漏斗过滤,用乙醚洗涤,并在真空下干燥以得到作为灰白色固体的12(NDS100283)(0.100g,54%)。1HNMR(400MHz,CD3OD)δ=8.26-8.11(m,1H),7.50(d,J=8.8Hz,1H),7.34(dd,J=1.8,8.9Hz,1H),7.29-7.17(m,5H),4.91(s,2H),3.78(s,4H);13CNMR(100MHz,CD3OD)δ=160.3,139.1,136.3,134.2,128.4,127.9,127.6,127.2,127.0,122.9,120.8,111.2,52.9,48.9;MS311(M+H)+.实施例:63-(4,5-二氢-1H-咪唑-2-基)-1H-吲唑(16)NDS100277:按照用于合成5(NDS100178)的相同方法。产率:51%;1HNMR(200MHz,DMSO-d6)δ=8.25(d,J=8.1Hz,1H),7.67-7.55(m,1H),7.48-7.35(m,1H),7.23(d,J=7.3Hz,1H),3.66(s,4H);13CNMR(50MHz,DMSO-d6)δ=159.8,141.1,135.8,126.2,122.0,121.4,121.1,110.5,49.4;MS187(M+H)+.1-甲基-1H-吲唑-3-甲腈17:按照合成6的方法。产率:97%;1HNMR(200MHz,CDCl3)δ=7.84(td,J=0.9,8.2Hz,1H),7.57-7.47(m,2H),7.37(dd,J=4.0,8.0Hz,1H),4.17(s,3H);MS158(M+H)+.实施例:73-(4,5-二氢-1H-咪唑-2-基)-1-甲基-1H-吲唑18(NDS100278):按照合成7(NDS100179)的相同方法。产率:42%;1HNMR(200MHz,CD3OD)δ=8.16(td,J=1.0,8.2Hz,1H),7.57(td,J=0.9,8.5Hz,1H),7.44(ddd,J=1.0,6.9,8.4Hz,1H),7.37-7.20(m,1H),4.22-4.06(m,3H),3.78(s,4H);13CNMR(100MHz,CD3OD)δ=161.0,141.1,134.1,126.6,121.9,121.8,121.5,109.3,49.0,34.8;MS201(M+H)+.实施例:83-(3a,4,5,6,7,7a-六氢-1H-苯并[d]咪唑-2-基)-1H-吲唑(19)NDS100281:按照合成8的相同方法。产率:30%;1HNMR(200MHz,CD3OD)δ=8.09(d,J=8.1Hz,1H),7.56-7.43(m,1H),7.31(s,1H),7.16(d,J=7.8Hz,1H),3.84(t,J=3.6Hz,2H),1.84-1.24(m,8H);13CNMR(50MHz,CD3OD)δ=162.1,143.7,135.9,127.7,123.3,122.5,122.2,112.0,60.5,28.9,21.8;MS241(M+H)+.实施例9:NDS100178和NDS100179的促胰岛素活性的测量材料和方法通过如下所述的基于良好优化的ELISA测定(ShantaniProtocol#5205)来测量NDS100178和NDS100179的促胰岛素活性。材料·MIN6细胞(来源:NationalCenterforCellSciences,Pune)·小鼠胰岛素ELISA试剂盒(Mercodia,10-1247-01)·平板摇动器(来自Eppendorf的MixMate)·HEPES平衡Krebs-Ringer碳酸氢盐缓冲液(组分如下)*HEPES是2-[4-(2-羟乙基)哌嗪-1-基]乙磺酸方法i.在实验前两天,将达到几乎一半汇合的MIN-6细胞的增殖培养物接种到6孔板中;ii.在胰岛素诱导实验的当天,细胞应该变成几乎汇合,并处于良好的状态。iii.在实验的当天,首先制备如材料中所述的含有0.1%BSA(用于冲洗)和不含BSA(用于平衡和胰岛素诱导)的1×KRB-HEPES缓冲液。iv.制备平衡缓冲液:含有3.3mM葡萄糖的不含BSA的1×KRB-HEPES缓冲液(以将所有细胞的葡萄糖水平降低至相同水平)。例如,向不含BSA的20mlKRB-HEPES缓冲液中添加66ul1M葡萄糖储液。v.制备刺激缓冲液(胰岛素诱导):含有确定葡萄糖水平(在大多数情况下,将是16.7mM葡萄糖)和期望分子浓度的不含BSA的1×KRB-HEPES缓冲液。vi.将所有缓冲液在水浴中预热至37℃(以15分钟)。vii.从所有孔中除去培养基,用2ml的含有0.1%BSA的KRB-HEPES缓冲液将每个孔冲洗两次。viii.在每个孔中添加2ml的平衡缓冲液,并在37℃下孵育半小时。ix.孵育过后,向(适当标记的)各个孔中添加2ml的刺激缓冲液,并在37℃下孵育1小时。x.与此同时,启动冷冻离心机,并将温度设置为4℃。从MercodiaELISA试剂盒(在4℃下储存)中取出酶缀合物、稀释缓冲液、校准物(Calibrator)0和所需的条带(stripe)(例如,一式两份测试的8个样品的两个条带),并将其预热至室温(RT)。xi.1小时孵育结束后,从培养箱中取出板,不干扰细胞,并取出1ml的刺激缓冲液到适当标记的预冷管中。xii.将该管在600g下离心5分钟。xiii.取出500ul到刚刚适当标记的预冷管中。xiv.现在,在校准物0中稀释样品(1∶30),即,将3ul的每种样品添加到8个不同的适当标记的0.5ml管中的87μl的校准物0中。将其充分混合。xv.制备1×酶缀合物缓冲液,即,将180ul的酶(11×)与1800ul的稀释缓冲液混合以用于两个条带的ELISA。xvi.在两个相邻的孔中添加10ul的每份样品(稀释的,一式两份)。小心不要触碰底部。xvii.向每个孔中小心地添加100ul的酶缀合物缓冲液(1×),并在25℃下以800rpm在平板摇动器(eppendorfMixMate)上孵育2小时。xviii.在孵育结束前45分钟,取出清洗缓冲液、底物TMB和终止溶液。将它们保持在室温下。xix.在孵育结束前5分钟,制备1×清洗缓冲液(21×),即,容器中有40ml蒸馏水+2ml(21×)清洗缓冲液。xx.孵育结束后,用350ul的清洗缓冲液将每个孔清洗7次。使用多道(multichannel)(175ul)。xxi.清洗后,向每个孔中添加200uL底物TMB溶液。保持适当的速度。xxii.使孵育进行15分钟。在平板读数器上设置程序以便在450nm处读取吸光度。添加5秒的摇动步骤以使充分混合。xxiii.孵育后,立即以相同的速度向每个孔中添加50ul的终止溶液,并在450nm处读取吸光度。在所有试验中测定条件保持一致。对照实验(未用分子处理)在不同日子的吸光度值的差异归因于细胞培养条件。在各个图中指定了其他不同的条件。所得结果汇集如下。[注:如果未明确提及,HG=高葡萄糖(16.7mM),LG=低葡萄糖(3.3mM)]结果NDS100178和NDS100179提高葡萄糖刺激的胰岛素分泌在如图1中三个不同日子测量NDS100178和NDS100179的胰岛素分泌能力。如下所示,当用NDS100178或NDS100179(两者均为33uM浓度)处理细胞1小时时,观察到在高葡萄糖条件下MIN6细胞的胰岛素分泌显著提高。NDS100178和NDS100179的促胰岛素活性是葡萄糖依赖性的发现NDS100178和NDS100179的促胰岛素活性是葡萄糖依赖性的。如下所示,与如图2中的较低葡萄糖条件相比,在其中细胞存在于高葡萄糖条件下的各个对照中观察到胰岛素分泌显著提高。NDS100178和NDS100179在低浓度下表现出促胰岛素活性如下所示,当以100nM的浓度孵育时,NDS100178诱导胰岛素分泌提高超过100%。当浓度降低至50nM或10nM时,相对于对照实验未获得显著性差异。有趣的是,即使在低至10nM的浓度时NDS100179也是有活性的。尽管在10nMNDS100179的存在下,没有发现胰岛素分泌相对于对照实验的提高是统计上显著的,但是用50nM和100nM浓度的分子孵育清楚地表明分子是有活性的促胰岛素剂的趋势。化合物的促胰岛素特性MIN6细胞的胰岛素分泌表1:化合物浓度(μM)胰岛素分泌(ng/ml)NDS10017810.0/1.0/0.135.09(4.0)/12.49(1.9)/8.91(1.6)NDS10017910.0/1.0/0.115.45(1.2)/10.27(0.6)/5.55(1.0)括号内的值是测量值的标准误。实施例10:非糖尿病实验小鼠中通过NDS100179的葡萄糖降低和葡萄糖依赖性胰岛素分泌C57BL/6J小鼠中的葡萄糖降低将12至13周的雄性C57BL/6J小鼠禁食过夜。在早晨向动物经口给予不同浓度的NDS100179或对照载剂以及3g/kg的葡萄糖。在即将给药前和将化合物给药后30、60、90和120分钟时测量血糖。分子剂量依赖地降低了C57BL/6J小鼠的血糖(图4)。C57BL/6J小鼠中的胰岛素提高在上述进行的研究中,即,将12至13周的雄性C57BL/6J小鼠禁食过夜,并在早晨向动物经口给予不同浓度的NDS100179或对照载剂以及3g/kg的葡萄糖,还测量了0分钟和15分钟时间点的胰岛素。发现由于NDS100179的胰岛素分泌是血浆浓度葡萄糖依赖性的(图5)。实施例11:通过NDS100179提高葡萄糖刺激的胰岛素分泌(GlucoseStimulatedInsulinSecretion,GSIS)NDS100179是仅在高葡萄糖浓度下才提高胰岛素分泌的促胰岛素化合物。在人胰岛、小鼠和MIN6细胞中在低和高葡萄糖条件下进行了NDS100179诱导的胰岛素测量。呈现的数据清楚地表明,在不同的生物系统中,NDS100179的GSIS提高能力相似(图5)。实施例12:NDS100179-糖尿病动物模型(db/db小鼠)中的禁食血浆葡萄糖和葡萄糖耐量db/db或瘦素缺失小鼠是普遍接受的糖尿病模型。向7周龄db/db小鼠经口给予10mg/kg、30mg/kg的NDS100179和仅载剂30天。在研究开始前、在第15天和第30天测量动物的禁食血浆葡萄糖水平。用NDS100179处理的动物表现出对基础血糖水平上升的显著控制,该作用依赖于给予动物的分子的量。用30mg/kg的NDS100179处理的动物未显示出禁食血糖水平的统计学上显著的上升。在30天结束时进行的口服葡萄糖耐量试验(OralGlucoseToleranceTest,OGTT)显示出经NDS100179处理的小鼠中葡萄糖耐量的显著改善(图6a和6b)。实施例13:NDS100179-糖尿病动物模型(db/db小鼠)中β-细胞功能保留/恢复对7周的db/db小鼠经口给予10mg/kg、30mg/kg的NDS100179和仅载剂30天。在30天结束时,使用HOMA-β%计算评估β细胞功能。经NDS100179处理的小鼠显示出β-细胞功能的显著改善(图6c)。实施例14:NDS100179-糖尿病动物模型(db/db小鼠)中甘油三酯的降低对7周的db/db小鼠经口给予10mg/kg、30mg/kg的NDS100179和仅载剂30天。在30天结束时测量甘油三酯水平。经NDS100179处理的小鼠显示出甘油三酯水平的显著降低(图7a)。实施例15:NDS100179-糖尿病动物模型(db/db小鼠)中没有体重变化对7周的db/db小鼠经口给予10mg/kg、30mg/kg的NDS100179和仅载剂30天。每三天测量动物体重。在经NDS100179处理的小鼠中没有观察到体重有显著变化(图7b)。实施例16:NDS100179的药代动力学特性基于在小鼠中进行的药代动力学研究,NDS100179是100%口服生物可利用的化合物(图9)。测量值Cmax(ng/ml)631.1Tmax(h)0.25AUC(inf)(hr*ng/ml)854.231AUC(0-t)(hr*ng/ml)837.113AUC(inf)/AUC(0-t)%102.049t1/2(h)1.7实施例17:体外ADME特性实施例18:NDS100179-HepG2细胞的葡萄糖摄取提高NDS100179提高了HepG2细胞的葡萄糖摄取(图8)。在高葡萄糖条件下,用各药物培养HepG2细胞24小时,使其具有胰岛素抵抗后进行测定。如下24小时后进行测定:使细胞在无血清培养基(含有各药物)中饥饿2小时,接着在KRB缓冲液(具有各药物)中孵育30分钟,最后用2-NBDG(荧光葡萄糖类似物)孵育15分钟。将细胞充分清洗并用1%triton-X裂解。立即在Ex:465和Em:540下读取荧光读数。实施例19:作用机理NDS100178系列化合物主要激活咪唑啉受体I1/I3(IC50~50nM)。在高葡萄糖条件下,这种活化导致形成甘油二酯(Diacylglycerol,DAG)。DAG随后在细胞中产生花生四烯酸(ArachidonicAcids,AA)。AA的代谢物(尤其是环氧二十碳三烯酸(epoxyeicosatrienenoicacid,EET)和羟基二十碳四烯酸(hydroxyeicosatetrenoicacid,HETE)引起胞吐作用,导致细胞胰岛素分泌提高。可改变葡萄糖/DAG诱导的AA库的另一主要信号传导途径是白三烯途径,即,通过将AA代谢成不同的白三烯,而不是可抑制其胰岛素分泌作用的EET和HETE。通过白三烯途径可抑制AA代谢的分子可维持AA库,这导致其代谢仅通过EET和HETE,并因此可提高胰岛素分泌。白三烯途径中的主要酶之一是将LTA4转换成LTB4的LTA4H水解酶,其是抑制胰岛素分泌的AA衍生物。本发明人已确立了一个新发现:抑制LTA4H可提高胰岛素分泌。NDS100178抑制LTA4H(IC50<500nM),而对于来自专利US20040009976化合物5-氯-2-甲基-3-(4,5-二氢-1-H-咪唑-2-基)-1H-吲哚的化合物6之LTA4H靶标的IC50大于10uM。本发明的优点新的抗糖尿病化合物。相对于周围环境中的葡萄糖水平的受控的胰岛素分泌。改善其他抗糖尿病药的任何副作用(如低血糖)。通过降低甘油三酯提供心血管保护。增强/保留β-细胞功能。有效地对抗1型和2型糖尿病及相关并发症。制备方法经济且在商业上可行。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1