一种查尔酮化合物HDPC-12及其药物组合物、制备方法和应用与流程
本发明涉及一种查尔酮化合物,尤其涉及HDPC-12(2-羟基-4,4′-二异戊烯氧基查尔酮)以及以该查尔酮化合物为活性物质的药物组合物,该查尔酮化合物的制备方法和应用。
背景技术:
查尔酮类化合物是以1,3-二苯基丙烯酮为基本骨架结构的有机化合物,广泛存在于甘草、红花等多种药物植物中,是植物体内合成黄酮的前体,同时也是一类重要的有机医药中间体,由于其分子具有较大的柔性,能与不同的受体结合,表现出多方面的生物学活性,特别是在抗失眠、抗衰老、抗肿瘤、抗寄生虫、抗病毒、抗菌、抗炎、抗血小板凝集等方面活性显著,已成为国内外天然药物开发利用研究的热点。如:专利号为ZL02113777.3(授权公告号为CN 1197560C)的中国发明专利《一种预防或治疗艾滋病的药物及其制备方法和应用》公开了一种具有预防或治疗艾滋病作用的酒花查尔酮;申请号为CN2014102451182.9(公开号为CN104016843A)的中国发明专利《一种具有改善睡眠作用的查尔酮化合物》;专利号为ZL200910264515.1(授权公告号为CN101759544A)的中国发明专利《一种新查耳酮化合物及其制备方法与应用》公开了一种具有抗肿瘤和抗炎症作用的新耳酮化合物。
肿瘤是威胁人类生命的常见疾病,据统计,每年全球肿瘤死亡总数达700万人,我国每年死于肿瘤者达100多万人,并呈逐年增加趋势,肿瘤已成为城市人口的第一位死因,因此寻找有效、安全、毒副作用小的抗肿瘤药物,一直是肿瘤药物研发工作这孜孜以求的目标。目前研究发现的查尔酮化合物抗肿瘤作用主要表现为:(1)抑制细胞增殖,对肿瘤细胞有细胞毒作用,对正常细胞无毒性和致突作用,同时具有抗氧化和正向的免疫调节作用;(2)诱导肿瘤细胞凋亡;(3)查尔酮类化合物能抑制细胞信号转导过程中的酪氨酸蛋白激酶、蛋白激酶等的活性;(4)查尔酮化合物具有抗炎、抗氧化作用和促进抑癌基因表达的作用。近年来对查尔酮化合物的化学结构与生物活性的相关性研究越来越受重视,这对从自然界中寻找查尔酮先导化合物和进行结构改造或修饰,以及对创制新药具有重要意义。
技术实现要素:
本发明所要解决的第一个技术问题是针对现有技术而提供一种具有抗肿瘤活性的查尔酮化合物HDPC-12(2-羟基-4,4′-二异戊烯氧基查尔酮)。
本发明所要解决的第二个技术问题是针对现有技术而提供一种上述查尔酮化合物HDPC-12的制备方法。
本发明所要解决的第三个技术问题是针对现有技术而提供一种以上述查尔酮化合物HDPC-12为活性组分的药物组合物。
本发明所要解决的第四个技术问题是针对现有技术而提供一种上述查尔酮化合物HDPC-12的应用。
本发明解决第一个技术问题所采用的技术方案为:一种查尔酮化合物HDPC-12,其特征在于,所述查尔酮化合物的结构式如式Ⅰ所示。
本发明解决第二个技术问题所采用的技术方案为:上述查尔酮化合物HDPC-12的制备方法中,以式Ⅱ所述的化合物Ⅱ为起始物制备。
进一步,上述查尔酮化合物HDPC-12的具体制备方法为:向所述化合物Ⅱ中加入4-异戊烯氧基苯甲醛,混合均匀后滴加由无水乙醇和KOH固体配成的14%KOH溶液,室温反应9~10h,所述化合物Ⅱ、4-异戊烯氧基苯甲醛和KOH的质量比为1:1.2~1.4:9~10;反应结束,将反应液倒入冰水中,用3mol/L HCl调至中性,过滤得到黄色固体,干燥得粗产品,最后粗产品用95%乙醇重结晶,即得所述查尔酮化合物。
本发明解决第三个技术问题所采用的技术方案为:一种用于抗肿瘤活性的药物组合物,包括有效剂量的作为活性组分的上述的查尔酮化合物HDPC-12和至少一种可药用赋形剂,所述的可药用赋形剂为惰性无毒赋形剂,该药物组合物特别指适合口服、非肠道(静脉或皮试)和鼻内途径给药的那些片剂或糖衣片剂、舌下片剂、明胶胶囊、栓剂、霜剂、软膏剂、皮肤用凝胶剂、可注射制剂或可饮用悬浮液等。可特别提及适合口服、非肠道(静脉或皮试)和鼻内途径给药的那些片剂或糖衣片剂、舌下片剂、明胶胶囊、栓剂、霜剂、软膏剂、皮肤用凝胶剂、可注射制剂或可饮用悬浮液等,各种剂型可以按 照药物领域的常规方法制备。
本发明解决第四个技术问题所采用的技术方案为:上述查尔酮化合物在抗肿瘤药物中的应用。
与现有技术相比,本发明的优点在于:本发明中的查尔酮化合物HDPC-12具有显著的抗肿瘤活性作用,该查尔酮化合物能显著抑制人肺癌SPC-A-1细胞增殖并呈一定的浓度相关性,抑制SPC-A-1细胞生长和诱导其凋亡,并且一定浓度的HDPC-12对SPC-A-1细胞中的pro-caspase9、caspase 9、caspase 3、Bax的蛋白水平均具有明显的上调作用,对Bcl-2蛋白水平具有明显的下调作用,显示出具有价值的作为抗肿瘤的药理性质作用;同时该查尔酮化合物原料来源丰富、低廉,制备方法简单,可制成各种剂型的抗肿瘤药物或者与其他药物共同组方,制成多靶点抗肿瘤的复方药物。
附图说明
图1为本发明实施例2中不同浓度的HDPC-12对SPC-A-1增殖活性的影响;
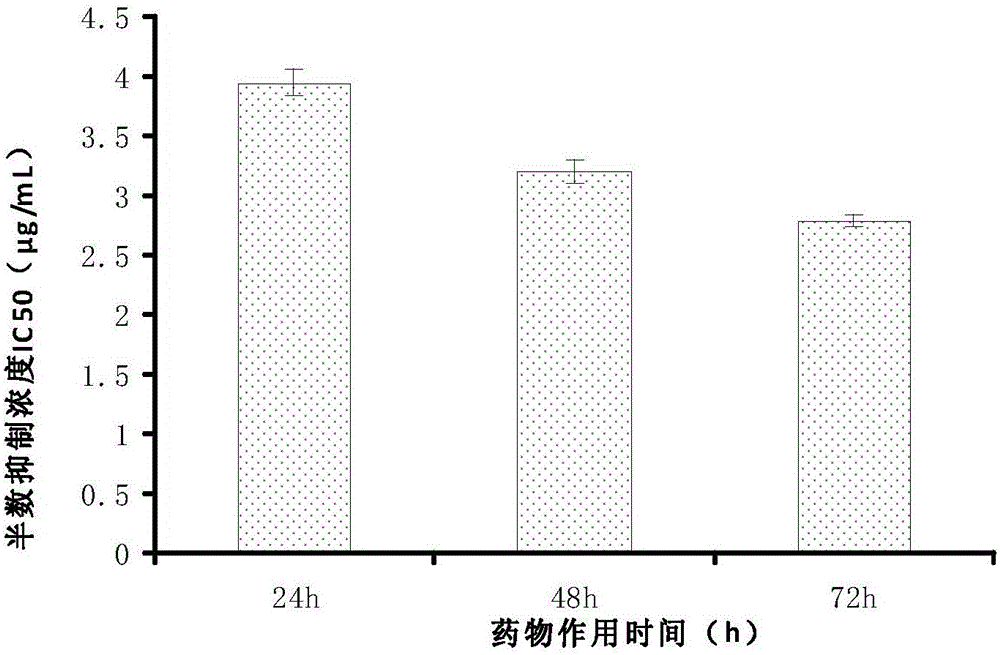
图2为本发明实施例2中HDPC-12不同作用时间下对SPC-A-1的IC50值;
图3为本发明实施例3中HDPC-2对SPC-A-1细胞影响的倒置显微镜下细胞形态图(×200),其中A为对照组,B为25μg/mL加药组,C为50μg/mL加药组,D为100μg/mL加药组;
图4为本发明实施例3中HDPC-12对SPC-A-1细胞影响的HE染色细胞形态图(×400),其中A为对照组,B为25μg/mL加药组,C为50μg/mL加药组,D为100μg/mL加药组;
图5为本发明实施例3中HDPC-12对SPC-A-1细胞影响的AO/EB染色细胞形态图(×200),其中A为对照组,B为25μg/mL加药组,C为50μg/mL加药组,D为100μg/mL加药组;
图6为本发明实施例3中HDPC-12对SPC-A-1细胞影响的透射电镜图,其中A为对照组(×4200),B为25μg/mL加药组(×2500),C为50μg/mL加药组(×4200),D为100μg/mL加药组(×5900);
图7为本发明实施例4中流式细胞检测HDPC-12对SPC-A-1细胞凋亡的影响,其中左上图为对照组,右上图为25μg/mL加药组,左下图为50μg/mL加药组,右下图为100μg/mL加药组;
图8为本发明实施例5中HDPC-12作用24h对SPC-A-1细胞影响的线粒体膜电位图,其中左上图为对照组,右上图为25μg/mL加药组,左下图为50μg/mL加药组,右下图为100μg/mL加药组;
图9为本发明实施例6中HDPC-12作用24h后的SPC-A-1细胞中Bcl-2、Bax、 pro-caspase9、caspase9和caspase 3的Western blotting蛋白电泳条带图,图中正常为对照组,低浓度组为25μg/mL组,中浓度组为50μg/mL组,高浓度组为100μg/mL组;
图10为本发明实施例6中HDPC-12作用24h后的SPC-A-1细胞中Bax蛋白经Aphla化学发光系统数据分析后的水平表达与β-actin比值变化示意图;
图11为本发明实施例6中HDPC-12作用24h后的SPC-A-1细胞中Bcl-2蛋白经Aphla化学发光系统数据分析后的水平表达与β-actin比值变化示意图;
图12为本发明实施例6中HDPC-12作用24h后的SPC-A-1细胞中caspase9蛋白经Aphla化学发光系统数据分析后的水平表达与β-actin比值变化示意图。
具体实施方式
以下结合附图实施例对本发明作进一步详细描述。
实施例1:HDPC-12(2-羟基-4,4′-二异戊烯氧基查尔酮)的制备
向0.5g 3.2mmol化合物II中加入0.648g 4.8mmol 4-异戊烯氧基苯甲醛,混合均匀后,滴加由35mL无水乙醇和4.9g KOH配成14%KOH的溶液,室温反应10h,其中上述化合物II的结构式为如下式II所示。
反应结束,将反应液倒入60mL冰水中,用3mol/L HCl调pH至中性,过滤得到黄色固体,干燥,粗产品用95%乙醇重结晶,得黄色晶体,即所需的查尔酮化合物HDPC-12(2-羟基-4,4′-二异戊烯氧基查尔酮)。
上述制备的查尔酮化合物HDPC-12经过IR、1H-NMR、13C-NMR、MS和元素分析确定其结构和纯度,光谱数据如下:
产率:71%,熔点:75-77℃。1H NMR(CDCl3,300MHz):δ1.69(s,6H,-C2H6),1.74(s,6H,-C2H6),4.49(m,4H,-C2H4),5.42(t,2H,J=9Hz,=CH),6.40-7.74(m,4H,-C6H4),7.39(d,1H,J=15Hz,=CH),6.86-6.93(m,3H,-C6H3),7.79(d,1H,J=15Hz,=CH),13.50(s,1H,-OH).13C-NMR(CDCl3,75MHz):18.2,18.4,25.4,25.7,65.1,65.2,102.7,108.6,113.7,118.5,123.3,123.4,127.6,128.6,130.5,131.5,131.8,132.3,132.5,136.6,138.6,139.4,165.5,166.9,191.7.IR(KBr)cm-1:3215,1642,1584,1221,970.Anal.Calcd.for C25H28O4:C,76.50;H,7.19;O,16.31.Found:C,76.45;H,7.05;O,16.20.MS m/z 393(M+1)。
实施例2:细胞增殖抑制试验
2.1SPC-A-1细胞培养
人肺癌SPC-A-1细胞(购于中科院细胞库)置于1640培养液(GIbco公司)、37℃、5%CO2的培养箱中培养。待细胞呈单层贴壁生长时,0.25%的胰蛋白酶消化,每2~3天传代1次。实验时选用对数生长期的SPC-A-1细胞悬液,以1×104/mL接种至96孔板,每孔200μL,培养24h后吸弃上清。
2.2MTT法检测
设对照组及12.5、25、50和100μg/mL加药组,每组设3个复孔,分别培养24h、48h和72h后弃培养液,加入1mg/mLMTT(GIbco公司)200μL,继续培养4h。吸弃MTT,加入150μL的DMSO,充分混合。置酶标仪(美国Bio-Rad公司)在490nm测吸光度,计算细胞增殖抑制指数(IR),IR=[(对照组A值-加药组A值)/(对照组A值-调零孔A值]×100%,重复实验3次。
2.3试验结果
试验结果如图1所示,由图1可见,随着HDPC-12浓度的增加和作用时间的延长,SPC-A-1细胞的增殖抑制指数明显上升,与对照组相比具有统计学意义(P<0.05),并且,如图2所示,24h、48h和72h的IC50分别为27.9μg/mL、31.9μg/mL和39.5μg/mL。
实施例3:人肺癌SPC-A-1细胞形态观察
3.1光镜下的细胞形态学观察
6孔培养板内放入经处理过的盖玻片(经赖氨酸浸泡),取SPC-A-1单细胞悬液,将细胞浓度调至1×105/mL,接种于培养板,每孔2ml,次日换液,设对照组及25μg/mL、50μg/mL和100μg/mL加药组,培养24h后,倒置显微镜下观察形态并拍照。
随后取出盖玻片,用PBS洗3次,95%乙醇固定30min,苏木素染染色5~10min,自来水浸洗,伊红染色0.5~1min,经梯度酒精逐级脱水,二甲苯透明,中性树胶封片,光学显微镜下观察细胞形态并拍照。
倒置显微镜观察结果如图3所示,对照组SPC-A1细胞生长良好,形态饱满,呈上皮样生长,边界清楚(如图3A所示)。如图3B和C所示,HDPC-12作用SPC-A1细胞24h后,细胞收缩变圆,体积缩小,形态不规则,细胞贴壁能力下降,部分细胞漂浮于培养液中,并且,如图3D所示,当药物浓度为100μg/mL时,细胞失去了正常形态,部分细胞破裂,培养液中可见明显的细胞碎片及颗粒物,部分细胞坏死。由上可见,HDPC-12对SPC-A1细胞具有生长抑制作用,并且呈一定的浓度依赖性。
HE染色结果如图4所示,由图4A可见,对照组SPC-A1细胞呈上皮样,核仁数目多。药物作用后,细胞形态出现不规则:由图4B可见,当HDPC-12浓度为25μg/mL时,胞质溶解,出现较多空泡,核仁数目减少;由图4C可见,当药物浓度为50μg/mL时,细胞体积明显缩小,出现胞芽,核固缩,部分细胞核消失;由图4D可见,当药物浓度为100μg/mL时,细胞形态各异,大部分细胞核溶解、消失,存在的细胞核也进一 步固缩,出现凋亡的形态学变化。
3.2AO/EB染色
6孔培养板内放入经处理过的盖玻片(经赖氨酸浸泡),取SPC-A-1单细胞悬液,将细胞浓度调至1×105/mL,接种于培养板,每孔2ml,次日换液,设对照组及25μg/mL、50μg/mL和100μg/mL加药组,培养24h。
取AO和EB各1mg分别溶解于10mL pH7.2的PBS中,摇匀混合,用前配制,遮光保存。取上述经24h培养的盖玻片,观察前滴加40μL PBS和10μLAO/EB混合液于载玻片上,将有细胞一面的盖玻片朝下,荧光显微镜观察、拍照。
AO/EB染色结果如图5所示,由图5A可见,对照组无明显凋亡细胞出现,细胞大小均匀,细胞核形态规则,胞核呈现绿色荧光。用药后细胞均不同程度出现形态变化:由图5B可见,25μg/mL组细胞出现早期凋亡的现象,胞质出现空泡,核呈黄绿色荧光,核固缩呈新月形;由图5C可见,50μg/mL组细胞核呈桔黄色荧光,核固缩;由图5D可见,当药物浓度为100μg/mL时,细胞形态出现多样性,体积明显缩小,部分细胞核消失,核成桔红色荧光,表示细胞已处于晚期凋亡状态;部分细胞核呈均一红色,表示细胞已坏死。
3.3透射电镜观察细胞形态
6孔培养板内放入经处理过的盖玻片(经赖氨酸浸泡),取SPC-A-1单细胞悬液,将细胞浓度调至1×105/mL,接种于培养板,每孔2ml,次日换液,设对照组及25μg/mL、50μg/mL和100μg/mL加药组。
培养48h后后经消化、离心,加2.5%的戊二醛前固定,PBS洗2次后,1%锇酸固定1h,PBS洗2次;乙醇梯度脱水,丙酮+环氧树脂618渗透包埋,超薄切片约70nm厚,醋酸铀、硝酸银双重染色,透射电镜下观察超微结构并拍照。
结果如图6所示,由图6A可见,对照组细胞培养48h后可见细胞表面有较多微绒毛.核膜完整,染色质分布均匀,核仁明显。由图6B、C及D可见,应用HDPC-12后的SPC-A-1细胞超微结构发生明显改变,可见细胞表面的微绒毛明显减少,染色质电子密度增高并浓缩聚集至核膜边缘,部分细胞表面有“出芽”现象,出现凋亡小体,为细胞凋亡的表现。
实施例4:流式细胞仪分析细胞凋亡率
将细胞密度约为1×105的SPC-A-1细胞接种在25mL的培养瓶中,常规培养24h后加入分别含25μg/mL、50μg/mL和100μg/mL的HDPC-12的培养液继续培养,同时设立空白对照组。
继续培养24h后,0.25%胰蛋白酶消化,预冷的PBS悬浮细胞,1000r/min离心5min。去上清,加入1×Annexin V结合液400μL吹打混匀,然后加入5μL Annexin V-FITC染 液,混匀后避光孵育15min后,再加入10μL的PI,室温下在暗室静置5min后过200目筛子,置于流式细胞仪(美国MILLIPORE公司)进行检测,其中Annexin V-FITC/PI双染试剂盒购于上海贝博生物。
结果如图7所示,以FITC和PI荧光作双参数点图,细胞分成4个区:左下象限(LL),代表正常细胞;左上象限(μL)Annexin V-FITC-PI+,代表机械损伤细胞;右下象限(LR)Annexin V-FITC+/PI-,为早期凋亡细胞;右上象限(μR)Annexin V-FITC+/PI+凋亡晚期或坏死细胞。从图中可见,对照组细胞基本分布在LL区域,以不同浓度的HDPC-12作用后,早期凋亡细胞明显增多,当HDPC-12浓度达到100μg/mL时,早期凋亡率达到14.86%,晚期凋亡细胞达14.47%。
实施例5:流式细胞仪分析线粒体膜电位变化
细胞浓度约为1×105的SPC-A-1细胞接种在25mL的培养瓶中,常规培养24h后分别加入含25μg/mL、50μg/mL和100μg/mL的HDPC-12的培养液继续培养,同时设立空白对照组。培养24h后,0.25%胰酶消化细胞转移到离心管中,再用3mL PBS洗涤细胞两次(离心1000rpm,5min1000r/min离心5min),收集细胞。取500μL 1×Incubation Buffer,加1μL的JC-1混合均匀,吸取500μL的JC-1工作液将细胞悬浮,放置于37℃、5%CO2条件下的细胞培养箱中孵育20min。离心(1500rpm,5min)并收集细胞,用1×IncubationBuffer悬浮细胞,重复两次,最后将用1×Incubation Buffer悬浮均匀的细胞过200目筛子,置于流式细胞仪进行检测,其中线粒体膜电位检测试剂盒购自南京凯基生物发展有限公司。
细胞内线粒体对JC-1染料的摄取依赖于线粒体的膜电位,正常情况下的SPC-A-1细胞线粒体的膜电位比较高,呈现出红色荧光,当细胞受到损伤后,线粒体的膜电位出现下降,出现由红色荧光向绿色荧光的转变。如图8所示,图8中右上象限表示为正常线粒体膜电位所占细胞的百分率(即JC-1聚集在线粒体膜上),右下象限则为线粒体膜电位降低细胞的百分率(即JC-1释放为单体形式存在)。结果如图8所示,当HDPC-12作用SPC-A-1细胞24h后,线粒体膜电位开始下降,当HDPC-12作用浓度分别为25μg/mL、50μg/mL和100μg/mL时,其膜电位降低细胞所占的百分率分别为2.68%、7.42%和21.50%,表明随药物浓度的增加,线粒体膜电位也逐渐降低。
实施例6:Western blotting
药物浓度及分组设置同3.1,加入RIPA(250μL/50mm2)+PMSF(10μL/mL)后反复吹打,冰上细胞裂解30min。收集细胞裂解液,12000r/min离心10min,取上清液。按照测定的蛋白含量取等体积的蛋白提取液,与5×蛋白上样缓冲液按1:4的比例混合,沸水浴5min后,-80℃储存备用。
采用SDS-PAGE法,按照实验需要先后配置分离胶和浓缩胶。取蛋白样品各25μL经上样缓冲液处理后上样,电压60v电泳25min后转换电压100v,电泳90min;在转 膜溶液中将蛋白转印至PVDF膜上,用含20%Tween-20的TBST溶液漂洗1次后,将PVDF膜至于5%脱脂奶粉中4℃封闭2h;TBST 10mL溶液洗膜2次,TBS 10mL溶液洗膜1次,将膜置于1%BSA溶液稀释后的一抗(稀释比例参照使用说明书)的杂交袋,4℃孵育过夜;洗膜后加入1%BSA的溶液稀释的辣根过氧化物酶标记的二抗(稀释比例参照说明书),4℃摇床孵育2h后,洗膜后ECL显影,应用Alpha化学发光仪(美国Alpha公司)进行扫描并记录光密度强度。以β-actin作为内参对照校正并做相对量分析,数值以两者的光密度值积分比值表示。
SPC-A-1细胞经不同浓度的CHIPC作用24h后,Bcl-2、Bax、pro-caspase9、caspase9和caspase 3的蛋白电泳条带结果如图9所示,经Aphla化学发光系统数据分析后Bax、Bcl-2以及caspase9蛋白的水平表达与β-actin比值变化示意图分别如图10、图11及图12所示。Western blotting结果显示,25μg/mL组细胞中的Bcl-2蛋白表达水平较对照组明显降低,Bax蛋白表达水平显著增加,pro-caspase9、caspase 9、caspase 3水平显著上调,结果表明一定浓度的HDPC-12对pro-caspase9、caspase 9、caspase 3、Bax的蛋白水平均具有明显的上调作用,对Bcl-2蛋白水平具有明显的下调作用。
本实施例使用的Bcl-2、Bax、TNF-α、Caspase-9、Caspase-3抗体均购于北京中杉金桥生物技术有限公司。
- 还没有人留言评论。精彩留言会获得点赞!
- 一类水溶性含双苯并三氮唑‑查尔酮二联体的有机磺酸盐衍生物合成与应用的制作方法与工艺
- 一种从甘草渣制备甘草查尔酮A的方法与流程
- 一种氟化查尔酮的制备方法与流程
- 一类具抗肿瘤活性的甘草查尔酮A二氢氨基嘧啶类化合物及其合成方法与流程
- 一类具抗肿瘤活性的甘草查尔酮A硫脲嘧啶类衍生物及其合成方法与流程
- 一种具抗肿瘤活性的甘草查尔酮A二氢吡唑甲酰胺类化合物及其合成方法与流程
- 3‑去氧苏木查尔酮在制备预防和治疗结直肠癌药物中的应用的制作方法与工艺
- 具有2’‑羟基查尔酮结构Diels‑Alder产物的制备方法与流程
- 一种海南龙血树查尔酮异构酶DcCHIL1及其编码基因和应用的制造方法与工艺
- 一类具抗肿瘤活性的甘草查尔酮A二氢嘧啶类化合物及其合成方法与流程