转基因玉米T4‑1‑1品系特异性检测方法及试剂盒与流程
本发明涉及一种转基因作物的品系特异性检测,特别涉及转基因玉米T4-1-1品系特异性PCR检测方法及试剂盒。
背景技术:
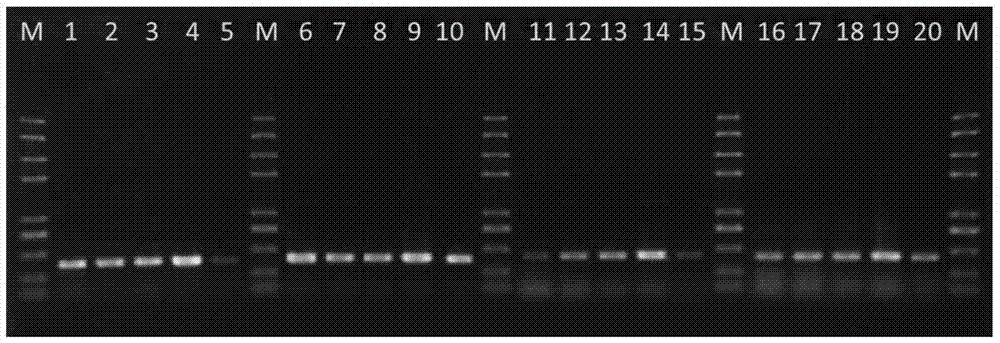
::在对进行转基因植物及其加工产品进行成分定性检测时,可根据其检测的特异性分为筛选检测方法、基因特异性检测方法和品系特异性检测方法等。品系特异性检测是通过检测插入载体与植物基因组的连接区序列实现的,由于每一个转基因植物品系,都具有特异的外源插入载体与植物基因组的连接区序列。品系特异性具有更高的特异性和准确性,最适合做转基因产品检测。根据《转基因植物及其产品成分检测》国家标准,品系特异性检测方法中往往对特异性PCR反应扩增的产物有一定要求,即长度120-300bp之间、扩增条带单一、并可用于多种仪器进行结果显示。这样符合检测上快速、准确、特异的要求,更加方便转基因产品成分检测上的应用。转基因玉米T4-1-1品系是由四川省农业科学院生物技术核技术研究所开发的玉米品系,具有极好的抗除草剂能力。目前尚未有任何关于转基因玉米T4-1-1的品系特异性PCR检测方法。技术实现要素:本发明的目的是提供转基因玉米T4-1-1品系特异性PCR检测方法及试剂盒。为达到上述目的,要解决的关键技术是提供合适的用于检测转基因玉米T4-1-1的品系特异性PCR检测引物。本发明的上述目的是通过以下技术方案来实现的:本发明首先根据转基因玉米T4-1-1的3’端侧翼序列(SEQIDNo.9),设计了用于检测转基因玉米T4-1-1的品系特异性PCR检测引物,其核苷酸序列选自以下引物对1~4中任一:引物对1:SEQIDNo.1和SEQIDNo.2;引物对2:SEQIDNo.3和SEQIDNo.4;引物对3:SEQIDNo.5和SEQIDNo.6;引物对4:SEQIDNo.7和SEQIDNo.8。其中,经实验证实,引物对1的扩增效率最高。本发明还提供了一种用于检测转基因玉米T4-1-1的品系特异性PCR检测试剂盒,其特征在于包括有上述的4对PCR检测引物中任一。优选的PCR检测引物是引物对1。由此,本发明建立了一种转基因玉米T4-1-1品系特异性的PCR定性检测方法,其特征在于使用前述的PCR检测引物。上述方法的具体步骤如下:(1)提取待检测水稻样品的DNA;(2)以提取的DNA为模板,用权利要求1所述的PCR检测引物,建立PCR扩增体系,并进行PCR扩增;(3)根据是否能扩增出核苷酸序列为SEQIDNo.10的DNA片段的条带,确定品系特异性:如果扩增出该条带,则确定被检测的样品是转基因玉米T4-1-1;如果不能扩增出,则确定不是转基因玉米T4-1-1。其中,所述的从待检测样品中提取DNA的方法,可以是从植物材料中提取DNA的各种常用方法,例如可以是CTAB法、异硫氰酸胍法或盐酸胍法等各种方法。在上述方法中,PCR反应体系和扩增条件对检测效果有影响。特别是,PCR反应体系中引物的终浓度以及退火温度对于检测结果的特异性、灵敏度;本发明考察了PCR反应体系中引物的终浓度以及退火温度对于检测的特异性和灵敏度的影响,实验结果发现在引物终浓度为0.2μM、退火温度为58℃时,检测结果的特异性最强,灵敏度最高。本发明中所述的PCR扩增体系可参考以下方法建立:反应体系的总体积为25.0μL,其中,10×PCR缓冲液5μL,dNTPs混合溶液2μL,10μmol/LSEQIDNo.1所示的引物1.0μL,10μmol/LSEQIDNo.2所示的引物1.0μL,5U/μLGoTaq酶0.2μL,25mg/LDNA模板2.0μL,余量为双蒸水。所述的PCR扩增条件优选为:94℃,5min;94℃,20s,58℃,20s,72℃,20s,35个循环;72℃,2min。采用本发明建立的转基因玉米T4-1-1的品系特异性PCR定性检测方法对常规玉米吉单180、吉东26、沈玉21、郁青281和转基因玉米T4-1-1、GA21、NK603、T25、TC1507、Bt11、Bt176、MON863、MON89034、MIR604以及其它转基因植物(例如:水稻科丰6号、大豆356043、棉花MON1445和油菜MS1等)进行了定性检测。定性PCR扩增结果表明,在转基因玉米T4-1-1基因组中扩增得到了目的片段大小的条带(293bp),在其它转基因植物以及常规玉米等基因组中没有扩增得到目的片段大小的片段;通过测序分析表明转基因玉米T4-1-1基因组中扩增获得的序列与目的扩增片段序列一致。实验结果表明,本发明所建立的转基因玉米T4-1-1品系特异性定性PCR检测方法具有较强的特异性。检出限实验结果表明,转基因玉米T4-1-1成分为1%、0.5%、0.1%、0.05%的PCR反应中均扩增出了目的片段大小的条带,说明本发明转基因玉米T4-1-1品系特异性PCR定性检测方法的检出限为0.05%,具有高度的灵敏性。附图说明图1引物扩增结果,其中M:100bpDNAmarker;1:空白对照;2:阴性对照;3:引物1;4:引物2;5:引物3;6:引物4。图2PCR反应体系中引物1终浓度和退火温度优化结果:M:Trans2KplusIIDNAMarker;1-5引物终浓度为0.1μM/L;1:55℃;2:56℃;3:58℃;4:60℃;5:62℃;6-10引物终浓度为0.2μM/L;6:55℃;7:56℃;8:58℃;9:60℃;10:62℃;11-15引物终浓度为0.5μM/L;11:55℃;12:56℃;13:58℃;14:60℃;15:62℃;16-20引物终浓度为1.0μM/L;16:55℃;17:56℃;18:58℃;19:60℃;20:62℃。图3转化体方法特异性检测;M:Trans2KplusIIDNAMarker;1:空白对照;2:阴性对照;3:T4-1-1样品;4-13:分别为样品1、样品2、样品3、样品4、样品5、样品6、样品7、样品8、样品9、样品10。图4转化体方法检测限测试结果。A灵敏度测试结果;M:Trans2KplusIIDNAMarker;1:空白对照;2:阴性对照;3-7分别为:T4-1-1阳性1%、0.5%、0.1%、0.05%、0.01%。B检测限测试结果;M:Trans2KplusIIDNAMarker;1-10:T4-1-1阳性0.05%的10个平行;11-20:T4-1-1阳性0.01%的10个平行。实施例1转基因玉米T4-1-1的品系特异性定性检测引物的筛选1、引物的设计根据T4-1-1插入基因载体和其3’端旁侧序列的连接区序列(SEQIDNo.9)为靶序列设计4对转化体特异性引物,引物序列如下:引物1:扩增产物片段大小为293bp1-F:TCGTGAGAGTTTAGCGATTGG(SEQIDNo.1)1-R:ATGACGTTATTTATGAGATGGGTTT(SEQIDNo.2)引物2:扩增产物片段大小为176bp2-F:GAATCTTAGCTGTCCATGTTGGG(SEQIDNo.3)2-R:GGATAAATTATCGCGCGCG(SEQIDNo.4)引物3:扩增产物片段大小为270bp3-F:AATGGAATCTTAGCTGTCCA(SEQIDNo.5)3-R:GACGTTATTTATGAGATGGGTTTTT(SEQIDNo.6)引物4:扩增产物片段大小为122bp4-F:GTGTTGGATCAATGGCTGCC(SEQIDNo.7)4-R:AACTAGGATAAATTATCGCGCG(SEQIDNo.8)2、引物的扩增及筛选扩增外源插入载体和玉米基因组的连接区序列,扩增产物的大小均不小于100bp。应用通用的PCR反应条件,用4对引物进行PCR扩增,设置2个重复;从扩增结果可见,这4对引物均能特异性地从T4-1-1样品中扩增出预期片段,但是用SEQIDNo.1和SEQIDNo.2所示的引物扩增的293bp的条带最为清晰且引物二聚体较少(图1),因此,本发明优先采用SEQIDNo.1和SEQIDNo.2所示引物作为检测转基因玉米T4-1-1的品系特异性PCR检测的引物。实施例2基于转基因玉米T4-1-1品系外源插入片段的旁侧序列建立的T4-1-1品系特异性定性PCR检测方法一、植物基因组DNA的提取与检测1植物DNA提取(1)100mg样品研磨成粉末后转移至2mL离心管中;(2)1mL预热至65℃的CTAB提取缓冲液,充分混合、悬浮试样,并轻柔混合,65℃水浴40min,期间颠倒混匀数次;(3)12000×g离心15min。转移上清至一新离心管,加入等体积酚、氯仿-异戊醇(24:1),充分混合。重复本操作1次;(4)12000×g离心10min,取上清,加入2/3体积异丙醇,1/10体积乙酸钠。-20℃放置2小时或更长时间;(5)12000×g离心10min,弃上清,加入500μL,70%乙醇溶液,并颠倒离心管数次。离心,弃上清,充分挥发乙醇,干燥DNA。(6)加100μL水溶解DNA,用重蒸馏水将DNA溶液浓度调制为100ng/μL,储存于-20℃备用。备注:CTAB提取缓冲液的配制600mL蒸馏水中加入81.7gNaCl和20gCTAB,再加入100mL的1MTris-HCl(pH7.5)溶液,100mL的0.5MEDTA(pH8.0)溶液,调pH至8.0,加水定容至1000mL。高温高压(103.4kPa/121℃)条件下灭菌20min后使用。2DNA检测取5ul提取的DNA溶液,以0.8%的琼脂糖凝胶电泳,根据其亮度和带型来判断DNA的质量。采用紫外分光光度计测定所提DNA的浓度和纯度。二、检测引物所使用的检测引物为上述实施例1中筛选的引物对1,其核苷酸序列为SEQIDNo.1和SEQIDNo.2所示。三、PCR反应体系和条件优化调整优化PCR反应体系中引物的终浓度,设置0.1μM、0.2μM、0.5μM、1.0μM等4个浓度梯度,并以55℃、56℃、58℃、60℃、62℃为退火温度进行PCR反应的扩增。结果表明,在所设的不同引物浓度和不同退火温度条件下均能扩增出预期大小的片段,但在引物终浓度为0.2μM、退火温度为58℃时效果最好(图2)。经过优化,T4-1-1转基因玉米品系特异性定性PCR检测的体系见表1,PCR反应程序见表2。表1转基因玉米T4-1-1品系特异性定性PCR检测体系试剂终浓度体积水14.8μL10×PCR缓冲液1×5μLdNTPs混合溶液(各2.5mmol/L)各0.2mmol/L2μL10μmol/L上游引物0.2μmol/L0.5μL10μmol/L下游引物0.2μmol/L0.5μLGoTaq酶5U/μL0.2μL25mg/LDNA模板2mg/L2.0μL总体积25.0μL表2转基因玉米T4-1-1品系特异性定性PCR反应程序实施例3T4-1-1转基因玉米品系特异性定性PCR检测方法的特异性分析一、实验材料样品1:非转基因玉米吉单180、吉东26、沈玉21、郁青281,等量混合制成一个样品。样品2:水稻阴性。样品3:大豆阴性。样品4:棉花阴性。样品5:油菜阴性。样品6:转基因玉米GA21、NK603、T25、TC1507、Bt11、Bt176、MON863、MON89034、MIR604,混合制成1个样品,含量各5%。样品7:转基因水稻科丰6号、克螟稻、M12、TT51,混合制成一个样品,含量各5%。样品8:转基因大豆356043、305423、CV127、MON89788、A2704-12、GTS40-3-2,混合制成1个样品,含量各5%。样品9:转基因棉花MON1445、MON88913、LLCOTTON25、MON15985,混合制成1个样品,含量各5%。样品10:转基因油菜MS1、MS8、RF1、RF2、RF3、T45、Oxy235,混合制成1个样品,含量各5%。以上实验材料由中国农科院生物技术研究所和四川省农业科学院生物技术核技术研究所提供。二、实验方法及结果以SEQIDNo.1和SEQIDNo.2为检测引物对,按照实施例2所建立的T4-1-1转基因玉米品系特异性定性PCR检测方法对各种材料进行扩增。结果表明,在T4-1-1转基因玉米基因组中扩增得到了目的片段大小的条带(293bp),在其他样品基因组中均未扩增得到目的片段大小的片段(图3)。通过测序分析表明T4-1-1转基因玉米基因组中扩增获得的序列与目的扩增片段序列一致。上述结果表明,引物SEQIDNo.1和SEQIDNo.2建立的转基因玉米T4-1-1品系特异性定性PCR检测方法具有高度特异性。实施例4转基因玉米T4-1-1品系特异性定性PCR检测方法的检出限分析以SEQIDNo.1和SEQIDNo.2为特异性引物对,按照实施例2所建立的转基因玉米T4-1-1品系特异性定性PCR检测方法进行检出限分析。T4-1-1阳性DNA和其受体DNA按不同质量比混合,制备T4-1-1质量分数分别为0.1%、0.5%、0.1%、0.05%、0.01%的样品,按照优化的反应体系及反应程序进行PCR扩增,实验结果表明,转基因水稻PA110-15成分为1%、0.5%、0.1%、0.05%的PCR反应体系中均能扩增出大小为293bp的目的片段(图4A)。转基因玉米T4-1-1的含量为0.05%时,在10个平行中均能稳定扩增出预期大小条带,而该条带在阳性0.01%的10个平行中扩增呈现不稳定性(图4B),因此本发明转基因玉米T4-1-1品系特异性定性PCR检测方法的检测限为0.05%。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 用于检测AEDs引起的SJS/TEN的引物、试剂盒及方法与制造工艺
- 检测植原体的LAMP引物组及其试剂盒和应用的制造方法与工艺
- 用于多重PCR检测致腹泻寄生虫的引物组及试剂盒的制造方法与工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种基于特异性SS-COI引物的丽草蛉PCR快速检测方法与制造工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 紫苑石斛的分子特异性标记引物及检测方法
- 一种检测牛hcd携带者的特异性pcr引物、试剂盒及检测方法