一种制备含有两个手性中心α-氟-β-乙炔基酮化合物的方法与流程
本发明属于有机合成领域,具体涉及一种制备含有两个手性中心α-氟-β-乙炔基酮化合物的方法。
背景技术:
含氟有机化合物在医药、农药、材料等领域有着广泛应用,因此发展有效的方法来构建含氟有机化合物具有重要的意义。这其中,手性含氟有机化合物的合成更是其中的难点和热点之一。[(a)O’Hagan,D.;Harper,D.B.Nat.Prod.Rep.1994,11,123;(b)Hiyama,T.Organofluorine Compounds,Chemistry and Applications;Springer-Verlag:Berlin Heidelberg,2000;(c)Kirsch,P.Modern Fluoroorganic Chemistry;Wiley-VCH:Weinheim,2013;(d)Wang,J.;Snnchez-Roselló,M.;J.L.;del Pozo,C.;Sorochinsky,A.E.;Fustero,S.;Soloshonok,V.A.;Liu,H.Chem.Rev.2013,114,2432.]。手性α-氟化酮化合物,特别是其中的手性α-三级氟化酮化合物是一类重要的含氟化合物,在过去十多年里人们进行了很多研究。目前主要有以下两个合成策略:1)通过酮化合物α位与氟源发生不对称亲电氟化反应[(a)Ma,J.-A.;Cahard,D.Chem.Rev.2004,104,6119;(b)Ibrahim,H.;Togni,A.Chem.Commun.2004,1147;(c)Lectard,S.;Hamashima,Y.;Sodeoka,M.2010,352,2708;(d)Yang,X.-Y.;Wu,T.;Phipps,R.J.;Toste,F.D.Chem.Rev.2015,115,826.]。2)通过氟化酮化合物或其类似物中酮羰基α位与烷基化试剂发生不对称烷基化反应[(a)Mohr,J.T.;Behenna,D.C.;Harned,A.M.;Stoltz,B.M.Angew.Chem.Int.Ed.2005,44,6924;(b)Nakamura,M.;Hajra,A.;Endo,K.;Nakamura,E.Angew.Chem.Int.Ed.2005,44,7248;(c)Bélanger,;Cantin,K.;Messe,O.;Tremblay,M.;Paquin,J.J.Am.Chem.Soc.2007,129,1034.]。目前第二种策略研究相对较少,这其中通过氟化酮化合物或其类似物的不对称炔丙基取代反应来构建手性α-氟-β-乙炔基酮化合物更是未见报道。手性α-氟-β-乙炔基酮化合物不仅含有氟原子,而且存在一个很容易进行多种衍生化的炔基,因此通过不对称炔丙基取代反应合成该类化合物具有重要意义。本发明首次利用手性铜催化剂催化的氟化烯醇硅醚与炔丙基类化合物间的不对称炔丙基取代反应,高非对映选择性及高对映选择性地合成了含有两个手性中心的α-氟-β-乙炔基酮化合物,为手性α-氟-β-乙炔基酮化合物提供了一条操作简单,反应条件温和,非对映选择性以及对映选择性高的合成路线。
技术实现要素:
本发明的目的是提供一种通过铜催化的氟化烯醇硅醚与炔丙基类化合物通过不对称炔丙基反应来合成含有两个手性中心α-氟-β-乙炔基酮化合物的方法。本发明具有原料易得,操作简单,反应条件温和,非对映选择性和对映选择性高等特点。
本发明提供了一种制备含有两个手性中心手性α-氟-β-乙炔基酮化合物的方法,在碱添加剂存在或不加碱条件下,手性铜催化剂在反应介质中催化氟化烯醇硅醚与炔丙基类化合物通过不对称炔丙基取代反应合成,具体步骤为:
(1)手性铜催化剂的制备:氮气保护下,将铜盐与P,N,N-配体按摩尔比1:0.1-10在反应介质中搅拌0.5-2小时制得手性铜催化剂;
(2)手性α-氟-β-乙炔基酮化合物的制备:将氟化烯醇硅醚、炔丙基类化合物溶于反应介质中,加入或不加入碱添加剂,然后将该溶液在氮气保护下加入到上述搅拌好的手性铜催化剂的溶液中,一定温度下搅拌反应1-36小时;反应完毕,减压旋蒸,柱分离,得到含有两个手性中心的α-氟-β-乙炔基酮化合物;
所述手性铜催化剂与氟化烯醇硅醚的摩尔比为0.01-100%:1;
所述碱添加剂与氟化烯醇硅醚的摩尔比为0-10:1;
所述炔丙基类化合物与氟化烯醇硅醚的摩尔比为1-10:1。
所述反应介质为甲醇、乙醇、甲苯、苯、二甲苯、二氯甲烷、二氯乙烷、乙醚、四氢呋喃、乙酸乙酯中的至少一种,。
所述含有两个手性中心α-氟-β-乙炔基酮化合物具有以下结构:
式中:R1,R2,R3为C1-C40的烷基、C3-C12的环烷基或带有取代基的C3-C12环烷基、苯基及取代苯基、苄基及取代苄基、含一个或二个以上氧、硫、氮原子的五元或六元杂环芳香基团或酯基;
C3-C12环烷基的取代基、苯基上取代基、或苄基的取代基分别为C1-C40烷基、C1-C40的烷氧基、卤素、硝基、酯基或氰基。
所述氟化烯醇硅醚具有以下结构:
式中:R1,R2为与上述结构式I中R1,R2相同基团;R4,R5,R6为C1-C40的烷基、C3-C12的环烷基或带有取代基的C3-C12环烷基、C2-C40的烯基或带有取代基的C2-C40烯基、苯基及取代苯基、苄基及取代苄基、卤素;
C3-C12环烷基的取代基、C2-C40烯基的取代基、苯基上取代基、或苄基的取代基分别为C1-C40烷基、C1-C40的烷氧基、卤素、硝基、酯基或氰基。
所述炔丙基类化合物具有以下结构:
式中:R3为与结构式上述I中R3相同基团;X为氟、氯、溴、碘、烷基羧酸酯、烷基碳酸酯、烷基磺酸酯、烷基磷酸酯,苯基及取代苯基羧酸酯、苯基及取代苯基碳酸酯、苯基及取代苯基磺酸酯或苯基及取代苯基磷酸酯;取代苯基上的取代基为C1-C40烷基、C1-C40的烷氧基、卤素、硝基、酯基或氰基中的一种或二种以上,取代基个数为1-5个。
所述铜盐为水合醋酸铜、水合硫酸铜、无水醋酸铜、无水硫酸铜、三氟甲磺酸酮、氯化铜、醋酸亚铜、氯化亚铜、碘化亚铜、高氯酸亚铜、三氟甲磺酸亚酮、Cu(CH3CN)4BF4、Cu(CH3CN)4ClO4中的至少一种。优选水合醋酸铜、三氟甲磺酸酮、Cu(CH3CN)4BF4、Cu(CH3CN)4ClO4中的至少一种。
所述手性P,N,N-配体结构式为:
式中:R7,R8为H、C1-C10内的烷基、C3-C8内的环烷基、苯基及取代苯基或苄基及取代苄基;取代苯基或取代苄基上的取代基为C1-C40烷基、C1-C40的烷氧基、卤素、硝基、酯基或氰基中的一种或二种以上,取代基个数为1-5个;
R9,R10为H、卤素、C1-C40的烷基和C3-C12的环烷基、苯基及取代苯基、C1-C40的烷氧基、苯氧基,酰基或硝基;取代苯基上的取代基为C1-C40烷基、C1-C40的烷氧基、卤素、硝基、酯基或氰基中的一种或二种以上,取代基个数为1-5个;
R11为C1-C40的烷基、C3-C12的环烷基、苯基及取代苯基、萘基及取代萘基或含一个或以上氧、硫、氮原子中的一种或二种以上的五元或六元杂环芳香基团;取代苯基或取代萘基上的取代基为C1-C40烷基、C1-C40的烷氧基、卤素、硝基、酯基或氰基中的一种或二种以上,取代基个数为1-5个。
所述碱添加剂为各种无机碱或有机碱,优选N,N-二异丙基乙胺、三乙胺、叔丁醇钾、磷酸钾、KOH、NaOH、K2CO3、Na2CO3或NaHCO3等。
所述步骤(2)催化反应条件优选为:温度为-20℃;反应介质为甲醇;压力为常压;时间为12小时。
所述手性铜催化剂与氟化烯醇硅醚的摩尔比优选为1-10%;
所述碱添加剂与氟化烯醇硅醚的摩尔比优选为2.5:1;
所述炔丙基类化合物与氟化烯醇硅醚的摩尔比优选为2.5:1。
本发明的反应方程式为:
本发明具有以下优点:
1、起始原料廉价易得。
2、手性配体合成简便,催化剂廉价易得,用量少。
3、反应活性好、非对映选择性和对映选择性高、反应条件温和。
4、该方法可以方便地合成出含有两个手性中心的α-氟-β-乙炔基酮化合物,并且其中一个是季碳含氟手性中心。
附图说明
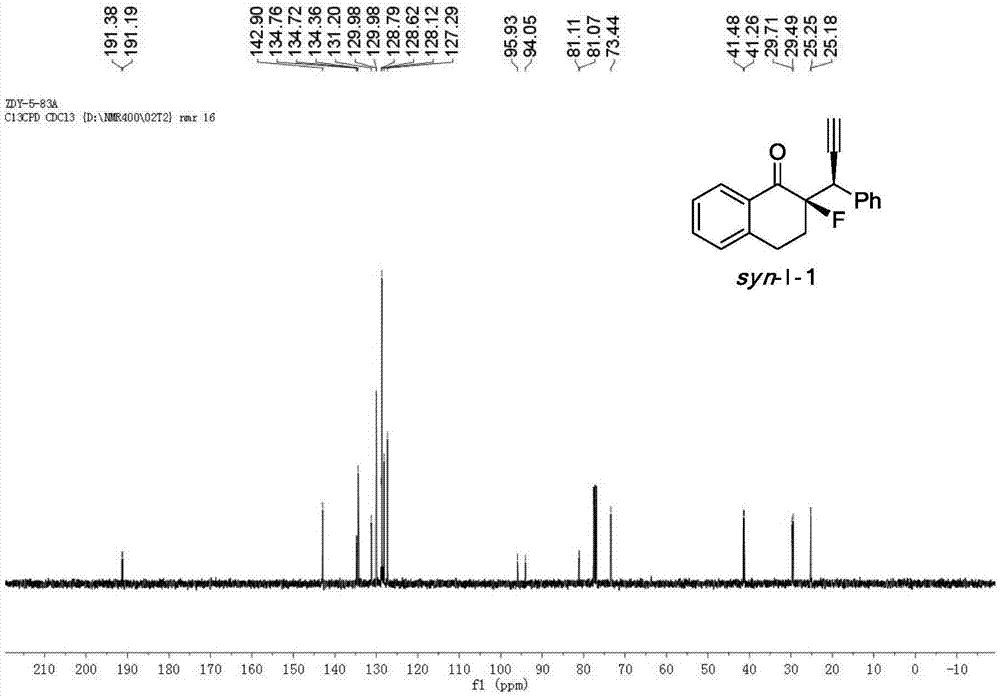
图1化合物syn-I-1的核磁共振氢谱
图2化合物syn-I-1的核磁共振碳谱;
图3化合物syn-I-1的核磁共振氟谱;
图4化合物syn-Ⅰ-2的核磁共振氢谱
图5化合物syn-Ⅰ-2的核磁共振碳谱;
图6化合物syn-Ⅰ-2的核磁共振氟谱。
具体实施方式
下面的实施例将对本发明予以进一步的说明,但并不因此而限制本发明。核磁共振是通过Bruker核磁共振仪测定,高效液相色谱(HPLC)是通过Agilent 1100系列高效液相色谱测定。
实施例1
Cu(CH3CN)4BF4和L-1-1络合作为催化剂催化反应,生成手性α-氟-β-乙炔基酮产物I-1。
在反应瓶中加入金属前体Cu(CH3CN)4BF4(0.015mmol,5mol%)及手性配体L-1-1(0.0165mmol,5.5mol%),氮气保护下加入1.0毫升无水甲醇,室温搅拌1小时。将氟化烯醇硅醚II-1(0.30mmol,1.0equiv),炔丙醇酯Ⅲ-1(0.75mmol,2.5equiv)和N,N-二异丙基乙胺(0.75mmol,2.5equiv)溶于2.0毫升无水甲醇,然后将该溶液在氮气保护下加入到上述搅拌好的催化剂溶液中,-20℃搅拌反应12h。反应完毕,减压旋蒸,残留物冲硅胶短柱,旋蒸后残留物送核磁确定dr值,然后将核磁粗样柱分离,得到化合物I-1。白色固体,88%收率,93/7dr(syn/anti),99%ee(syn),>99%ee(anti).
化合物syn-I-1的核磁共振氢谱,核磁共振碳谱和核磁共振氟谱分别如图1、图2、图3所示:
1H NMR(400MHz,CDCl3,syn-I-1):δ8.03(d,J=7.7Hz,1H),7.50–7.45(m,3H),7.32–7.18(m,5H),4.65(dd,J=16.0,2.5Hz,1H),3.16–3.08(m,1H),2.96–2.89(m,1H),2.61–2.52(m,1H),2.37(d,J=2.3Hz,1H),2.09–2.00(m,1H).13C NMR(100MHz,CDCl3,syn-I-1):δ191.3(d,J=18.8Hz),142.9,134.7(d,J= 4.2Hz),134.4,131.2,130.0,130.0,128.8,128.6,128.1,127.3,95.0(d,J=189.3Hz),81.1(d,J=4.0Hz),73.4,41.4(d,J=22.4Hz),29.6(d,J=21.9Hz),25.2(d,J=7.7Hz.19F NMR(376MHz,CDCl3,syn-I-1):δ-158.0(m,1F).HPLC(Chiralcel OJ-H,n-hexane/i-PrOH=85/15,0.8ml/min,254nm,40℃):tR(syn,major)=18.2min,tR(syn,minor)=20.3min,tR(anti,major)=28.2min,tR(anti,minor)=32.6min。
II-1,III-1,Ⅰ-1,L-1-1的结构式如下:
实施例2
L-2-1作为配体反应生成手性α-氟-β-乙炔基酮产物I-1
将实施例1中的配体L-1-1用配体L-2-1代替,其余同实施例1。反应得到化合物I-1,70%收率,75/25dr(syn/anti),98%ee(syn),99%ee(anti).
L-2-1的结构式如下:
实施例3
L-2-2作为配体反应生成产物α-氟-β-乙炔基酮产物I-1
将实施例2中的配体L-2-1用配体L-2-2代替,其余同实施例1。反应得到化合物Ⅰ-1,60%收率,67/33dr(syn/anti),88%ee(syn),94%ee(anti).
L-2-2的结构式如下:
实施例4
Cu(OAc)2·H2O和L-1-1络合作为催化剂催化反应生成产物α-氟-β-乙炔基酮产物Ⅰ-1
将实施例1中Cu(CH3CN)4BF4用Cu(OAc)2·H2O代替。其余同实施例1,得到化合物Ⅰ-1,82%收率,92/8dr(syn/anti),98%ee(syn),99%ee(anti).
实施例5
没有碱添加剂反应生成产物Ⅰ-1
将实施例1中的N,N-二异丙基乙基胺去掉,其余同实施例1,得到化合物Ⅰ-1,8%收率,87/13dr(syn/anti),58%ee(syn),63%ee(anti).
实施例6
三乙胺作为碱添加剂反应生成产物Ⅰ-1
将实施例1中的N,N-二异丙基乙基胺替换为三乙胺。其余同实施例1,得到化合物Ⅰ-1,70%收率,86/14dr(syn/anti),98%ee(syn),98%ee(anti)。
实施例7
III-2作为底物反应生成产物Ⅰ-2
将实施例1中的炔丙醇酯III-1替换为III-2,其余同实施例1,得到产物Ⅰ-2,90%收率,91/9dr(syn/anti),99%ee(syn),>99%ee(anti)。
化合物syn-Ⅰ-2的核磁共振氢谱,核磁共振碳谱和核磁共振氟谱为分别如图4、图5、图6所示:
1H NMR(400MHz,CDCl3,syn-I-2):δ8.03(d,J=7.8Hz,1H),7.49(t,J=7.5Hz,1H),7.44(d,J=8.4Hz,2H),7.32(t,J=7.4Hz,1H),7.27(d,J=8.5Hz,2H),7.21(d,J=7.7Hz,1H),4.68(dd,J=14.3,2.4Hz,1H),3.21–3.13(m,1H),2.95–2.88(m,1H),2.65–2.56(m,1H),2.39(d,J=2.4Hz,1H),2.12–1.98(m,1H).13C NMR(100MHz,CDCl3,syn-I-2):δ190.9(d,J=18.9Hz),143.0,134.5,134.1,133.4(d,J=4.7Hz),131.4(d,J=1.0Hz),131.1,128.8,128.8,128.7,94.7(d,J=188.7Hz),80.7(d,J=3.5Hz),73.8,40.9(d,J=22.9Hz),29.5(d,J=22.0Hz),25.1(d,J=7.3Hz).19F NMR(376MHz,CDCl3,syn-I-2):δ-158.0(s,1F).HPLC(Chiralcel OJ-H,n-hexane/i-PrOH=85/15,0.8mL/min,254nm,40℃):tR(syn,major)=17.5min,tR(syn,minor)=19.6min,tR(anti,major)=27.1min,tR(anti,minor)=31.2min。
III-2,Ⅰ-2的结构式如下:
实施例8-28
反应底物适用性
本发明具有广泛的底物适用性,按照实施例1中的反应条件,许多底物都能参与该反应,高收率、高非对映选择性和高对映选择性的获得含有两个手性中心的α-氟-β-乙炔基酮产物,其反应式为:
实施例里8~28中,当R1,R2,’R3被替换,其产率,非对映体过量和对映体过量值如表1所示:
表1
本发明可以方便地合成带有各种取代基团含有两个手性中心的α-氟-β-乙炔基酮化合物,对映体过量百分数更是高达大于99%。本发明具有原料易得,操作简单,反应条件温和,非对映选择性和对映选择性高等特点。
- 还没有人留言评论。精彩留言会获得点赞!