编码人无调同源物‑1(HATH1)的腺病毒载体的制作方法
本发明要求2014年10月9日提交的美国临时专利申请号62/061,748的权益,所述文献通过引用的方式并入作为参考。
通过参考并入的电子方式递交的材料
通过引用方式完整并入本文的是与之同时提交并标识如下的计算机可读取核苷酸/氨基酸序列表:一份2015年9月25日创建的名为“721767_ST25.TXT”的49,240比特ASCII(文本)文件。
发明背景
世界大部分人群或许在其一生中将经历某种听力下降或平衡障碍。大约17%(三千六百万)美国成人报告了某种程度的听力损失,并且在美国每1,000名儿童约2-3名出生就耳聋或听力不佳(来自美国国家耳聋和其他交流障碍研究院(NIDCD)的统计结果)。
在听到和平衡时,机械刺激由感觉毛细胞转换成神经信号,损伤所述感觉毛细胞是许多类型听力损失和平衡障碍的原因。例如高噪声所致的机械损伤使耳蜗毛细胞弯折到毛细胞不能再转导信号至听神经的程度。由于哺乳动物毛细胞天然不再生,如果毛细胞受损,则能出现永久性听力损失。除了作为听力受损主要原因的声学创伤以外,听力损失还可以由遗传综合征、细菌或病毒性感染、使用处方药和老年性耳聋(与老龄相关的听力损失)引起。同样地,平衡障碍,特别地前庭障碍,可以由感染、头部损伤、使用药物和年龄引起。
听力损失的最常见治疗包括助听器和耳蜗植入物。全球大约188,000人已经接受耳蜗植入物,这包括在美国的大约41,599名成人和25,500名儿童(NIDCD统计结果)。平衡障碍的治疗选项包括平衡再训练、抗眩晕或抗恶心药物和前庭康复治疗。然而如果这种障碍为渐进性,则或许将在延长的时间段范围内需要这类疗法,并且平衡障碍的许多疗法不提供永久缓解头晕。目前,不存在针对涉及耳内感觉毛细胞损失或损伤的病症的有效药物治疗。
因此,仍需要可以改善与感觉毛细胞破坏或损失相关的病症如听力损失和平衡障碍的药剂。本发明提供这种药剂。
发明简述
本发明提供一种腺病毒载体,所述腺病毒载体包含血清型5腺病毒基因组,但是在所述血清型5腺病毒基因组中VA RNA I区两个碱基对缺失,E1区的一个或多个内源核苷酸缺失以造成E1区中的内源性基因功能上缺损,E3区的一个或多个内源核苷酸缺失,并且E4区的一个或多个内源核苷酸缺失以造成E4区中的内源性基因功能上缺损,其中右侧反向末端重复序列(ITR)、E4区聚腺苷酸化序列和E4区启动子保留,(b)SV40早期聚腺苷酸化序列,(c)编码包含SEQ ID NO:1的人无调同源物-1(human atonal homolog-1;Hath1)蛋白的核酸序列,(d)人胶质原纤维酸性蛋白(GFAP)启动子,和(e)转录惰性间隔子(TIS)。元件(b)、(c)和(d)在腺病毒基因组的E1区中相对于腺病毒基因组按3’至5’的顺序存在,并且其中元件(e)位于病毒基因组的E4区中,在E4聚腺苷酸化序列和E4启动子之间。
本发明还提供利用前述腺病毒载体在人内耳中产生感觉细胞的组合物和方法。
附图简述
图1是质粒pAdE1(GFAP.Hath1)E3(10)E4(TIS1)的示意图。
图2是腺病毒载体AdGFAP.HATH1.11D的示意图。
发明详述
本发明至少部分地基于以下发现:通过向内耳递送血清型5腺病毒载体能产生感觉毛细胞,所述载体包含编码人无调同源物-1(Hath1)蛋白的核酸序列。
如本文所用,术语“腺病毒载体”,指一种腺病毒,其中腺病毒基因组已经过操作以容纳相对于腺病毒基因组而言非天然的核酸序列。一般地,通过以下方式产生腺病毒载体:向腺病毒的腺病毒基因组中引入一个或多个突变(例如,缺失、插入或置换),从而容纳非天然核酸序列插入腺病毒中。
腺病毒载体的病毒基因组来源是人血清型5腺病毒。人腺病毒分为亚组A(例如,血清型12、18和31)、亚组B(例如,血清型3、7、11、14、16、21、34、35和50)、亚组C(例如,血清型1、2、5和6)、亚组D(例如,血清型8、9、10、13、15、17、19、20、22-30、32、33、36-39和42-48)、亚组E(例如,血清型4)、亚组F(例如,血清型40和41)或未分类的血清组(例如,血清型49和51)。腺病毒血清型1至51(即,Ad1至Ad51)从美国典型培养物保藏中心(ATCC,马纳萨斯,弗吉尼亚)可获得。
本发明的腺病毒载体是复制缺陷的。因而,例如,因一个或多个复制必需基因功能或区域的缺陷,复制缺陷型腺病毒载体需要互补复制所需要的一个或多个腺病毒基因组基因功能或区域,从而腺病毒载体在常见宿主细胞、尤其人类中待被腺病毒载体感染的那些细胞中不复制。
如本文所用,基因功能或基因组区域的缺陷定义为破坏(例如,缺失)足够的腺病毒基因组遗传物质以消除或损害基因的功能,其中所述基因被完整或部分地破坏(例如,缺失)了其核酸序列(例如,从而基因产物的功能降低至少约2倍、5倍、10倍、20倍、30倍、或50倍),因而造成基因或基因组区“功能上缺损”。对于破坏复制必需基因功能而言,通常不需要完整基因区域的缺失。然而,出于在腺病毒基因组中为一个或多个转基因提供足够空间的目的,可能需要移除一个或多个基因区域的大部分。在这个方面,腺病毒载体合乎需要地包含缺失了一个或多个复制必需基因或基因组区的一个或多个内源核苷酸以使得内源性基因或基因组区功能上缺损的腺病毒基因组。尽管优选遗传物质的缺失,但遗传物质的突变也适用于破坏基因功能。复制必需基因功能是腺病毒复制(例如,增殖)所要求并且例如由腺病毒早期区域(例如,E1、E2和E4区)、晚期区域(例如,L1、L2、L3、L4和L5区域)、参与病毒包装的基因(例如,IVa2基因)和病毒相关的RNA(例如,VA-RNA-1和/或VA-RNA-2)编码的那些基因功能。
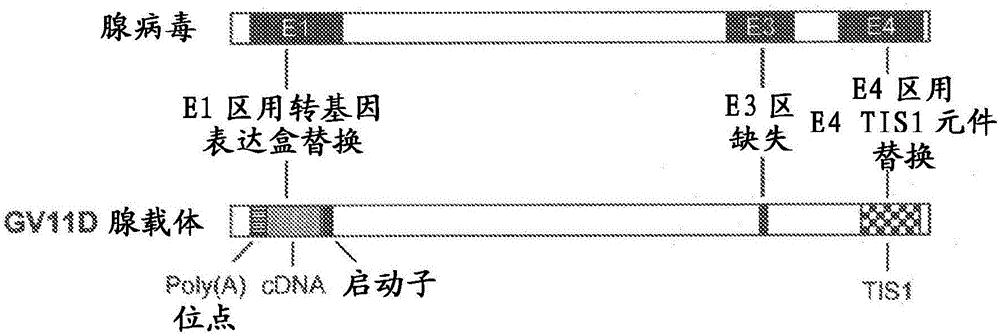
复制缺陷型腺病毒载体优选地保留腺病毒基因组的至少一部分。腺病毒载体可以包含腺病毒基因组的任何部分,包括蛋白质编码区和非蛋白质编码区。腺病毒载体可以包含这样的核酸序列,其编码任何合适的腺病毒蛋白,例如,由任一个早期区域基因(即,E1A、E1B、E2A、E2B、E3和/或E4区)编码的蛋白质,或由编码病毒结构蛋白的任一个晚期区域基因(即,L1、L2、L3、L4和L5区)编码的蛋白质。备选地,腺病毒载体可以包含腺病毒基因组的非蛋白质编码区,例如包括一个或多个启动子、转录终止序列,或早期区域基因或晚期区域基因的聚腺苷酸化序列,或一个或多个反向末端重复序列(ITR)序列。在一个实施方案中,本发明的腺病毒载体保留至少右侧反向末端重复序列(ITR)、E4区聚腺苷酸化序列和E4区启动子。
复制缺陷型腺病毒载体可以按任何适合的方式修饰,以在一个或多个用于增殖的腺病毒基因组区域中造成一个或多个复制必需基因功能的缺陷。互补一个或多个腺病毒基因组区域中一个或多个复制必需基因功能缺陷指使用外源手段以提供功能上缺损的复制必需基因功能。这类互补可以按任何适合方式(例如,通过使用编码受破坏的复制必需基因功能的互补细胞和/或外源DNA(例如,辅助腺病毒))实现。
腺病毒载体可以在腺病毒基因组的仅早期区域(即,E1-E4区)、仅腺病毒基因组的仅晚期区域(即,L1-L5区)、腺病毒基因组的早期和晚期区域或全部腺病毒基因(即,高容量腺载体(HC-Ad))的一个或多个复制必需基因功能方面缺陷。参见Morsy等人,Proc.Natl.Acad.Sci.USA,95:965-976(1998);Chen等人,Proc.Natl.Acad.Sci.USA,94:1645-1650(1997);和Kochanek等人,Hum.Gene Ther.,10:2451-2459(1999)。复制缺陷型腺病毒载体的例子在美国专利5,837,511;5,851,806;5,994,106;6,127,175;6,482,616和7,195,896及国际专利申请公开WO 1994/028152、WO 1995/002697、WO 1995/016772、WO 1995/034671、WO 1996/022378、WO 1997/012986、WO 1997/021826和WO 2003/022311中公开。
腺病毒基因组早期区域包括E1区、E2区、E3区和E4区。E1区包含E1A和E1B亚区域,并且E1区中的一个或多个复制必需基因功能缺陷可以包括在E1A和E1B亚区域的任一区域中或两个区域中的一个或多个复制必需基因功能缺陷,因而需要互补腺病毒基因组的E1A亚区域和/或E1B亚区域来用于腺病毒载体增殖(例如,以形成腺病毒载体粒子)。E2区包含E2A和E2B亚区域,并且E2区中的一个或多个复制必需基因功能缺陷可以包括在E2A和E2B亚区域的任一区域中或两个区域中的一个或多个复制必需基因功能缺陷,因而需要互补腺病毒基因组的E2A亚区域和/或E2B亚区域来用于腺病毒载体增殖(例如,以形成腺病毒载体粒子)。
E3区不包括任何复制必需基因功能,从而E3区的部分或完整缺失不需要互补E3区中的任何基因功能来用于腺病毒载体增殖(例如,以形成腺病毒载体粒子)。在本发明背景下,E3区定义为这样的区域,该区域始于编码与来自人腺病毒5的E3区的12.5K蛋白(NCBI参考序列AP_000218)高度同源的蛋白质的可读框并且止于编码与来自人腺病毒5的E3区的14.7K蛋白(NCBI:参考序列AP_000224.1)高度同源的蛋白质的可读框。E3区可以完整或部分地缺失;或完整或部分地保留。可以调整缺失的尺寸,从而保留其基因组非常匹配最佳基因组包装尺寸的腺病毒载体。较大的缺失将容纳较大的异源核酸序列插入腺病毒基因组中。在本发明的一个实施方案中,保留E3区中原有的L4聚腺苷酸化信号序列。
E4区包含编码多个内源基因的多个可读框(ORF)。除了ORF6和在一些情况下ORF3外的E4区全部可读框缺失的腺病毒载体不需要互补E4区中的任何基因功能来用于腺病毒载体增殖(例如,以形成腺病毒载体粒子)。相反地,具有或没有E4区任何其他可读框或天然E4启动子、聚腺苷酸化序列和/或右侧反向末端重复序列(ITR)破坏或缺失的情况下,破坏或缺失E4区ORF6和在一些情况下ORF3(例如,基于E4区ORF6和/或ORF3的复制必需基因功能缺损)的腺病毒载体需要互补E4区(特别地,E4区的ORF6和/或ORF3)来用于腺病毒载体增殖(例如,以形成腺病毒载体粒子)。
腺病毒基因组晚期区域包括L1区、L2区、L3区、L4区和L5区。腺病毒载体还可以在主要晚期启动子(MLP)中具有突变,如国际专利申请公开WO 2000/000628中讨论,如果需要,所述突变可以使得腺病毒载体复制缺陷。
优选地,腺病毒基因组中含有一个或多个复制必需基因功能缺陷的一个或多个区域合乎需要地是一个或多个腺病毒基因组早期区域,即,E1区、E2区和/或E4区,任选地缺失部分或完整的E3区。
在一个实施方案中,在本发明的腺病毒载体中缺失E1区和E4区的一个或多个内源核苷酸,以使E1区中的内源性基因功能上缺损和E4区中的内源性基因功能上缺损(代表E1/E4缺陷型腺病毒载体)。本发明的腺病毒载体可以包含腺病毒基因组E1区的至少一个复制必需基因功能的缺失并且优选地包含E1区全部复制必需基因功能的缺失。在这个方面,本发明腺病毒载体E1区的缺失可以包含E1A和E1B内源基因的启动子和编码区的缺失。E4区的缺失合乎需要地包含E4区的至少一个复制必需基因功能的缺失,并且优选地包含E4区全部复制必需基因功能的缺失。在这个方面,本发明腺病毒载体E4区的缺失可以包含E4区全部内源基因的缺失。可以在本发明的腺病毒载体中除缺失腺病毒基因组E1区和E4区之外,还缺失E3区的一个或多个内源核苷酸,并且优选地,本发明的腺病毒载体包含腺病毒基因组非必需E3区的至少一个基因功能的缺失(代表E1/E3/E4缺陷型腺病毒载体)。除缺失血清型5腺病毒基因组的E1区、E3和E4区之外,本发明的腺病毒载体还合乎需要地包含在病毒相关的RNA(例如,VA-RNA-1和/或VA-RNA-2)之一中的缺失。优选地,本发明的腺病毒载体包含在VA-RNA-I区中的缺失。VA-RNA-I区的缺失可以是任何合适的尺寸,但是合乎需要地是1至10个碱基对、优选地1至5个碱基对并且最优选地1至3个碱基对,或由任何前述两个值限定的范围。在一个实施方案中,腺病毒载体的VA RNA I区中两个碱基对缺失。
在一个优选的实施方案中,本发明血清型5腺病毒载体的基因组包含E1区核苷酸356-3510(包括所述值范围之内)的缺失、E3区核苷酸28,593-30,471(包括所述值范围之内)的缺失、E4区核苷酸32,827-35,563(包括所述值范围之内)的缺失和VA-RNA-1区域核苷酸10594和10595的缺失。然而,其他缺失可以是适宜的。例如,可以移除核苷酸356-3329或356-3510以产生复制必需E1基因功能的缺损,并且可以从腺病毒基因组E3区缺失核苷酸28,594-30,469。
本发明的腺病毒载体包含转录惰性间隔子(TIS)。转录惰性间隔子序列提供多重复制缺陷型腺病毒载体(例如,E1/E4缺陷型腺病毒载体)在互补细胞系中的生长,所述生长类似于通过单一复制必需基因功能缺陷的腺病毒载体(例如,E1缺陷型腺病毒载体)实现的生长。TIS序列可以含有任何核苷酸序列或具有所需长度的序列,所需长度例如是至少约15个核苷酸(例如,约15个核苷酸和约12,000个核苷酸之间)、优选地约100个核苷酸至约10,000个核苷酸、更优选地约500个核苷酸至约8,000个核苷酸、甚至更优选地约1,500个核苷酸至约6,000个核苷酸并且最优选地约2,000个至约3,000个核苷酸长度或由任何前述两个值限定的范围。TIS序列可以是编码的或非编码的并且相对于腺病毒基因组是天然或非天然的,但是不向缺陷区域恢复复制必需功能。TIS还可以含有表达盒。
在一个实施方案中,转录惰性间隔子包含相对于腺病毒载体为非天然的聚腺苷酸化序列和/或基因。间隔区元件可以包含任何合适的聚腺苷酸化序列,如,例如,牛生长激素(BGH)、多瘤病毒、胸苷激酶(TK)、EB病毒(EBV)、人乳头瘤病毒(HPV)和牛乳头瘤病毒(BPV)的聚腺苷酸化序列。优选地,TIS序列包含猿猴病毒40(SV40)聚腺苷酸化序列。纳入TIS中的合适非天然基因的例子包括但不限于,编码标记蛋白如pGUS、分泌型碱性磷酸酶、萤光素酶、β-半乳糖苷酶和人抗胰蛋白酶的核酸序列;治疗性因子;潜在免疫调节物如B3-19K、E3-14.7、ICP47、fas配体和CTLA4;无生物活性的序列(例如,(i)不转录以产生产物或(ii)编码缺陷性或无生物活性产物的序列);和其他无害序列(例如,β-葡糖醛酸糖苷酶基因)。
优选地,TIS相对于腺病毒基因组按5’至3’依次包含(i)聚腺苷酸化(poly(A))序列和来自猿猴病毒40(SV40)的转录终止序列,(ii)编码β-葡糖醛酸糖苷酶基因的核酸序列,和(iii)聚腺苷酸化(poly(A))序列和来自牛生长激素(BGH)基因的转录终止序列。在例如美国专利5,851,806和国际专利申请公开WO 1997/021826中进一步描述了在腺病毒载体中使用转录惰性间隔子。
通过移除全部或部分腺病毒基因组,例如,腺病毒基因组E1区、E3区和E4区的一个或多个内源核苷酸,所产生的腺病毒载体能够接受插入外源核酸序列,同时保留包装入腺病毒衣壳的能力。可以在腺病毒基因组中的任何位置插入外源核酸序列,只要在该位置的插入允许腺病毒载体粒子的形成即可。外源核酸序列优选地定位于腺病毒基因组的E1区、E3区或E4区中。
可以在互补细胞系中以旨在产生高滴度病毒载体原液的适宜水平产生本发明的复制缺陷型腺病毒载体,所述互补细胞系提供复制缺陷型腺病毒载体中不存在、但是为病毒增殖所需要的基因功能。这类互补细胞系是已知的并且包括但不限于293细胞(在例如,Graham等人,J.Gen.Virol.,36:59-72(1977)中描述)、PER.C6细胞(在例如国际专利申请公开WO 1997/000326和美国专利5,994,128和6,033,908中描述)和293-ORF6细胞(在例如国际专利申请公开WO 95/34671和Brough等人,J.Virol.,71:9206-9213(1997)中描述)。其他合适的互补细胞系包括已经生成以增殖腺病毒载体的细胞,所述腺病毒载体编码转基因,所述转基因的表达抑制宿主细胞中的病毒生长(参见,例如,美国专利申请公开号2008/0233650)。额外的合适互补细胞在例如美国专利6,677,156和6,682,929及国际专利申请公开WO 2003/020879中描述。在一些情况下,细胞基因组不需要包含其基因产物互补复制缺陷型腺病毒载体全部缺陷的核酸序列。复制缺陷型腺病毒载体中缺少的一个或多个复制必需基因功能可以由辅助病毒供应,例如,反式供应复制缺陷型腺病毒载体复制所需要的一个或多个必需基因功能的腺病毒载体。备选地,本发明的腺病毒载体可以包含互补本发明复制缺陷型腺病毒载体中缺少的一个或多个复制必需基因功能的非天然复制必需基因。例如,可以将E1/E4缺陷型腺病毒载体工程化以含有编码E4ORF6的核酸序列,所述核酸序列从不同的腺病毒(例如,血清型与本发明腺病毒载体不同的腺病毒或物种与本发明腺病毒载体不同的腺病毒)获得或衍生。
本发明的腺病毒载体包含编码人无调同源物-1(Hath1)蛋白的核酸序列。Hath1是无调相关因子。无调相关因子是将支持细胞转分化成耳内感觉毛细胞的碱性螺旋-环-螺旋(bHLH)蛋白家族的转录因子。该蛋白质的碱性结构域负责DNA结合和蛋白质功能。无调相关因子存在于多种动物和昆虫中,包括小鼠(小鼠无调同源物-1(Math1))、鸡(鸡无调同源物-1(Cath1))、非洲爪蟾(Xenopus)(非洲爪蟾无调同源物-1(Xath1))和人(人无调同源物-1(Hath1))。已经显示无调相关蛋白如Math1和Hath1是毛细胞发育必需的并且可以刺激耳内毛细胞再生(参见,例如Grove等人,Annu.Rev.Neurosci.,36:361-381(2013))。Hath1进一步在例如Ben-Arie等人,Human Molecular Genetics,5,1207-1216(1996);和Mulvaney,J.和Dabdoub,A,J.Assoc.Res.Otolaryngol.,13(3):281-289(2012)中表征,并且在国际专利申请WO 00/73764中一般性地描述了无调相关因子。
Hath1核酸序列和氨基酸序列分别作为例如Genbank登录号U61148(GI号1575354)和AAB41305.1(GI号1575355)可公开获得。优选地,本发明的腺病毒载体包含编码Hath1蛋白的包含SEQ ID NO:1的核酸序列。
尽管编码Hath1蛋白的核酸序列包含SEQ ID NO:1,但是该核酸序列的许多修饰和变异(例如,突变)是可能的并且在本发明背景下适宜。认为无调相关因子的功能是依赖于蛋白质的螺旋-环-螺旋(HLH)部分,尤其HLH结构域的碱性区域(Chien等人,Proc.Natl.Acad.Sci.,93,13239-13244(1996))。因此,对编码Hath1蛋白的核酸序列的任何修饰合乎需要地位于该蛋白质的碱性结构域外部,从而保留或增强Hath1蛋白的功能。
除编码Hath1蛋白的核酸序列之外,本发明的腺病毒载体优选地还包含提供核酸序列在宿主细胞中表达的表达控制序列,如启动子、增强子、聚腺苷酸化信号、转录终止子、内部核糖体进入位点(IRES)等。示例性表达控制序列是本领域已知的并且在例如Goeddel,Gene Expression Technology:Methods in Enzymology,第185卷,Academic Press,San Diego,California(1990)描述。理想地,编码Hath1的核酸序列与启动子和聚腺苷酸化序列有效连接。启动子合乎需要地是组织特异性启动子,即,启动子在给定的组织中优先激活并且导致在启动子激活的组织中表达基因产物。可以基于待表达的编码Hath1的核酸序列的靶组织或细胞类型来选择用于本发明腺病毒载体中的组织特异性启动子。用于本发明腺病毒载体中的优选组织特异性启动子对支持细胞或感觉毛细胞是特异的。毛细胞中特异性激活的组织特异性启动子例如包括无调启动子或肌球蛋白VIIa启动子。支持细胞中特异性激活的组织特异性启动子例如包括hes-1启动子和人胶质原纤维酸性蛋白(GFAP)启动子。在一个优选的实施方案中,启动子是包含SEQ ID NO:2的人GFAP启动子。人GFAP蛋白是主要在中枢神经系统的星形细胞、不形成髓鞘质的施旺细胞和选择的其他细胞类型中表达的可溶性结构蛋白。在内耳解剖学中,GFAP表达主要限于感觉器官的支持细胞(即,柯替器官的代特斯细胞和指细胞、位于壶腹管(canal ampullae)内部的那些细胞和椭圆斑/球囊斑中Extrastriolar区域的支持细胞)。
可以在本发明中使用的组织特异性启动子的其他例子包括BRN.3C启动子、BRN3.1启动子、POU ORF3因子启动子、BRK1启动子、BRK3启动子、脊索发生素启动子、头蛋白(noggin)启动子、jagged1启动子、jagged2启动子、和刻缺蛋白1启动子。
为了优化蛋白质产生,编码Hath1的核酸序列还在Hath1编码序列下游包含聚腺苷酸化序列。可以使用任何合适的聚腺苷酸化序列,包括合成性优化序列,以及牛生长激素(BGH)、多瘤病毒、胸苷激酶(TK)、EB病毒(EBV)、人乳头瘤病毒(HPV)和牛乳头瘤病毒(BPV)的聚腺苷酸化序列。聚腺苷酸化序列优选地是猿猴病毒-40(SV40)早期聚腺苷酸化序列,其为SV40早期RNA产物的聚腺苷酸化序列(参见,例如Carswell,S.和Alwine,J.C.,Mol.Cell.Biol.,9(10):4248-4258(1989))。除启动子和聚腺苷酸化序列之外,编码Hath1的核酸序列还合乎需要地包含恰当布置的全部适宜转录信号(和根据需要,翻译信号),从而核酸序列在引入它的细胞中恰当地表达。如果需要,核酸序列还可以并入剪接位点(即,剪接接纳体和剪接供体位点)以促进mRNA产生。
组织特异性启动子、编码Hath1蛋白的核酸序列和SV40早期聚腺苷酸化序列可以按任何合适的取向安置在本发明的腺病毒载体内部,只要不妨碍腺病毒载体的产生并且编码Hath1的核酸序列在宿主细胞中高效表达。通常而言,启动子将位于编码Hath1的核酸序列的上游,并且SV40早期聚腺苷酸化序列将位于编码Hath1的核酸序列的下游。在一个实施方案中,腺病毒载体可以按5’至3’的顺序相对于腺病毒基因组包含前述元件:组织特异性启动子(例如,人GFAP启动子)、编码Hath1蛋白的核酸序列和SV40早期聚腺苷酸化序列。备选地,腺病毒载体可以按5’至3’的顺序相对于腺病毒基因组包含前述元件:SV40早期聚腺苷酸化序列、编码Hath1蛋白的核酸序列和组织特异性启动子(例如,人GFAP启动子)。编码Hath1蛋白的核酸序列以及与之有效连接的组织特异性启动子和SV40早期聚腺苷酸化序列可以插入腺病毒基因组中的任何位置,只要在该位置的插入允许腺病毒载体粒子的形成。优选地,编码Hath1的核酸序列位于腺病毒基因组的E1区或E4区中。在一个优选的实施方案中,将腺病毒基因组的E1区相对于腺病毒基因组按3’至5’的顺序,替换为SV40早期聚腺苷酸化序列、编码Hath1蛋白的核酸序列和人GFAP启动子。
本发明的腺病毒载体可以包含例如SEQ ID NO:3的核酸序列。
本发明提供一种组合物,其包含本文所述的腺病毒载体及其运载体(carrier)(例如,可药用运载体)。组合物合乎需要地是生理可接受(例如,可药用)的组合物,所述组合物包含运载体、优选地生理可接受(例如,可药用)运载体和腺病毒载体。可以在本发明背景范围内使用任何合适的运载体,并且这类运载体是本领域熟知的。运载体的选择将部分地由组合物的具体用途(例如,施用至动物)和用来施用组合物的具体方法决定。理想地,在复制缺陷型腺病毒载体的背景下,药物组合物优选地是不含能够复制的腺病毒。药物组合物任选地可以是无菌的。
合适的组合物包括水质和非水等渗无菌溶液,所述溶液可以含有抗氧化剂、缓冲剂和抑菌剂,并且水质和非水无菌悬液可以包含助悬剂、增溶剂、增稠剂、稳定剂和防腐剂。组合物可以在单位剂量或多剂量密封容器例如安瓿和小瓶中提供,并且可以在冷冻干燥(冻干)的条件下储存,仅需要在临用前才添加无菌液态载体,例如,水。现场用溶液剂和混悬剂可以从无菌散剂、颗粒剂和片剂配制。优选地,运载体是缓冲盐水溶液。更优选地,腺病毒载体是组合物的组成部分。其中所述组合物在施用前配制以保护腺病毒载体免受损伤。例如,可以配制组合物以减少腺病毒载体在用来配制、储存或施用腺病毒载体的装置(如玻璃器具、注射器或针)上的损失。可以配制组合物以降低腺病毒载体的光敏感性和/或温度敏感性。为此目的,组合物优选地包含可药用液态运载体,例如,上文描述的那些,和选自聚山梨醇酯-80、L-精氨酸、聚乙烯吡咯烷酮、海藻糖及其组合的稳定剂。这种组合物的使用将延长腺病毒载体的货架期并利于其施用。含有腺病毒载体的组合物的制剂进一步在例如美国专利6,225,289、美国专利6,514,943和国际专利申请公开WO 2000/034444中描述。
还可以配制组合物以增强转导效率。此外,本领域普通技术人员将理解腺病毒载体可以在含其他治疗剂或生物活性剂的组合物中存在。例如,控制炎症的因子如布洛芬(ibuprofen)或类固醇可以是组合物的组成部分以减少与体内施用腺病毒载体相关的肿胀和炎症。抗生素,即,杀微生物剂和杀真菌剂,可以存在以治疗现有感染和/或降低未来感染(如与基因转移操作相关的感染)的风险。
本发明也提供一种在有需求的人的内耳中产生感觉细胞的方法。该方法包括施用一种组合物,其包含本文所述的本发明腺病毒载体,因此编码Hath1蛋白的核酸序列表达并且感觉细胞在内耳中生成。如本文所用,术语“治疗”、“正在治疗”等指获得所需的药理和/或生理效果。优选地,这种效果是治疗性的,即,该效果部分地或完全治愈疾病和/或归因于疾病的不良症状。为此目的,本发明方法包括向人施用“治疗有效量”的组合物。“治疗有效量”指以需要的剂量并持续需要的时间段,有效实现所需治疗结果的量。治疗有效量可以根据多种因素如疾病状态、个体的年龄、性别和重量和本发明腺病毒载体在个体中激发所需反应的能力而变动。例如,本发明组合物的治疗有效量是导致Hath1蛋白以治疗人类中听力损失或平衡障碍的水平表达的量。
备选地,药理和/或生理效果可以是预防性的,即,该效果完全或部分地阻止疾病或其症状。在这个方面,本发明方法包括施用“预防有效量”的包含本发明腺病毒载体的组合物。预防有效量指以需要的剂量并持续需要的时间段,有效实现所需预防结果(例如,阻止疾病发作)的量。可以通过定期评估治疗的患者,监测治疗性或预防性功效。
可以通过本领域普通技术人员已知的常规范围确定技术,确定合适剂量和剂量方案。合乎需要地,单剂腺病毒载体包含约1x105个或更多个粒子(也称作粒子单位(pu))的腺病毒载体粒子,例如,约1x106个或更多个粒子、约1x107个或更多个粒子、约1x108个或更多个粒子、约1x109个或更多个粒子或约3x108个或更多个粒子的腺病毒载体粒子。备选地或额外地,单剂腺病毒载体包含约3x1014个或更少个粒子的腺病毒载体粒子,例如,约1x1013个或更少个粒子、约1x1012个或更少个粒子、约3x1011个或更少个粒子、约1x1011个或更少个粒子、1x1010个或更少个粒子或约1x109个或更少个粒子的腺病毒载体。因此,单剂腺病毒载体可以包含处于由前述任何两个值限定的范围内的腺病毒载体粒子量。例如,单剂腺病毒载体可以包含1x105-1x1014个粒子、1x107-1x1012个粒子、1x108-1x1011个粒子、3x108-3x1011个粒子、1x109-1x1012个粒子、1x109-1x1011个粒子、1x109-1x1010个粒子或1x1010-1x1012个粒子的腺病毒载体。换而言之,单剂腺病毒载体可以包含,例如,约1x106pu、2x106pu、4x106pu、1x107pu、2x107pu、4x107pu、1x108pu、2x108pu、3x108pu、4x108pu、1x109pu、2x109pu、3x109pu、4x109pu、1x1010pu、2x1010pu、3x1010pu、4x1010pu、1x1011pu、2x1011pu、3x1011pu、4x1011pu、1x1012pu、2x1012pu、3x1012pu、或4x1012pu的腺病毒载体。当然,其他施用途径可能需要更小或更大剂量以实现治疗效果。剂量和施用途径的任何必需变异可以由普通技术人员使用本领域已知的例行技术确定。
内耳结构的内部空间有限。应当仔细监测直接施用至内耳结构中的药物组合物的体积,因为压入过多组合物将损伤感觉上皮。对于人类患者,施用的体积优选地是约1μl至约500μl(例如,约10μl至约400μl)组合物。例如,可以是施用约10μl至约200μl(例如,约15μl、20μl、30μl、40μl、50μl、60μl、70μl、80μl、90μl、100μl、125μl、150μl、175μl或前述任何两个值限定的范围)的组合物。在一个实施方案中,将内耳结构(例如,耳蜗或半规管)的整个流体内容物替换为药物组合物。在另一个实施方案中,将包含本发明方法的表达载体的药物组合物缓慢释放至内耳结构中,从而机械创伤最小化。
在本发明方法的一个实施方案中,将包含编码Hath1的腺病毒载体的组合物在给定的治疗期间向人内耳施用仅一次。换句话说,本发明方法包括向人的内耳施用单剂本发明的腺病毒载体。在其他实施方案中,可以有利的是向人的内耳施用组合物两次或更多次(即,多次)。因此,本发明提供向人的内耳施用两剂或更多剂本发明的腺病毒载体。例如,包含本发明腺病毒载体的组合物可以向相同的耳施用至少2次。当组合物向人的内耳施用多次时,每次施用可以相隔数天、数周、数月或甚至数年,这取决于人对首次和后续组合物施用的反应。例如,多次施用可以相隔约1周至约4周(例如,2周或3周),或相隔约30天至约90天(例如,约40天、约50天、约60天、约70天、约80天或前述任何两个值限定的范围)。然而,多次组合物施用(例如,3、4、5、6,或更多次施用)可以相隔任何合适的天数(例如,各剂量之间相隔2、7、10、14、21、28、35、42、49、56、63、70、77、85或更多天)、月数(例如,各剂量之间相隔1、3、6或9个月)或年数(例如,各剂量之间相隔1、2、3、4、5年或更多年),只要编码Hath1蛋白的核酸序列充分地表达并且在内耳中生成感觉细胞。
将组合物合乎需要地施用至人以治疗与内耳中感觉毛细胞损失、损伤或不存在相关的病症,如听力损失和平衡障碍。在这个方面,可以将组合物施用至患有听力损失或平衡障碍的人或者患有听力损失和平衡障碍的人。听力损失可以由柯替器官的毛细胞损伤引起,所述损伤因细菌感染或病毒感染、遗传、物理损伤、听力创伤等所致。尽管听力损失容易鉴定,但平衡障碍表现为广泛类型的容易归因于其他病痛的并发症。平衡障碍的症状包括定向障碍、头晕、眩晕、恶心、视力模糊、笨拙和频繁跌倒。通过本发明方法治疗的平衡障碍优选地包括外周前庭障碍(即,前庭器官中障碍),其涉及机械刺激因损伤或缺少感觉毛细胞而机能不良地转换成神经冲动。在实施方案中,将组合物施用至患有重度至极重度双侧的听力损失的人。
可以使用本领域已知的任何合适方法,将组合物施用至人的内耳。人的内耳由骨迷路组成,所述骨迷路是包含两个主要部分的传递系统:(a)用于听力的耳蜗和(b)用于平衡的前庭系统。将组合物合乎需要地施用至耳蜗或前庭系统,或施用至耳蜗和前庭系统。无论施用途径是什么,本发明的腺病毒载体必须抵达内耳的感觉上皮,例如,耳蜗和/或前庭系统的感觉上皮。因此,大部分直接的施用途径带来允许接近内耳内部的外科手术。借助耳蜗造口术(cochleostomy)接种允许直接施用表达载体至与听力相关的内耳区域。耳蜗造口术包括穿过耳蜗壁(例如,在镫骨动脉下方耳囊中)钻洞,如Kawamoto等人,Molecular Therapy,4(6),575-585(2001)中所述,并释放包含腺病毒载体的组合物。施用至内淋巴室特别可用于施用组合物至负责听力的内耳区域。备选地,组合物可以借助半规管造口术(canalostomy)施用至半规管。半规管造口术在前庭系统和耳蜗中提供转基因表达,而耳蜗造口术(cochleostomy)在前庭空间中未提供同样有效的转导。由于直接注射至耳蜗空间中能对毛细胞导致机械损伤,所以使用半规管造口术降低损伤耳蜗功能的风险(Kawamoto等人,上文)。施用操作还可以在流体(例如,人工外淋巴)下进行,所述流体可以包含减轻治疗或施用操作副作用的因子,如凋亡抑制剂或抗炎剂。
另一个至内耳的直接施用途是通过圆窗(round window),以注射或局部施加至圆窗。对于递送腺病毒载体至外淋巴空间,特别优选经圆窗施用。经圆窗施用表达载体后,已经在耳蜗和前庭神经元和耳蜗感觉上皮中观察到转基因表达(Staecker等人,Acta Otolaryngol,121,157-163(2001))。在另一个实施方案中,组合物可以借助迷路内(IL)输注经卵圆窗施用至内耳,以递送组合物至外淋巴空间。在某些情况下,可以适宜的是,实施多次应用和/或采用多个路径,例如,半规管造口术和耳蜗造口术,以确保支持细胞充分暴露于腺病毒载体。例如,美国专利7,387,614中描述了向内耳递送本发明组合物的特别优选的方法。
包含本发明腺病毒载体的组合物可以存在于允许控释或持续释放腺病毒载体的装置中或其上,如海绵、网状物、机械储器或泵或者机械植入物。例如,可以将浸泡在包含腺病毒载体的组合物中的生物相容海绵或明胶海绵(gelform)毗邻圆窗放置,通过所述圆窗,表达载体渗透以抵达耳蜗(如Jero等人,Hum.Gene Ther.,12:539-548(2001)中所述)。在另一个实施方案中,微型渗透泵可以用来在延长的时间段(例如,5至7天)范围提供腺病毒载体的持续释放,允许施用小体积包含腺病毒载体的组合物,这可以防止对内源感觉细胞的机械损伤。组合物还可以按例如包含明胶、硫酸软骨素、聚磷酸酯如双-2-羟乙基-对苯二酸酯(BHET)或聚乳酸-乙醇酸的持续释放制剂形式施用(参见,例如美国专利5,378,475)。
尽管不优选,但包含本发明腺病毒载体的组合物可以肠胃外、肌内、静脉内或腹腔内施用。如果肠胃外施用至患者,合乎需要地将腺病毒载体特异性靶向感觉上皮细胞,如支持细胞。例如,可以将腺病毒载体靶向瘢痕化的感觉上皮以促进外源毛细胞产生以替换受损的内源毛细胞。可以通过缺失尾丝(fiber)、五邻体或六邻体区域、将各种天然或非天然配体插入外壳蛋白部分等,修饰腺病毒载体以改变表达载体对潜在宿主细胞上受体的结合特异性或识别。本领域普通技术人员将理解,肠胃外施用可以需要大剂量或多次施用以有效递送表达载体至适宜的宿主细胞。
在一个实施方案中,本发明方法包括借助迷路内(IL)输注向人施用包含约20μL和90μL之间(以5.0x1011个粒子(vp)/mL腺病毒载体浓度的)本发明组合物的单剂。
在一个实施方案中,本发明方法包括借助迷路内(IL)输注向人以约10μL/分钟至约20μL/分钟之间的输注速率施用包含约20μL和90μL之间(以5.0x1011个粒子(vp)/mL腺病毒载体浓度的)本发明组合物的单剂。
本发明方法可以是涉及其他治疗模式的治疗方案的组成部分。例如,本发明方法可以对已经治疗过、正在接受治疗或将用一种或多种药物或手术治疗的人进行。此外,本发明方法可以与诱导内耳中支持细胞增殖的增殖剂如血管内皮生长因子(VEGF)、纤维母细胞生长因子(FGF)、表皮生长因子(EGF)、E2F和细胞周期上调剂联合使用。本发明方法还可以与植入听力装置如耳蜗植入物结合进行。
可以使用本领域已知的多种手段,确定内耳中的感觉细胞(例如,毛细胞)生成。例如,可以通过扫描电子显微术或通过检测肌球蛋白VIIa,检测感觉毛细胞,其中肌球蛋白VIIa是通过免疫化学检测到的毛细胞特异性蛋白。然而,仅存在感觉毛细胞不必然地暗示识别环境刺激的有功能系统。有功能的感觉细胞必须与神经通路有效连接,从而机械刺激转换成脑识别的神经冲动。因此,尽管检测毛细胞生成适于确定编码Hath1的核酸序列向靶组织成功表达,但是产生感觉细胞优选地导致人类受试者的感官知觉改善。在这个方面,检验受试者认知度是感官知觉变化的指标。
可以通过实施简单的听力测验,如常由听力学家实施的音调测验,评估受试者探测声音的能力的变化。在大部分哺乳动物中,对不同频率的反应指示感官知觉的变化。在人类中,理解语言也是适宜的。例如,受试者可能听到但不理解语音。感官知觉的变化由区分不同类型声学刺激(如区分语言与背景噪声)的能力和理解语音指示。语音阈值试验和区分试验可用于这类评估。
还可以使用多种技术,实现评价平衡、运动认知度和/或运动刺激反应时程的变化。可以通过比较运动刺激反应的幅度(增长)或反应起始时程(相),测量前庭功能。可以使用评价感官知觉改善的巩膜探查线圈,测试动物的前庭-眼反射(VOR)增长和相。眼震电图描记法(ENG)记录响应于刺激如例如移动或闪光的眼运动、身体重定位、半规管内部流体运动等。在这个方面也有用的是使用转椅或移动平台评价运动期间的平衡。
以下实施例进一步说明本发明,不过当然不应当解释为以任何方式限制其范围。
实施例1
这个实施例说明一种产生本发明血清型5腺病毒载体的方法。
使用例如美国专利6,475,757中描述的ADFASTTM方案,构建了包含E1区、E3区和E4区缺失并编码Hath1蛋白的血清型5腺病毒基因组的腺病毒载体。使用ADFASTTM方法,构建了编码完整血清型5腺病毒载体基因组的质粒。通过细菌中的两个依次菌落生长步骤,实现最终载体基因组的遗传单克隆的分离。当引入互补腺病毒载体生长的哺乳动物细胞时,将这个AdFASTTM质粒转换成病毒载体。随后通过连续传代进行后续扩充,以产生腺病毒载体原液。下文总结了构建表达Hath1的血清型5腺病毒载体的步骤。
质粒的构建
用限制性酶消化称为pAd3511gfa2.HATH1.sv的质粒以凝胶提取GFAP.HATH1表达盒。将包含血清型5腺病毒基因组的基础质粒线性化和纯化,其中所述血清型5腺病毒基因组具有E1区、E3区和E4区缺失和含有SV40聚腺苷酸序列和转录终止序列的转录惰性间隔子、β-葡糖醛酸糖苷酶基因以及牛生长激素基因(BGH)poly(A)和转录终止序列(称作pAdE1(BN)E3(10)E4(TIS1))。将pAdE1(BN)E3(10)E4(TIS1)质粒与GFAP.HATH1表达盒在大肠杆菌中同源重组,产生质粒pAdE1(GFAP.Hath1)E3(10)E4(TIS1)。
为了确保全长腺病毒载体质粒的克隆性,通过有限连续稀释,将一等分量的pAdE1(GFAP.Hath1)E3(10)E4(TIS1)ADFASTTM质粒DNA用来转化DH10B大肠杆菌。从稀释度最高的含有最少菌落的平板选择良好界定和分离的菌落。制备微量制备的质粒DNA并用Hind III+SpeI消化以通过RFLP分析证实质粒完整性。微量制备的相应阳性DNA用来产生另一个系列的有限稀释物,它们随后用来转化DH10B大肠杆菌。来自含有最少菌落的平板上的单菌落的液体培养物等分试样用来产生微量制备的DNA,而ApaI用来进一步证实质粒完整性。阳性克隆的剩余液体培养物用来进行LB-卡那霉素平板划线。通过HISPEEDTM质粒Maxi试剂盒(Qiagen,Venlo,The Netherlands)遵循制造商的操作方案,扩充单个细菌转化体以制备EndoFree ADFASTTM质粒DNA。通过BglI、EcoRV、HindIII、KpnI和BamHI+PacI限制性核酸内切酶消化,证实所产生的质粒制备物。图1中显示pAdE1(GFAP.Hath1)E3(10)E4(TIS1)的图。随后测定pAdE1(GFAP.Hath1)E3(10)E4(TIS1)的DNA序列。
载体转化
将18μg无内毒素pAdE1(GFAP.HATH1)E3(10)E4(TIS1)在300μL中用Pac I限制性核酸内切酶消化并通过苯酚氯仿异戊醇(PCI)纯化。简而言之,将100uL PCI添加至限制性反应,通过剧烈颠倒来混合,在微量离心机中按13,000转/分钟离心2分钟并将上层水相转移至一支新管。将DNA通过添加30μL(0.1体积)5M NaCl和800μL无水乙醇沉淀,在冰上温育10分钟,并且随后在微量离心机中按13,000转/分钟离心10分钟,并且滗析上清液。将沉淀物如上用500μL 70%乙醇洗涤,离心和滗析,并且晾干DNA沉淀物。将DNA重悬于30μL TE中并且通过260nm处吸光度来确定DNA浓度。使用POLYFECTTM试剂(Qiagen,Venlo,The Netherlands),将293-ORF6细胞用4μg Pac I消化和纯化的DNA转染,并且在37℃,5%CO2温育三天。转染裂解物(通过三次冻融循环产生)用来启动连续传代以产生高滴度裂解物。通过PCR证实后,高滴度裂解物用来扩充AdGFAP.HATH1.11D腺载体。
AdGFAP.HATH1.11D腺病毒载体的构建
为了构建腺病毒载体AdGFAP.HATH1.11D,又称作GV501A(其图在图2中显示)和CGF166,将ADFASTTM质粒pAdE1(GFAP.HATH1)E3(10)E4(TIS1)用限制性核酸内切酶PacI消化并且使用标准程序,转染至293-ORF6细胞中。来自转染细胞的腺载体裂解物连续传代5次以扩充AdGFAP.HATH1.11D/GV501A裂解物的滴度和体积和产生高滴度(HT2)原液。将用于GV501A转染和构建的293-ORF6细胞在限制进入的细胞培养室中维持以确保与其他活动隔离。此外,AdGFAP.HATH1.11D/GV501A载体的转染、连续传代和生产在独立的病毒培养室中依据维持隔离和限制进入的程序实施。在HT2传代时通过PCR分析证实AdGFAP.HATH1.11D/GV501A载体的身份和完整性。HT2裂解物随后用来产生腺载体原液扩充物。
Hath1转基因表达测定法
基于小鼠椭圆囊模型中HATH1驱动的感觉细胞再生,认证AdGFAP.HATH1.11D载体的功能性转基因表达。这个实验的结果显示AdGFAP.HATH1.11D载体能够诱导感觉细胞再生并且因此产生有功能的HATH1蛋白。此外,使用改良的Hath1 mRNA表达测定法,对AdGFAP.HATH1.11D检验Hath1转基因mRNA的表达。该测定法包括用AdGFAP.HATH1.11D感染293细胞并且感染后24小时分离总RNA。通过半定量RT-PCR方法测量Hath1-特异性mRNA表达。这个测定法的结果显示观察到的基于RNA/DNA引物和仅DNA引物和探针的Hath1表达证据。
这个实施例的结果证实产生血清型5腺病毒载体,所述载体中已经缺失E1区和E4区的一个或多个内源核苷酸并且所述载体包含SV40早期聚腺苷酸化序列、与人GFAP启动子有效连接的编码Hath1的核酸序列和转录惰性间隔子(TIS)。
实施例2
这个实施例描述了设计成评价CGF166(AdGFAP.HATH1.11D)的安全性、耐受性及其经迷路内(IL)输注法递送以改善人类中听力和前庭功能的潜在能力的临床研究。
这个临床试验将是一个在非手术耳内前庭功能完整的、严重至极重度双侧听力损失患者中利用开放标签、单剂量、序贯队列的三部分研究。要求患者在入选之前患有记录的非波动的严重至极重度双侧听力损失。最多45名患者可以入选这个三部分、六队列试验。
试验的A部分将评估IL单剂20μL CGF166浓度(5.0x 1011个病毒粒子(vp)/mL)后的安全性和耐受性及潜在疗效。交错进行患者入选,从而安全性数据评审可以在每名治疗的患者之后(治疗后约4周)在给予后续每名患者之前完成。
试验的B部分将包括容积递增设计以评价4个患者队列(n=3个/队列;总共12名患者)中相同CGF166浓度(5.0x 1011vp/mL)的达4种可能输注体积(20μL和90μL之间)。全部剂量体积将基于试验安全性数据发生变化。
每个后续队列将仅在认定前一个队列中递送的体积安全和可耐受,如通过安全评审委员(SRC)确定后才给药。此外,对每个队列中首名患者交错时序安排和给药,以允许在每个队列中治疗剩余两位患者期间之间至少4周间隔时间。
B部分中确定的最高安全和可耐受体积将用于C部分患者中的IL输注。本研究的C部分将需要总计20名患者。无论何时一组5名受试者完成前四周研究评估,均进行类似于对A部分和B部分描述的安全性评审。
在试验的全部部分(A-C)中,患者将接受方案要求的相同评估和访视安排。本研究的C部分将仅在A部分和B部分中患者中已经确立CGF166及相关递送方法的初步安全性和耐受性后才开始。
试验持续时间将由以下组成:63天筛选阶段,随后是1-3天基线评估阶段及内部手术给药/术后评估阶段(大约6-14天),随后是6个月给药后评估阶段。此外,向A-C部分中给药的全部受试者告知入选一项独立的5年安全性随访试验的机会。
在筛选阶段期间,在研究中心验证潜在患者的合格性。
在接受方案要求的手术之前评价潜在患者的健康状况并基于体检、MRI、既往/当前医疗史和实验室检验评价计划的疗法。在筛选阶段期间,潜在患者也将接受治疗前生活质量测验、听力测验和前庭功能测验。
在筛选阶段期间预计至少两次门诊患者访视,以完成需要的验证和评估。如果全部筛选评估均可以在一次访视中完成,则这是允许的。允许额外的门诊患者筛查访视(即,超过两次访视期),待定患者安排和门诊部安排及再验证和潜在再检验的需要。
基于筛选评估结果,将选择一只耳作为研究耳并将接受研究要求的手术。选择研究耳的标准包括:(1)具有如通过纯音测听和语音识别评分所确定的更严重听力损失的耳,和(2)如果双耳具有相等的听力损失严重程度,则研究耳将依据研究者的偏好选择。
一旦完成筛查访视,将安排合格患者进行基线访视和手术。
基线(第-3天至第-1天)
合格患者将在基线时(第-3天至第-1天)返回研究中心并且接受术前准备以及治疗前功能评估。
第1天访视
在第1天,研究患者将接受要求的方案评估和进行镫骨足板造孔术以递送研究药物至内耳的前庭阶外淋巴空间。在完成手术和研究药物输注时,研究患者将在手术中心术后设施中恢复并接受术后评价和评估。研究患者可以转送至手术中心的入院患者病房或接近手术中心的预先布置的临时住所。
第2天至第6天访视
研究患者将在术后接下来5天(第2天至第6天)受到随访并且将接受方案要求的安全性随访评价。如果不存在需要延长监测的明显不良事件,研究患者将出院回家。患者将有权选择留在提供的住所直至第14天访视完成。将在出院前为研究患者安排后续访视。
第14天访视
研究患者将返回研究中心以从其耳取出手术填塞物并且还将接受研究要求的评估。患者将在研究要求的全部评价结束时出院回家或进入其当地住所。将提醒患者的下一次预定访视。
随访和结束研究访视期(每四周)
在每月一次研究中心访视期间,将监测并评价研究耳的术后恢复。研究患者也将在每次访视期间接受研究要求的安全性测验、生活质量测验、听力测验和前庭功能测验。也将在每次访视期间采集生物分布血液样品。将按照血液记录采集免疫原性检验样品。在完成六个月术后访视(研究结束访视)时,如果不存在需要延长监测的明显不良事件,将认定研究患者已经完成研究并且他们将出院回家。
给药的全部患者将预计参与独立的延长/随访试验。
安全性数据评审
对A部分(队列1)的每名患者给药之前及对B部分(队列2-5)的两名剩余患者给药之前,将评审全部安全性和耐受性数据以及评审选择的听力和前庭功能数据。认定供评审的数据将是直至给药后四周可获得的那些,如SRC章程中所概述。必须评估安全性和耐受性为令人满意,以便继续向队列中的剩余患者给药。对于队列2-5,SRC将作出对剩余两位患者给药的决定。如果在计划的剂量水平之一存在明显的不良事件或安全顾虑,可以改变下一个计划的剂量水平。
在一个队列完成后及推进至下一个队列之前,评审全部安全性和耐受性数据,以及将对接受某剂量CGF166并且已经完成至少4周研究评估的全部患者有限的听力和前庭数据评估。必须评估安全性和耐受性为令人满意,以便推进至下一个队列。SRC将作出这个决定。如果在计划的剂量水平之一存在明显的不良事件或安全顾虑,可以改变下一个计划的剂量水平。
对于C部分,在每五名受试者完成其前四周研究评估时,将进行上文描述的安全性评审。
结果
在队列A、B和C中用20至40uL本发明组合物治疗的首批患者在2-6个月随访范围内已报告了每队列0个和3个之间的不良事件-均分类为轻度至中度。大部分不良事件,包括分类为中度的全部事件,疑似与治疗不相关。此外,用组合物治疗后,不存在有临床显著的实验室的值变化。这些结果表明,本发明组合物发明在施用至人时安全。
这个实施例描述了设计成评价本发明的腺病毒载体治疗人类中听力损失的安全性和疗效的临床方案。
本文中援引的全部参考文献,包含出版物、专利申请和专利,因而通过引用的方式并入至相同程度,如同单独和专门地指出通过引用的方式并入并且在本文中完整阐述每篇参考文献。
除非本文另外说明或与语境明显矛盾,否则使用术语“一个”和“一种”和“该”和“至少一个”及相似指称在描述本发明的语境下(尤其在以下权利要求的语境下)解释为涵盖单数和复数。除非本文中另外说明或依据上下文明显抵触,否则使用术语“至少一个”接续一系列一个或多个事项(例如,“至少一个A和B”)将解释为意指选自所列事项中的一个事项(A或B)或两个或更多个所列事项的任何组合(A和B)。除非另外指出,否则术语“包含”、“具有”、“包括”和“含有”应解释为开放式术语(即,意指“包括但不限于”)。除非本文中另外说明,否则本文中对值范围的描述仅意在作为单独指称落入该范围内的每个独立值的简化方法,并且将每个独立值如同本文中单独提到的那样并入本说明书中。除非本文另外说明或除非与语境明显矛盾,否则本文所述的全部方法可以按任何合适的顺序进行。本文中提供的使用任何和全部实施例或示例性表述(例如,“如”)仅意在更好地说明本发明而不是对本发明的范围加以限制,除非另外声明。本说明书中的语言均不应解释为表示任何未要求保护的要素是对实施本发明为必需的。
本文中描述了本发明的优选实施方案,包括本发明人已知用于实施本发明的最佳模式。这些优选实施方案的变体可能对本领域普通技术人员在阅读前述描述时显而易见。发明人希望技术人员根据需要采用此类变化,并且发明人希望本发明不仅仅如本文具体所描述的那样实施。因此,本发明包括适用法律所允许的在本文所附权利要求书中所述主题的全部修改和等同物。另外,本发明包括全部可能变化中上述要素的任何组合,除非本文另外说明或另外与语境明显矛盾。
- 还没有人留言评论。精彩留言会获得点赞!