HCVNS3单克隆抗体及丙型肝炎检测试剂盒的制作方法
本发明涉及一种检测试剂盒,具体地说是一种丙型肝炎检测试剂盒和其专用HCV NS3单克隆抗体杂交瘤细胞株HCV4及HCV5和由该细胞株分泌的单克隆抗体。
背景技术:
丙型肝炎是由丙型肝炎病毒(HCV)引起的一种严重威胁人们身体健康传染病。超过50%的HCV患者将发展成为慢性肝炎,10~20%的HCV患者最终发展成为肝硬化,同时肝细胞癌变的风险也大大增加。HCV的检测对丙型肝炎病毒感染的早期诊断和指导临床治疗有重大的意义。目前丙型肝炎的检测主要是丙肝抗体和丙肝RNA两项检测指标,HCV感染后一般到丙肝抗体的检出平均有70天的“窗口期”,因此存在一定的漏检率,HCV RNA检测具有早期、敏感和特异等特点,但该方法在技术和设备上要求较高,且费时,检出率较低。类似于HIV病毒的抗体检测试剂,尽管目前应用最为广泛,但对于感染“窗口期”的检测则灵敏性欠佳。而病毒核酸的检测往往采用RT-PCR扩增的方法,因此具有易污染,且需要基因扩增仪等缺点,难于在基层单位开展。血中病毒抗原的出现早于抗体的出现,亦是一种直接的病原检测手段,将作为HCV诊断方法的有力补充。HCV感染者血清中HCVNS3抗原(HCAg NS3)是HCV复制的一个直接标志物,在感染一周左右即可出现,而且还有利于HCV感染患者的早期发现,特别是某些免疫功能紊乱、免疫功能低下的患者和某些不产生抗体的携带者。因此,检测感染者血中NS3抗原是最理想的HCV感染检测靶目标,然而,HCAg NS3在血清中的浓度(102~103CID/ml)常常低于目前国内外使用最为普遍的酶联免疫吸附分析法(ELISA)的检测限(0.1ng/ml~1μg/ml),使HCAg NS3检出率受到很大限制,成为HCV抗原检测试剂开发的瓶颈。因此,迫切需要一种高灵敏度、高特异性的丙型肝炎抗原定性和定量检测试剂。
技术实现要素:
本发明的首要目的在于解决上述现有技术中的问题,提出一种高灵敏性、高特异性的检测HVC NS3的单克隆抗体HCV4。
本发明的第二目的在于提出一种检测抗体,即HCV NS3单克隆抗体HCV5。
本发明的第三目的在于提出一种由上述单克隆抗体制备得到的免疫磁珠。
本发明的第四目的在于提出一种高灵敏性和高特异性检测丙型肝炎的检测试剂盒。
为实现上述目的,本发明采用如下技术方案:
杂交瘤细胞株HCV4,建议的分类命名:骨髓瘤杂交细胞。所述细胞株的保藏编号为:CGMCC No.10120。
HCV NS3单克隆抗体HCV4,由保藏编号为CGMCC No.10120的杂交瘤细胞株分泌得到。该细胞株于2014年12月12日保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编:100101。电话:010-64807355。
杂交瘤细胞株HCV5,建议的分类命名:骨髓瘤杂交细胞。所述细胞株的保藏编号为:CGMCC No.12282。
HCV NS3单克隆抗体HCV5,上述HCV NS3单克隆抗体HCV5由保藏编号为CGMCC No.12282的杂交瘤细胞株分泌得到。该细胞株于2016年4月14日保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编:100101。电话:010-64807355。
上述单克隆抗体HCV4和/或单克隆抗体HCV5在制备检测丙型肝炎试剂盒中的应用。
一种检测丙型肝炎的试剂盒,其中,所述试剂盒包括捕获抗体和检测抗体,所述捕获抗体为上述HCV NS3单克隆抗体HCV4;所述检测抗体为上述HCV NS3单克隆抗体HCV5。
一种生物素标记的上述单克隆抗体HCV4与链霉亲和素修饰的纳米磁珠偶联得到的免疫磁珠。
上述磁珠直径为10~12nm,其表面覆盖无机小分子单层为二氧化硅SiO2。
上述免疫磁珠在制备检测丙型肝炎试剂盒中的应用。
一种检测丙型肝炎的试剂盒,其中,所述试剂盒含有上述的免疫磁珠及上述的HCV NS3单克隆抗体HCV5。
所述试剂盒由下述试剂组成:链霉亲和素修饰的抗HCV4单克隆抗体偶联免疫磁珠板96人份×1块、HCV-NS3阳性对照1ml×1瓶、HCV-NS3阴性对照1ml×1瓶、样品稀释液12ml×1瓶、HRP标记的抗HCV5单克隆抗体0.3ml×1瓶、浓缩的抗体酶结合物稀释液24ml×1瓶、浓缩洗涤液(20×)50ml×1瓶、显色剂A液7ml×1瓶、显色剂B液7ml×1瓶、终止液7ml×1瓶、封板膜3张、说明书1份。
本发明的优点和有益效果是:
(1)本发明制备得到的针对HCV NS3N末端表位“MWTVYHGAG”和表位“TRKGSSGGP”两株单克隆抗体杂交瘤细胞株HCV4和HCV5,两单克隆抗体配对检测HCV NS3抗原具有很高的灵敏性和特异性。具有早期检测优势,即患者感染一周左右即可检测到。高灵敏度,平均检测灵敏度为5.2pg/ml,远远低于现有技术中ELISA检测法的1~2ng/ml。
(2)本发明采用生物素标记单克隆抗体HCV4偶联链霉亲和素修饰的纳米磁珠制 备得到免疫磁珠,具有特殊的超顺磁性效应,在无外加磁场时无剩磁,可以完全消除磁性团聚,均匀分散在溶液中,这就快速、高效地促进了抗原、抗体之间的反应,抗原、抗体之间的反应只需30min即可完成。同时还具有较高的抗体偶联量和很好的稳定性。磁珠直径的选择是关键,本发明选择直径为10~12nm的磁珠,具有巨大的比表面积,能够偶联更多的抗体,而且使抗体的抗原结合位点充分暴露,减少位阻效应,有效的提高了检测的灵敏度。由于免疫磁珠在磁场中可控运动的特点,反应后产物很容易磁性分离,使本方法操作简便快速。
(3)本发明所提供的纳米磁珠丙型肝炎核心抗原诊断方法与HCV RNA检测方法(本发明中对照HCV RNA定量检测由CobasTaqman HCV RNA定量检测试剂完成)的相关性良好,阳性符合率为84%。
附图说明
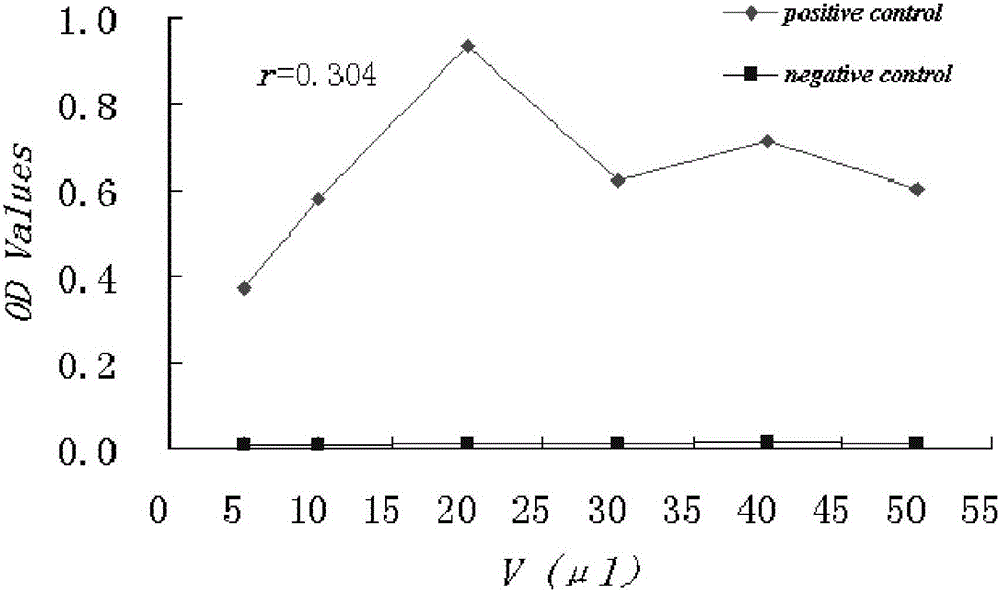
图1为免疫磁珠用量的选择结果图;
图2为免疫磁珠最佳反应时间的选择结果图;
图3为本发明检测试剂盒的稳定性结果示意图;
图4为本发明试剂盒检测灵敏度标准曲线。
具体实施方式
下述实施例中使用的方法如无特殊说明均为本领域常规方法。下述实施例中使用的材料、试剂等如无特殊说明均可通过市售购买获得。
实施例1HCV NS3单克隆抗体的建立
1.抗原制备:
(1)表达质粒的构建:以HCV NS3的全长序列为模板,利用下述引物,通过PCR合成基因片段,进行PCR产物胶回收纯化,常规方法转化连接入PMD18T(测序载体),进行测序验证。
引物设计和克隆:根据GenBank中人HCV NS3的全长序列(FJ890494.1)设计上、下游引物,如SEQ ID No.1及SEQ ID No.2所示:
上游SEQ ID No.1:atgctaggcaccataatcacaa
下游SEQ ID No.2:cactgctttatccacacccgg
PCR反应循环参数为:94℃,4min;94℃,30s;55℃,,30s;72℃,1min,20个循环,72℃延伸4min。
(2)目的蛋白表达与纯化:采用含BamHI、EcoRI酶切位点的引物扩增HCV NS3基因(465bp),酶切纯化后常规方法与经BamHI、EcoRI酶切后的PGEX-4T-2质粒连接, 转化入BL21。选取阳性克隆进行扩大培养,1%NP-40裂解,-80℃反复冻融3次,采用层析法纯化HCV NS3抗原。
(3)根据HCV NS3N末端蛋白酶区域,设计并合成两段针对催化中心的H57,S139的多肽,分别序列为N-MWTVYHGAG和N-TRKGSSGGP,BSA偶联。
2.动物免疫
取HCV重组抗原蛋白500mg/L与完全福氏佐剂等量混合制成乳化剂,共免疫6周龄雌性Balb/c小鼠5只。第1次免疫100μg/只,皮下多点注射,2周后用不完全福氏佐剂乳化抗原,第2次免疫,剂量、途径与第1次相同,2周后进行第三次免疫,剂量、途径与方法同前。2周后尾静脉取血测定效价,抗HCV效价达1:1000~1:5000时供融合用。融合前3天用抗原直接腹腔脾区加强免疫1次,3天后取小鼠脾细胞与SP2/0细胞融合。
另,分别将以上两个多肽抗原(E814-1-1-1)免疫鼠龄为6周的雌性BALB/c健康小鼠3只。第一次用福氏完全佐剂,每只50ug,腹腔注射,总剂量0.5ml/只,间隔3周第二次起用福氏不完全佐剂,剂量为50ug/0.5ml/只,第三次注射后10天检测血抗体滴度(ELISA法),选择免疫反应最好的小鼠脾脏进行融合。
3.融合和单抗筛选
免疫反应最好的小鼠的脾细胞与骨髓瘤细胞(SP2/0)进行融合,融合后的细胞经过适当稀释,分置于96孔培养板中培养,培养10-14天进行ELISA检测,挑选OD值高的孔中的细胞进行有限稀释法亚克隆。具体方法如下:将有限稀释的细胞培养至96孔板中,待克隆生长到全孔的1/6时,标记单克隆及多克隆,对单克隆进行ELISA检测。ELISA检测后将OD值最高的单克隆再有限稀释接入96孔板中如上法所述再次亚克隆,此过程重复数次,直至阳性孔比率为100%,我们即认为此为单克隆。即我们通常认为的建株成功的细胞株。将筛选得到的阳性单克隆扩大培养,细胞数按1~2×106/管进行冻存。同时收集细胞安排腹水制备。
4.腹水制备
细胞株采用小鼠腹腔接种法制备腹水,10-14天收集腹水,ELISA检测腹水是否制备成功。纯化腹水,纯化后抗体进行效价测定,显示出5株抗体最高效价为1:2560000(见表1),其中抗HCV1-3为HCV NS3全长融合蛋白免疫产生,抗HCV4为N-MWTVYHGAG;抗HCV5为N-TRKGSSGGP免疫产生。
表1 5株抗-HCV McAb上清液和腹水的效价测定
5.抗体鉴定
(1)特异性鉴定
以重组HCV基因工程表达抗原、大肠杆菌BL-21菌体和HDV重组蛋白分别包被聚苯乙烯板条,置4℃过夜。用2%BSA-PBS封闭后,分别加入不同株细胞培养上清液,室温2h后,加入抗IgG-HRP标记物,室温1h,洗涤后显色,观察各细胞株与不同抗原有无交叉反应,见表2。
表2 5株抗-HCV McAb与其他抗原蛋白的交叉反应OD值
(2)亚类鉴定
用HCAg(2.5mg/L)包被96孔板条,4℃过夜。2%BSA-PBS-Tween20封闭后,加入不同株细胞培养上清液(0.1ml/孔),室温2h,洗涤后加入抗小鼠Ig及其亚类的兔免疫血清,37℃孵育1h,洗涤后加入酶标记羊抗兔Ig抗体,37℃1h,洗涤,显色,判断结果,见表3。
表3HCV单克隆抗体亚类鉴定
其中针对N末端抗原表位的抗HCV4(表位MWTVYHGAG)和抗HCV5(表位TRKGSSGGP)效价显著高于其他株抗体。
(3)几株单克隆抗体分别配伍进行HCV NS3抗原的检测,选择配伍检测效率最高的用于试剂盒开发:
选择抗HCV1,抗HCV4和抗HCV5分别进行磁珠标记和HRP标记(方法见实施例2),分别作为捕获抗体和检测抗体进行配伍检测HCV NS3重组蛋白和HCV患者血清中HCV NS3抗原水平,其中检测HCV NS3抗原实验重复5次,取均值。结果见表4,表5,对于HCV NS3重组蛋白的检测,几组配伍之间无显著性差异,但对于HCV患者血清的检测可以看出,以HCV‐4和HCV‐5两株抗体配伍的检测值最高,即检测效率最高。
表4单克隆抗体配伍检测HCV NS3重组蛋白OD值
表5单克隆抗体配伍检测HCV患者血清OD值
实施例2本发明纳米磁珠丙型肝炎检测试剂盒的制备
1.免疫磁珠(MIB)的制备
本实施例使用的微球,可以为专利号ZL201010168903.2,专利名称为“一种合成磁性聚合物微球的方法”中所述的微球,或其他市售的超顺磁性聚合物微球。
取1mg链霉亲和素修饰磁微球,用MIB清洗缓冲液洗一次,加入100μl生物素标记HCV NS3单克隆抗体HCV4,充分混匀,室温反应30min,磁性分离,吸取上清液,测蛋白浓度,用MIB清洗缓冲液洗三次,加入1ml MIB保存缓冲液,4℃保存备用。
2.免疫磁珠表面抗体的偶联效率的鉴定
采用紫外可见分光光度计测定偶联前的抗体溶液(pre)、偶联后的上清液(post)和偶联过程中清洗液(wash)在波长280nm处的OD值,测量结果分别为:OD pre=0.325,OD post=0.040,OD wash=0.002,按以下公式计算得到抗体的偶联效率为87.1%,该结果表明生物素标记HCV NS3单克隆抗体HCV4高效地与链霉亲和素修饰磁微球进行了偶联,形成了MIB。偶联效率计算公式如下:
3.试剂盒中免疫磁珠用量和反应时间的优化选择
以基因工程表达HCAg NS3为阳性对照,正常人血清为阴性对照。将20μl HCAg NS3,20μlMIB(上述方法制备得到的),50μl HRP标记HCV NS3单克隆抗体HVC5和50μl反应缓冲液加入离心管中,充分混匀,37℃反应30min,磁性分离后,用0.02mol/L PBST洗三次,加入TMB底物液,37℃反应10min,以2mol/L H2SO4终止反应,磁性分离,在波长450nm处测定上清液的吸光度(OD)值,如图1所示。分别加入MIB 5,10,20,30,40和50μl后,测定阳性对照和阴性对照的OD值。结果表明差异的统计学意义不明显(r=0.304,p>0.05),随着MIB量的增加,阳性对照OD值增加到一定程度后趋于减少,而阴性对照OD值变化不明显,MIB最佳用量为20μl。
按上述方法,选择不同反应时间测定阳性对照和阴性对照的OD值:5,10,15,20,30和40min,如图2所示。结果显示差异有统计学意义(r=0.956,p<0.01),随着反应时间延长,阳性对照OD值增加,在反应时间30min后,阳性对照OD值增加不明显。阴性对照在所研究的每个反应时间点都显示很低的OD值。最佳反应时间为30min。
4.本发明检测试剂盒的稳定性试验
将上述方法3中的主要试剂,包括MIB、HRP标记物、阳性对照、阴性对照、反应缓冲液和底物液于4℃放置,分别在第1个月、3个月、6个月、9个月和12个月时测定阳性对照和阴性对照的OD值,计算P/N,结果如图3所示。结果显示差异有统计学意义(r=-0.985,p<0.01),P/N无明显下降,在第12个月时,P/N仍大于2.1,显示本检测试剂盒有很好的稳定性。
5.本发明检测试剂盒的灵敏度和精密度测定
对零标准浓度进行10次平行测定,计算OD值的平均值及其标准偏差,OD值平均值减去两倍标准偏差后的值代入标准曲线求得的浓度即为灵敏度。重复试验三次,得到平均检测灵敏度为5.2pg/ml。应用HCV NS3重组蛋白倍比稀释后,分别检测其OD值如表6,图4所示,以OD值大于1.0为阳性Cutoff值,最低检测限为5pg/ml。
表6试剂盒灵敏度检测
用同批制备的MIB对浓度为100,200和500pg/ml的HCAg NS3溶液进行10次批内、3次批间重复试验,结果见表7,批内和批间相对标准偏差均小于15%,表明该方法有较好的重复性。
表7精密度测定结果
实施例4本发明丙型肝炎检测试剂盒在临床标本检测方面的应用实验验证
1. 3708例HCV抗体阴性血清标本的检测:
HCV抗体由万泰丙型肝炎-丙型肝炎病毒(HCV)抗体诊断试剂盒(双抗原夹心酶联免疫法,国药准字S20130002)完成,收集北京佑安医院2003年1月至2005年12月留取的血清标本(-80℃保存),其中48例检测到HCV NS3抗原阳性(1.3%),抗原阳性患者的检测OD值见表8为本发明试剂盒检测48例HCV抗体阴性、HCV NS3抗原阳性患者OD值(>0.168为阳性)。
表8HCV抗体阴性血清标本HCV NS3抗原阳性检测结果
2. 173例HCV抗体阳性患者HCV NS3抗原检测:173HCV抗体阳性样本中,42例为HCV NS3抗原检测阳性,其比例约为24.3%。
3.HCV NS3抗原检测阳性标本的确认:
(1)15例HCV NS3抗原阳性标本中,9例(60%)为HCV RNA阳性;
(2)当与HCV抗体阳性血清中和以后,23例HCV NS3抗原阳性血清标本的OD值显著降低,以下降50%为例,其中和比率为87.0%(20/23)。中和反应结果见表9。
表9
(3)将23例HCV NS3抗原阳性的血清标本进行免疫印迹检测,16(69.6%)例为免疫印迹检测阳性。
4. 25例系列血清标本的动态HCV NS3抗原检测:
我们检测了11例HCV NS3抗原阳性的患者系列动态血清标本,其HCV NS3抗原OD值随着患者感染时间的延长而降低,HCV NS3抗原检测OD值与患者感染时间的关系见表10。
表10 25例系列血清标本的动态HCV NS3抗原检测
5. 25例HCV患者HCV-RNA、HCV抗体检测结果与本发明HCV NS3抗原检测结果的相关性分析:HCV NS3抗原检测与HCV-RNA阳性的符合率达84%,与HCV抗体检测亦有较好的相关性,见表11。
表11HCV-RNA、HCV抗体检测结果与本发明HCV NS3抗原检测结果的相关性分析
- 还没有人留言评论。精彩留言会获得点赞!