一种修饰的抗草甘膦基因及抗草甘膦水稻的培育方法与流程
本发明属于植物基因工程技术领域,具体涉及一种微生物来源的抗草甘膦基因的修饰、一种包含抗草甘膦基因的植物表达载体的构建、一种具有商业潜力的高抗草甘膦转基因水稻的培育,以及通过杂交方法获得具有商业潜力的高抗草甘膦转基因水稻新品种的方法。
背景技术:
水稻是中国最重要的粮食作物之一,提供了60%人群的主食。杂草是影响水稻产量和品质的重要因素。传统农业主要通过人工除草结合翻耕及灌水等管理方式来控制稻田杂草,需要投入大量人力、物力。随着中国城镇化速度加快,许多水稻种植地区劳动力短缺问题日益突出,促使水稻栽培方式由移栽向直播转变,人工除草也逐渐被化学除草取代。化学除草是目前最经济有效的杂草管理方法,可以有效减少粮食产量损失和大大减低劳动力成本。草甘膦是20世纪70年代由孟山都公司开发的除草剂,可以与莽草酸途径中的5-烯醇丙酮酰莽草酸-3-磷酸合酶(5-enolpyruvylshikimate3-phosphatesynthase,epsps)结合,抑制芳香族氨基酸的合成(steinrückenandamrhein,1980),从而可以达到高效广谱的除草目的。由于莽草酸途径只存在于植物、微生物、及低等动物apicomplexanparasites中,人和哺乳动物中尚未发现莽草酸途径的存在,所以草甘膦对人畜相对安全(herrmann,1995)。同时草甘膦具有价格低廉、在环境中易降解等特点,因此成为目前使用最广泛的广谱型除草剂。由于草甘膦对水稻有毒性,草甘膦在稻田中的使用比较少,局限于苗前处理。开发抗草甘膦水稻,可以拓宽稻田除草剂使用的种类、降低生产成本、促进直播生产技术的发展。
通过转基因方法将抗草甘膦基因转入水稻是培育抗草甘膦水稻的重要途径。考虑到抗草甘膦转基因水稻的生产安全性,获得的转基因水稻需要在田间生产条件下对草甘膦呈现高抗性,在使用高剂量草甘膦处理时转基因水稻的主要农艺性状不发生改变。尽管目前有较多的抗草甘膦基因,但是只有极少数基因(玉米tipsepsps、cp4epsps)被应用于商业化生产,因此培育抗草甘膦转基因水稻以新型的高抗草甘膦基因为基础。
一些微生物来源的基因由于其序列特征在水稻中的表达可能存在异常,为了提高微生物来源的基因在水稻中的表达,需要对微生物来源的基因进行密码子优化以提高植物偏爱密码 子的使用频率、去除可以形成复杂二级结构的序列、去除富含at碱基的序列同时去除常用的限制性内切酶酶切位点以利于基因工程操作。
通过遗传转化方法可以获得大量的转基因水稻植株,但是由于组织培养过程中产生的体细胞变异及外源基因插入产生位置效应等因素,需要耗费大量的人力、物力和时间进行理想转基因水稻株系的筛选,限制了转基因技术在农业生产上的应用。通过杂交手段将理想转基因株系中的外源基因整合特征导入新的水稻品种,可以克服一些水稻品种难以进行组织培养、难以进行遗传转化等问题,加快新型转基因水稻的培育速度。
目前我国水稻种植中,一半以上的水稻种植面积是杂交稻品种。杂交稻极大的促进了我国水稻产量的增加,对保障我国粮食安全具有重要意义。然而杂交稻生产过程中面临杂种纯度低影响水稻产量和品质等问题,通过培育抗草甘膦水稻恢复系品种,可以有效解决杂交稻制种中种子纯度低的问题,促进杂交水稻生产,为我国的粮食产量的提高做出贡献。
技术实现要素:
本发明的目的在于克服现有技术存在的缺陷,提供一种修饰的抗草甘膦基因及抗草甘膦水稻的培育方法。
本发明所述目的基因是一种人工合成和修饰的抗草甘膦基因i.variabilis-mepsps基因(该基因的原始序列由华中农业大学刘子铎教授课题组克隆并提供(来源于微生物材料),通过对原始序列进行密码子优化及人工合成得到新的i.variabilis-epsps蛋白编码序列i.variabilis-mepsps)。采用农杆菌介导的籼稻遗传转化法,将所述的i.variabilis-mepsps基因导入受体水稻品种明恢86。通过pcr方法检测转基因植株阳性率,利用southernblot确定不同转基因家系i.variabilis-mepsps的拷贝数,通过反向pcr方法分离得到i.variabilis-mepsps基因侧翼序列,利用northernblot和westernblot确定i.variabilis-mepsps基因的表达,田间草甘膦抗性试验确定转基因水稻对草甘膦的抗性等过程,最终获得i.variabilis-mepsps基因单拷贝整合在基因间区且i.variabilis-mepsps基因表达正常的高抗草甘膦水稻品种gt28。gt28可以与三系杂交中的不育系品种杂交,进而获得高抗草甘膦且农艺性状优良的杂交稻新品种。i.variabilis-mepsps基因在gt28中的整合特征可以通过有性杂交或体细胞杂交技术重组到新的水稻种质中去,进而培育农艺性状优良且高抗草甘膦转基因水稻衍生新品种(系)。
本发明公开了i.variabilis-mepsps基因的获得、植物表达载体的构建、水稻遗传转化、高抗草甘膦水稻品种gt28的分子鉴定和田间抗草甘膦试验、gt28与不育系品种的杂交及杂 种的分子鉴定、草甘膦抗性鉴定等过程。
本发明的具体步骤是:
先以pcambia1300质粒为基础载体,构建去除选择标记hpt基因的载体p130,再将人工合成的i.variabilis-mepsps基因和带有5’引导序列utr的叶绿体定位信号肽编码序列mctp插入其多克隆位点,形成相应的植物表达载体pu130-i.variabilis-mepsps。将水稻品种明恢86的成熟种子消毒后诱导胚性愈伤组织。将含有表达载体pu130-i.variabilis-mepsps的农杆菌菌株与胚性愈伤组织进行共培养后,在含有草甘膦的筛选培养基上进行抗性愈伤组织的筛选,将筛选出来的抗性愈伤组织在分化培养基上进行分化,当分化的小植株长到2cm左右时,切掉原生根,转移到生根培养基上进行生根,当新根生长到2cm左右时,炼苗后移栽到温室。这些再生小苗即为t0代转基因植株。
在t0代植株生长期间,通过pcr方法检测i.variabilis-mepsps在转基因植株中的整合,利用southernblot方法检测i.variabili-mepsps在转基因植株的拷贝数,对i.variabilis-mepsps单拷贝整合的转基因植株分单株收种。在t1代,转基因植株分家系进行种植,利用反向pcr的方法确定i.variabilis-mepsps在这些转基因家系中的整合位点,对i.variabilis-mepsps整合在基因间区的家系分单株收种。收获后的种子在含有草甘膦的培养基上进行发芽试验筛选得到纯合的转基因单株。通过进一步northernblot和westernblot检测、田间草甘膦抗性检测等相关试验,最终获得具有商业潜力的抗草甘膦转基因水稻家系gt28。通过gt28与水稻不育系品种杂交,对杂种进行southernblot、westernblot及田间草甘膦抗性检测的过程确定通过杂交方法可以获得高抗草甘膦杂交稻新品种。
本发明的优点在于:
(1)修饰后得到的i.variabilis-mepsps基因相比原始基因序列gc含量显著降低,可以避免i.variabilis-mepsps基因在水稻中异常转录和翻译;i.variabilis-mepsps基因相比原始基因序列限制性内切酶识别位点数量显著降低,有利于基因工程操作。
(2)植物表达载体pu130-i.variabilis-mepsps的t-dna区不包含i.variabilis-mepsps基因以外的其它筛选标记基因,利用该载体获得转基因植株具有较高的生物安全性。
(3)本发明中抗草甘膦基因i.variabilis-mepsps基因整合入杂交稻恢复系品种明恢86基因组中,绝大多数转基因植株对草甘膦呈现高抗性。
(4)本发明通过southernblot、侧翼序列分离、northernblot及westernblot方法筛选到i.variabilis-mepsps基因以单拷贝形式整合到基因间区且表达正常的转基因株系gt28。gt28 转基因纯合后代在受到相当于10倍农业推荐剂量草甘膦处理时,主要农艺性状不发生改变,可以应用于农业生产。
(5)本发明培育的gt28与水稻不育系品种的杂交后代在受到相当于10倍农业推荐使用剂量草甘膦处理时,杂交后代的主要农艺性状不发生改变,可以利用草甘膦有效解决杂交稻制种中伪杂种的问题及降低杂交稻生产过程中控制杂草的生产成本。
(6)i.variabilis-mepsps基因在gt28整合特征可以通过杂交、回交的方式,导入到其它水稻品种,进而加快培育农艺性状优良且高抗草甘膦的水稻新品种或新品系的速度,避免重新进行遗传转化过程中涉及的一系列关键技术问题(例如一些水稻品种难以进行组织培养、或难以进行遗传转化、或因i.variabilis-mepsps基因拷贝数及i.variabilis-mepsps基因整合位点确定相对困难等问题。)
附图说明
序列表seqidno:1是人工合成和修饰的抗草甘膦基因i.variabilis-mepsps的核苷酸全序列。序列长度为1374bp。
序列表seqidno:2是在i.variabilis-mepsps基因序列的5’末端加入sphⅰ内切酶识别位点序列、3’末端加入终止密码子taa和sacⅰ内切酶识别位点序列后,人工合成的dna片段序列。序列长度为1389bp。
序列表seqidno:3是经过密码子优化的叶绿体定位信号肽编码序列(简称mctp)。序列长度为225bp。
序列表seqidno:4是在mctp的5’末端加入引导序列utr、3’末端加入tgc序列后,人工合成的dna片段序列。序列长度为340bp。
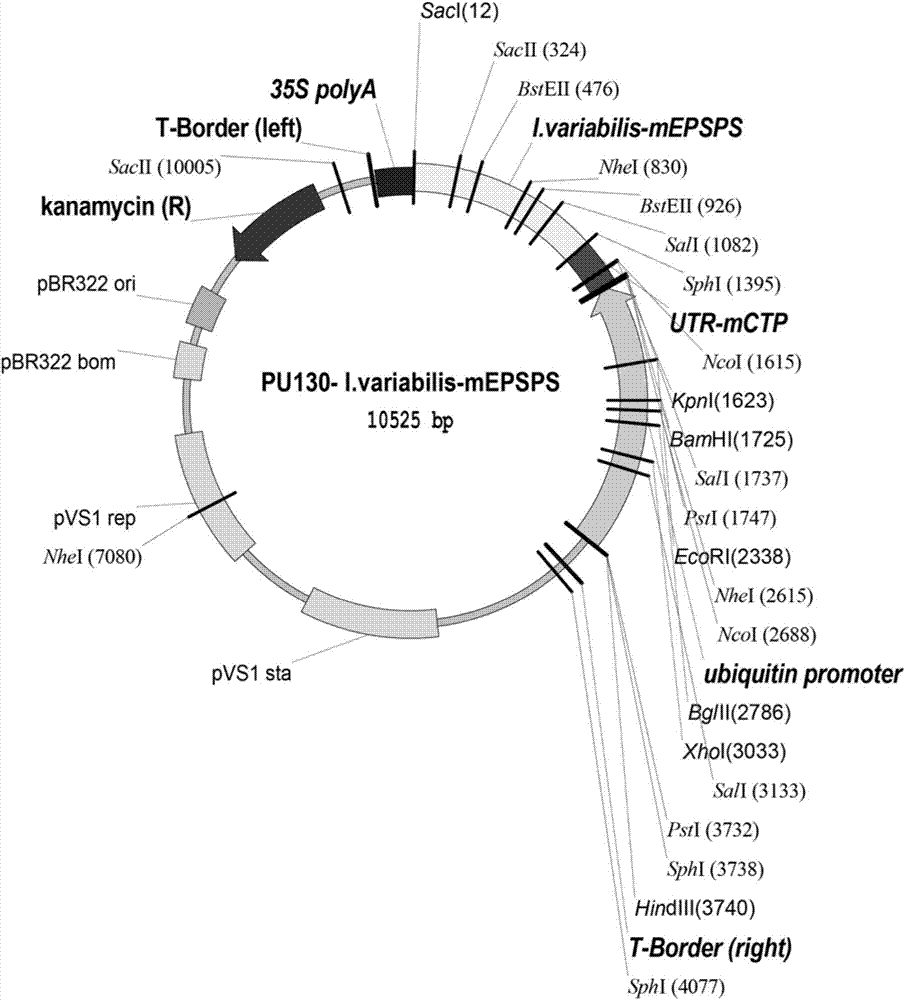
序列表seqidno:5是植物表达载体pu130-i.variabilis-mepsps的全长序列。长度为10525bp。
序列表seqidno:6是转基因家系gt28水稻外源基因插入位点相邻的5’基因组侧翼序列。序列长度为377bp。
序列表seqidno:7是转基因家系gt28水稻的插入外源基因序列。序列长度为4247bp。序列表seqidno:8是转基因家系是gt28水稻外源基因插入位点相邻的3’基因组侧翼序列。序列长度为200bp。
序列表seqidno:9-16是本发明所涉及到的相关pcr引物对的序列。
序列表seqidno:17是来源于微生物的i.variabilis-epsps原基因的核苷酸序列。序列长度为1374bp。
序列表seqidno:18是来源于微生物的i.variabilis-epsps原基因的蛋白质序列。编码457个氨基酸。
图1:是商用载体pcambia1300的图谱,本发明利用其骨架构建植物转化载体。
图2:本发明构建的植物转化载体pu130-i.variabilis-mepsps结构示意图。该载体是在pcambia1300的基础上改造而来,在多克隆位点处连接了外源基因i.variabilis-mepsps的表达框架及去除了选择标记hpt基因的表达框架。
图3:本发明获得的转基因家系gt28的拷贝数检测结果。用hindⅲ或者sacⅰ对转化载体和水稻基因组dna进行酶切,用dig标记i.variabilis-mepsps探针进行杂交,野生型(非转基因)水稻明恢86没有杂交条带,转化载体pu130-i.variabilis-mepsps和gt28有杂交条带。附图标记说明:m:为dig标记marker;泳道1、2和3分别表示转化载体、野生型明恢86、gt28的基因组dna用hindⅲ酶切;泳道4、5和6分别表示转化载体、野生型明恢86、gt28的基因组dna用sacⅰ酶切。
图4:i.variabilis-mepsps基因在gt28的插入位点分析结果。i.variabilis-mepsps基因在转基因水稻家系gt28中整合在第11号染色体上。
图5:本发明获得的转基因家系gt28的特征性pcr胶图。附图标记说明:泳道1和2分别以gt28和野生型明恢86基因组dna为模板,用引物gt28-f(见seqidno:15)和iva-2(见seqidno:14)进行扩增;泳道3和4分别以gt28和野生型明恢86基因组为模板,用引物gt28-r(见seqidno:16)和ubi-2(见seqidno:13)进行扩增。附图标记说明:m代表dnamarker,从上到下条带大小依次为5kb、3kb、2kb、1kb、750bp、500bp、250bp和100bp。
图6:本发明克隆的i.variabilis-mepsps基因在转基因家系gt28中的表达量的检测结果。附图标记说明:图6中的a图:利用northernblot对i.variabilis-mepsps在gt28的转录进行检测。杂交使用的探针为dig标记的i.variabilis-mepsps探针。图6中的b图是rna上样量。图6中的c图是利用westernblot对i.variabilis-mepsps基因在转基因家系gt28中的翻译进行检测(使用的抗体为抗i.variabilis-epsps多克隆抗体,购自上海佑隆生物科技有限公司)。 图6中的d是蛋白的上样量。
图7:本发明获得的转基因家系gt28的草甘膦抗性。附图标记说明:gt28表示转i.variabilis-mepsps基因明恢86纯合株系;mh86表示野生型明恢86。
图8:本发明获得的转基因家系gt28与水稻不育系品种杂交后代(ⅱ-32a×gt28)分子检测结果。附图标记说明:图8中的a图表示杂种ⅱ-32a×gt28的southernblot结果。泳道m代表dig标记marker;泳道1-5分别代表转化载体、野生型明恢86、野生型明恢86与不育系ⅱ-32a的杂种(ⅱ-32a×mh86)、gt28、gt28与水稻不育系ⅱ-32a的杂种(ⅱ-32a×gt28)的基因组dna用hindⅲ酶切,用dig标记i.variabilis-mepsps探针进行杂交的结果。图8中的b图是利用westernblot对i.variabilis-mepsps基因在gt28与水稻不育系ⅱ-32a的杂种(ⅱ-32a×gt28)中的翻译进行检测的结果(使用的抗体为抗i.variabilis-epsps多克隆抗体,购自上海佑隆生物科技有限公司),在图8的b图中:mh86、ⅱ-32a×mh86、gt28和ⅱ-32a×gt28分别代表野生型明恢86、野生型明恢86与不育系ⅱ-32a的杂种、转基因家系gt28、转基因家系gt28与不育系ⅱ-32a的杂种。图8中的c图是蛋白的上样量。
图9:本发明获得的转基因家系gt28与水稻不育系品种杂交后代(ⅱ-32a×gt28)的草甘膦抗性结果。附图标记说明:ⅱ-32a×mh86和ⅱ-32a×gt28分别表示野生型明恢86与水稻不育系ⅱ-32a的杂种及转基因家系gt28与不育系ⅱ-32a的杂种。
具体实施方式
实施例1:i.variabilis-epsps和ctp序列的密码子优化
本发明所用目的基因i.variabilis-mepsps的原始序列是华中农业大学刘子铎教授课题组从微生物即细菌isoptericolavariabilis中克隆获得(基因功能验证也是在微生物中验证的,并没有在植物特别是没有在说到转化中进行验证,参见文献:yis,etal.characterizationofanewtypeofglyphosate-tolerant5-enolpyruvylshikimate-3-phosphatesynthasefromisoptericolavariabilis.jmolcatalb:enzym.2015,111:1-8),原始基因命名为的i.variabilis-epsps,其核苷酸序列如seqidno:17所示,编码氨基酸的序列如seqidno:18所示,不同密码子的使用频率如表1所示。对原始i.variabilis-epsps基因进行分析,将其应用于抗草甘膦水稻的培育可能存在如下问题。(1)原始i.variabilis-epsps基因中碱基a的含量为11.4%,碱基c的含量为40.8%,碱基g的含量为36.1%,碱基t的含量为11.7%,其gc含量高达76.9%。由于在植物中表达的基因gc含量应介于30%-70%,所以原始的i.variabilis-epsps基因在植物中的表达可能存在问题;(2)用dnaman软件对原始i.variabilis-epsps基因序列进行分 析,其序列包含46种限制性内切酶的121个识别位点,这些限制性内切酶包括一些常用的限制性内切酶如nocⅰ、sacⅰ、sphⅰ、xhoⅰ等,所以原始i.variabilis-epsps基因直接应用于基因工程操作存在困难;(3)原始i.variabilis-epsps基因中一些非最优密码子如丙氨酸密码子gcg、脯氨酸密码子ccc、精氨酸密码子cgg等过多使用不仅导致序列gc含量提高而且可能导致翻译异常;(4)原始i.variabilis-epsps基因中天冬氨酸密码子全部采用gac,而谷氨酸密码子全部采用gag,可能导致蛋白翻译异常。
本发明以不同密码子在单子叶植物中的使用频率为依据,在不改变编码氨基酸序列的前提下对来自微生物源的原始i.variabilis-epsps基因序列进行修饰。修饰后的i.variabilis-epsps基因命名为i.variabilis-mepsps,其核苷酸序列如seqidno:1所示,密码子使用频率如表1所示。经测定本发明修饰的i.variabilis-mepsps基因序列中:(1)碱基a的含量为16.0%、碱基c的含量为34.4%、碱基g的含量为32.5%、碱基t的含量为17.2%,其gc含量降低到66.9%,本发明修饰的i.variabilis-mepsps基因序列与原基因i.variabilis-epsps序列的同源性为80.8%,但是本发明修饰的基因编码的氨基酸序列与原始来源基因编码的氨基酸序列完全相同;(2)用dnaman软件对i.variabilis-mepsps基因序列进行分析,限制性内切酶识别位点降低到32种限制性内切酶的54个识别位点,不存在一些常用的限制性内切酶如nocⅰ、sacⅰ、sphⅰ、xhoⅰ等的识别位点;(3)丙氨酸、脯氨酸和精氨酸等氨基酸的最优密码子使用频率提高;(4)42个密码子的使用频率相比原始序列发生改变,导致修饰后的序列最优密码子与非最优密码子的使用频率更加均衡,利于蛋白质表达。同时我们在修饰的i.variabilis-mepsps基因序列的5’末端添加了sphⅰ内切酶识别位点序列gcatgc,在3’末端依次添加了终止密码子taa和sacⅰ内切酶识别位点序列gagctc,构成如seqidno:2所示的序列,进行化学合成,用于植物表达载体构建。
本发明所使用的叶绿体定位信号肽编码序列ctp原始序列是拟南芥epsps的叶绿体定位信号肽的编码序列,从ncbi数据库中获得(genebank:x06613.1)。ctp序列的长度为225bp,含有22.7%的碱基a、25.3%的碱基c、23.6%的碱基g和28.4%的碱基t。根据不同密码子在单子叶植物中的使用频率对ctp序列进行优化得到如seqidno:3所示的序列,我们将该序列命名为mctp序列。mctp序列含有20.9%的碱基a、37.3%的碱基c、26.7%的碱基g和15.1%的碱基t,mctp序列与原始ctp序列的同源性为70.27%,相比原始序列40个密码子的使用频率发生改变(如表1所示)。在mctp序列的5’末端添加了bamhⅰ内切酶识别位点序列ggatcc和长度为106bp的引导序列utr,在3’末端添加了tgc序列使mctp序列的3’末端形成sphⅰ内切酶识别位点序列gcatgc,最终形成如seqidno:4所示的 序列,进行化学合成。
表1密码子使用频率统计
实施例2:植物表达载体的构建
本发明所用的原始转化载体为农杆菌ti双元载体pcambia1300(由澳大利亚pcambia实验室,centerfortheapplicationofmolecularbiologytointernationalagriculture提供)。用xhoⅰ+ecorⅰ双酶切pcambia1300(图1),然后用t4dna聚合酶抹成平末端,形成中间载体p130。再用hindⅲ+bamhⅰ双酶切p130连入玉米ubiquitin启动子;进一步用bamhⅰ+sacⅰ双酶切后,连入seqidno:2所示的序列和seqidno:4所示的序列形成最终表达载体pu130-i.variabilis-mepsps(序列见seqidno:5,构建图见图2)。将pu130-i.variabilis-mepsps转化到农杆菌eha105中,将转化后的农杆菌菌株置于-70℃保存待用。
实施例3:农杆菌介导的水稻明恢86的遗传转化
愈伤组织诱导和继代培养主要参考现有文献。通过梯度试验确定水稻品种明恢86(为常规品种,材料来源由华中农业大学作物遗传改良国家重点实验室保存)抗性愈伤组织筛选所需最适的草甘膦浓度为200mg/l(农杆菌介导的明恢86的转化的操作过程步骤见3.1-3.8所述)。
3.1愈伤组织诱导
将成熟的水稻明恢86种子去壳,然后依次用75%的乙醇处理1min,0.15%氯化汞种子 表面消毒15min;用灭菌水洗种子5次;将种子放在愈伤组织诱导培养基上(ms培养基基础上添加2.5mg/l2,4-d,0.8g/l水解酪蛋白,0.6g/l脯氨酸,0.5g/l谷氨酰胺,30g/l麦芽糖和3g/lphytagel);将接种后的种子置于黑暗处培养4周(培养温度28±1℃)。
3.2愈伤组织继代培养
挑选亮黄色、紧实且相对干燥的胚性愈伤组织,放于继代培养基(营养成分与诱导培养基相同),黑暗下培养3周(温度28±1℃)。
3.3农杆菌培养
在含有50mg/l卡那霉素的la培养基(10g/ltryptone,5g/lyeastextract,10g/lnacl,15g/l琼脂粉,ph7.0)预培养农杆菌2d(温度为28±1℃);将农杆菌转移至悬浮培养基(1/2ms培养基大量元素成分、1/2ms培养基微量元素成分、1/2ms培养基铁盐成分和ms培养基维生素成分基础上添加2.5mg/l2,4-d,0.8g/l水解酪蛋白,0.6g/l脯氨酸,30g/l麦芽糖,10g/l葡萄糖和100μm乙酰丁香酮,其中本发明所用到的ms培养基的基础成分或称ms基本培养基参见:murashige和skoog,1962文献,为本领域常用培养基,下同),在摇床上以28℃,200rpm的条件培养2h。
3.4农杆菌侵染
将愈伤组织转移至灭好菌的三角瓶内;调节农杆菌的悬浮液至od600值为0.3左右;将愈伤组织在农杆菌悬浮液中浸泡30min;转移愈伤组织至灭好菌的滤纸上吸干;然后放置在共培养基(1/2ms培养基大量元素成分、1/2ms培养基微量元素成分、1/2ms培养基铁盐成分和ms培养基维生素成分基础上添加2.5mg/l2,4-d,0.6g/l脯氨酸,30g/l麦芽糖,10g/l葡萄糖,100μm乙酰丁香酮和8g/l琼脂粉)上培养3d(培养温度19℃)。
3.5愈伤组织洗涤和选择培养
用灭菌水洗涤愈伤组织10次;然后将愈伤组织浸泡在含500mg/l的羧苄青霉素的灭菌水中30min;转移愈伤组织至灭好菌的滤纸上吸干;再转移愈伤组织至选择培养基(ms培养基基础上添加2.5mg/l2,4-d,0.6g/l脯氨酸,200mg/l草甘膦,500mg/l羧苄青霉素,30g/l麦芽糖和8g/l琼脂粉)上选择培养3次,每次培养2周。
3.6分化
将抗性愈伤组织转移至分化培养基上(ms培养基基础上添加2mg/lkt,0.2mg/lnaa,2mg/l6-ba,0.2mg/liaa,0.8g/l水解酪蛋白,0.6g/l脯氨酸,30g/l麦芽糖和3g/lphytagel),光照(2000lux)下培养(温度26±1℃)。
3.7生根
剪掉分化时产生的根,然后将其转移至生根培养基(1/2ms培养基基础上添加20g/l蔗糖和3g/lphytagel)中,2000lux光照培养3周(温度26±1℃)。
3.8移栽
洗掉根上的残留培养基,将具有良好根系的幼苗转入温室,同时在最初的几天保持土壤湿润。
实施例4:转基因植株的pcr检测
采用ctab法提取水稻叶片总dna(文献:murry&thompson,1980)。pcr引物的设计利用primer3软件完成(http://bioinformatics.hzau.edu.cn/)。用于i.variabilis-mepsps基因扩增的两条引物分别是i.variabilis-mepsps-f(见seqidno:9)和i.variabilis-mepsps-r(见seqidno:10)。用引物i.variabilis-mepsps-f和i.variabilis-mepsps-r扩增到得到的pcr产物大小是576bp。pcr反应体系:50ng模板dna,2μl10×pcrbuffer(mg2+plus),0.4μldntp(10mm),0.3μli.variabilis-mepsps–f引物(10μm),0.3μli.variabilis-mepsps–r引物(10μm),1utaqdnapolymerase,补ddh2o至20μl。pcr反应程序:94℃预变性5min,94℃变性30s,58℃退火30s,72℃延伸40s;重复32个循环;72℃终延伸8min。扩增产物在0.8%的琼脂糖凝胶上进行检测。对所有t0代植株进行pcr检测,分析i.variabilis-mepsps在转基因植株中的整合情况。一共检测t0代转化植株72株,其中60株转化植株为i.variabilis-mepsps阳性植株。
实施例5:转基因植株i.variabilis-mepsps拷贝数检测
利用southern杂交对60个可育的i.variabilis-mepsps家系进行i.variabilis-mepsps拷贝数分析。利用ctab法抽提转基因水稻植株叶片总dna(参见文献:murry&thompson,1980),southern杂交分析方法参见roche公司的地高辛应用手册。总dna用hindiii或者sacⅰ酶切,以地高辛标记的i.variabilis-mepsps基因的pcr扩增产物为杂交探针进行检测。根据southern杂交结果,共确定19个转基因株系为单拷贝转基因株系。
实施例6:转基因植株i.variabilis-mepsps整合位点分析
采用反向pcr方法对19份i.variabilis-mepsps单拷贝整合的转基因株系进行插入位点及插入序列完整性分析。取1μg基因组dna,用hindⅲ或者sacⅰ进行酶切,然后用t4dna连接酶进行连接。取0.5μl连接产物进行常规巢式pcr,第一轮pcr反应体系为50ng模板dna,10μl2×kodbuffer,4μldntp(8mm),0.4μl10μmubi-1(序列见seqidno: 11),0.4μl10μmiva-1(序列见seqidno:12),0.4μlkodpolymerase,补ddh2o至20μl。pcr反应程序:95℃预变性5min,98℃变性10s,68℃退火4.5min;重复30个循环;68℃终延伸10min。第二轮pcr反应体系为0.5μl第一轮pcr产物,10μl2×kodbuffer,4μldntp(8mm),0.4μl10μmubi-2(序列见seqidno:13),0.4μl10μmiva-2(序列见seqidno:14),0.4μlkodpolymerase,补ddh2o至20μl。pcr反应程序:95℃预变性5min,98℃变性10s,68℃退火4.5min;重复38个循环;68℃终延伸10min。对第二轮pcr产物进行电泳分离、回收和测序,测序结果与ncbi数据库进行比对分析,确定i.variabilis-mepsps在水稻基因组插入位点。根据插入位点的序列信息,在插入位点的上游和下游分别设计引物,利用特征性pcr对插入位点分析结果进行验证。最终确定i.variabilis-mepsps表达框架插入位点处不存在基因且i.variabilis-mepsps表达框架中ubiquitin1启动子和35spolya没有任何缺失的转化家系gt28。i.variabilis-mepsps基因在转基因家系gt28的拷贝数分析结果见图3所示,插入位点分析结果见图4所示,特征性pcr结果见图5所示。对转基因家系gt28进行特征性pcr的两对引物分别是gt28-f/iva-2和gt28-r/ubi-2。ubi-2、iva-2、gt28-f、gt28-r的序列分别如seqidno:13、seqidno:14、seqidno:15、seqidno:16所示。特征性pcr反应体系:50ng模板dna,2μl10×pcrbuffer(mg2+plus),0.4μldntp(10mm),10μm的引物gt28-f(或者gt28-r)和10μm的引物iva-2(或者ubi-2)各0.3μl,1utaqdnapolymerase,补ddh2o至20μl。pcr反应程序:94℃预变性5min,94℃变性30s,54℃退火30s,72℃延伸40s;重复32个循环;72℃终延伸8min。扩增产物在0.8%的琼脂糖凝胶上进行检测。
实施例7:纯合阳性转基因单株筛选
对转基因家系gt28的t1代株系分单株收种,将收获后的成熟种子在含有草甘膦的培养基上进行发芽试验。草甘膦培养基发芽试验具体操作步骤如下:将转基因家系gt28的t1代的成熟种子去壳,先用75%的乙醇浸泡消毒1min,然后将75%的乙醇倒掉,再用0.15%的升汞溶液消毒15min;最后将0.15%的升汞倒掉,用灭菌水洗5次。将消毒后的种子分别接种于草甘膦浓度为0和30mg/l的1/2ms培养基上(ms培养基参照:murashige和skoog,1962文献,为本领域常用培养基),2000lux光照培养(培养温度为26±1℃,培养时间为16小时光照/8小时暗培养)5天后统计发芽率。以理论值计算,若消毒的种子在含0mg/l草甘膦的条件下应具有100%的发芽活力,则在含草甘膦的1/2ms培养基上,阳性纯合转基因单株的发芽率为100%,杂合转基因单株的发芽率为75%左右,阴性纯合单株的发芽率为0%。 通过草甘膦培养基发芽试验挑选出gt28纯合阳性转基因单株。
实施例8:i.variabilis-mepsps基因在纯合阳性转基因株系中的表达
当gt28的纯合株系和野生型明恢86生长至苗期,用trizol试剂(购自北京全式金生物技术有限公司)提取rna,用蛋白抽提液(含20mmph8.0tis-hcl,137mmnacl,10%glycerol,1%tritonx-100,2mmedta和2×proteaseinhibitor)提取总蛋白。nouthernblot的分析方法参照roche公司的地高辛应用手册。i.variabilis-mepsps蛋白多克隆抗体通过在大肠杆菌e.colibl21(de3)中表达带有gst标签的i.variabilis-mepsps蛋白,利用glutathionesepharose4b(购自ge公司)纯化表达出的蛋白,将纯化的i.variabilis-mepsps蛋白免疫兔子得到。按照常用的westernblot的分析方法进行操作。根据northernblot结果,本发明的i.variabilis-mepsps基因在转基因家系gt28纯合阳性株系中可以正常转录;根据westernblot结果i.variabilis-mepsps基因在转基因家系gt28的纯合阳性株系中可以翻译成蛋白(见图6)。
实施例9:转基因家系gt28在田间对草甘膦抗性的检测
2015年夏季,在湖北省武汉市华中农业大学校园内的试验田中进行水稻转基因家系gt28对草甘膦抗性进行评价。首先在水稻的分蘖盛期,对gt28转基因纯合和阴性株系喷施840g/ha草甘膦(草甘膦使用浓度为840mg/l),喷施草甘膦20天后转基因纯合株系正常生长而转基因阴性株系全部死亡(见图7的右边)。另外对gt28转基因纯合株系在田间分别用5个不同剂量的草甘膦进行处理,5个剂量分别为0g/ha、840g/ha、1680g/ha、3360g/ha和8400g/ha(对应的草甘膦使用浓度分别为0mg/l、840mg/l、1680mg/l、3360mg/l和8400mg/l),每个处理重复3次。草甘膦处理过程如下:播种后10d,对处于三叶期的试验材料进行第一次草甘膦处理,处理14d后每个处理随机取20个水稻植株移栽到田间,移栽15d后进行第二次草甘膦处理。对试验材料的考查内容包括水稻成熟期的株高、有效穗数、穗长、每穗实粒数、结实率、千粒重、单株产量等。gt28农艺性状考查结果如表2所示,根据结果gt28t3代转基因纯合株系的主要农艺性状在各处理间不存在显著性差异。
表2不同剂量草甘膦处理下gt28转基因纯合株系的农艺性状
表1的说明:实验数据用lsd法分析,同一列数据后具有相同字母“a”或者“a”分别表示在p=0.05或者p=0.01水平上没有差异。
实施例10:gt28与不育系水稻品种(ⅱ-32a)的杂交及杂种ⅱ-32a×gt28的分子检测
将gt28转基因纯合株系播种于田间,10d后播种不育系水稻品种ⅱ-32a(华中农业大学作物遗传改良国家重点实验室提供),保证gt28和ⅱ-32a花期相遇。待ⅱ-32a抽穗开花后,授予gt28转基因纯合株系的花粉。待种子成熟后,收获杂种ⅱ-32a×gt28。将杂种ⅱ-32a×gt28播种到田间,在苗期提取基因组dna及总蛋白(按常规方法),进行southernblot和westernblot检测,具体步骤分别见实施例5和实施例8所述。结果如图8所示。本发明修饰的i.variabilis-mepsps基因可以通过有性杂交的方式由父本进入杂交后代,且在杂交后代中正常表达。
实施例11:杂种ⅱ-32a×gt28的草甘膦抗性检测
在苗期对非转基因杂种ⅱ-32a×mh86和转基因杂种ⅱ-32a×gt28喷施3360g/ha草甘膦(草甘膦使用浓度为3360mg/l),喷施7d后非转基因杂种ⅱ-32a×mh86全部死亡,转基因杂种ⅱ-32a×gt28正常生长(图9)。在田间对转基因杂种ⅱ-32a×gt28分别用4个不同剂量的草甘膦进行处理(4个剂量分别是0g/ha、840g/ha、3360g/ha和8400g/ha;对应的草甘膦使用浓度分别是0mg/l、840mg/l、3360mg/l和8400mg/l),每个处理重复3次。草甘膦处理过程如下:播种后10d,对处于三叶期的试验材料进行第一次草甘膦处理,处理14d后每个处理随机取20个水稻植株移栽到田间,移栽15d后进行第二次草甘膦处理。对试验材料的考查内容包括水稻成熟期的株高、有效穗数、穗长、每穗实粒数、结实率、千粒重、单株产量等。ⅱ-32a×gt28农艺性状考查结果如表3所示,根据结果ⅱ-32a×gt28的主要农艺性状在各处理间不存在显著性差异。
表3不同剂量草甘膦处理下ⅱ-32a×my28农艺性状
表2的说明:实验数据用lsd法分析,同一列数据后具有相同的字母“a”和“a”分别表示在p=0.05或者p=0.01水平上没有差异。
参考文献:
1.herrmannkm(1995)theshikimatepathway:earlystepsinthebiosynthesisofaromaticcompounds.plantcell7:907-919
2.murashigetandskoogf(1962)arevisedmediumforrapidgrowthandbio-assayswithtobaccotissuecultures.physiolplant15:473-497;
3.murrymg,thompsonwf(1980)rapidisolationofhighmolecularweightplantdna.nuleicacidsres8:4321-4325;
4.steinrückenhc,amrheinn(1980)theherbicideglyphosateisapotentinhibitorof5-enolpyruvylshikimicacid-3-phosphatesynthase.biochembiophysrescommun94:1207-1212;
5.yis,etal,(2015)characterizationofanewtypeofglyphosate-tolerant5-enolpyruvylshikimate-3-phosphatesynthasefromisoptericolavariabilis.jmolcatalb:enzym111:1-8。
- 还没有人留言评论。精彩留言会获得点赞!
- 5-烯醇丙酮莽草酸-3-磷酸合酶抗体的免疫原及其制备方法与应用的制作方法
- 一种便于使用的抗草甘膦转基因大豆pcr-elisa检测试剂盒的制作方法
- 一种快速检测抗草甘膦g2-epsps蛋白的金标试剂盒的制作方法
- 一种以基因优化方法获得的抗草甘膦基因及其表达载体的制作方法
- 一种双甘膦废水套用制备草甘膦中间体双甘膦的工艺的制作方法
- 草甘膦降解酶基因和含该基因的载体的制作方法
- 草甘膦抗性基因及含该基因的载体和转化子的制作方法
- 分离自土壤的高抗草甘膦epsp合酶及其编码序列的制备和用途的制作方法
- 一种抗草甘膦EPSP合成酶GmEPSPS-2及其编码基因与应用的制作方法
- 一种抗草甘膦EPSP合成酶GmEPSPS及其编码基因与应用的制作方法