一种能够表达ALV‑J囊膜蛋白的重组A亚群禽白血病病毒及其构建方法和用途与流程
本发明涉及一种重组病毒及其构建方法,特别涉及一种能够表达ALV-J囊膜蛋白的ALV-A重组病毒,还涉及该重组病毒的构建方法。本发明属于生物技术领域。
背景技术:
禽白血病病毒(Avian leukosis virus,ALV)能够引起的禽的多种肿瘤性疾病。ALV分为A-J共10个亚群。目前,在我国流行的主要为A、B、J亚群,其中,ALV-J对我国养禽业的危害更为严重。因而,对于ALV-J致病机制等的研究尤为重要。反转录病毒感染宿主细胞需要病毒表面囊膜蛋白与其特定的细胞受体的相互作用。病毒囊膜蛋白的不同决定了病毒的宿主范围。病毒受体介导病毒进入宿主细胞,是病毒感染过程的第一步。因而,禽白血病病毒受体的相关研究是解析禽白血病病毒感染机制的重要基础,建立合理的检测病毒进入的方法,对于研究反转录病毒与其受体的相互作用有很大帮助。
Ⅰ型Na+/H+交换蛋白(chNHE1)是ALV-J的受体(Ning,C.and B.Paul,Na+/H+exchanger type 1is a receptor for pathogenic subgroup J avian leukosis virus.Proceedings of the National Academy of Sciences,2006.103(14):p.5531-6.Dana,K.,et al.,Nonconserved tryptophan 38of the cell surface receptor for subgroup J avian leukosis virus discriminates sensitive from resistant avian species.Journal of Virology,2013.87(15):p.8399-8407.)。ALV-J的囊膜蛋白(envelop,env)通过与宿主细胞表面的受体chNHE1结合,引起跨膜区(TM)构象改变,介导病毒与细胞膜融合,从而使病毒核酸进入胞内(Barnard,R.J.O.,D.Elleder,.,and J.A.T.Young,Avian sarcoma and leukosis virus-receptor interactions:from classical genetics to novel insights into virus-cell membrane fusion.Virology,2006.344(1):p.25-29.)。受体介导病毒进入,对于病毒的感染有重要影响,因而对于受体与病毒相互作用的研究尤为重要。
作为逆转录病毒的一员,传统的ALV-J病毒复制能力差,病毒滴度较低,其感染早期病毒载量低,不利于其实验室研究。相对于ALV-J,ALV-A的病毒滴度相对较高,可弥补ALV-J病毒滴度不高的缺陷。ALV-A感染性克隆(pRAV-1)由本实验室所构建,其转染细胞后所拯救的病毒具有较高的复制能力,但只能用于ALV-A病毒的相关研究。为了解决传统ALV-J株复制能力差,病毒滴度低等问题,本发明以本实验室保存的ALV-A感染性克隆为骨架,将囊膜蛋白基因替换为ALV-J的囊膜蛋白基因,为了进一步提高病毒检测敏感性,在其囊膜蛋白基因后引入海参荧光素酶(luciferase)报告基因,构建带有luciferase报告基因的囊膜蛋白为ALV-J囊膜蛋白的重组ALV-A病毒。经验证,该重组病毒侵染宿主细胞后,能够表达ALV-J的囊膜蛋白和luciferase报告基因,具有较高的敏感性和较强的复制能力,易于早期微量病毒检测及定量,而且能够利用ALV-J特异性受体chNHE1感染非允许细胞系。本发明所构建的重组病毒,与传统的ALV-J株相比,具有复制能力强,病毒滴度高等优点,有利于探讨ALV-J致病机制等相关研究工作的开展,为病毒与其受体之间相互作用的研究以及抗ALV-J抗体检测奠定了基础。
技术实现要素:
本发明的目的之一是提供一种能够表达ALV-J囊膜蛋白的重组A亚群禽白血病病毒感染性克隆;
本发明的目的之二是提供由上述感染性克隆所拯救得到的重组病毒。
为了达到上述目的,本发明采用了以下技术手段:
本发明的一种能够表达ALV-J囊膜蛋白的重组A亚群禽白血病病毒感染性克隆,其是以ALV-A感染性克隆为骨架,将其囊膜蛋白替换为ALV-J的囊膜蛋白,并在囊膜蛋白3’端携带luciferase报告基因的重组A亚群禽白血病病毒感染性克隆,其中所述的ALV-A感染性克隆的核苷酸序列如SEQ ID NO.2所示。
在本发明中,优选的,所述的感染性克隆是通过以下方法构建得到的:
(1)将SEQ ID NO.2所示的ALV-A感染性克隆用KpnⅠ/StuⅠ进行双酶切,胶回收大片段,作为载体骨架片段;
(2)以ALV-J毒株pHPRS103为模板,使用引物PF1/PR1进行PCR扩增,得到包含部分pol基因及整个env基因的片段,将该PCR产物通过ClonExpressTM II One Step Cloning Kit同源重组于步骤(1)所得到的载体骨架之中,即构建得到表达ALV-J的囊膜蛋白的质粒命名为pALV-A(J),其中,ALV-J毒株pHPRS103的核苷酸序列如SEQ ID NO.1所示;
PF1引物TGATAAGGTTATTTGGGTACCTTCTCGGAAAGT
PR1引物GCTGCCCACAGGCCTCTACAGCTGCTCCCTAATTC
(3)用EagⅠ和SalⅠ对pALV-A(J)质粒进行双酶切,胶回收大片段;以ALV-A(J)质粒为模板,以PF2/PR2引物对扩增得到片段1;
PF2引物GCAGAATAGTATAAGCGGCCGCTACATGGGTGGTGGTA
PR2引物TTTTTGGCGTCTTCCATGGTGGTCGGCTGCAC
(4)以pGL3Luciferase报告质粒为模板,以PF3/PR3引物对扩增luciferase报告基因,并在其3’端引入SalⅠ酶切位点;
PF3引物ATGGAAGACGCCAAAAACATAAA
PR3引物CAGGTCGACTCTAGAGGATCCCCGCTTTACACGGCGATCTT
(5)将扩增得到luciferase报告基因片段与片段1通过重叠延伸PCR融合,与步骤(3)酶切后的大片段连接,得到携带luciferase报告基因的重组A亚群禽白血病病毒感染性克隆。
在本发明中,优选的,所述的一种能够表达ALV-J囊膜蛋白的重组A亚群禽白血病病毒感染性克隆,命名为pALV-A(J)-luciferase,其核苷酸序列如SEQ ID NO.3所示。
进一步的,本发明还提供了以上任一项所述的病毒感染性克隆在拯救表达ALV-J囊膜蛋白和luciferase的重组A亚群禽白血病病毒中的应用。
一种拯救表达ALV-J囊膜蛋白和luciferase的重组A亚群禽白血病病毒的方法,其包括以下步骤:将以上构建的病毒感染性克隆转染于形成80%单层的DF-1细胞中,6h后弃掉上清,用无血清的DMEM清洗两遍后,加入含10%胎牛血清的DMEM,置于37℃,5%CO2条件下培养,转染72h后,收获细胞,即得。
在本发明所述的方法中,优选的,还包括将收获的细胞冻存至-80℃冰箱中,冻融两次后在DF-1细胞上进行连续传代,以获得表达ALV-J囊膜蛋白和luciferase的重组A亚群禽白血病病毒的传代毒。
更进一步的,本发明还提出了按照以上所述的制备得到的表达ALV-J囊膜蛋白和luciferase的重组A亚群禽白血病病毒。以及
所述的表达ALV-J囊膜蛋白和luciferase的重组A亚群禽白血病病毒在研究ALV-J致病机制以及检测抗ALV-J抗体中的用途。
综上,本发明以ALV-A感染性克隆为骨架,构建了囊膜蛋白替换为ALV-J的囊膜蛋白,并携带luciferase报告基因的重组病毒感染性克隆,并成功拯救出ALV-A(J)-luciferase重组病毒。经验证,该重组病毒具有较高的复制能力,病毒滴度达到105.21TCID50/ml,是ALV-J原型毒株HPRS103的125倍,且能够与ALV-J特异性的细胞受体相互作用,由于携带有luciferase报告基因,病毒检测比传统ELISA方法更加简便和敏感,易于定量。该重组病毒侵染表达chNHE1的293T细胞,最早在感染后8h即可检测到病毒,具有较高的敏感性。
由本发明构建的病毒感染性克隆拯救得到的pALV-A(J)-luciferase病毒,具有病毒滴度高,复制能力强,检测敏感性高的优点,能够有效地检测病毒早期感染过程,对于病毒与其受体的相关研究以及抗ALV-J抗体检测有重要作用。
附图说明
图1为pALV-A(J)-luciferase重组病毒构建策略示意图;
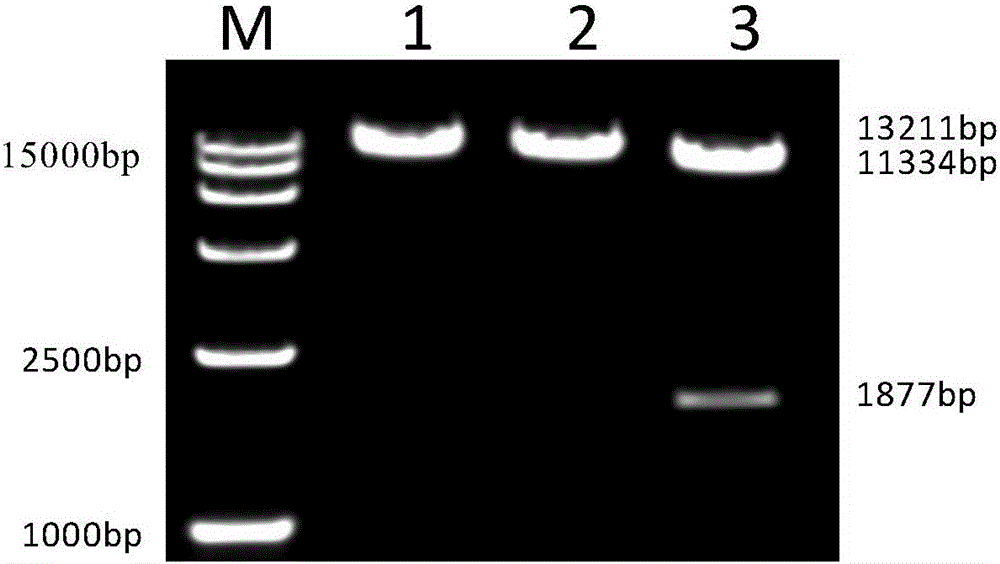
图2为pALV-A(J)-luciferase质粒酶切鉴定;
1为EagⅠ单酶切的结果;2为SalⅠ单酶切的结果;3为EagⅠ/SalⅠ双酶切的结果;
图3为重组病毒的Western Blot验证;
图4为重组病毒活性鉴定(A)及其与ALV-J病毒滴度比较(B);
图5为重组病毒对ALV-J受体chNHE1的识别。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
本实施例所涉及的主要材料及其来源:
ALV-J毒株pHPRS103(核苷酸序列如SEQ ID NO.1所示)及含有ALV-A毒株感染性克隆的载体pRAV-1(核苷酸序列如SEQ ID NO.2所示)及pGL3Luciferase报告质粒为本实验室保存;DF-1细胞及pCAGGS-chNHE1质粒由本实验室保存;Polyjet转染试剂购自SignaGen Laboratories公司;Luciferase Assay System购自Promega公司;ClonExpressTM II One Step Cloning Kit购自Vazyme公司;PCR纯化试剂盒,胶回收试剂盒购自AXYGEN;感受态DH5α细胞购自天根生化科技有限公司;质粒提取试剂盒购自QIAGEN;RT-PCR试剂盒及DNA Marker购自TaKaRa公司;蛋白Marker及Pierce IP裂解缓冲液均购自Thermo scientific公司;限制性内切酶及T4DNA连接酶购自NEB公司;ALV-J gp85单克隆抗体(MAb)4A3由本实验室制备(Li,X.,et al.,Identification of a novel B-cell epitope specific for avian leukosis virus subgroup J gp85protein.Archives of Virology,2015.160(4):p.995-1004.);山羊抗小鼠IRDye800CW红外标记的IgG购自LI-COR Bioscience公司。
实施例1表达ALV-J囊膜蛋白和luciferase的重组ALV-A病毒感染性克隆ALV-A(J)-luciferase的构建
1、ALV-A(J)-luciferase重组质粒的构建:
将含有ALV-A毒株感染性克隆的pRAV-1载体(核苷酸序列如SEQ ID NO.2所示)经KpnⅠ/StuⅠ进行双酶切,胶回收大小约为11 000bp的载体骨架片段。以pHPRS103(核苷酸序列如SEQ ID NO.1所示)为模板,按表1中的引物PF1/PR1,PCR扩增大小约1 700bp的目的片段(包含部分pol基因及整个env基因片段)。将该PCR产物通过ClonExpressTM II One Step Cloning Kit同源重组于载体骨架之中,构建得到表达ALV-J的囊膜蛋白的质粒命名为pALV-A(J)。随后,用EagⅠ和SalⅠ对pALV-A(J)质粒进行双酶切,胶回收大小约为11 000bp的条带。以pALV-A(J)质粒为模板,以PF2/PR2引物对扩增EagⅠ位点至其下游约200bp的片段1;以pGL3Luciferase报告质粒为模板,以PF3/PR3引物对扩增luciferase报告基因,并在其3’端引入SalⅠ酶切位点。胶回收后通过重叠延伸PCR将片段1和luciferase报告基因融合成为能够与载体骨架两端重合的Luciferase片段。将Luciferase片段连接至骨架载体后得到携带luciferase报告基因表达ALV-J囊膜蛋白的重组ALV-A病毒的感染性克隆,重组病毒构建策略示意图如图1所示。
表1.本实施例所用引物
2、ALV-A(J)-luciferase重组质粒的鉴定:
将构建得到的携带luciferase报告基因表达ALV-J囊膜蛋白的重组ALV-A病毒的感染性克隆经SalⅠ单酶切,EagⅠ&SalⅠ双酶切,进行重组质粒的鉴定。鉴定结果表明,用EagⅠ和SalⅠ分别单酶切后可获得长度为13 211bp的片段,用EagⅠ和SalⅠ双酶切后可获得长度为11 334bp和1 877bp的两条片段,大小正确,结果如图2所示。酶切正确的质粒经测序后,序列正确,表明重组质粒构建正确。将测序正确的质粒命名为pALV-A(J)-luciferase,其核苷酸序列如SEQ ID NO.3所示。
实施例2表达ALV-J囊膜蛋白和luciferase的重组A亚群禽白血病病毒的拯救
1、方法
1.1重组病毒的拯救
将实施例1构建的病毒感染性克隆pALV-A(J)-luciferase进行纯化,利用Polyjet转染试剂按照使用手册转染于形成80%单层的DF-1细胞中,6h后弃掉上清,用无血清的DMEM清洗两遍后,加入含10%胎牛血清的DMEM,置于37℃,5%CO2条件下培养。转染后72h,收取细胞,冻存至-80℃冰箱中,冻融两次后在DF-1细胞上连续传代。
1.2拯救病毒的western blot鉴定
取所拯救的传代两次的ALV-A(J)-luciferase病毒,进行SDS-PAGE电泳,转印至硝酸纤维素膜,以5%脱脂乳封闭,以抗ALV-J的4A3MAb(1:200)为一抗,山羊抗小鼠IRDye800CW红外标记的IgG为二抗,通过近红外荧光扫描成像系统进行重组病毒的western blot。
1.3荧光素酶试验检测病毒感染能力
将拯救的ALV-A(J)-luciferase病毒接种于形成80%单层的DF-1细胞中,4h后弃掉上清,用无血清的DMEM清洗两遍后,加入含10%胎牛血清的DMEM,然后在37℃,5%CO2条件下继续培养24h后,收集感染细胞,4 000r/min离心2min,弃上清。用50μL PBS悬浮细胞后,转移至白色96孔检测板的孔中,加入50μLLuciferase Assay反应液,混匀后室温反应10min后,使用仪器检测荧光强度。同时以DF-1空白细胞作为阴性对照。
1.4重组病毒TCID50测定
将拯救的重组病毒按10-1~10-7进行10倍比稀释,每个稀释度做3次重复,分别接种于形成80%单层的DF-1细胞上,进行效价检测。同时设未接毒对照孔。7d后,将细胞收至-80℃冰箱中,反复冻融两次后,采用ELISA方法检测ALV的p27蛋白,按Reed-Muech氏法计算TCID50。同时,进行ALV-J株HPRS103TCID50的检测,以作对照。
1.5重组病毒对ALV-J受体chNHE1的识别
使用Polyjet试剂转染ALV-J受体chNHE1真核表达质粒至形成80%密度的293T细胞中,转染后24h进行ALV-A(J)-luciferase病毒感染,分别于感染后8h、16h和24h收取细胞,按照Luciferase Assay System的操作说明书检测荧光强度,进行统计分析。同时设293T未转染组接毒对照。
1.6重组病毒在检测抗ALV-J中和抗体中的应用
利用pALV-A(J)-luciferase重组病毒的感染可以通过直接检测luciferase荧光强度来定量的优势,本发明应用拯救的pALV-A(J)-luciferase重组病毒进行中和抗体检测试验。使用了临床采集血清92份、动物实验的ALV-J血清58份和SPF鸡阴性血清15份以及抗ALV-A,ALV-B,REV和MDV血清各3份。所有的血清在使用pALV-A(J)-luciferase重组病毒检测中和抗体的同时,也使用HPRS-103来进行传统病毒微量中和试验作为对照。具体操作步骤参考(Fadly,A.M.Leukosis and sarcoma.In:A laboratory manual for the isolation and identification of avian pathogens,3rd ed.S.B.Hitchner,C.H.Domermuth,H.G.Purchase,andJ.E.Williams,eds.American Associationo f AvianP athologists,K ennettS quare,Pa.pp.54-58.1989.)进行。在luciferase重组病毒试验中,荧光检测值低于1000(表明病毒阴性)即可判定血清中ALV-J中和抗体为阳性。传统病毒微量中和试验中,禽白血病病毒群特异性抗原ELISA检测阴性即可判定血清中ALV-J中和抗体为阳性。
2.结果
2.1重组病毒的拯救与鉴定
将拯救的pALV-A(J)-luciferase重组病毒处理后,进行SDS-PAGE凝胶电泳及western Blot。所用的一抗为本实验室所制备的特异性针对ALV-J的单克隆抗体4A3。重组病毒的Western Blot结果如图3所示,结果证明,所拯救的pALV-A(J)-luciferase重组病毒能很好的表达ALV-J囊膜蛋白。
2.2重组病毒滴度测定
用所获取的pALV-A(J)-luciferase病毒感染易感细胞DF-1,24h后检测荧光强度。重组病毒活性鉴定(A)及其与ALV-J病毒滴度比较(B)如图4所示,结果发现,感染组荧光强度约为空白细胞的1000倍,表明所拯救的重组病毒具有高效的感染能力。将病毒进行10倍比稀释后,感染DF-1细胞。7天后收毒,用ELISA方法检测ALV。按Reed-Muech氏法计算结果表明,所拯救的重组病毒滴度为105.21TCID50/mL。同时测得ALV-J HPRS103毒株的TCID50为103.11TCID50/ml。
2.3重组病毒对ALV-J受体chNHE1的识别
为了验证所拯救的pALV-A(J)-luciferase重组病毒具有正常ALV-J病毒结合病毒受体的能力,利用拯救的pALV-A(J)-luciferase重组病毒感染表达chNHE1的293T细胞。分别于接毒后8h、16h和24h收获细胞,检测荧光强度。重组病毒对ALV-J受体chNHE1的识别结果如图5所示。结果发现,转染chNHE1受体组接毒后的荧光强度是未转染组的3-10倍。证明所拯救的pALV-A(J)-luciferase重组病毒能够有效侵染表达chNHE1的293T细胞。
2.4pALV-A(J)-luciferase重组病毒在检测抗ALV-J中和抗体中的应用
pALV-A(J)-luciferase重组病毒和传统病毒微量中和试验检测ALV-A、ALV-B、REV和MDV血清以及15份SPF鸡血清均为阴性,特异性好。对92份临床血清检测结果表明,pALV-A(J)-luciferase重组病毒组中和抗体阳性28份,传统病毒微量中和试验组阳性为24份。对58份ALV-J感染动物实验血清检测结果表明,pALV-A(J)-luciferase重组病毒组中和抗体阳性28份,传统病毒微量中和试验组阳性为26份。两种方法的符合率为96%(见表2)。临床血清和动物实验血清检测结果表明,利用pALV-A(J)-luciferase重组病毒进行的中和试验方法敏感性高于传统方法。
表2pALV-A(J)-luciferase重组病毒和传统病毒微量中和试验检测结果
- 还没有人留言评论。精彩留言会获得点赞!