一种BRCA2基因突变体及其应用的制作方法
本发明涉及brca2基因突变体及其应用。具体地,本发明涉及分离编码brca2突变体的核酸,分离的多肽,以及检测brca2基因突变体的方法、系统和试剂盒。
背景技术:
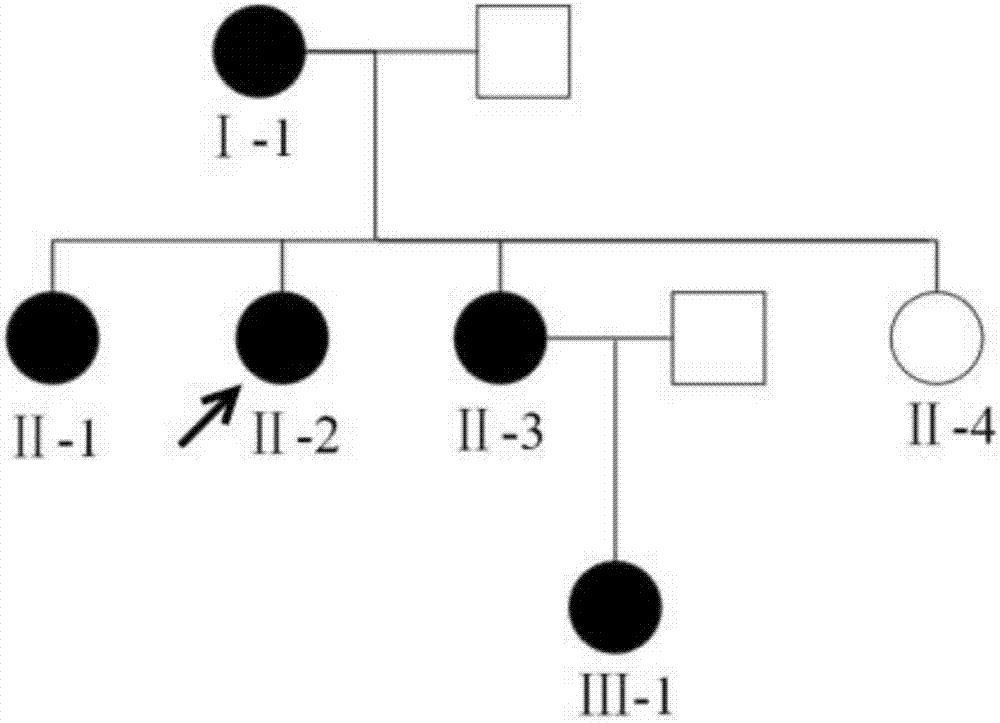
:近年来我国癌症的发病率和死亡率不断攀升,恶性肿瘤已成为我国重大的公共卫生问题。据我国肿瘤登记中心2016年发布的结果显示,2012年我国肿瘤新发病例数358.6万例,死亡例数218.7万例,粗发病率265/10万,死亡率161.5/10万。在恶性肿瘤发病现状中,乳腺癌在女性恶性肿瘤中处于第一位,每年新发约27.3万,且发病年龄不断呈现年轻化趋势,是严重威胁女性生命的第一杀手。乳腺癌是具有很强遗传背景的恶性肿瘤,现有研究显示,5-10%的乳腺癌是由遗传因素导致。目前brca1,brca2,tp53,palb2,pten,chek2,atm以及rad50等基因被认定为乳腺癌易感基因,其中brca1和brca2基因为遗传性乳腺癌的主要易感基因。研究表明,携带有brca1和brca2基因致病突变的人群在70岁之前发生乳腺癌的概率分别可达40–80%和20–85%。同时,已被诊断为遗传性乳腺癌或卵巢癌的患者,发生复发转移的可能性也高于普通人群。brca1和brca2属于抑癌基因,均呈常染色体显性遗传,且突变容易引发早年发病。brca2基因位于人类染色体13ql2,包含27个外显子,编码brca2蛋白含3418个氨基酸,对细胞生长的调节有重要作用。brca2基因发生突变后表达的蛋白质失去了修复dna损伤的功能,导致染色体不稳定,促进肿瘤发生。男性brca2突变携带者终生患前列腺癌,乳腺癌,胰腺癌的概率分别为20%,6%和3%。而女性brca2突变携带者终生患乳腺癌为26%–84%,卵巢癌的概率为20%。brca2基因突变相关的肿瘤往往会表达er(雌激素受体)与pr(孕激素受体),与散发性乳腺癌表现出相似的特征。现已经报道的brca2突变种类数量多于1800,变异范围达整个基因的编码区。主要发生的突变为移码突变,也会发生大量的错义突变,但错义突变大多属于意义未明变异。因此发现brca2新的致病突变,对开展遗传性乳腺癌的分子诊断具有重要意义。区域捕获测序是利用特制的dna序列探针将全基因组中的特定区域捕获下来,然后针对每个区域进行深度测序的技术,与传统的连锁分析、候选基因关联分析技术相比,区域捕获测序技术针对基因组内特定目标区域,目标集中,测序深度和精度更高。随着区域捕获测序等二代测序技术的广泛应用,一批新的致病突变基因和新的致病位点被相继发现,极大地推动了相关疾病及其防治措施的研究进程。技术实现要素:本发明旨在提供一种与遗传性乳腺癌相关的brca2基因突变体及其在制备检测生物样品是否含有brca2基因突变体的试剂盒方面的应用,同时还提供了一种检测brca2基因突变的方法与系统。本发明采用区域捕获测序技术,针对一个常染色体显性遗传的遗传性乳腺癌家系进行了特定区域的高通量测序,结合生物信息分析发现brca2基因上的c.3467delc(p.s1156fs)突变与遗传性乳腺癌有关,并通过共分离实验等方法验证了这一变异,将会为遗传性乳腺癌发病机制的研究奠定重要基础,也有可能为遗传性乳腺癌患者治疗提供全新的理论依据,丰富和完善遗传性乳腺癌疾病的诊断流程,从而对遗传性乳腺癌患者的临床诊断提供更多的支持和参考,为开发有效的致病基因筛查和干预治疗措施提供科学依据。根据本发明的第一方面,本发明提供了一种分离的brca2突变体的核酸。根据本发明的实施例,所述核酸具有如seqidno:3所示的序列,与seqidno:1相比,具有c.3467delc突变,即相对于野生型brca2基因,本发明的brca2基因突变体的cdna第3467位剪切位点缺失了碱基c,发生了移码突变。根据本发明的第二方面,本发明提供了所述突变体核酸在制备用于检测生物样本是否存在brca2基因突变的试剂盒中的应用。所述的试剂盒还含有适于检测brca2基因突变的试剂,任选地,所述试剂为该核酸探针或引物。任选地,所述核酸探针或引物具有如seqidno:5-6所示的核苷酸序列。根据本发明的第三方面,本发明提供了一种分离的多肽。根据本发明的实施例,所述分离的多肽具有如seqidno:4所示的氨基酸序列,与seqidno:2相比,具有p.s1156fs突变。本发明进一步提供了所述编码brca2突变体多肽在制备用于检测生物样品是否存在brca2基因突变的试剂盒中的应用。根据本发明的第四方面,本发明提出了一种检测与遗传性乳腺癌相关的brca2基因突变位点的方法,包括以下步骤:从所述生物样品提取核酸样本;确定所述核酸样本的核酸序列;所述核酸样本的核酸序列与seqidno:1相比,具有c.3467delc突变是所述生物样品易患遗传性乳腺癌的标记。通过将所述核酸样本的核酸序列与seqidno:1进行比对,检测是否具有c.3467delc突变,任选地,所述生物样本为选自人体血液、皮肤、皮下组织的至少一种,任选地,所述核酸样本为选自外显子组dna、全基因组dna的至少一种。从所述生物样品提取核酸样本进一步包括:从所述生物样品提取rna样本,优选所述rna样本为mrna;以及基于所述rna样本,通过逆转录反应,获得cdna样本,所述cdna样本构成所述核酸样本。确定所述核酸样本的核酸序列进一步包括:针对所述核酸样本,构建核酸测序文库;以及对所述核酸测序文库进行测序,以便获得由多个测序数据构成的测序结果,任选地,采用选自completegenomics、hiseq2000、solid、454和单分子测序装置的至少一种对所述核酸测序文库进行测序,任选地,针对所述核酸样本,构建核酸测序文库进一步包括:利用brca2基因外显子特异性引物对,对所述核酸样本进行pcr扩增;以及针对所得到的扩增产物,构建所述核酸测序文库,任选地,所述特异性引物具有如seqidno:5-6所示的核苷酸序列。根据本发明的第五方面,本发明提供了一种检测brca2基因突变位点的系统,其特征在于,包括:核酸提取装置,所述核酸提取装置用于从所述生物样品提取核酸样本;核酸序列确定装置,所述核酸序列确定装置与所述核酸提取装置相连,用于对所述核酸样本进行分析,以便确定所述核酸样本的核酸序列;判断装置,所述判断装置与所述核酸序列确定装置相连,判断所述核酸样本的核酸序列与seqidno:1相比,是否具有c.3467delc突变,任选地,所述核酸提取装置进一步包括:rna提取单元,所述rna提取单元用于从所述生物样品提取rna样本;以及逆转录单元,所述逆转录单元与所述rna提取单元相连,用于对所述rna样本进行逆转录反映,以便获得cdna样本,所述cdna样本构成所述核酸样本。所述核酸序列确定装置进一步包括:文库构建单元,所述文库构建单元用于针对所述核酸样本,构建核酸测序文库;以及测序单元,所述测序单元与所述文库构建单元相连,用于对所述核酸测序文库进行测序,以便获得由多个测序数据构成的测序结果,任选地,所述文库构建单元进一步包括:pcr扩增模块,所述pcr扩增模块中设置有brca2基因外显子特异性引物,以便利用所述特异性引物,对所述核酸样本进行pcr扩增,任选地,所述特异性引物具有如seqidno:5-6所示的核苷酸序列,任选地,所述测序单元包括选自completegenomics、hiseq2000、solid、454和单分子测序装置的至少一种。本发明的brca2基因中的突变位点,可以用于遗传性乳腺癌的检测和诊断。本发明发现了遗传性乳腺癌相关基因的突变,对这些基因突变的检测可能用于遗传性乳腺癌患者的辅助诊断,并且可能有利于明确遗传性乳腺癌患者的分子诊断。因此,本发明的检测突变brca2基因(蛋白)的方法可以用于诊断遗传性乳腺癌的目的,例如高危人群筛查,患者筛查,用药指导风险评估。然而,本发明的方法并不仅限于用于诊断疾病的目的。因此,本研究丰富了brca2基因的致病突变谱,对开展遗传性乳腺癌的分子诊断与高危人群筛查具有重要意义。本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。附图说明:1.图1.显示了根据本发明一个实施例ⅱ-2号先证者sanger测序峰图,箭头位置为突变所在/起始位点。2.图2.显示了根据本发明一个实施例的遗传性乳腺癌家系。空白圆形:表型正常女性;空白方形:表型正常男性;实心圆形:表示女性乳腺癌患者;箭头所指为家系内先证者。3.图3.ⅰ-1号sanger测序峰图,箭头位置为突变所在/起始位点。4.图4.ⅱ-1号sanger测序峰图,箭头位置为突变所在/起始位点。5.图5.ⅱ-3号sanger测序峰图,箭头位置为突变所在/起始位点。6.图6.ⅱ-4号sanger测序峰图,箭头位置为突变所在/起始位点。7.图7.ⅲ-1号sanger测序峰图,箭头位置为突变所在/起始位点。具体实施方式本发明旨在提供一种与遗传性乳腺癌相关的brca2基因突变体及其在制备检测生物样品是否含有brca2基因突变体的试剂盒方面的应用,同时还提供了一种检测brca2基因突变的方法与系统。本发明采用区域捕获测序技术,针对一个常染色体显性遗传的遗传性乳腺癌家系进行了特定区域的高通量测序,结合生物信息分析发现brca2基因上的c.3467delc(p.s1156fs)突变与遗传性乳腺癌有关,并通过共分离实验等方法验证了这一变异,将会为遗传性乳腺癌发病机制的研究奠定重要基础,也有可能为遗传性乳腺癌患者治疗提供全新的理论依据,丰富和完善遗传性乳腺癌疾病的诊断流程,从而对遗传性乳腺癌患者的临床诊断提供更多的支持和参考,为开发有效的致病基因筛查和干预治疗措施提供科学依据。根据本发明的第一方面,本发明提供了一种分离的brca2突变体的核酸。根据本发明的实施例,所述核酸具有如seqidno:3所示的序列,与seqidno:1相比,具有c.3467delc突变,即相对于野生型brca2基因,本发明的brca2基因突变体的cdna第3467位剪切位点缺失了碱基c,发生了移码突变。根据本发明的第二方面,本发明提供了所述突变体核酸在制备用于检测生物样本是否存在brca2基因突变的试剂盒中的应用。所述的试剂盒还含有适于检测brca2基因突变的试剂,任选地,所述试剂为该核酸探针或引物。任选地,所述核酸探针或引物具有如seqidno:5-6所示的核苷酸序列。根据本发明的第三方面,本发明提供了一种分离的多肽。根据本发明的实施例,所述分离的多肽具有如seqidno:4所示的氨基酸序列,与seqidno:2相比,具有p.s1156fs突变。本发明进一步提供了所述编码brca2突变体多肽在制备用于检测生物样品是否存在brca2基因突变的试剂盒中的应用。根据本发明的第四方面,本发明提出了一种检测与遗传性乳腺癌相关的brca2基因突变位点的方法,包括以下步骤:从所述生物样品提取核酸样本;确定所述核酸样本的核酸序列;所述核酸样本的核酸序列与seqidno:1相比,具有c.3467delc突变是所述生物样品易患遗传性乳腺癌的标记。通过将所述核酸样本的核酸序列与seqidno:1进行比对,检测是否具有c.3467delc突变,任选地,所述生物样本为选自人体血液、皮肤、皮下组织的至少一种,任选地,所述核酸样本为选自外显子组dna、全基因组dna的至少一种。从所述生物样品提取核酸样本进一步包括:从所述生物样品提取rna样本,优选所述rna样本为mrna;以及基于所述rna样本,通过逆转录反应,获得cdna样本,所述cdna样本构成所述核酸样本。确定所述核酸样本的核酸序列进一步包括:针对所述核酸样本,构建核酸测序文库;以及对所述核酸测序文库进行测序,以便获得由多个测序数据构成的测序结果,任选地,采用选自completegenomics、hiseq2000、solid、454和单分子测序装置的至少一种对所述核酸测序文库进行测序,任选地,针对所述核酸样本,构建核酸测序文库进一步包括:利用brca2基因外显子特异性引物对,对所述核酸样本进行pcr扩增;以及针对所得到的扩增产物,构建所述核酸测序文库,任选地,所述特异性引物具有如seqidno:5-6所示的核苷酸序列。根据本发明的第五方面,本发明提供了一种检测与遗传性乳腺癌相关的brca2基因突变位点的系统,其特征在于,包括:核酸提取装置,所述核酸提取装置用于从所述生物样品提取核酸样本;核酸序列确定装置,所述核酸序列确定装置与所述核酸提取装置相连,用于对所述核酸样本进行分析,以便确定所述核酸样本的核酸序列;判断装置,所述判断装置与所述核酸序列确定装置相连,判断所述核酸样本的核酸序列与seqidno:1相比,是否具有c.3467delc突变,任选地,所述核酸提取装置进一步包括:rna提取单元,所述rna提取单元用于从所述生物样品提取rna样本;以及逆转录单元,所述逆转录单元与所述rna提取单元相连,用于对所述rna样本进行逆转录反映,以便获得cdna样本,所述cdna样本构成所述核酸样本。所述核酸序列确定装置进一步包括:文库构建单元,所述文库构建单元用于针对所述核酸样本,构建核酸测序文库;以及测序单元,所述测序单元与所述文库构建单元相连,用于对所述核酸测序文库进行测序,以便获得由多个测序数据构成的测序结果,任选地,所述文库构建单元进一步包括:pcr扩增模块,所述pcr扩增模块中设置有brca2基因外显子特异性引物,以便利用所述特异性引物,对所述核酸样本进行pcr扩增,任选地,所述特异性引物具有如seqidno:5-6所示的核苷酸序列,任选地,所述测序单元包括选自completegenomics、hiseq2000、solid、454和单分子测序装置的至少一种。本发明的brca2基因中的突变位点,可以用于遗传性乳腺癌的检测和诊断。本发明发现了遗传性乳腺癌相关基因的突变,对这些基因突变的检测可能用于遗传性乳腺癌患者的辅助诊断,并且可能有利于明确遗传性乳腺癌患者的分子诊断。因此,本发明的检测突变brca2基因(蛋白)的方法可以用于诊断遗传性乳腺癌的目的,例如高危人群筛查,患者筛查,用药指导风险评估。然而,本发明的方法并不仅限于用于诊断疾病的目的。因此,本研究丰富了brca2基因的致病突变谱,对开展遗传性乳腺癌的分子诊断与高危人群筛查具有重要意义。下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。实施例1确定遗传性乳腺癌brca2基因突变1.实验材料样本信息:一个遗传性乳腺癌家系,包括一名先证者和5名家属,具体信息见表2主要仪器信息:移液器,pcr仪,离心机,涡旋振荡器,电泳仪,dna打断仪,磁力架,干式恒温金属浴,completegenomics测序仪主要试剂:qiagen血液dna提取试剂盒,completegenomics平台建库试剂,人基因组(hg19)内目标区域约为600kb的液相探针(罗氏公司,nimblegenez芯片)2.样本采集如图2所示,遗传性乳腺癌家系包含6个成员,其中乳腺癌患者4名。在家系中选取1位乳腺癌患者作为先证者,区域捕获测序样本,该乳腺癌患者的基本情况如表1所示,采集先证者外周血样品5ml,加入edta抗凝,-80摄氏度保存。后又收集家系内3位患者和2位正常对照个体作为二次验证样本,基本情况如表2所示,每位采集外周血样品5ml,加入edta抗凝,-80摄氏度保存。表1.遗传性乳腺癌家系区域捕获测序样本基本情况表编号性别患病年龄患病情况ⅱ-2女54乳腺癌表2.遗传性乳腺癌家系验证样本基本情况表编号性别患病年龄患病情况ⅰ-1女未知乳腺癌ⅱ-1女62乳腺癌ⅱ-3女56乳腺癌ⅱ-4女未知表型正常ⅲ-1女未知表型正常3实验技术流程(1)dna提取使用qiagendnabloodminikit,并按照该试剂盒的提取说明书,从乳腺癌患者血液样本中提取基因组dna,使用检测dna浓度,原则上每份样本的dna获得量≥2μg,然后电泳检测dna是否完整和其降解程度。(2)测序前的文库构建参考completegenomics外显子组测序文库构建流程,具体步骤为:1)基因组dna打断,随机打断成220-400小片段,然后进行纯化和末端修复;2)加a接头,并进行pcr扩增;3)通过碱基互补配对的原理,使用探针对与其配对的基因组目标区域的dna进行杂交,捕获到目标区域的dna,通过特殊的试剂将目标dna从探针上洗脱下来;4)pcr扩增,对dna进行双链环化;5)在接头两端26bp处酶切;6)末端修复,添加b接头;7)分离dna双链成单链,对单链进行环化;8)单链环化分子滚环复制,形成dna纳米球dnb。(3)completegenomics高通量测序对质控合格后的文库dna,按照completegenomics测序的操作说明进行上机测序。获得的每个样本的测序原始数据量达到0.6gb以上,目标区域的平均测序深度达到400×,目标区域覆盖度为99%以上。(4)测序数据处理及生物信息分析根据测序平台的数据处理说明及实际需求,对下机所得数据进行初步处理及进行信息分析。首先进行序列比对,将测序得到的序列用teramap软件比对到人的参考基因组上,同时不允许有插入和缺失;然后鉴定可能与参考基因组不一样的区域,将有可能比对到这些区域的序列拿出来进行局部组装,将组装得到的序列与参考基因组比较,确定各种类型的变异;进而,使用varscorevaf和varscoreeaf对检测到的突变进行打分;最后,过滤掉低质量(vqlow),低深度(alt_depth<2/allreads<5)和低频率(maf<0.25)的突变,得到的最后的突变位点信息。(5)对乳腺癌易感基因的突变数据进行解读,找出致病突变经过生物信息分析获得的snp和indel突变数据列表需要对其进行进一步的解读、筛选,解读步骤如下:首先,将所有乳腺癌易感基因的snp和indel突变数据筛选出来,其次,将乳腺癌易感基因的外显子区域和外显子和内含子连接区域的剪接突变,无义突变以及移码突变筛选出来;然后,在bic(breastcancerinformationcore)数据库,hgmd(thehumangenemutationdatabase)数据库以及相关研究文献中对筛选出来的突变位点进行搜索,明确突变位点是否为已知的突变,如果在现有数据库或研究文献中没有搜索到相应的报道,则说明该突变为新突变。4.实验结果展示通过对样本ⅱ-2的测序数据进行分析、数据库对比及解读,发现先证者存在乳腺癌相关易感基因的突变位点,同时发现这些突变位点目前均未在研究文献、bic等数据库报道过,故判定为新的突变位点。该样本中通过分析解读后的突变位点如表3所示:表3.先证者ⅱ-2血液dna样本中测序所得的突变位点信息以下是对发现的新发现的遗传性乳腺癌突变位点的详细描述:(1)brca2基因编码区的野生型序列和突变型序列如seqidno:1和seqidno:3所示,brca2基因编码的多肽野生型和突变型序列如seqidno:2和seqidno:4所示。通过序列比对可以发现:野生型的brca2基因共编码3418个氨基酸。ⅱ-2号先证者样本的乳腺癌易感基因突变发生在brca2基因编码区上,具体突变位点是在第3467核苷酸。测序数据显示其在第3467位核苷酸碱基c缺失,发生移码突变,最终导致只能编码1166个氨基酸。实施例2使用金标准(sanger测序)对致病突变位点进行验证为了验证该发明的技术准确性,对该突变位点所在的区域设计pcr引物,引物序列见表4。常规pcr扩增后进行sanger测序,分析目标位点的峰图情况。表4.brca2基因c.3467delc突变位点pcr引物序列pcr反应体系:40μlpcr反应条件验证结果显示高通量测序cg测序平台分析结果与sanger测序结果一致,sanger测序所得峰图如图1所示。实施例3对突变携带者的相关家属进行突变验证和家族史分析使用pcr联合sanger测序法,对携带有乳腺癌易感基因突变的先证者的家属进行相应突变位点的验证,明确突变位点是否与疾病产生共分离,家系图如图2所示。验证流程如下:(1)dna提取使用qiagendnabloodminikit,并按照该试剂盒的提取说明书,从乳腺癌患者血液样本中提取基因组dna,使用检测dna浓度,原则上每份样本的dna获得量≥2μg,然后电泳检测dna是否完整和其降解程度。对该突变位点所在的区域设计pcr引物,常规pcr扩增后进行sanger测序,分析目标位点的峰图情况。sanger测序所得峰图如下所示(箭头标记为突变所在/起始位点)。从峰图可以看出位点突变在患者中杂合缺失一个碱基,一半序列为野生型,一半序列有一个碱基的错位,因此出现套峰的情况。验证结果显示高通量测序分析结果与sanger测序结果一致,ⅰ-1号样本sanger测序峰图:brca2基因:c.3467delc突变型,如图3所示;ⅱ-1号样本sanger测序峰图:brca2基因:c.3467delc突变型,如图4所示;ⅱ-3号样本sanger测序峰图:brca2基因:c.3467delc突变型,如图5所示;ⅱ-4号样本sanger测序峰图:brca2基因:c.3467delc野生型,如图6所示;ⅲ-1号样本sanger测序峰图:brca2基因:c.3467delc突变型,如图7所示。表5.遗传性乳腺癌家系家属sanger验证结果表编号突变信息患病情况ⅰ-1brca2:c.3467delc患病ⅱ-1brca2:c.3467delc患病ⅱ-3brca2:c.3467delc患病ⅱ-4negative正常ⅲ-1brca2:c.3467delc正常参与验证的家属包括该先证者主要的女性家族成员。如表5所示,验证结果表明,家族中乳腺癌患者均携带和先证者相同的突变位点,而没有携带相应的突变位点的家属没有患乳腺癌,符合疾病共分离的规律。以上结果表明,发明人所发现的brca2基因乳腺癌易感基因突变位点会导致乳腺癌发生风险升高,是遗传性乳腺癌的致病突变。实施例4检测试剂盒制备检测试剂盒,其包含能够检测brca2基因的c.3467delc基因突变的引物,用于检测生物样品是否含有c.3467delc突变体,其中这些引物为brca2基因外显子的特异性引物,其序列如seqidno:5-6所示。利用上述试剂盒检测brca2基因突变体的具体步骤为:按照实施例1步骤3(1)所述的方法提取待测者的dna,以所提取的dna为模板与上述brca2基因的外显子特异性引物进行pcr反应,并按照本领域常规方法对pcr产物纯化,将纯化的产物进行测序,然后观察测序所得到的序列是否具有c.3467delc突变,以达到检测目的。在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。尽管已经示出和描述了本发明的实施例,本领域的普通技术人员可以理解:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1