一种制备治疗外科手术感染的药物头孢曲松钠晶体化合物的方法与流程
本发明属于医药技术领域,具体涉及一种制备治疗外科手术感染的药物头孢曲松钠晶体化合物的方法。
背景技术:
头孢曲松钠分子式:C18H17N8NaO7S3三倍半水合物,结构式如下:
头孢曲松钠化学名为(6R,7R)-3-[[(1,2,5,6-四氢-2-甲基-5,6-二氧代-1,2,4-三嗪-3-基)硫代]甲基]-7-[[(2-氨基-4-噻唑基)甲氧亚氨基乙酰基]氨基]-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸钠盐三倍半水合物。为白色或类白色结晶性粉末,无臭无味,有引湿性,易溶于水,在甲醇中微溶,在三氯甲烷或乙醚中几乎不溶。
头孢曲松钠由瑞士Hoffmann-LaRoche公司研发,1982年首次在瑞士上市。属于第三代头孢菌素类抗生素,广泛应用于对本品敏感的呼吸道感染、泌尿系统感染、包括肾盂肾炎、淋病、败血症、脑膜炎、术后感染、骨关节、软组织、皮肤及伤口感染、皮肤及伤口感染、腹部感染、烧伤感染等,以及手术期感染预防,对肠杆菌科细菌有强大抗菌活性。因其具有半衰期长、抗菌谱广、毒性低等优点而为人们所重视。
头孢曲松钠自从1995年被罗氏制药引进我国后,开启了我国高端抗生素市场。近5年来,头孢曲松钠一直是全身抗感染用药金额排名前几位的药物,其制剂和原料药都成为了备受瞩目的对象。头孢曲松钠的市场需求量大,临床疗效突出。这些基本要素决定了头孢曲松钠成为引领头孢类抗生素市场的核心品种。因此,头孢曲松钠的精制也随之受到重视。
现有技术公开了多种结晶方法,主要有以下几种:
CN102875574A公开了一种头孢曲松钠晶型及其制备方法,a.取头孢曲松钠粗品,加入纯化水中,控温搅拌至固体全部溶解,过滤,滤液备用;b.搅拌,控温,向步骤a制备得到的滤液中滴加丙酮,得混合液;c.将步骤b制备得到的混合液降温,静置,得结晶液;d.将步骤c制备得到的结晶液抽滤,洗涤,干燥,得头孢曲松钠晶体。
CN102993215B公开了一种头孢曲松钠晶体的制备方法,向头孢曲松钠粗品的水溶液,搅拌下向水溶液中缓慢加入有机溶剂(无水乙醇、丙酮、乙酸乙酯或异丙醇),出现浑浊时停止搅拌,静置;继续搅拌加入有机溶剂,直至形成的晶体不再增加为止;晶体过滤,滤饼用无水乙醇、水混合溶剂洗涤至中性,再用无水乙醇洗涤1-3次,35℃以下常压干燥即得头孢曲松钠晶体。得到的头孢曲松钠晶体在所有晶体中水溶液的澄清度最好、过敏反应发生率最低,安全性最高。本发明制备方法工艺简单、重现性好。
上述纯化方法虽然在一定程度上解决了其纯度等问题,但经进一步的研究发现,由于头孢曲松钠的稳定性较差,其在贮存过程中也容易发生降解和聚合反应,随着存放时间的延长,其杂质和高聚物含量增加,影响头孢曲松的质量,使人体产生过敏性反应的风险增大,最终影响头孢曲松的安全性和有效性。
目前大量的研究已经证实,头孢菌素类药物过敏反应的发生并非由药物本身引起的,而是与药物中存在的高分子杂质有关。研究发现,高分子杂质的含量越低,过敏反应的发生率也就越低,反之,高分子杂质的含量越高,过敏反应发生率也就越高。在此所说的高分子杂质是指药品中比药物分子本身的相对分子质量更大的杂质,其来源通常分为外源性杂质和内源性杂质两类。外源性杂质一般来源于药物合成前期的发酵工艺,内源性杂质是指药物的自身聚合产物,这种聚合物可在生产过程或储存过程中产生。药物中的杂质多数具有潜在生物活性,可与药物相互作用,影响药物的安全性和有效性,甚至产生毒性。头孢曲松钠中除了能导致过敏反应的高分子杂质头孢曲松聚合物外,还存在其它杂质,如合成过程中残留的原料等,虽然尚未有资料表明这些杂质会给人体造成直接的伤害,但其毕竟是药品中的“污染物”,不具有治疗作用,应尽可能的将其降到最低水平,这是药物研发者的一项重要工作,符合各国对药物研发中关于杂质研究的指导原则。
中国药典2010版对头孢曲松钠的杂质和聚合物有严格的限定,要求头孢曲松钠中最大单杂不得高于0.5%,总杂质不得高于2.0%,头孢曲松聚合物不得高于0.5%。现有技术得到的头孢曲松钠产品质量水平基本以满足药典标准为目标,或是只有某一项指标明显高于药典标准,未能达到多个关键质量指标均高于药典标准的水平。
梅丹等人所发表的《市售注射用头孢曲松钠部分产品质量比较》一文中,对市售7个厂家生产的17批注射用头孢曲松钠产品进行了质量比较,所选指标包括澄清度、颜色、吸收值、水分、pH值、不溶性微粒、含量、降解产物或相关物质、聚合物、装量差异、有机溶剂残留量和西林瓶外壁残留等12个方面。检测结果显示,各批次产品质量指标各有优略,其中,最大单杂、总杂质、聚合物的最低值分别为0.053%、0.053%、0.15%。
兰州理工大学公开的《头孢曲松钠生产工艺的优化》研究中对头孢曲松钠的生产工艺进行了优化,最后一步结晶是精制提纯单元操作,在结晶时加入了头孢曲松钠晶种,这样得到的头孢曲松钠产品主粒度大,粒度分布均匀。工艺改进后,检验结果最大杂质含量≤0.2%,总杂质含量≤0.4%,头孢曲松聚合物≤0.1%,含量92.4%。
因此,降低头孢曲松钠中各类杂质包括聚合物的含量,获得高质量的产品,是确保头孢曲松钠临床用药安全的一项重要工作。
本发明人以现有头孢曲松钠粗品为原料,经过大量试验,制得了一种不同于现有技术的新晶型的头孢曲松钠化合物,并通过试验,惊喜地发现该晶体化合物纯度高,聚合物含量低,稳定性好,且不易吸湿、流动性好。利用该晶体化合物制成的胶囊溶出度高、杂质含量低,稳定性好。
技术实现要素:
本发明的目的在于提供一种制备治疗外科手术感染的药物头孢曲松钠晶体化合物的方法,该方法工艺简单,收率高,重复性强,适合于工业化生产。
为实现本发明的目的,本发明采用如下技术方案:
一种制备治疗外科手术感染的药物头孢曲松钠晶体化合物的方法,该方法包括如下步骤:
将头孢曲松钠粗品溶解于35℃水、二甲亚砜的混合溶剂中;先以40ml/min的速度加入乙醇与乙醚的混合溶剂,边加边搅拌,控制温度35℃,养晶3小时;然后再以20ml/min的速度加入异丙醇,养晶1小时后,降温,然后保持搅拌速度90转/分钟搅拌析晶、养晶3小时;过滤,洗涤,减压干燥得到头孢曲松钠晶体化合物;
上述制得的头孢曲松钠晶体化合物的结构式如式(Ⅰ)所示,该晶体化合物以2θ±0.2°衍射角表示的X射线粉末衍射图谱如图1所示,
式()。
本发明中,所述的头孢曲松钠粗品可通过现有技术方法制备得到,也可以通过其他方式获得。
本发明的制备方法中,其中,所述水、二甲亚砜的混合溶剂体积(ml)为头孢曲松钠重量(g)的4-6倍,水与二甲亚砜的体积比为5:1.5。所述乙醇与乙醚的混合溶剂体积(ml)为头孢曲松钠重量(g)的7-9倍,乙醇、乙醚的体积比为2:2。所述异丙醇的体积(ml)为头孢曲松钠重量(g)的5-7倍。所述降温速度为以10℃/小时的速度降温至-5℃。
本发明还提供一种头孢曲松钠胶囊,所述的胶囊含有本发明的制备方法制得的头孢曲松钠晶体化合物。
所述的头孢曲松钠胶囊,以重量份计,由100-200重量份的头孢曲松钠晶体化合物、80-100重量份的微晶纤维素、8-12重量份的交联羧甲基纤维素钠、2-4重量份的微粉硅胶组成。
优选的,所述的头孢曲松钠胶囊,以重量份计,由150重量份的头孢曲松钠、90重量份的微晶纤维素、9重量份的交联羧甲基纤维素钠、3重量份的微粉硅胶组成。
所述的头孢曲松钠胶囊,由以下制备方法制备而成:
1)原料处理:用振动分筛机将头孢曲松钠过80目筛,备用;
2)将微晶纤维素、交联羧甲纤维素钠、微粉硅胶分别过60目筛,备用;
3)称量:根据处方进行称量原辅料;
4)预混:将处方量的微晶纤维素、微粉硅胶及1/3处方量的交联羧甲纤维素钠加入到混合机中,设置电机运转频率200r/min,开启混合机混合30分钟;
5)总混:将处方量的头孢曲松钠及2/3处方量的交联羧甲纤维素钠加入到混合机中,设置电机运转频率200r/min,开启混合机混合10分钟;然后加入预混好的微晶纤维素、微粉硅胶及1/3处方量的交联羧甲纤维素钠,设置电机运转频率150r/min,开启混合机混合20分钟;
6)全自动胶囊填充机灌装;
7)包装。
与现有技术相比,本发明具有如下优点:
(1)本发明所提供的头孢曲松钠晶体化合物不仅纯度高,聚合物含量低,稳定性好,而且其吸湿性、流动性等明显优于现有技术;
(2)本发明头孢曲松钠的制备方法工艺简单,收率高,重复性强,适合于工业化生产;
(3)本发明所提供的含有该头孢曲松钠晶体化合物的胶囊溶出度高、杂质含量低,稳定性好。
附图说明
图1为本发明制备的头孢曲松钠晶体化合物的X射线粉末衍射图;
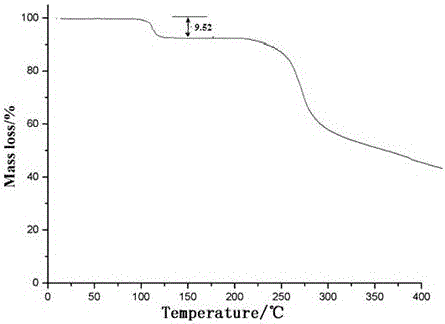
图2为本发明制备的头孢曲松钠晶体化合物的热分析图谱。
具体实施方式
以下用实施例对本发明的技术方案进行了详细说明,将有助于对本发明的技术方案的优点、效果有更进一步的了解,实施例不限定本发明的保护范围,本发明的保护范围由权利要求来决定。
实施例1头孢曲松钠晶体化合物的制备
将头孢曲松钠溶解于35℃体积为头孢曲松钠重量的4倍的水、二甲亚砜的混合溶剂中,水与二甲亚砜的体积比为5:1.5;先以40ml/min的速度加入体积为头孢曲松钠重量的7倍的乙醇与乙醚的混合溶剂,乙醇、乙醚的体积比为2:2,边加边搅拌,控制温度35℃,养晶3小时;然后再以20ml/min的速度加入体积为头孢曲松钠重量的5倍的异丙醇,养晶1小时后,以10℃/小时的速度降温至-5℃,然后保持搅拌速度90转/分钟搅拌析晶、养晶3小时;过滤,洗涤,减压干燥得到头孢曲松钠晶体化合物。
用粉末X射线衍射测定法测定,以2θ±0.2°衍射角表示的X-射线粉末衍射图谱如图1所示,在7.0°、9.2°、12.8°、15.6°、21.9°、25.0°处显示有特征衍射峰。
采用卡氏水分测定法测定水分含量为9.52wt%,与理论值基本吻合。
采用热重分析测定,结果如图2所示,结晶水含量为9.53wt%,与理论值基本吻合。
实施例2头孢曲松钠晶体化合物的制备
将头孢曲松钠溶解于35℃体积为头孢曲松钠重量的5倍的水、二甲亚砜的混合溶剂中,水与二甲亚砜的体积比为5:1.5;先以40ml/min的速度加入体积为头孢曲松钠重量的8倍的乙醇与乙醚的混合溶剂,乙醇、乙醚的体积比为2:2,边加边搅拌,控制温度35℃,养晶3小时;然后再以20ml/min的速度加入体积为头孢曲松钠重量的6倍的异丙醇,养晶1小时后,以10℃/小时的速度降温至-5℃,然后保持搅拌速度90转/分钟搅拌析晶、养晶3小时;过滤,洗涤,减压干燥得到头孢曲松钠晶体化合物。
用粉末X射线衍射测定法测定,以2θ±0.2°衍射角表示的X-射线粉末衍射图谱同实施例1。
实施例3头孢曲松钠晶体化合物的制备
将头孢曲松钠溶解于35℃体积为头孢曲松钠重量的6倍的水、二甲亚砜的混合溶剂中,水与二甲亚砜的体积比为5:1.5;先以40ml/min的速度加入体积为头孢曲松钠重量的9倍的乙醇与乙醚的混合溶剂,乙醇、乙醚的体积比为2:2,边加边搅拌,控制温度35℃,养晶3小时;然后再以20ml/min的速度加入体积为头孢曲松钠重量的7倍的异丙醇,养晶1小时后,以10℃/小时的速度降温至-5℃,然后保持搅拌速度90转/分钟搅拌析晶、养晶3小时;过滤,洗涤,减压干燥得到头孢曲松钠晶体化合物。
用粉末X射线衍射测定法测定,以2θ±0.2°衍射角表示的X-射线粉末衍射图谱同实施例1。
实施例4头孢曲松钠晶体化合物的制备
将头孢曲松钠溶解于35℃体积为头孢曲松钠重量的4倍的水、二甲亚砜的混合溶剂中,水与二甲亚砜的体积比为5:1.5;先以40ml/min的速度加入体积为头孢曲松钠重量的8倍的乙醇与乙醚的混合溶剂,乙醇、乙醚的体积比为2:2,边加边搅拌,控制温度35℃,养晶3小时;然后再以20ml/min的速度加入体积为头孢曲松钠重量的5倍的异丙醇,养晶1小时后,以10℃/小时的速度降温至-5℃,然后保持搅拌速度90转/分钟搅拌析晶、养晶3小时;过滤,洗涤,减压干燥得到头孢曲松钠晶体化合物。
用粉末X射线衍射测定法测定,以2θ±0.2°衍射角表示的X-射线粉末衍射图谱同实施例1。
实施例5头孢曲松钠晶体化合物的制备
将头孢曲松钠溶解于35℃体积为头孢曲松钠重量的6倍的水、二甲亚砜的混合溶剂中,水与二甲亚砜的体积比为5:1.5;先以40ml/min的速度加入体积为头孢曲松钠重量的7倍的乙醇与乙醚的混合溶剂,乙醇、乙醚的体积比为2:2,边加边搅拌,控制温度35℃,养晶3小时;然后再以20ml/min的速度加入体积为头孢曲松钠重量的7倍的异丙醇,养晶1小时后,以10℃/小时的速度降温至-5℃,然后保持搅拌速度90转/分钟搅拌析晶、养晶3小时;过滤,洗涤,减压干燥得到头孢曲松钠晶体化合物。
用粉末X射线衍射测定法测定,以2θ±0.2°衍射角表示的X-射线粉末衍射图谱同实施例1。
【制剂实施例1】头孢曲松钠胶囊
以重量份计,处方组成如下:头孢曲松钠100份、微晶纤维素80份、交联羧甲基纤维素钠8份、微粉硅胶2份。
头孢曲松钠为本发明实施例1制得的头孢曲松钠晶体化合物。
制备方法:
1)原料处理:用振动分筛机将头孢曲松钠过80目筛,备用;
2)将微晶纤维素、交联羧甲纤维素钠、微粉硅胶分别过60目筛,备用;
3)称量:根据处方进行称量原辅料;
4)预混:将处方量的微晶纤维素、微粉硅胶及1/3处方量的交联羧甲纤维素钠加入到混合机中,设置电机运转频率200r/min,开启混合机混合30分钟;
5)总混:将处方量的头孢曲松钠及2/3处方量的交联羧甲纤维素钠加入到混合机中,设置电机运转频率200r/min,开启混合机混合10分钟;然后加入预混好的微晶纤维素、微粉硅胶及1/3处方量的交联羧甲纤维素钠,设置电机运转频率150r/min,开启混合机混合20分钟;
6)全自动胶囊填充机灌装;
7)包装。
【制剂实施例2】头孢曲松钠胶囊
以重量份计,处方组成如下:头孢曲松钠100份、微晶纤维素90份、交联羧甲基纤维素钠12份、微粉硅胶2份。
制备方法:同制剂实施例1,所不同的是所用的头孢曲松钠为实施例2所制备的头孢曲松钠晶体。
【制剂实施例3】头孢曲松钠胶囊
以重量份计,处方组成如下:头孢曲松钠150份、微晶纤维素90份、交联羧甲基纤维素钠9份、微粉硅胶3份。
制备方法:同制剂实施例1,所不同的是所用的头孢曲松钠为实施例3所制备的头孢曲松钠晶体。
【制剂实施例4】头孢曲松钠胶囊
以重量份计,处方组成如下:头孢曲松钠200份、微晶纤维素80份、交联羧甲基纤维素钠12份、微粉硅胶2份。
制备方法:同制剂实施例1,所不同的是所用的头孢曲松钠为实施例4所制备的头孢曲松钠晶体。
【制剂实施例5】头孢曲松钠胶囊
以重量份计,处方组成如下:头孢曲松钠200份、微晶纤维素100份、交联羧甲基纤维素钠12份、微粉硅胶4份。
制备方法:同制剂实施例1,所不同的是所用的头孢曲松钠为实施例5所制备的头孢曲松钠晶体。
试验品1:本发明实施例1所制备的头孢曲松钠晶体化合物;
试验品2:本发明实施例3所制备的头孢曲松钠晶体化合物;
对照品1:按照CN102432629B实施例1的方法制得头孢曲松钠;
对照品2:按照汪东海等人发表的《头孢曲松钠精制方法的改进》1.2头孢曲松钠的制备方法制得头孢曲松钠;
对照品3:按照CN102617605B实施例1的方法制得头孢曲松钠;
对照品4:按照CN102993215B实施例1的方法制得头孢曲松钠;
对照品5:按照CN104031067B实施例1的方法制得头孢曲松钠;
对照品6:按照CN104341435B实施例1的方法制得头孢曲松钠;
对照品7:按照CN104370941A实施例1的方法制得头孢曲松钠晶体;
对照品8:按照CN104873466A实施例1的方法制得头孢曲松钠;
对照品9:按照CN104876948A实施例1的方法制得头孢曲松钠;
对照品10:按照CN104887621A实施例1的方法制得头孢曲松钠;
对照品11:按照CN105061472A实施例1的方法制得头孢曲松钠;
对照品12:按照CN102875574A实施例1的方法制得头孢曲松钠。
实验例1:热稳定性试验
将各样品分别暴露于相对湿度为75%、温度为40℃的环境下,按照中国药典2010版第二部附录有关物质检测方法和分子排阻色谱法测定高分子聚合物的含量,结果见表1a、1b:
表1a热稳定性试验结果
表1b热稳定性试验结果
药品质量的高低直接关系到千百万劳动人民身体的健康,也关系到我国经济建设的成效、国防的巩固和民族的兴旺发达;它已远不是医药工业企业本身范围的事,而是整个民族、世界的大事。本领域技术人员均清楚知晓,在制药技术发达的当代,药品安全标准被不断提升,所制备的药品的纯度也越来越高,有效地降低杂质含量,哪怕是零点几个百分点,也可以有效地降低不良反应的发生,因此杂质含量对药品质量和人民用药安全至关重要。药品从生产到流通过程中需要贮存和运输才能治病救人,因此,贮存和运输过程中药品的质量显得尤为重要,稳定性是决定药品质量好坏的关键,在药品贮存和运输过程中,稳定性不好,杂质变化大直接影响人民用药安全。
从上表可以看出,采用本发明的方法制得的头孢曲松钠晶体化合物的有关物质、聚合物等含量均很低,且热稳定性显著优于采用现有技术的方法进行纯化后得到的头孢曲松钠,有效地提升了药品安全性及存储的稳定性,降低了不良反应的发生。
对本发明其它实施例的头孢曲松钠晶体化合物也进行了上述试验,其获得的结果相似。
实验例2:流动性试验
本实验例通过测定样品的休止角来评价样品的流动性,具体方法如下:取样品颗粒,从固定的小漏斗中流入圆形的表面皿中,直到得到最高的圆椎体,量取圆锥体高度H和半径R,按tanα=H/R计算休止角α,结果见表2,休止角越大,流动性越差。
表2流动性试验结果
从表2可知,与现有技术中的头孢曲松钠相比,本发明所制备的头孢曲松钠化合物流动性显著提高,有利于提高分装的准确性,并且与其它成分混合时易于混合均匀。
对本发明其它实施例的头孢曲松钠晶体化合物也进行了上述试验,其获得的结果相似。
实验例3:吸湿性试验
将各样品开口置洁净培养皿中,摊成≤5mm厚的薄层,各两份,分别放入恒湿密闭容器中,在25℃分别于相对湿度75%与92.5%的条件下放置10天,于第5天和第10天取样,通过干燥失重实验测量各样品的水分含量,试验结果与0天比较,实验结果见表3。
表3吸湿性试验结果
从上表可以看出,本发明制备的头孢曲松钠晶体化合物在高湿度条件下基本不吸湿,其在高湿环境下的稳定性明显优于采用现有技术的纯化方法处理得到的头孢曲松钠。
对本发明其它实施例的头孢曲松钠晶体化合物也进行了上述试验,其获得的结果相似。
实验例4:处方筛选实验(采用本发明胶囊制备方法制备)
表4a 处方筛选实验结果
表4b 处方筛选实验结果
由上表可以看出,本发明制得的头孢曲松钠胶囊(处方十一)不仅流动性、溶出度好,而且聚合物、总杂含量显著降低。
实验例5:制剂影响因素试验
制剂试验品1:本发明制剂实施例1所制备的头孢曲松钠胶囊。
制剂试验品2:本发明制剂实施例3所制备的头孢曲松钠胶囊。
将制剂试验品模拟上市包装,在高温60℃、光照4500Lx、高湿(RH90%±5%)条件下放置10天,按稳定性重点考察项目进行检测,与0天样品比较,结果见表5。
表5 制剂影响因素试验结果
由以上结果发现,本发明所制备的含有该头孢曲松钠晶体化合物的胶囊溶出度高、杂质含量低,稳定性好。
对本发明其它制剂实施例的头孢曲松钠胶囊也进行了上述试验,其获得的结果相似。
- 还没有人留言评论。精彩留言会获得点赞!