利用PCR‑RFLP检测绵羊PCNP基因单核苷酸多态性的方法及其应用与流程
本发明属于分子遗传学领域,涉及以绵羊的功能基因的单核苷酸多态性(SNP)作为分子遗传标记,特别涉及绵羊PCNP基因的单核苷酸多态性及其检测方法。
背景技术:
在绵羊育种中,人们期望通过对繁殖性状密切相关,并且与数量性状紧密连锁的DNA标记的选择,达到早期选种和提高育种值准确性的目的,从而在畜禽育种中获得更大的遗传进展。
分子育种,即分子标记辅助选择育种(Molecular Mark-Assist Selection,MAS),该技术是借助DNA分子标记对遗传资源或育种材料进行选择,对畜禽的综合性状进行品种改良,它是利用现代分子生物学和传统遗传育种相结合的方法,进行新品种选育。
基因多态性是指不同物种或者同一物种内的不同个体间基因组序列的差异,这些差异是由于染色体中DNA等位基因中核苷酸改变引起,主要是包括碱基的替换、插入、缺失以及重复序列拷贝数的变化。
单核苷酸多态性(Single Nucleotide Polymorphism,SNP)是由美国麻省理工学院的人类基因组研究中心的学者Lander(1996)提出的一类遗传标记系统,就是指基因组DNA序列中由于单个核苷酸(A/T/C/G)的替换而引起的多态性。SNP作为新的遗传标记已广泛应用于基因定位、克隆、遗传育种及多样性的研究。SNP是基因组中存在的一种数量非常丰富的变异形式,占人类基因组中遗传多态性的90%以上。SNP与罕见的变异不同,通常在种群中频率等于或小于1%的此种变异被称为突变,而只有频率大于1%时才被称为单核苷酸多态性。它的变异形式有:颠换、转换、插入和缺失等,主要由单个碱基的转换或者颠换所引起。具有转换型的碱基变异的SNPs约占2/3。
根据基因组中单核苷酸多态性产生的位置,可分为以下3类:基因编码区单核苷酸多态性(Coding-region SNPs,cSNPs)、基因周边单核苷酸多态性(Perigenic SNPs,pSNPs)以及基因间单核苷酸多态性(Intergenic SNPs,iSNPs)。
研究表明,位于编码区内的cSNP比较少。基因编码区内的cSNP又可分为2种:一种是编码区内的同义cSNP(Synonymous cSNP),即SNP所致编码序列的改变并不会影响其所翻译的蛋白质中氨基酸序列的改变;另一种是编码区内的非同义cSNP(Non-Synonymous cSNP),即碱基序列的改变将导致编码氨基酸的改变,从而导致蛋白质中氨基酸序列的改变,可能最终影响到蛋白质的功能。
由于SNPs是二等位基因分子标记,所以,理论上在一个二倍体生物群体中,SNPs可能是由2个、3个或4个等位基因构成,但实际上3个或4个等位基因的SNPs很罕见,故SNPs通常被简单地称为二等位基因分子标记。目前,主要采用几种不同的路线来发现SNPs:即DNA序列测定方法、聚合酶链反应—单链构象多态(Polymerase Chain Reaction-Single Strand Conformation Polymorphism,PCR-SSCP)与DNA测序结合法、等位特异性PCR(Allele Specific PCR,AS-PCR)方法、引物延伸法和寡核苷酸连接反应等。在这些SNP检测技术中,DNA序列测定法是最为准确的SNP检测方法,但是,其检测费用昂贵,且需要有DNA测序仪等大型仪器,同时,在测序过程中需要非常熟练的技术人员和经验,所以,DNA序列测定法不是一种应用于生产实际的理想SNP检测方法;当然,利用PCR-SSCP与DNA测序结合法检测SNP可以适当降低检测费用,但是,PCR-SSCP的实验过程比较长,操作比较繁琐,且实验过程中存在假阳性问题,所以,也并非理想的SNP检测手段;AS-PCR方法作为一种新型的SNP检测方法,在未来的应用领域中具有非常广阔的前景,但是,该方法需要设计特别的引物,且只能针对特定的基因位点,同时,检测过程中还存在误检的概率,因此,目前不具有普遍应用的特点;而引物延伸法和寡核苷酸连接反应技术检测SNP位点,需要平板读数仪、基因芯片、微球阵列技术和质谱仪等检测平台,对于一般的分子实验室来说可实施性不强。
限制性片段长度多态性-聚合酶链反应(Restriction Fragment Length Polymorphism-Polymerase Chain Reaction,RFLP-PCR)方法是一种检测SNP的有效技术,在发现SNP位点后设计上下游引物用限制性内切酶进行切割,然后进行琼脂糖、聚丙烯凝胶电泳分析,就能准确地鉴别SNP位点。RFLP-PCR方法不仅具有DNA测序法的准确性,又克服了费用昂贵、繁琐操作、假阳性的缺点,而且所检测的序列位点无特殊性要求。
PCNP(PEST-containing nuclear protein)是一类定位于细胞核并含有PEST序列(即富含脯氨酸(P)、谷氨酸(E)、丝氨酸(S)和苏氨酸(T)四种氨基酸的蛋白。
通过比对多个物种的序列发现,PCNP基因核酸序列的同源性较高,尤其在哺乳动物中均达到94%以上,都比较保守,说明在生物体中该蛋白应具有重要的作用及功能。在人类基因组中PCNP基因被定位在3q12.3,编码178个氨基,对其理化性质进行分析后显示其是由18种氨基酸组成的一种半衰期较短且不稳定的亲水性蛋白。PCNP很可能在细胞周期调控与肿瘤发生过程中发挥作用,编码PCNP的基因所在的3号染色体含有趋化因子受体(CKR)基因簇和多种人类癌症相关基因位点,关键肿瘤抑制基因如凋亡调控因子RASSF1、细胞移调控因子HYAL1、血管生成抑制因子SEMA3B也都在3号染色体,马凡综合征、卟啉症、Von Hippel-Lindau综合症、成骨不全症等遗传病也与3号染色体相关。
国内外目前关于PCNP的研究还比较少。朱江木研究发现PCNP的过表达能显著促进小鼠骨骼肌细胞C2C12细胞生长,PCNP可能参与了肌细胞的周期调控,对肌细胞生长有调控作用,对肌细胞的功能也有影响。孙颖川研究发现在类风湿关节炎患者外周血中PCNP在基因水平和蛋白水平的表达增高,类风湿关节炎病情的轻重与PCNP的表达量正相关。在类风湿关节炎的发病中,该基因的表达变化和病人的病情密切相关,PCNP有可能成为临床诊断类风湿关节炎的检测指标,也可作为疾病病情发展、预后的参考指标,亦可能是潜在的分子治疗靶点。通过mRNA差异显示技术获得属于PCNP基因的表达量差异片段GW360093,在不同繁殖力山羊的卵巢组织中存在表达量差异,真正影响山羊繁殖性状差异的是该基因表达产物的多少。
PCNP在绵羊上被准确定位到1号染色体上,包括5个外显子。Genomic的登录号(NC_019458.1),predicted mRNA登录号XM_012189341.1,mRNA全长为712bp,该基因的CDS序列全长为537bp(7-543),可以编码179个氨基酸。针对绵羊PCNP的研究还很少,国内外鲜见报道。2013年河北农业大学邢增喜成功的克隆了山羊PCNP基因的启动子并预测了其核心调控区,为研究PCNP基因的转录调控机制奠定基础。
关于动物PCNP基因遗传变异的研究国内外多见于人、鼠、猪等动物,而未有绵羊PCNP基因遗传变异或SNP研究的报道。由于目前中国湖羊、小尾寒羊PCNP基因遗传变异领域的研究匮乏,使该基因位点的功能研究及该基因遗传变异与经济性状,如繁殖性状关联的研究成为空白。
技术实现要素:
本发明的目的在于提供一种利用PCR-RFLP检测绵羊PCNP基因单核苷酸多态性的方法及其应用,利用PCR-RFLP方法针对其基因位点上的错义突变可能导致编码蛋白构象发生变化的单核苷酸多态性进行检测,提前淘汰产生错义突变的个体,加快具有优质经济性状绵羊种群的建立。
本发明通过以下技术方案来实现:
绵羊PCNP基因第5019位为G或A的单核苷酸多态性的检测方法为:以包含PCNP基因的待测绵羊(如湖羊、小尾寒羊等)全基因组DNA为模板,以引物对P为引物,PCR扩增湖羊、小尾寒绵羊PCNP基因;用限制性内切酶SPhI消化PCR扩增产物之后,再对酶切后的扩增片段进行琼脂糖凝胶电泳;根据电泳结果鉴定绵羊PCNP基因第5019位的单核苷酸多态性;
所述的引物对P为:
上游引物:5’-AGAATAGCATGGGCAGAA-3’ 18nt;
下游引物:5’-TCATTTCTGTGGGACACC-3’ 18nt。
所述的PCR扩增反应程序为:94℃预变性5min;94℃变性30s,55.3℃退火30s,72℃延伸50s,35个循环;72℃延伸10min。
所述的琼脂糖凝胶电泳为质量浓度为1%的琼脂糖凝胶电泳。
根据琼脂糖凝胶电泳结果PCNP基因第5019位碱基多态性为:AA型表现:377bp和309bp;GA型表现:686bp、377bp和309bp;GG型表现:686bp。
与现有技术相比,本发明具有以下有益的技术效果:
本发明利用RFLP-PCR方法对绵羊PCNP基因第5019位点上的突变可能产生编码蛋白构象发生变化的单核苷酸多态性进行检测,当位点由G突变为A时,为G→A的突变,该突变未引起氨基酸的改变,属于同义突变,使具有重要生理功能的PCNP基因所编码蛋白的空间二、三级构型发生变化,以至影响蛋白的生物学功能。该核苷酸多态性能够作为一个分子遗传标记,利用标记位点信息和数量性状的表型信息,更准确估计动物个体的育种值,提高选择效率,加快育种进展。
本发明通过设计特定的PCR引物扩增片段,能够用RFLP-PCR方法简单、快速、成本低、精确的检测上述PCNP基因的单核苷酸的多态性。
本发明对PCNP基因的SNP进行了基因分型和基因频率分析,以及与湖羊、小尾寒羊生长性状之间进行了关联分析;结果显示PCNP基因的核苷酸多态位点能够成为分子遗传辅助育种的标记。
本发明提供的检测方法为PCNP基因的SNP与生长性状关系的建立奠定了基础,以便用于中国湖羊、小尾寒羊等绵羊品种生长性状的标记辅助选择,快速建立遗传资源优良的绵羊种群。
附图说明
图1为湖羊、小尾寒羊血样基因组DNA电泳检测图;
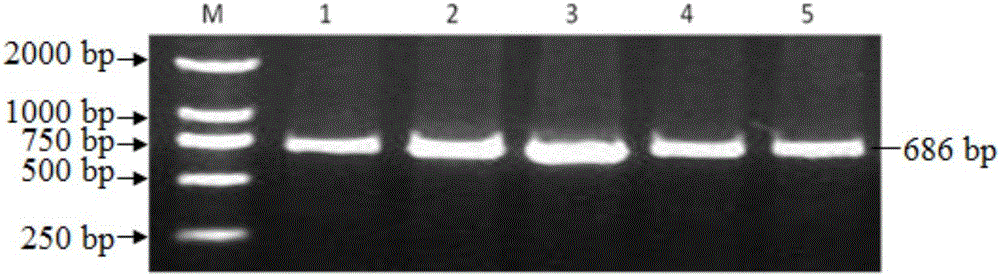
图2为湖羊、小尾寒羊PCNP基因PCR扩增的686bp片段的电泳图;
图3为湖羊、小尾寒羊PCNP基因686bp PCR产物的SPhI酶切电泳检测PCNP基因多态性的电泳结果图;泳道1,2:GG基因型个体(686bp);泳道3,4:AA基因型个体(377bp,309bp);泳道5,6:GA基因型个体(686bp,377bp和309bp);M:Marker(2000bp,1000bp,750bp,250bp,100bp);
图4为湖羊、小尾寒羊PCNP基因5019位SNP的不同基因型测序峰图,其中,a对应GG基因型,b对应AA基因型,c对应GA基因型。
具体实施方式
下面结合附图和实施例对本发明作进一步详细说明,所述实施例是对本发明的解释,而不是限定。
本发明以PCNP基因保守序列设计引物扩增PCNP基因第2外显子686bp片段,以湖羊、小尾寒羊基因组为模板,进行PCR扩增,扩增产物经测序后寻找该扩增片段的单核苷酸多态;针对发现的单核苷酸多态进行性状关联性分析,并提供其检测方法,使得PCNP基因的核苷酸多态性成为一种能够快速、方便检测的分子遗传标记,为加快建立具有优质经济性状的湖羊、小尾寒羊等绵羊种群提供依据。
a、绵羊PCNP基因多态性的检测
1、绵羊血样的采集及处理
取湖羊、小尾寒羊血样10mL,加入0.5mol/L的EDTA 500μL抗凝,缓慢颠倒3次后放入冰盒,-80℃保存备用。
本发明采用湖羊、小尾寒羊品种,具体如表1所示。
表1 绵羊样品来源表
2、血样基因组DNA的提取
(1)冰冻的血样在室温水浴中融化;
(2)将1mL全血转入一个无菌的2mL离心管中;
(3)加入等体积(1mL)的PBS缓冲液,温和摇动15-20min;
(4)4℃12000*g离心10min;
(5)用移液枪弃上清,重复步骤3、4至上清液透明,沉淀白色;
(6)离心管中加DNA提取液650-750μL,温和摇动使细胞沉淀悬浮;
(7)37℃水浴1h;(可省略)
(8)加入蛋白酶K 3μL(终浓度为60μg/mL),混匀;
(9)在恒温水浴箱中55℃温育过夜(16h左右),至细胞沉淀物被完全消化,溶液澄清;
(10)反应液冷却至室温,加入1倍体积(800μL-1mL)的Tris饱和酚,放置冰上温和摇动15min;
(11)4℃,12000g离心10min;
(12)将上层水相用移液枪移到另一灭菌离心管中;
(13)加入0.5倍体积(0.5mL)的酚和0.5倍(0.5mL)的氯仿,放置冰上温和摇动15min;
(14)4℃,12000g离心10min;
(15)将上层水相用移液枪移到另一灭菌离心管中;
(16)加入1倍体积(1mL)的氯仿,放置冰上温和摇动15min;
(17)4℃,12000g离心10min;
(18)将上层水相用移液枪移到另一灭菌离心管中;
(19)加入2倍体积的预冷无水乙醇(-20℃),轻轻口底摇晃多次至DNA析出,然后-20℃放置30min;
(20)4℃,12000g离心10min;弃上清液;
(21)加入70%乙醇1mL,温和摇动10min;
(22)4℃,12000g离心10min,弃乙醇,重复漂洗一次;
(23)真空干燥或室温下使乙醇挥发干净;
(24)根据DNA的量,加入超纯水100-300μL,4℃保存至DNA完全溶解,分光光度计测定浓度后,-80℃保存。
3、DNA池的构建
(1)1%琼脂糖凝胶电泳检测
选部分DNA样品进行琼脂糖凝胶电泳检测,选择DNA样品条带均一、无拖尾、无降解的样品进行DNA池的构建。
(2)OD值测定
用紫外光光度计测定DNA样品在260nm、280nm处的OD值。计算DNA含量和OD260/OD280的比值。如OD260/OD280比值小于1.6,说明样品中含有较多的蛋白质或酚,则应进行纯化;若比值大于1.8,则应该考虑去除RNA纯化。
DNA浓度(ng/μL)=50×OD260值×稀释倍数
(3)品种DNA池的构建
DNA检测完毕后,取出一定的量稀释至50ng/μL,然后从湖羊、小尾寒羊50个浓度为50ng/μL DNA样品中取10μL混合构建成品种DNA池;
湖羊、小尾寒羊血样基因组DNA的检测结果见图1,从图中可以看出湖羊、小尾寒羊基因组DNA的质量非常高。
4、PCR扩增
以绵羊DNA池为模版,用设计的引物对P进行PCR扩增,PCR总反应体系为25.3μL,见表2;PCR总反应程序,见表3。
表2 PCR反应体系
引物对P:
上游引物:5’-AGAATAGCATGGGCAGAA-3’ 18nt;
下游引物:5’-TCATTTCTGTGGGACACC-3’ 18nt
表3 引物最佳PCR反应程序
5、PCR产物纯化和测序
PCR扩增完成之后进行琼脂糖凝胶电泳,电泳结果如图2所示,可以清楚看到686bp的条带;然后进行PCR产物的切胶回收及纯化:在紫外灯下从琼脂糖凝胶上切下含目的片段的凝胶,放入1.5mL离心管中,然后用PCR产物回收纯化试剂盒(北京天根生物公司)纯化PCR产物,按照试剂盒说明书操作,具体步骤如下:
(1)首先向吸附柱中加入500μL平衡液BL,12000r/min离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。
(2)将单一的目的DNA条带从琼脂糖凝胶中切下放入干净的离心管中,称取重量。
(3)向胶块中加入等体积溶液PC,60℃水浴放置10min左右,其间不断温和地上下翻转离心管,以确保胶块充分溶解。
(4)将上一步所得溶液加入一个吸附柱中,12000r/min离心1min,倒掉收集管中的废液,将吸附柱重新放入收集管中。
(5)向吸附柱中加入700μL漂洗液,12000r/min离心1min,倒掉废液,将吸附柱重新放入收集管中。
(6)向吸附柱中加入500μL漂洗液,12000r/min离心1min,倒掉废液,将离心吸附柱放入收集管中,12000r/min离心2min,尽量除去漂洗液。将吸附柱置于室温或50℃温箱数分钟,彻底晾干。
(7)将吸附柱放到一个干净的离心管中,向吸附膜中间位置悬空滴加适量的洗脱缓冲液,室温放置2分钟。12000r/min离心1min收集DNA溶液。
(8)为了提高DNA的回收量,可将离心得到的溶液重新加回离心吸附柱中,重复步骤7。
把以湖羊、小尾寒羊DNA池为模板的PCR纯化产物送上海生物工程有限公司进行双向测序。湖羊、小尾寒羊PCNP基因目的片段686bp的测序结果如图4所示。
对测序峰图进行分析,其中在同一位点有两个不同峰的是发生了单核苷酸突变;位于湖羊、小尾寒羊PCNP基因的第5019位出现了G、A两种检测结果,即为筛查到的湖羊、小尾寒羊PCNP基因的SNP多态性,该位点是为G或A的碱基多态性。
b、绵羊PCNP基因G>A突变多态性的RFLP-PCR检测
由于筛查到的碱基多态性为自然酶切位点,能被常用的内切酶进行PCR-RFLP来鉴定。当湖羊、小尾寒羊的PCNP基因第5019位未发生G>A突变时,即为突变前G,利用引物对P扩增的PCNP基因序列GCATGC,为SPhI的限制性内切酶识别位点;可直接通过SPhI对目的片段的酶切进行基因分型。
1、RFLP-PCR引物设计
参照引物对P。
上述引物能够扩增湖羊、小尾寒羊PCNP基因2第外显子686bp片段。
2、RFLP-PCR反应条件
PCR产物扩增体系和反应条件分别如表2和表3所述,PCR扩增产物的1%琼脂糖凝胶电泳图谱如图2所示,可以看到设计的引物对P能够扩增686bp的片段。
3、PCR扩增产物的SPhI酶切
(1)酶切体系为:为sphI内切酶0.5μL,Buffer B 2μL,ddH2O 13μL,4μL PCR扩增产物,总计20μL。
(2)酶切消化条件:37℃恒温培养箱中消化12~16h。
(3)SPhI消化PCR产物后琼脂糖凝胶电泳分析
用1.0%的琼脂糖凝胶,200V电压电泳18min,核酸染料染色检测酶切结果,用UVP凝胶成像系统(GelDoc-It TS Imaging System)照相分析,并判型、记录其基因型;
由于PCR-RFLP扩增的686bp片段中不包含其它的SPhI酶切识别位点,当PCNP基因第5019位未发生G>A突变时,PCR扩增的PCNP基因产物被限制性内切酶SPhI识别后,在GCATGC/CGTACG对扩增片段酶切,将扩增片段切为2段;而当PCNP基因第5019位发生突变,不能形成新的限制性内切酶SPhI酶切识别位点,扩增片段不能被酶切;
由于绵羊为2倍体动物,所以当发生G>A的突变时,可形成3种不同的基因型,分别为GG、GA、AA,其PCR-RFLP检测的凝胶结果如图3所示:
其中,GG基因型为野生型,它的两条DNA链的SNP位点均不能被酶切,表现为686bp条带;发生突变后的AA基因型的两条链的SNP位点均能被SPhI酶切,表现为377bp和309bp条带;杂合子GA的两条链中的一条的SNP位点能够被识别而另一条不能被识别,表现为686bp,377bp和309bp条带,根据条带的个数和条带的大小,能够很清楚的判定是否发生了点突变,将三种基因型区分开,从而检测其SNP多态性。
(4)不同基因型个体PCR产物的测序验证
利用ABI 5019和ABI 3730测序仪对不同基因型个体PCR产物分别进行正反双向测序;同时,进行SNP位置分析,结果表明包含686bp、377bp和309bp条带的杂合子GA基因型个体其第5019位的测序图的确表示为G或A,如图4c所示,自左向右第5019位为两个峰;而GG基因型、AA基因型分别为G、A,分别如图4a、图4b所示。
c、不同绵羊群体中PCNP基因第5019位的SNP作为分子标记的应用
1、群体单核苷酸多态性的检测
利用上述的SNP多态性检测方法对湖羊、小尾寒羊共计604份DNA样品,进行SNP多态性的鉴定;统计其SNP位点的频率分布情况。
2、SNP位点的频率统计分析
基因型频率是指一个群体中某一性状的某种基因型个体数占总个体数的比率。PAA=NAA/N,其中PAA代表某一位点的AA基因型频率;NAA表示群体中具有AA基因型的个体数;N为检测群体的总数量。
基因频率是指一个群体中某一基因数对其等位基因总数的相对比率。计算的公式可以写成:PA=(2NAA+NAa1+NAa2+……+NAan)/2N。式中,PA表示等位基因A频率,NAA表示群体中具有AA基因型的个体数量,NAai表示群体中具有Aai基因型个体数量,a1-an为等位基因A的n个不同的复等位基因;统计结果见表4。
表4 湖羊、小尾寒羊PCNP基因第5019位SNP基因频率分布表
3、基因效应的关联分析
基因型数据:SPhI识别的基因型(GG、GA、GA)
繁殖性状数据:第一胎产羔数
关联分析模型:
利用SAS(9.2)软件分析基因位点与繁殖性状(产羔数)的相关性。先对数据进行描述性统计分析,确定是否存在离群值,根据数据特征,利用t分析、方差分析或是多元线性模型分析基因型效应。在数据处理中,根据影响产羔数因素不同,考虑到环境效应、年龄、基因型效应及相关的互作效应,采用固定模型进行分析,同时,根据实际情况进行取舍。完整的模型如下:
Yijk=μ+Gj+Eijk
其中:Yijk为个体表型记录;μ为群体均值;Gj为各位点的基因型效应;Eijk为随机误差。
表5 PCNP基因单核苷酸多态性与绵羊繁殖性状之间的方差分析
注:具有相同字母肩标的平均值间差异不显著(P>0.05),具有不同字母肩标的平均值间差异显著(P<0.05)
结果表明,在绵羊PCNP基因组序列的第5019位单核苷酸多态位点上的不同基因型与绵羊产羔数关联分析表明,AA基因的个体的产羔数显著高于GG基因型个体,见表5。根据这个研究结果,可以通过选择,建立基因型为AA纯合型绵羊群体,提高其产羔率。
核苷酸序列表
<110> 兰州大学
<120> 利用PCR-RFLP检测绵羊PCNP基因单核苷酸多态性的方法及其应用
<160> 2
<210> 1
<211> 18
<212> DNA
<213> 人工合成
<400> 1
agaatagcat gggcagaa 18
<210> 2
<211> 18
<212> DNA
<213> 人工合成
<400> 2
tcatttctgt gggacacc 18
- 还没有人留言评论。精彩留言会获得点赞!