紫花苜蓿根瘤菌固定化包埋颗粒剂型的制备方法及其应用与流程
本发明属于农业微生物应用领域,特别是涉及一种新型紫花苜蓿根瘤菌包埋固定化颗粒剂型的制备和应用。
背景技术:
豆科植物和根瘤菌共生体系是自然界存在的最重要的生物固氮体系之一,也是农业中应用最广、经济效益和社会效益最好的一个方面。目前的根瘤菌接种剂类型较多。常用的有普通草炭吸附剂型、液体剂型、琼脂斜面培养物剂型、液体矿油剂型、冷冻干燥剂型和颗粒剂型。其中最常用的就是草炭吸附菌剂,它是用草炭吸附发酵液制成的。由于含有大量的有机质,微生物在合适的温度下能够增殖,但是这种方法也有缺点,一是不宜机播,二是不利于人工接种的根瘤菌到土壤中与土著根瘤菌群体竞争结瘤。然而,近几年美国的研究表明,蛭石可以作为草炭替代物的首选,由于蛭石质轻、孔隙度大、吸附力强,可能在含菌数上超过草炭。但蛭石没有有机质,是致命的缺点。固定化细胞技术的发展为农业微生物的高效利用指明了方向。所谓固定化细胞技术,即是将微生物细胞固定于某些特殊材料(如海藻酸钠等)内,制成颗粒后形成有限空间,以使菌体在一定时间内保持其生物活性并得到增殖的方法。目前,在医药、食品、发酵工业及废水处理等领域已得到了广泛应用,在大豆根瘤菌包埋方面也有初步研究,而苜蓿根瘤菌包埋固定化颗粒的制备和应用目前还是空白。
技术实现要素:
本发明的目的是研制新型苜蓿根瘤菌固定化包埋颗粒,使苜蓿种植企业更加方便地添加苜蓿根瘤菌,在复配、加工、造粒和运输贮藏过程中不损失菌剂的活性,使种植户更加简便地使用苜蓿根瘤菌菌肥。突破了高耐受、高活力的苜蓿根瘤菌肥种子包被技术的主要技术瓶颈难点,解决苜蓿根瘤菌保护剂活力难以保持和添加使用不方便的技术难题。
为了实现上述目的,本发明采用的技术方案为:
一种紫花苜蓿根瘤菌固定化包埋颗粒剂型的制备方法,包括如下步骤:
步骤1、培养紫花苜蓿根瘤菌:利用YMA液体培养基或YMA固体培养基培养苜蓿根瘤菌,至活菌数达1×109个/ml以上,制成紫花苜蓿根瘤菌菌液;
步骤2、离心分离紫花苜蓿根瘤菌菌液:将步骤1制备的紫花苜蓿根瘤菌菌液分成每份10ml的菌液,进行离心,首次分离后去掉分离上清液后,分离后的紫花苜蓿根瘤菌底液添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,分离后的紫花苜蓿根瘤菌底液第二次添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,分离后的紫花苜蓿根瘤菌底液第三次添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,得到离心分离后的紫花苜蓿根瘤菌菌液;
步骤3、制备紫花苜蓿根瘤菌固定化包埋菌剂:向步骤2制得的离心分离后的紫花苜蓿根瘤菌菌液加入10ml无菌海藻酸钠溶液,向混合均匀后的溶液内加入5~20mL灭菌脱脂乳,充分搅拌均匀后制得紫花苜蓿根瘤菌固定化包埋菌剂;
步骤4、制备紫花苜蓿根瘤菌固定化包埋颗粒剂型:将步骤3制备的紫花苜蓿根瘤菌固定化包埋菌剂抽入到10mL无菌注射器中,将10mL无菌注射器中的紫花苜蓿根瘤菌固定化包埋菌剂缓慢匀速地滴入到20ml的CaCl2溶液中,滴入速度50~200滴/min,滴入后制成紫花苜蓿根瘤菌固定化包埋颗粒,将得到的紫花苜蓿根瘤菌固定化包埋颗粒在4℃下固定18h,得到紫花苜蓿根瘤菌固定化包埋颗粒剂型。
本发明所述的紫花苜蓿根瘤菌固定化包埋颗粒剂型的制备方法,步骤1中YMA液体培养基是称量甘露醇10g、酵母粉0.4g、NaCl0.1g、K2HPO40.5g、MgSO4·7H2O 0.2g加入1000蒸馏水中,121℃灭菌后降温至28℃,得到YMA液体培养基,溶液pH值为6.8~7;步骤1中YMA固体培养基是在YMA液体培养基中加入18~20g/l琼脂粉。
本发明所述的紫花苜蓿根瘤菌固定化包埋颗粒剂型的制备方法,步骤2中离心分离的转速为5000~10000转/min,离心时间1~10min。
本发明所述的紫花苜蓿根瘤菌固定化包埋颗粒剂型的制备方法,步骤3中无菌海藻酸钠溶液的浓度为质量分数3%~6%。分别称取海藻酸钠1.5g,2g,2.5g,3g溶解于50ml的蒸馏水中,配制成3%,4%,5%,6%的海藻酸钠溶液。
本发明所述的紫花苜蓿根瘤菌固定化包埋颗粒剂型的制备方法,步骤4中无菌注射器的针头型号是4号、6号或9号;步骤4中CaCl2溶液的浓度为0.15~0.3mol/l;步骤4中制得的紫花苜蓿根瘤菌固定化包埋颗粒剂型在无菌条件下贮存。
本发明所述的紫花苜蓿根瘤菌固定化包埋颗粒剂型的制备方法,利用所述的紫花苜蓿根瘤菌固定化包埋颗粒剂型的制备方法制备的紫花苜蓿根瘤菌固定化包埋颗粒剂型在苜蓿种植中的应用。
检测本发明制备的紫花苜蓿根瘤菌固定化包埋颗粒剂型的活菌数存活量方法是:本发明制备的紫花苜蓿根瘤菌固定化包埋颗粒剂型倾去CaCl2溶液,用质量分数为0.85%的无菌生理盐水清洗颗粒三遍。称取1g颗粒溶解到10ml浓度为0.2mol/l的柠檬酸钠溶液里,震荡溶解颗粒,然后采用稀释平板法对根瘤菌计数。选取菌落数在30~300个之间的为准。其中无菌生理盐水的制备是通过称取8.5g的NaCl溶于1000ml蒸馏水中,即为0.85%的生理盐水。
本发明利用YMA液体培养基或YMA固体培养基培养苜蓿根瘤菌,培养时间5~7天,活菌数能够达1×109个/ml以上。
本发明所述的灭菌脱脂乳为市售的脱脂乳,通过121℃高温灭菌即为灭菌脱脂乳。
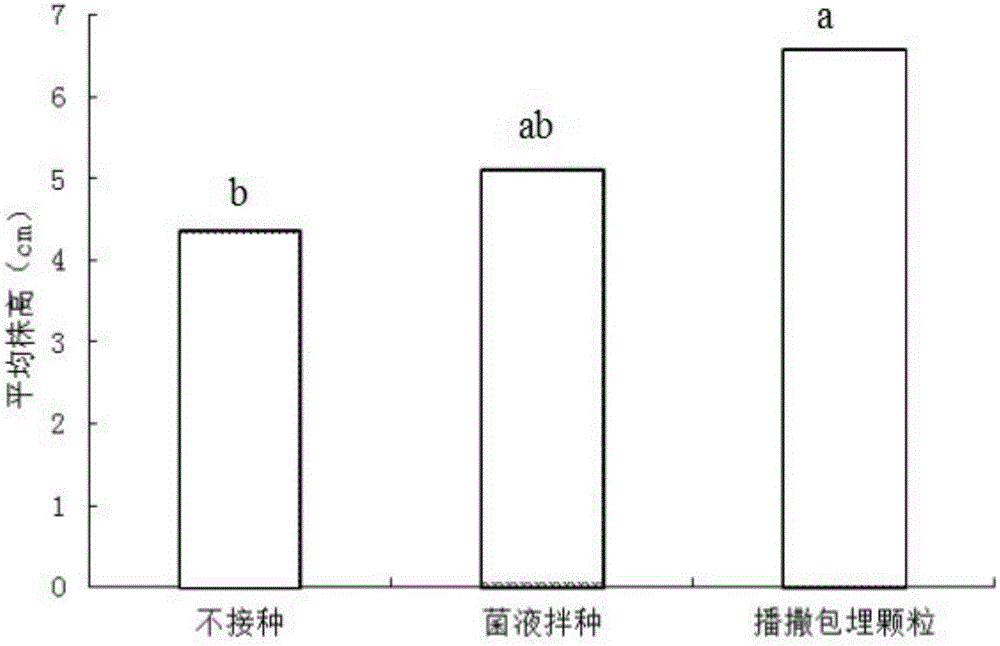
本发明所述的新型苜蓿根瘤菌固定化包埋颗粒,使苜蓿种植企业更加方便地添加苜蓿根瘤菌,在复配、加工、造粒和运输贮藏过程中不损失菌剂的活性,使种植户更加简便地使用苜蓿根瘤菌菌肥。突破了高耐受、高活力的苜蓿根瘤菌肥种子包被技术的主要技术瓶颈难点,解决苜蓿根瘤菌保护剂活力难以保持和添加使用不方便的技术难题。本发明所述的新型苜蓿根瘤菌固定化包埋颗粒,结瘤个数为菌液拌种的两倍,平均株高达到7cm,菌液拌种的苜蓿平均株高只有5cm,而且包埋颗粒中的活菌数活性半年后单克所述的新型苜蓿根瘤菌固定化包埋颗粒中的活菌数能够达到上万级别。
附图说明
图1为本发明不同接种方式的紫花苜蓿结瘤个数对比图;
图2为本发明不同接种方式的紫花苜蓿株高对比图;
图3为本发明紫花苜蓿根瘤菌固定化包埋颗粒剂型的活菌数对数值与天数曲线。
具体实施方式
具体实施方式一:本实施方式中紫花苜蓿根瘤菌固定化包埋颗粒剂型的制备方法是按下述步骤进行的:
步骤1、培养紫花苜蓿根瘤菌:利用YMA液体培养基培养苜蓿根瘤菌,至活菌数达1×109个/ml以上,制成紫花苜蓿根瘤菌菌液;
步骤2、离心分离紫花苜蓿根瘤菌菌液:将步骤1制备的紫花苜蓿根瘤菌菌液分成每份10ml的菌液,进行离心,离心分离机的转速为10000转/min,离心时间5min,首次分离后去掉分离上清液后,分离后的紫花苜蓿根瘤菌底液添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,分离后的紫花苜蓿根瘤菌底液第二次添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,分离后的紫花苜蓿根瘤菌底液第三次添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,得到离心分离后的紫花苜蓿根瘤菌菌液;
步骤3、制备紫花苜蓿根瘤菌固定化包埋菌剂:向步骤2制得的离心分离后的紫花苜蓿根瘤菌菌液分别加入10ml的无菌海藻酸钠溶液,无菌海藻酸钠溶液的质量分数分别为3%、4%、5%、6%,向混合均匀后的溶液内加入10mL灭菌脱脂乳,充分搅拌均匀后制得紫花苜蓿根瘤菌固定化包埋菌剂;
步骤4、制备紫花苜蓿根瘤菌固定化包埋颗粒剂型:将步骤3制备的紫花苜蓿根瘤菌固定化包埋菌剂抽入到10ml无菌注射器中,将10ml无菌注射器中的紫花苜蓿根瘤菌固定化包埋菌剂缓慢匀速地滴入到20ml的CaCl2溶液中,CaCl2溶液的浓度为0.15mol/l,滴入后制成紫花苜蓿根瘤菌固定化包埋颗粒,将得到的紫花苜蓿根瘤菌固定化包埋颗粒在4℃下固定18h,得到紫花苜蓿根瘤菌固定化包埋颗粒剂型。
将本实施方式制备的紫花苜蓿根瘤菌固定化包埋颗粒剂型进行活菌数存活量实验,得到的实验结果如表1所示:从表1中能够看出,随着海藻酸钠浓度的升高,苜蓿根瘤菌的有效活菌数逐渐降低,使用3%的海藻酸钠进行包埋能够保证根瘤菌有效活菌数在较高的水平,达到1.68×109CFU/g。
表1海藻酸钠浓度对细胞活性的影响
具体实施方式二:本实施方式中紫花苜蓿根瘤菌固定化包埋颗粒剂型的制备方法是按下述步骤进行的:
步骤1、培养紫花苜蓿根瘤菌:利用YMA固体培养基培养苜蓿根瘤菌,至活菌数达1×109个/ml以上,制成紫花苜蓿根瘤菌菌液;
步骤2、离心分离紫花苜蓿根瘤菌菌液:将步骤1制备的紫花苜蓿根瘤菌菌液分成每份10ml的菌液,进行离心,离心分离机的转速为10000转/min,离心时间5min,首次分离后去掉分离上清液后,分离后的紫花苜蓿根瘤菌底液添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,分离后的紫花苜蓿根瘤菌底液第二次添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,分离后的紫花苜蓿根瘤菌底液第三次添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,得到离心分离后的紫花苜蓿根瘤菌菌液;
步骤3、制备紫花苜蓿根瘤菌固定化包埋菌剂:向步骤2制得的离心分离后的紫花苜蓿根瘤菌菌液加入10ml的无菌海藻酸钠溶液,无菌海藻酸钠溶液的质量分数为3%,向混合均匀后的溶液内加入10ml灭菌脱脂乳,充分搅拌均匀后制得紫花苜蓿根瘤菌固定化包埋菌剂;
步骤4、制备紫花苜蓿根瘤菌固定化包埋颗粒剂型:将步骤3制备的紫花苜蓿根瘤菌固定化包埋菌剂分别抽入到不同型号的10ml无菌注射器中,10ml无菌注射器的型号分别为4号、6号、9号,将10ml无菌注射器中的紫花苜蓿根瘤菌固定化包埋菌剂缓慢匀速地滴入到20ml的CaCl2溶液中,CaCl2溶液的浓度为0.15mol/l,滴入后制成紫花苜蓿根瘤菌固定化包埋颗粒,将得到的紫花苜蓿根瘤菌固定化包埋颗粒在4℃下固定18h,得到紫花苜蓿根瘤菌固定化包埋颗粒剂型。
将本实施方式制备的紫花苜蓿根瘤菌固定化包埋颗粒剂型进行活菌数存活量实验,得到的实验结果如表2所示:从表2中能够看出,针头的型号决定包埋颗粒大小,针头型号越大,包埋颗粒的直径也越大。从表2中可以看出,采用4号针头制备包埋颗粒,其中的根瘤菌数量最高。而采用9号针头制备包埋颗粒,其中的苜蓿根瘤菌有效活菌数最低,说明越大的包埋颗粒越不利于苜蓿根瘤菌有效活菌的保持。
表2针头型号对细胞活性的影响
具体实施方式三:本实施方式中紫花苜蓿根瘤菌固定化包埋颗粒剂型的制备方法是按下述步骤进行的:
步骤1、培养紫花苜蓿根瘤菌:利用YMA液体培养基培养苜蓿根瘤菌,至活菌数达1×109个/ml以上,制成紫花苜蓿根瘤菌菌液;
步骤2、离心分离紫花苜蓿根瘤菌菌液:将步骤1制备的紫花苜蓿根瘤菌菌液分成每份10ml的菌液,进行离心,离心分离机的转速为5000转/min,离心时间10min,首次分离后去掉分离上清液后,分离后的紫花苜蓿根瘤菌底液添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,分离后的紫花苜蓿根瘤菌底液第二次添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,分离后的紫花苜蓿根瘤菌底液第三次添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,得到离心分离后的紫花苜蓿根瘤菌菌液;
步骤3、制备紫花苜蓿根瘤菌固定化包埋菌剂:向步骤2制得的离心分离后的紫花苜蓿根瘤菌菌液加入10ml的无菌海藻酸钠溶液,无菌海藻酸钠溶液的质量分数为3%,向混合均匀后的溶液内加入10ml灭菌脱脂乳,充分搅拌均匀后制得紫花苜蓿根瘤菌固定化包埋菌剂;
步骤4、制备紫花苜蓿根瘤菌固定化包埋颗粒剂型:将步骤3制备的紫花苜蓿根瘤菌固定化包埋菌剂抽入到不同型号的10ml无菌注射器中,将10ml无菌注射器中的紫花苜蓿根瘤菌固定化包埋菌剂缓慢分别匀速地滴入到20ml的CaCl2溶液中,CaCl2的浓度分别为0.15mol/l,0.2mol/l,0.25mol/l,0.3mol/l,滴入后制成紫花苜蓿根瘤菌固定化包埋颗粒,将得到的紫花苜蓿根瘤菌固定化包埋颗粒在4℃下固定18h,得到紫花苜蓿根瘤菌固定化包埋颗粒剂型。
将本实施方式制备的紫花苜蓿根瘤菌固定化包埋颗粒剂型进行活菌数存活量实验,得到的实验结果如表3所示:从表3中能够看出,在苜蓿根瘤菌包埋固定化过程中,CaCl2溶液所起的作用主要是与海藻酸根离子螯合成不溶于水的海藻酸钙凝胶,从而将细胞固定。而从表3数据中可见,越高浓度的CaCl2溶液导致苜蓿根瘤菌活菌数降低与高CaCl2溶液浓度的盐高渗作用有关,致使细胞脱水死亡。因此,苜蓿根瘤菌包埋固定化过程中最适CaCl2浓度为0.15mol/l。
表3 CaCl2浓度对细胞活性的影响
具体实施方式四:本实施方式中紫花苜蓿根瘤菌固定化包埋颗粒剂型的制备方法是按下述步骤进行的:
步骤1、培养紫花苜蓿根瘤菌:利用YMA液体培养基培养苜蓿根瘤菌,至活菌数达1×109个/ml以上,制成紫花苜蓿根瘤菌菌液;
步骤2、离心分离紫花苜蓿根瘤菌菌液:将步骤1制备的紫花苜蓿根瘤菌菌液分成每份10ml的菌液,进行离心,离心分离机的转速为10000转/min,离心时间3min,首次分离后去掉分离上清液后,分离后的紫花苜蓿根瘤菌底液添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,分离后的紫花苜蓿根瘤菌底液第二次添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,分离后的紫花苜蓿根瘤菌底液第三次添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,得到离心分离后的紫花苜蓿根瘤菌菌液;
步骤3、制备紫花苜蓿根瘤菌固定化包埋菌剂:向步骤2制得的离心分离后的紫花苜蓿根瘤菌菌液加入10ml的无菌海藻酸钠溶液,无菌海藻酸钠溶液的质量分数为3%,向混合均匀后的溶液内分别加入5ml、10ml、20ml的灭菌脱脂乳,充分搅拌均匀后制得紫花苜蓿根瘤菌固定化包埋菌剂;
步骤4、制备紫花苜蓿根瘤菌固定化包埋颗粒剂型:将步骤3制备的紫花苜蓿根瘤菌固定化包埋菌剂抽入到不同型号的10ml无菌注射器中,将10ml无菌注射器中的紫花苜蓿根瘤菌固定化包埋菌剂缓慢分别匀速地滴入到20ml的CaCl2溶液中,CaCl2的浓度为0.15mol/l滴入后制成紫花苜蓿根瘤菌固定化包埋颗粒,将得到的紫花苜蓿根瘤菌固定化包埋颗粒在4℃下固定18h,得到紫花苜蓿根瘤菌固定化包埋颗粒剂型。
将本实施方式制备的紫花苜蓿根瘤菌固定化包埋颗粒剂型进行活菌数存活量实验,得到的实验结果如表4所示:从表4中能够看出,脱脂乳是一种保护剂,有利于微生物的增殖。但是脱脂乳的添加量与成本和颗粒形态保持有着密切的关系,通过脱脂乳比例试验,从表4中可见,使用10ml的脱脂乳为苜蓿根瘤菌包埋颗粒有效增殖并保持形态稳定起到了关键作用。
表4脱脂乳体积对细胞活性的影响
具体实施方式五:本实施方式中紫花苜蓿根瘤菌固定化包埋颗粒剂型的制备方法是按下述步骤进行的:
步骤1、培养紫花苜蓿根瘤菌:利用YMA液体培养基培养苜蓿根瘤菌,至活菌数达1×109个/ml以上,制成紫花苜蓿根瘤菌菌液;
步骤2、离心分离紫花苜蓿根瘤菌菌液:将步骤1制备的紫花苜蓿根瘤菌菌液分成每份10ml的菌液,进行离心,离心转速8000rpm,离心时间5min,首次分离后去掉分离上清液后,分离后的紫花苜蓿根瘤菌底液添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,分离后的紫花苜蓿根瘤菌底液第二次添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,分离后的紫花苜蓿根瘤菌底液第三次添加新鲜的YMA液体培养基至10ml后混匀,再次离心分离,得到离心分离后的紫花苜蓿根瘤菌菌液;
步骤3、制备紫花苜蓿根瘤菌固定化包埋菌剂:向步骤2制得的离心分离后的紫花苜蓿根瘤菌菌液分别加入10ml的无菌海藻酸钠溶液,无菌海藻酸钠溶液的质量分数为3%,向混合均匀后的溶液内加入10mL灭菌脱脂乳,充分搅拌均匀后制得紫花苜蓿根瘤菌固定化包埋菌剂;
步骤4、制备紫花苜蓿根瘤菌固定化包埋颗粒剂型:将步骤3制备的紫花苜蓿根瘤菌固定化包埋菌剂抽入到10ml无菌注射器中,将10ml无菌注射器中的紫花苜蓿根瘤菌固定化包埋菌剂缓慢匀速地滴入到20ml浓度为0.15mol/l的CaCl2溶液中,滴入后制成紫花苜蓿根瘤菌固定化包埋颗粒,将得到的紫花苜蓿根瘤菌固定化包埋颗粒在4℃下固定18h,无菌条件下贮存,得到紫花苜蓿根瘤菌固定化包埋颗粒剂型。
利用本具体实施方式五制备的紫花苜蓿根瘤菌固定化包埋颗粒剂型与使用SD101菌液进行拌种和不接种不施肥两种情况进行对比,
表5三种不同接种方式
苜蓿品种:敖汉。
苜蓿根瘤菌:苜蓿中华根瘤菌SD101
盆栽基质:采用灭菌蛭石。
处理数:3个接种处理*8个平行=24盆
接种方式:ab.使用SD101菌液进行拌种:YMA液体培养基培养SD101至活菌数在×109个/ml以上。使用羧甲基纤维素钠与菌液混合均匀,再与种子混合并晾干再进行播种;a.播撒SD101包埋颗粒:将包埋颗粒埋在苜蓿种子附近,接种后,在种子表面再覆盖一层无菌蛭石。
研究结果如图1、图2、图3所示:
图1为本发明不同接种方式的紫花苜蓿结瘤个数对比图。从图1中可以看出,接种紫花苜蓿是一种提高紫花苜蓿结瘤数的最佳方法,并且不同接种方式对紫花苜蓿结瘤数的提高程度不一。因为根瘤菌通常都是侵染根毛导致根毛卷曲内陷形成侵染线再发展成根瘤。因此根毛的产生与有效根瘤菌的定殖时期有着密切的联系。使用根瘤菌拌种,仅仅是在紫花苜蓿主根形成过程中保证苜蓿根瘤菌的有效侵染,在后期大量次生根的形成过程中就已经彻底消亡了,对利用次根形成根瘤几乎没有任何作用。而包埋颗粒可以缓慢释放有效根瘤菌,在次生根的形成过程中也能够与次生根互相作用形成大量有效根瘤,对苜蓿植株的生长产生较大的贡献,图2为本发明不同接种方式的紫花苜蓿株高对比图,从图2中可以看出本发明大大增加了植株的生物量及株高。
图3为本发明紫花苜蓿根瘤菌固定化包埋颗粒剂型的活菌数对数值与天数曲线。在苜蓿根瘤菌包埋颗粒制作好后的第1天,第30天,第60天,第90天,第120天,第150天和第180天取样采用稀释平板法进行活菌数测定,结果如图3所示。随着时间的推移,包埋颗粒中的活菌数逐渐下降,但是即使半年后单克颗粒中的活菌数仍能达到上万级别,说明将苜蓿根瘤菌制成包埋固定化颗粒是一种有效促进根瘤菌长效利用的办法。
- 还没有人留言评论。精彩留言会获得点赞!