一种特异性抗Kif18A蛋白695位丝氨酸磷酸化抗体的制备方法与应用与流程
本发明涉及生物医药技术应用,尤其涉及一种特异性抗Kif18A蛋白695位丝氨酸磷酸化抗体的制备方法与应用。
背景技术:
驱动蛋白分子的研究是近几年生命科学领域的又一热点。对其功能的揭示不仅有助于深入理解正常细胞生长、组织发育及器官功能,也可为许多疾病发生发展基本机制的揭示提供新思路。染色体驱动蛋白分子Kif18A在细胞有丝分裂期,定位于动粒和纺锤体,参与染色体整列、纺锤体形成和胞质分裂过程。因此制备特异性抗Kif18A蛋白S695磷酸化抗体对深入研究其磷酸化状态对Kif18A自身功能发挥的调节以及对整个细胞有丝分裂过程的影响具有重要意义。
技术实现要素:
本发明克服了现有技术中的缺点,提供了一种特异性抗Kif18A蛋白695位丝氨酸磷酸化抗体的制备方法与应用。
为了解决上述技术问题,本发明是通过以下技术方案实现的:
一种Kif18A-S695磷酸化多肽,具有如SEQ ID No.1所述的氨基酸序列
Cys-Ser-Val-Gln-Leu-Asn-Ser-Leu-Ser-Lys-Gln-Pro-Ile-Val-Tyr-Thr-Pro-Glu-Asp,其中第七位的(即第二个)丝氨酸进行磷酸化,即外带一个磷酸根(pSer)。
一种Kif18A-S695磷酸化抗原,由所述的Kif18A-S695磷酸化多肽与血蓝蛋白KLH交联制备形成,按照下列具体步骤进行:
(1)将G-25交联葡聚糖800rpm,5min离心,弃上清,加入与葡聚糖等体积的PBS缓冲液混匀;
(2)向25ml玻璃瓶中加入134微升KLH,1866微升pH为6.0的PBS,最终KLH终浓度为10mg/ml;
(3)称0.006g MBS,溶于200微升DMSO;
(4)在搅拌情况下,将步骤(3)的MBS分散体系缓慢加入到步骤(2)的KLH分散体系中,采用移液枪枪头尖伸至液面以下的方式进行缓慢加入,持续搅拌30min;
(5)取一个25ml塑料移液管(作为层析柱),用剪刀剪去上口,玻璃纤维堵住下口,将步骤(1)中G25交联葡聚糖充分混匀倒入管子,纯葡聚糖约5-6ml,使用50ml pH为7.4的PBS清洗蛋白亲和层析柱;
(6)将步骤(4)中经搅拌分散均匀的KLH-MBS混合液加入步骤(5)准备的柱子;
(7)待KLH-MBS混合液全部进入柱子后,用pH 7.4PBS洗1次,同时开始用1.5ml的EP管在下面接液体,每管1ml,应用BCA蛋白浓度测定试剂盒测定蛋白浓度,选浓度最高的3管液体进行混合,用于下述多肽交联;
(8)将10mg多肽(SEQ ID No.1所述的氨基酸序列:Cys-Ser-Val-Gln-Leu-Asn-Ser-Leu-Ser-Lys-Gln-Pro-Ile-Val-Tyr-Thr-Pro-Glu-Asp,其中第七位的丝氨酸进行磷酸化)加入200微升pH 7.4PBS溶解,将溶解的多肽加入1.5ml经过步骤(7)得到的KLH混合物,搅拌1h;
(9)将经过步骤(8)交联的物质用pH 7.4PBS透析12小时,每12h更换透析液(pH 7.4PBS),每次800ml;取出透析后的液体,加入pH 7.4PBS至总体积10ml,每管1ml分装,-80度冻存。
一种特异性抗Kif18A蛋白695位丝氨酸磷酸化抗体的制备方法,按照下列步骤进行:
步骤一,制备多肽与KLH交联的抗原:
(1)将G-25交联葡聚糖800rpm,5min离心,弃上清,加入与葡聚糖等体积的PBS缓冲液混匀;
(2)向25ml玻璃瓶中加入134微升KLH,1866微升pH为6.0的PBS,最终KLH终浓度为10mg/ml;
(3)称0.006g MBS,溶于200微升DMSO;
(4)在搅拌情况下,将步骤(3)的MBS分散体系缓慢加入到步骤(2)的KLH分散体系中,采用移液枪枪头尖伸至液面以下的方式进行缓慢加入,持续搅拌30min;
(5)取一个25ml塑料移液管(作为层析柱),用剪刀剪去上口,玻璃纤维堵住下口,将步骤(1)中G25交联葡聚糖充分混匀倒入管子,纯葡聚糖约5-6ml,使用50ml pH为7.4的PBS清洗蛋白亲和层析柱;
(6)将步骤(4)中经搅拌分散均匀的KLH-MBS混合液加入步骤(5)准备的柱子;
(7)待KLH-MBS混合液全部进入柱子后,用pH 7.4PBS洗1次,同时开始用1.5ml的EP管在下面接液体,每管1ml,应用BCA蛋白浓度测定试剂盒测定蛋白浓度,选浓度最高的3管液体进行混合,用于下述多肽交联;
(8)将10mg多肽(SEQ ID No.1所述的氨基酸序列:Cys-Ser-Val-Gln-Leu-Asn-Ser-Leu-Ser-Lys-Gln-Pro-Ile-Val-Tyr-Thr-Pro-Glu-Asp,其中第七位的丝氨酸进行磷酸化)加入200微升pH 7.4PBS溶解,将溶解的多肽加入1.5ml经过步骤(7)得到的KLH混合物,搅拌1h;
(9)将经过步骤(8)交联的物质用pH 7.4PBS透析12小时,每12h更换透析液(pH 7.4PBS),每次800ml;取出透析后的液体,加入pH 7.4PBS至总体积10ml,每管1ml分装,-80度冻存。
步骤二:抗原乳化
将步骤1制备的透析好的抗原与弗氏完全佐剂和弗氏不完全佐剂,按照1:1体积比均匀混合,分别制得抗原与弗氏完全佐剂混合液、抗原与弗氏不完全佐剂混合液,在操作中,将弗氏佐剂滴加到抗原中,4℃摇匀2小时,振荡,超声,至形成油包水的小滴。
步骤三:动物免疫
挑选健康的雄性6周左右的新西兰大白兔,动物房饲养一周使其适用环境。
实验前,在兔的耳缘静脉取1.5ml血作为免疫前血清。
第一周,在兔的背部和腹股沟注射200-300ug抗原与弗氏完全佐剂混合液(即实施例2中乳化的抗原)。
第三周,注射200ug抗原与弗氏不完全佐剂混合液。
第五周,耳缘取血。取血清检测抗体的效价和特异性。
第六周,注射200ug抗原与弗氏不完全佐剂混合液。
第七周,耳缘取血。取血清检测抗体的效价和特异性。
以大白兔耳缘静脉抽血,制备血清(含特异抗Kif18A-S695磷酸化抗体)。
与现有技术相比,本发明的有益效果是:特异性抗Kif18A蛋白S695磷酸化抗体对深入研究其磷酸化状态对Kif18A自身功能发挥的调节以及对整个细胞有丝分裂过程的影响具有重要意义,该抗体制备及应用为揭示Kif18A分子的磷酸化状态在细胞周期有丝分裂过程中的基本调节机制,初步分析其与癌症发生的关系,对深刻理解细胞有丝分裂的基本规律,以及基于Kif18A分子靶点的肿瘤防治策略的设计提供了研究基础。
附图说明
图1为多肽竞争性实验及蛋白激酶PLK1小分子抑制剂处理实验验证抗Kif18A蛋白S695磷酸化抗体特异识别有丝分裂细胞中S695磷酸化的Kif18A。
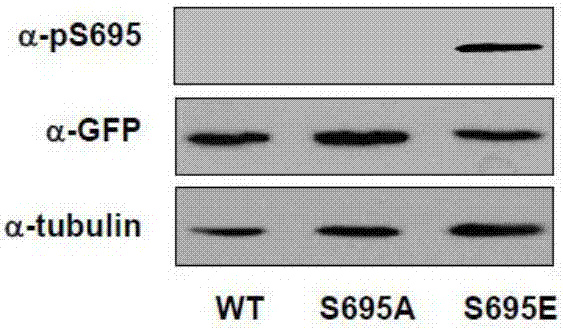
图2为外源性表达的S695点突变蛋白检测验证抗Kif18A蛋白S695磷酸化抗体特异识别S695磷酸化的Kif18A。
具体实施方式
下面结合附图与具体的实施方式对本发明作进一步详细描述:
以下实施例中所用到的药品和仪器如下:
G-25交联葡聚糖购自合肥兰旭生物技术有限公司,
KLH(血蓝蛋白)、MBS(3-马来酰亚胺基苯甲酸琥珀酰亚胺酯交联剂)、DMSO(二甲基亚砜)、弗氏完全佐剂、弗氏不完全佐剂均购自西格玛奥德里奇有限公司,
蛋白亲和层析柱购自深圳逗点生物技术有限公司,
BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司,
实施例1—制备多肽与KLH交联的抗原
(1)将G-25交联葡聚糖800rpm,5min离心,弃上清,加入与葡聚糖等体积的PBS缓冲液混匀;
(2)向25ml玻璃瓶中加入134微升KLH,1866微升pH为6.0的PBS,最终KLH终浓度为10mg/ml;
(3)称0.006g MBS,溶于200微升DMSO;
(4)在搅拌情况下,将步骤(3)的MBS分散体系缓慢加入到步骤(2)的KLH分散体系中,采用移液枪枪头尖伸至液面以下的方式进行缓慢加入,持续搅拌30min;
(5)取一个25ml塑料移液管(作为层析柱),用剪刀剪去上口,玻璃纤维堵住下口,将步骤(1)中G25交联葡聚糖充分混匀倒入管子,纯葡聚糖约5-6ml,使用50ml pH为7.4的PBS清洗蛋白亲和层析柱;
(6)将步骤(4)中经搅拌分散均匀的KLH-MBS混合液加入步骤(5)准备的柱子;
(7)待KLH-MBS混合液全部进入柱子后,用pH 7.4PBS洗1次,同时开始用1.5ml的EP管在下面接液体,每管1ml,应用BCA蛋白浓度测定试剂盒测定蛋白浓度,选浓度最高的3管液体进行混合,用于下述多肽交联;
(8)将10mg多肽(SEQ ID No.1所述的氨基酸序列:Cys-Ser-Val-Gln-Leu-Asn-Ser-Leu-Ser-Lys-Gln-Pro-Ile-Val-Tyr-Thr-Pro-Glu-Asp,其中第七位的丝氨酸进行磷酸化)加入200微升pH 7.4PBS溶解,将溶解的多肽加入1.5ml经过步骤(7)得到的KLH混合物,搅拌1h;
(9)将经过步骤(8)交联的物质用pH 7.4PBS透析12小时,每12h更换透析液(pH 7.4PBS),每次800ml;取出透析后的液体,加入pH 7.4PBS至总体积10ml,每管1ml分装,-80度冻存。
实施例2—抗原乳化
将实施例1制备的透析好的抗原与弗氏完全佐剂和弗氏不完全佐剂,按照1:1体积比均匀混合,分别制得抗原与弗氏完全佐剂混合液、抗原与弗氏不完全佐剂混合液,在操作中,将弗氏佐剂滴加到抗原中,4℃摇匀2小时,振荡,超声,至形成油包水的小滴。
实施例3—动物免疫
A.挑选健康的雄性6周左右的新西兰大白兔,动物房饲养一周使其适用环境。
B.实验前,在兔的耳缘静脉取1.5ml血作为免疫前血清。
第一周,在兔的背部和腹股沟注射200-300ug抗原与弗氏完全佐剂混合液(即实施例2中乳化的抗原)。
第三周,注射200ug抗原与弗氏不完全佐剂混合液。
第五周,耳缘取血。取血清检测抗体的效价和特异性。
第六周,注射200ug抗原与弗氏不完全佐剂混合液。
第七周,耳缘取血。取血清检测抗体的效价和特异性。
以大白兔耳缘静脉抽血,制备血清(含特异抗Kif18A-S695磷酸化抗体)
实施例4—应用血清进行分子生物学实验检测
1.如附图1所示,应用2mM胸苷(Thymidine)药物培养人子宫颈癌细胞HeLa 18小时,再换含有30nM诺考达唑(Nocodazole)培养液继续培养细胞过夜(10~12小时),收集悬浮细胞(同步化在细胞有丝分裂期),裂解后进行蛋白电泳(SDS-PAGE)及蛋白印迹杂交(Westernblot)实验。分别应用特异性抗微管蛋白(Tubulin)和抗Kif18A抗体作为对照显示样品中微管蛋白及Kif18A蛋白量。同时应用特异性抗Cyclin B1蛋白抗体检测显示药物处理的细胞处于有丝分裂期。再应用特异性抗Kif18A-S695磷酸化抗体(α-pS659)以及应用磷酸化多肽中和的抗Kif18A-S695磷酸化抗体(α-pS659+phospho-peptide)进行杂交检测。结果显示抗Kif18A-S695磷酸化抗体(α-pS659)可以识别有丝分裂期细胞中的Kif18A,但被磷酸化多肽中和的抗体不能识别有丝分裂期细胞中的Kif18A蛋白。将上述细胞培养液中加入特异蛋白激酶PLK1小分子抑制剂BI2536处理细胞12小时,再次进行上述蛋白印迹杂交鉴定。结果显示特异α-pS659抗体不再识别细胞裂解液中的Kif18A蛋白。
2.如附图2所示,应用点突变技术将Kif18A-S695蛋白(野生型蛋白WT)突变成Kif18A-A695(非磷酸化突变体蛋白TA)或Kif18A-E695(拟磷酸化突变体蛋白TE)的表达质粒,细胞转染表达外源性GFP融合蛋白(WT、TA、TE)。收集细胞裂解进行蛋白电泳及蛋白印迹杂交实验。分别应用特异性抗微管蛋白(Tubulin)和抗GFP抗体作为对照检测样品中内源性微管蛋白及外源性GFP融合蛋白。再应用特异性抗Kif18A-S695磷酸化抗体(α-pS659)进行杂交检测。结果显示,外源性表达的拟磷酸化突变体蛋白GFP-Kif18ATE可以被α-pS659抗体识别,相反外源性表达的野生型GFP-Kif18AWT蛋白及非磷酸化突变体蛋白GFP-Kif18AS695A均不能被该抗体识别。
以上对本发明进行了详细说明,但所述内容仅为本发明的较佳实施例,不能被认为用于限定本发明的实施范围。凡依本发明申请范围所作的均等变化与改进等,均应仍归属于本发明的专利涵盖范围之内。
序列表
<110> 天津师范大学
<120> 一种特异性抗Kif18A蛋白695位丝氨酸磷酸化抗体的制备方法与应用
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 19
<212> PRT
<213> 人工序列
<400> 1
Cys Ser Val Gln Leu Asn Ser Leu Ser Lys Gln Pro Ile Val Tyr Thr
1 5 10 15
Pro Glu Asp
- 还没有人留言评论。精彩留言会获得点赞!