一种咪唑二羧酸镍配合物、制备方法及其应用与流程
本发明涉及一种咪唑二羧酸镍配合物、制备方法及其应用,属于配位化学领域。
背景技术:
自1967年美国密执安州立大学B.Rosenbergr教授等发现顺铂具有抗肿瘤活性以来,金属配合物在生物医药方面的研究引起了人们的极大关注。很多含有咪唑环的天然产物具有广泛的应用,尤其是在生物、医药等方面显示出非常独特的性能,如在抗真菌、抗癌,以及治疗低血糖和生理紊乱等方面具有很好的应用价值。咪唑二羧酸类化合物含有多个配位原子,具有多种配位方式,可与多种金属形成性能优良的配合物。镍是动物必需的微量元素,与动物心血管、内分泌及免疫系统存在密切的关系,并参与核酸和蛋白质的代谢,具有缓解肾上腺素升高血压和增强胰岛素降低血糖的作用。咪唑二羧酸镍配合物的合成与生物活性研究具有重要的意义。
血清白蛋白是血浆中最丰富的蛋白,药物进入机体的血循环后,与血清白蛋白不同程度的可逆性非共价结合直接影响药物在体内的分布、贮存、转运、代谢及药理活性的发挥。白蛋白分子内因含有色氨酸、酪氨酸等氨基酸残基而发射较强的内源性荧光,药物与白蛋白的相互作用引起的白蛋白分子内源性荧光变化可为蛋白质分子中荧光生色基团的结构及其所处微环境变化提供有用的信息。利用荧光光谱法研究咪唑二羧酸镍配合物与血清白蛋白的相互作用,反映药物在生物体内的性质,使我们更清楚地认识药物在生物体内的具体作用,为药物的设计、筛选及新药的开发提供理论依据。
技术实现要素:
为了解决上述问题,本发明的目的是提供一种咪唑二羧酸镍配合物、制备方法及其应用。所述的咪唑二羧酸镍配合物制备方法简单,反应条件温和,纯度高。利用荧光光谱法研究配合物与血清白蛋白的相互作用发现,咪唑二羧酸镍配合物可与血清白蛋白自发发生作用,与血清白蛋白之间形成荧光较弱或者无荧光的复合物而引起BSA、HSA内源性荧光猝灭,其与BSA、HSA的结合改变了蛋白质分子的构象,结合位点更接近于色氨酸残基。
为了实现上述目的,本发明所采用的技术方案是:
一种2-羟甲基-1H-4,5-咪唑二羧酸制备的咪唑二羧酸镍配合物,所述的咪唑二羧酸镍配合物的分子式为C6H6N2Ni0.5O6。
一种咪唑二羧酸镍配合物的制备方法,包括以下步骤:
(1)将2-羟甲基-1H-4,5-咪唑二羧酸分散于溶剂中,配制成2-羟甲基-1H-4,5-咪唑二羧酸浓度为0.05mol/L的配体溶液;
将Ni(NO3)2·6H2O溶解于溶剂中,配制成Ni(NO3)2·6H2O浓度为0.05mol/L的镍盐溶液;
(2)将镍盐溶液和配体溶液按照2-羟甲基-1H-4,5-咪唑二羧酸和Ni(NO3)2·6H2O物质的量比1:1的比例混合;
(3)将步骤(2)的混合液置于反应容器中,在110-140℃条件下反应72h,再以5℃/h的速率降温至室温,自然干燥,即得。
所述的溶剂为去离子水。
所述的反应容器为聚四氟乙烯内衬不锈钢反应釜。
优选的,所述的反应温度为120℃。
一种所述的咪唑二羧酸镍配合物与牛血清白蛋白(BSA)、人血清白蛋白(HSA)的相互作用。
一种所述的咪唑二羧酸镍配合物在作为研究生物活性试剂方面的应用。
本发明的有益效果:
1、本发明以2-羟甲基-1H-4,5-咪唑二羧酸为配体,与镍离子配位,得到一种新的咪唑二羧酸镍配合物,该配合物为单斜晶系,P2(1)/c空间群;晶胞参数α=90°,β=104.72(3)°,γ=90°;V=817.7A3;Z=4;Dc=1.880Mg/m3;R1=0.0486,ωR2=0.1029。
2、本发明采用水热法,将Ni(NO3)2·6H2O与2-羟甲基-1H-4,5-咪唑二羧酸进行反应,使配体与相应的金属发生配合,从而得到新的咪唑二羧酸镍配合物。该合成方法简单、方便、安全,反应条件温和,产物为晶体,纯度高,便于后续活性研究。
3、本发明采用荧光光谱法研究配合物与牛血清白蛋白(BSA)、人血清白蛋白(HSA)的相互作用。结果表明,该配合物与BSA、HSA均能发生较强的相互作用,配合物作为药物可被血浆载运和储存。
附图说明
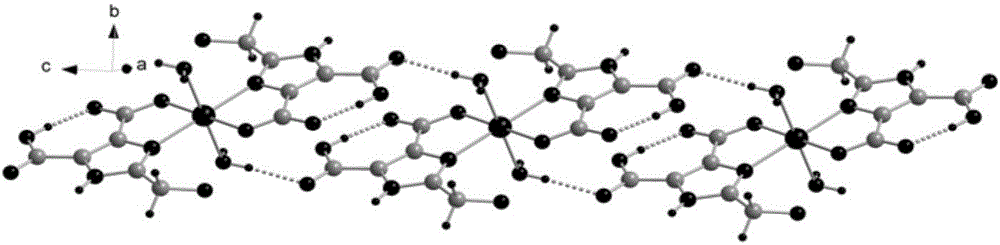
图1为咪唑二羧酸镍配合物的配位环境图。
图2为咪唑二羧酸镍配合物的一维超分子链状结构图。
图3为咪唑二羧酸镍配合物的三维超分子网状结构图。
图4为咪唑二羧酸镍配合物的模拟与实测的PXRD图谱对比图。
图5为不同温度下,BSA/HSA溶液随着咪唑二羧酸镍配合物浓度的增加荧光光谱的变化(箭头所指方向为咪唑二羧酸镍配合物浓度增加的方向)。a为298K时BSA的荧光光谱变化图,b为308K时BSA的荧光光谱变化图,c为298K时HSA的荧光光谱变化图,d为308K时HSA的荧光光谱变化图;插图为340nm处荧光强度随咪唑二羧酸镍配合物浓度的增加的变化图。
图6为不同温度下,咪唑二羧酸镍配合物对BSA、HSA的Stern-volmer曲线图。a为配合物对BSA的Stern-volmer曲线图,b为配合物对HSA的Stern-volmer曲线图。
图7为不同温度下,咪唑二羧酸镍配合物对BSA、HSA的双对数图。a为配合物对BSA的双对数图,b为配合物对HSA的双对数图。
图8为不同温度下,咪唑二羧酸镍配合物对BSA、HSA的同步荧光光谱图(箭头所指方向为咪唑二羧酸镍配合物浓度增加的方向)。a、b、c、d为不同温度时,BSA的同步荧光光谱图;e、f、g、h为不同温度时,HSA的同步荧光光谱图。
图9为不同温度下,咪唑二羧酸镍配合物对BSA、HSA的3D荧光光谱图。a、c、e、g分别为不同温度时,BSA、HSA的3D荧光光谱图;b、d、f、h为不同温度时,配合物与白蛋白的物质的量比为20:1时的3D荧光光谱图。
具体实施方式
以下结合实施例对本发明的具体实施方式作进一步详细说明。
本发明的配体2-羟甲基-1H-4,5-咪唑二羧酸的合成方法参照论文Sheng-Run Zheng,Song-Liang Cai,Mei Pan,Jun Fan,Tian-Tian Xiao,Wei-Guang Zhang,The construction of coordination networks based on imidazole-based dicarboxylate ligand containing hydroxymethyl group,CrystEngComm,2011,13,883–888。
实施例1 咪唑二羧酸镍配合物的合成
(1)将2-羟甲基-1H-4,5-咪唑二羧酸分散于去离子水中,配制成2-羟甲基-1H-4,5-咪唑二羧酸浓度为0.05mol/L的配体溶液;
将Ni(NO3)2·6H2O溶解于去离子水中,配制成Ni(NO3)2·6H2O浓度为0.05mol/L的镍盐溶液;
(2)将镍盐溶液和配体溶液按照2-羟甲基-1H-4,5-咪唑二羧酸和Ni(NO3)2·6H2O物质的量比1:1的比例混合;
(3)将步骤(2)的混合液置于聚四氟乙烯内衬不锈钢反应釜中,在120℃条件下反应72h,再以5℃/h的速率降温至室温,自然干燥,得到蓝色棱柱状晶体,即为咪唑二羧酸镍配合物。
实施例2 咪唑二羧酸镍配合物的结构表征
1、晶体结构分析
采用Bruker APEX-II CCD型单晶衍射仪对实施例1得到的咪唑二羧酸镍配合物进行晶体结构测试,测试结果为:
该配合物为单斜晶系,P2(1)/c空间群;晶胞参数α=90°,β=104.72(3)°,γ=90°;V=817.7A3;Z=4;Dc=1.880Mg/m3;R1=0.0486,ωR2=0.1029。
采用石墨单色化的Mo Kα射线以ω扫描方式收集数据。晶体结构采用直接法解出,并且用傅立叶技术扩展,按各向异性进行修正,所有数据经Lp因子校正。SHELXL-97程序对所有非氢原子坐标和温度因子进行了全矩阵最小二乘法精修。得到如图1所示咪唑二羧酸镍配合物的配位环境图,如图2所示的咪唑二羧酸镍配合物的一维超分子链状结构图,如图3所示的咪唑二羧酸镍配合物的三维超分子网状结构图。
由图1可知,所述咪唑二羧酸镍配合物的组成为[Ni0.5(H2hmIDC)(H2O)]n(n为大于等于1的整数,中括号内为最小不对称单元的组成),分子式为C6H6N2Ni0.5O6。配合物的单元结构包含半个Ni(II)离子、一个脱质子的H2hmIDC2-阴离子和一个配位水分子。在配合物中Ni(II)为六配位,分别与来自两个H2hmIDC2-配体上的两个氧原子(O1,O1#1)、两个氮原子(N1,N1#1)和两个配位水分子上的两个氧原子(O6,O6#1)螯合。Ni(II)处于稍扭曲的八面体NiN2O4配位构型中,O6、O6#1占据八面体的顶点位置,键角O(6)#1-Ni(1)-O(6)为180.00(8)°。Ni(II)周围的Ni-O配位键长为Ni(1)-O(1):Ni(1)-O(1)#1:Ni(1)-O(6):Ni(1)-O(6)#1:Ni-N配位键长为Ni(1)-N(1):Ni(1)-N(1)#1:
如图2所示,相邻分子通过羧基间的O-H…O连接成超分子链状结构。超分子链沿b方向通过配位水分子与羧基上的O-H…O氢键相连,扩展成二维结构。如图3所示,超分子链通过咪唑环与羟基之间的N-H…O氢键堆积形成超分子立体结构。
2、红外光谱分析
采用美国赛默飞公司(Thermo SCIENTIFIC)公司的NICOLET iS50傅里叶变换红外光谱仪对实施例1得到的咪唑二羧酸镍配合物进行红外光谱测试(采用KBr压片法,室温下扫描,测试范围为400-4000cm-1)。红外光谱中的特征吸收峰(cm-1):3309,2907,2791,1709,1542,1456,1386,1269,1223,1096,1039,984,906,860,774,728,671,538,456。
3、X射线粉末衍射分析
采用PANalytical公司生产的X’Pert PRO型粉末衍射仪,通过使用Cu-Kα1射线采集实施例1得到的咪唑二羧酸镍配合物的衍射数据(见图4)。
从图4分析可知,测得的咪唑二羧酸镍配合物的PXRD的图谱与模拟图谱基本吻合,这说明所述咪唑二羧酸类配合物的纯度很高,可用于性能研究。
实施例3 咪唑二羧酸镍配合物与血清白蛋白的相互作用
实验仪器:荧光分光光度计型号为F7000,日本日立公司生产。
试剂的配制及测试条件设置:
1、样品液的配制
2-羟甲基-1H-4,5-咪唑二羧酸镍配合物溶液:称取0.0046g 2-羟甲基-1H-4,5-咪唑二羧酸镍配合物配制成浓度为2×10-3mol/L的DMSO溶液。
Tris-HCl缓冲溶液:取Tris(三羟甲基氨基甲烷)3.0285g、氯化钠7.3124g,转移至250mL容量瓶中,蒸馏水定容后,摇匀。然后用盐酸调节pH至7.40。
牛血清白蛋白(BSA)溶液:称取牛血清白蛋白0.0333g,置于10mL容量瓶中,加入5mL Tris-HCl缓冲溶液溶解,用Tris-HCl溶液定容,配制成浓度为5×10-5mol/L的牛血清白蛋白溶液。
人血清白蛋白(HSA)溶液:称取人血清白蛋白0.0331g,置于10mL容量瓶中,加入5mL Tris-HCl缓冲溶液溶解,用Tris-HCl溶液定容,配制成浓度为5×10-5mol/L的人血清白蛋白溶液。
2、荧光光谱测试条件的设置
分别在298K、308K条件下,设定激发波长为280nm,激发和发射狭峰均为5nm,在285~450nm范围扫描其荧光光谱;在发射波长250~550nm,激发波长200~400nm范围内扫描其3D荧光光谱。并分别在波长差Δλ=15nm和Δλ=60nm时,扫描其同步荧光光谱。
3、荧光光谱的测定
取0.3mL牛血清白蛋白溶液(0.6mL人血清白蛋白溶液),Tris-HCl缓冲溶液14.7mL(14.4mL)于圆底烧瓶中,配成浓度为1×10-6mol/L的牛血清白蛋白溶液(浓度为2×10-6mol/L的人血清白蛋白溶液)。加入不同体积的配合物溶液,并在不同温度时测定其荧光光谱的变化(与BSA相互作用时,配合物浓度范围:0~8.47×10-4mol/L;与HSA相互作用时,配合物浓度范围:0~7.10×10-4mol/L)。
荧光光谱法测定配合物与血清白蛋白的相互作用:
1、荧光猝灭
蛋白质的荧光主要来自于由色氨酸残基,且蛋白质的内源性荧光及其变化能直接反映蛋白质内色氨酸残基自身及其所处环境的变化。采用荧光光谱法用实施例1所合成的配合物对牛血清白蛋白(BSA)、人血清白蛋白(HSA)的相互作用进行研究,结果如图5,BSA的浓度为1×10-6mol/L,随着配合物浓度的增加,BSA的内源性荧光逐渐减弱,当配合物浓度为8.47×10-4mol/L时,配合物对BSA内源性荧光的猝灭基本达到平衡;HSA的浓度为2×10-6mol/L,随着配合物浓度的增加,HSA的内源性荧光逐渐减弱,当配合物浓度为7.10×10-4mol/L时,配合物对HSA内源性荧光的猝灭基本达到平衡。说明在这298K、308K两个温度下,BSA、HSA的内源性荧光能有效的被配合物猝灭,而发射峰的形状和位置并没有发生变化,表明配合物与BSA、HSA之间形成了荧光较弱或者无荧光的复合物而造成BSA、HSA内源性荧光被猝灭。
2、猝灭机制
引起BSA、HSA荧光猝灭的原因有静态猝灭和动态猝灭。动态猝灭是一种能量转移或电子转移的过程,不影响蛋白质的结构和生理活性。静态猝灭是由于发生了配合反应,通常是产生了不发荧光的配合物,对蛋白质的二级结构可产生影响,并可能影响其生理活性。动态猝灭遵循Stern-volmer方程:
F0/F=1+Ksv[Q]=1+Kqτ0[Q] 公式(1)
F0和F分别为未加入和加入猝灭剂时BSA、HSA的荧光强度;Kq为双分子猝灭过程速率常数;Ksv为Stern-volmer方程的猝灭常数;τ0为没有猝灭剂存在下生物大分子平均寿命,约为10-8s;[Q]为配合物的浓度。
由以上公式可求得BSA、HSA猝灭过程的速率常数Kq(见表1)。
表1镍配合物与BSA、HSA相互作用的速率常数、结合常数、结合位点数
图6为不同温度下,咪唑二羧酸镍配合物对BSA、HSA的Stern-volmer图。由图6可知,在不同温度下,配合物-蛋白的Stern-volmer曲线呈现良好的线性关系;随着温度的升高Stern-volmer常数逐渐降低,表明配合物对蛋白的猝灭方式为静态猝灭。而两个温度下,配合物对蛋白质的猝灭过程的速率常数均大于各类猝灭剂对生物大分子的最大动态猝灭速率常数2.0×1010L·mol-1·s-1,进一步说明配合物与蛋白相互作用形成了不发荧光的复合物。
3、结合常数和结合位点数
配合物与BSA、HSA相互作用的结合常数和结合位点数可通过双对数方程获得:
log[(F0-F)/F]=logKb+nlog[Q] 公式(2)
图7为不同温度下,咪唑二羧酸镍配合物对BSA、HSA的双对数图。Kb为结合常数,n为结合位点数,计算结果(见表1)表明,配合物与BSA、HSA可形成1个结合位点,说明配合物与BSA、HSA均具有较强的结合能力。以血清白蛋白为载体,作为药物2-羟甲基-4,5-咪唑二羧酸镍配合物可通过血液运载和存储。
4、作用力类型
药物和白蛋白等生物大分子之间的作用力主要有分子间氢键、范德华力和静电引力等,分子间作用力的发生会引起体系热力学参数的变化,通过测定体系热力学参数的变化可以判断药物与白蛋白之间的主要作用力类型。不同药物与白蛋白的结合力类型也不相同,药物与蛋白之间的作用力类型的确定可根据两者作用前后焓变ΔH和熵变ΔS来判断,当温度变化不大时,反应的焓变ΔH可认为是常数。配合物与BSA、HSA的作用力类型由Van’t Hoff方程判断:
ln(K2/K1)=[1/T1-1/T2]ΔH/R 公式(3)
ΔG=ΔH-TΔS=-RTlnK 公式(4)
R为气体常数(8.314472J K-1mol-1),K1、K2为温度为T1、T2时的结合常数,镍配合物与BSA、HSA相互作用的热力学参数列于表2。
表2不同温度下镍配合物与BSA、HSA相互作用的热力学参数
一定条件下,药物与白蛋白的结合反应是否能自发进行与体系的吉布斯自由能变有关,吉布斯自由能小于零时,反应能够自发进行。这种自发过程可以分为熵驱动和焓驱动。熵、焓的大小与作用力类型之间的关系如表3:
表3熵焓的大小与作用力类型之间的关系
由表2、表3,配合物与BSA、HSA相互作用的热力学常数ΔH<0,ΔS<0,说明配合物与BSA、HSA之间存在氢键或范德华力。ΔG<0,则表明配合物与BSA、HSA的相互作用过程是自发进行的。
5、同步荧光光谱
血清白蛋白分子中因含有色氨酸、酪氨酸及苯丙氨酸等残基而发射较强的内源性荧光,其中色氨酸和酪氨酸的荧光强度比较大,并且两者的激发光谱相似,发射光谱会严重重叠,利用同步荧光光谱选择合适的Δλ可以达到简化光谱、减少光谱重叠和窄化谱带的目的,而通常情况下,Δλ=60nm的同步荧光光谱只显示色氨酸的特征光谱,Δλ=15nm的同步光谱只显示酪氨酸的特征光谱。根据同步荧光光谱发射波长的变化可以推测配合物对BSA、HSA色氨酸和酪氨酸微环境产生的影响,进而可以判断蛋白质构象的变化。
图8为不同温度下,咪唑二羧酸镍配合物对BSA、HSA的同步荧光光谱图,最大发射波长的位移结果列于表4。从图8可以看出随着配合物浓度的增加,Δλ=60nm时BSA、HSA的最大荧光强度比Δλ=15nm时降低更多,表4表明,Δλ=60nm时最大发射波长的红移更明显,证明随着配合物的加入BSA、HSA的构象发生变化,色氨酸所处环境的疏水性降低,即BSA、HSA内部的疏水腔结构有所瓦解,肽链的伸展程度有所增加。
表4最大发射波长的位移
6、3D荧光光谱
在三维荧光光谱中,荧光分子的荧光强度既随激发波长变化又随发射波长变化,荧光分子状态的变化可以通过三维荧光的指纹信息和荧光峰位置较好的反映出来。三维荧光光谱能够提供蛋白质构象变化的详细信息,氨基酸残基的最大发射波长与蛋白质微环境的极性有密切关系。咪唑二羧酸镍配合物对BSA、HSA的三维光谱如图9,峰a(peak a)为瑞利散射峰,其特征是λex=λem(Δλ=0);峰1(peak 1)、峰2(peak 2)是两种典型的光谱峰,从峰的位置看:加入配合物后,BSA、HSA的瑞利散射峰起始位置及荧光峰位置均无显著变化;从Stokes位移看:加入配合物后,BSA荧光峰的Stokes位移均不变,HSA荧光峰峰2的Stokes位移有所减小;从峰的强度看:加入配合物后,峰a的强度增强,而荧光峰的相对强度均有不同程度的降低;从荧光峰强度变化程度看:峰1和峰2强度降低的程度是不一样的,很显然配合物对峰2的猝灭作用更为明显。随着配合物的增加峰1、峰2荧光强度降低是由于配合物与白蛋白的结合位于由疏水性氨基酸构成的疏水腔中,正是配合物的引入导致了这种疏水微环境极性的改变,进而引起BSA、HSA构象的变化。
以上所述仅为本发明最佳的实施例,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!