一种利用UiO‑66金属有机框架材料净化含硒废水的方法与流程
本发明属于环境工程中的废水处理技术领域,具体地说,是涉及UiO-66金属有机框架材料用于净化含硒废水的方法。
背景技术:
硒元素最初是在硫酸制造厂的废物铅室渣中发现的。由于其在地壳中丰度很低,硒和碲、铼等一般被称作“稀有元素”或“稀散金属”。硒具有独特的光敏特性,此特性使其在静电复印领域应用最广。近年来,随着研究的不断深入,硒在电子、冶金、化学、玻璃制造等工业领域的应用越来越广泛,且在农业、医学领域也有一定的应用。此外,硒是被WHO(联合国卫生组织)确定的“人体必需”的微量元素之一,并被赋予“生命火种”的美誉。以硒半胱氨酸形式存在的硒是多种酶的活性中心,从而参与到生物体的新陈代谢,激素调节,抗氧化等过程中。但是,硒的不足或者过量都会造成生物体的病变。硒摄入量不足,会导致如克山病、大骨节病等;硒摄入量过多,则会导致硒中毒甚至癌症的发生。目前,硒污染的主要来源是农业灌溉用水、矿业开采用水以及工业污水等。
硒在废水中的主要存在形式为硒酸盐(Se(VI))和亚硒酸盐(Se(IV))。目前较为成熟的去除方法主要有化学沉淀法、絮凝沉淀法和生物处理法。化学沉淀法即使用含铁盐或铝锌粉末作为沉淀剂,可以有效的去除酸性废水中的亚硒酸根离子(SeO32-),但对硒酸根离子(SeO42-)的去除效果不明显;絮凝沉淀法是通过向废水中加入亚铁盐,使可溶性硒转化为不可溶的物质,但此法需要大量的亚铁盐,且会产生大量的污泥;通过厌氧生物处理将可溶性硒转化为单质硒并去除的方法虽然简单易行,但硒的去除率并不稳定。
金属有机框架(MOFs)材料是一类有机-无机的杂交材料,其是由无机金属中心(金属离子或金属簇)与桥连的有机配体通过自组装相互连接,形成的一类具有周期性网络结构的晶态多孔材料。MOFs材料一般具有多孔性、比表面积大、结构多样性、具有不饱和金属位点等特点,其比表面积一般在1000—10000m2/g之间,孔隙率通常可以达到材料本体的50%以上。此外,不同的无机金属中心的金属离子配位数不同,相同的无机中心金属离子在不同的有机配体环境中也可能会呈现不同的配位数;有机配体的种类更是多种多样,其结构也是丰富多彩,并且,有机配体容易通过后修饰的手段定向引入功能基团(如Br、NH2、CH3等),对材料进行修饰和功能化,因此,可被广泛的用于吸附、催化和生物材料的制备等领域。此外,MOFs材料具有独特的拓扑结构,可以应用于对物质的立体选择性分离。MOFs材料应用于催化反应时也具有很好的作用效果,是因为材料上的活性点位可以催化反应。因此,近年来,MOFs材料逐渐成为研究的热点内容。
UiO-66材料是以锆为金属中心,对苯二甲酸为有机配体的MOFs材料。因Zr-O-C键比较牢固,故UiO-66较其他的MOFs材料有更好的物理和化学稳定性;UiO-66系列材料具有较大的比表面积和较多的官能团,对多种污染物具有很好的吸附性能,如气体(CO2、CH4、水蒸气等)和有机物(正己烷、环己烷、二甲苯等),然而,UiO-66材料很少应用于阴阳离子的吸附;此外,UiO-66材料吸附的阴离子在碱性条件下容易解析,这利于材料的再生利用和阴离子的回收。
技术实现要素:
本发明的目的在于克服现有技术中存在的不足之处,提供一种高效净化含硒废水的硒酸根和亚硒酸根离子的方法,本发明还提供一种UiO-66金属有机框架材料净化含硒废水的用途。
本发明的首先提供一种UiO-66金属有机框架材料的制备方法,该方法步骤如下:
1)称取氯化锆(ZrCl4)溶解在的二甲基甲酰胺(DMF)中,搅拌30-40分钟;
2)称取对苯二甲酸(H2BDC)溶解在DMF中,搅拌15-25分钟后,逐滴加入2-10mL的冰醋酸;
3)将上述两溶液混合并搅拌20-30分钟,使混合均匀;
4)转入有聚四氟乙烯内衬的反应釜中,在120-130℃温度下,密封反应24-30h;
5)反应结束后,将反应釜自然冷却到室温,倾倒出上清液,离心得到白色固体物质,然后用无水乙醇浸泡洗涤4-6天,每天更换3-4次乙醇溶液;-50~-80℃冷冻干燥2-5小时后,得到UiO-66材料。
优选的,
步骤1)中,ZrCl4的质量为0.318-1.59g,DMF的体积为9.4-47mL
步骤2)中,H2BDC的质量为0.204-1.02g,DMF的体积为9.4-47mL,冰醋酸的体积为2-10mL。
本发明另外提供一种利用上述材料净化含硒废水的方法,所述方法包括:
1)调节含硒废水的pH值,然后将吸附剂UiO-66金属有机框架材料投入到含硒废水的反应容器中;
2)使吸附剂和含硒废水充分混合;
3)吸附达到平衡后,采用过滤的方法,分离UiO-66金属有机框架材料,即可得到澄清的待测溶液,即去硒的净化水:
其中:所述吸附剂为UiO-66金属有机框架材料。
所述的UiO-66金属有机框架材料净化含硒废水的方法,
步骤1)中,含硒废水浓度控制在1-120mg/L;用氢氧化钠或硝酸调节废水的pH值为5~7;吸附剂UiO-66系列金属有机框架材料的投加量为0.1~1.0g/L;
步骤2)中,充分混合吸附剂和含硒废水温度控制在15-35℃,振荡反应器的速度为150-250rpm/min,反应时间为1.5-24h;
步骤3)中分离的方法,采用过滤的方法分离UiO-66金属有机框架材料。
所述的UiO-66金属有机框架材料用于净化含硒废水的用途,主要应用于净化废水中的硒,包括含硒废水的硒酸根和亚硒酸根离子。
本发明与现有技术相比,具有如下的优点:
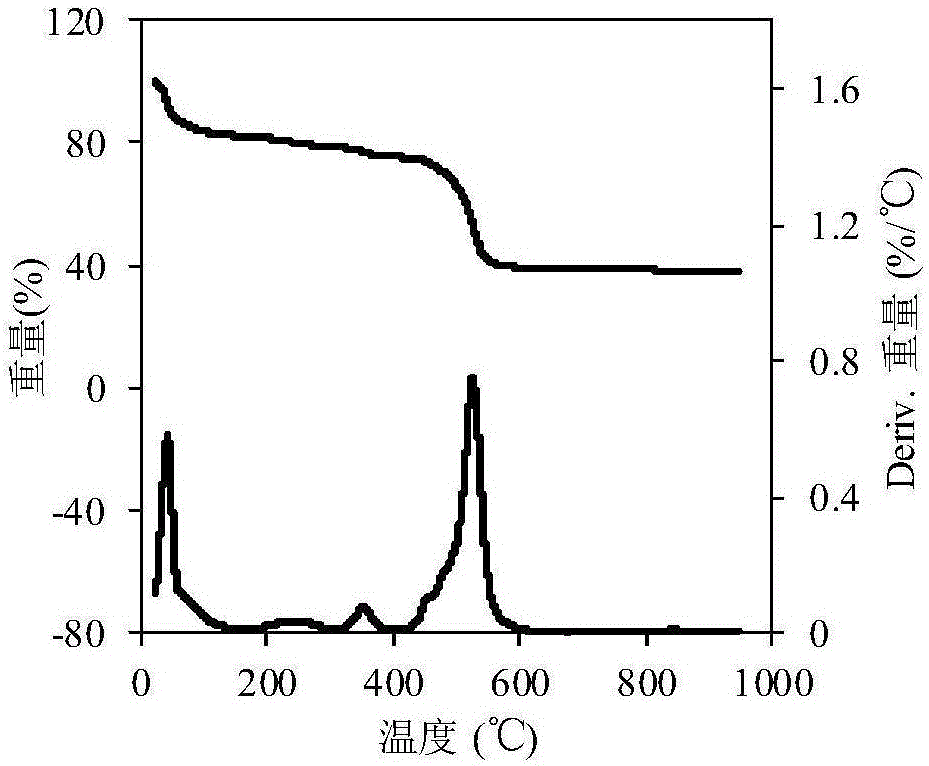
(1)本发明提供的UiO-66金属有机框架材料稳定性高(在水中可稳定存在,热解温度高达400℃);
(2)本发明提供的UiO-66金属有机框架材料比表面积大(1171m2/g),有利于快速接触水体中的硒离子,缩短了吸附平衡所需的时间,吸附速率快;
(3)本发明提供的UiO-66金属有机框架材料对硒的吸附容量大,净化效率高:UiO-66材料对于亚硒酸和硒酸的饱和吸附量分别可达59.9mg/g和37.3mg/g(以硒计)。
(4)该技术所使用材料吸附污染物后,材料易通过过滤手段,在短时间内从水体分离回用,回用时净化效果基本不受影响;解吸后的硒易回收利用。既完成废水处理,又实现硒的回收利用,一举两得。因此,UiO-66金属有机框架材料在硒的净化方面具有广阔的应用前景。
附图说明
图1为本发明实施例一中UiO-66材料的氮气吸附-脱附等温线图;
图2为本发明实施例一中UiO-66材料的热重曲线;
图3为本发明实施例一中UiO-66材料对亚硒酸根(Se(IV))和硒酸根(Se(VI))的吸附动力学图;
图4为本发明实施例一中UiO-66材料对亚硒酸根(Se(IV))和硒酸根(Se(VI))的等温吸附曲线图;
图5为本发明UiO-66净化亚硒酸根(Se(IV))和硒酸根(Se(VI))的重复利用结果。
具体实施方式
下面结合附图和三个实例对本发明作进一步描述,但以下实施例只用于对发明内容的进一步说明,并不会形成对本发明的限制。
实施例一
1)称取0.318-1.59gZrCl4溶解在9.4-47mL的二甲基甲酰胺(DMF)中,搅拌30-40分钟;
2)称取0.204-1.02g的对苯二甲酸(H2BDC)溶解在9.4-47mL的DMF中,搅拌15-25分钟后,逐滴加入2-10mL的冰醋酸;
3)将上述两溶液混合并搅拌20-30分钟,使混合均匀;
4)转入有聚四氟乙烯内衬的反应釜中,在120-130℃温度下,密封反应24-30h;
5)反应结束后,将反应釜自然冷却到室温,倾倒出上清液,离心得到白色固体物质,然后用无水乙醇浸泡洗涤4-6天,每天更换3-4次乙醇溶液;-50~-80℃冷冻干燥2-5小时后,得到UiO-66材料。
实施例二
1)将实施例一制备的材料,投加量为0.5g/L,投加到20mg/L含硒废水浓度的反应容器中,用氢氧化钠或硝酸调节废水的pH值为6±0.2;
2)25℃条件下,以180rpm/min的速度振荡反应容器,使吸附剂和含硒废水充分混合,反应时间为12h;
3)吸附平衡后,用过滤法分离此材料,即可得到澄清的待测液,待测液中的硒浓度使用电感耦合等离子体发射光谱仪(ICP-OES)测定,得到剩余硒浓度为5.07mg/L(亚硒酸钠)和16.5mg/L(硒酸钠)。
实施例三
为了确定实施例一制备的材料处理含硒废水效果,先进行模拟废水的一系列因素的实验。由于硒酸盐和亚硒酸盐是水体中硒存在的主要形式,因此用硒酸钠和亚硒酸钠分别配置含硒废水。将吸附材料与模拟废水混合,装入锥形瓶中,在恒温振荡培养箱中振荡,重复混合反应,反应后的混合液经过过滤分离,利用ICP-OES测定上清液中硒的浓度。吸附量计算公式如下:
式中:
qe为吸附材料平衡吸附量(mg/g);
C0为溶液中硒的初始浓度(mg/L);
Ce为溶液中硒的平衡浓度(mg/L);
V为溶液体积(L);
m为吸附材料质量(g);
由于UiO-66金属有机框架材料吸附硒后,可以经过滤分离,同时吸附的硒也随之分离,达到水体中硒的净化。因此,采用UiO-66金属有机框架材料对硒的吸附量代表净化硒的性能。吸附量越大,证明其净化效果越好。
不同影响因素的含硒废水对UiO-66吸附量的影响
(1)反应时间对UiO-66吸附含硒废水的影响
用0.01g实施例1制备的材料分别对20mL初始pH为6±0.2、浓度为20mg/L的含亚硒酸钠和硒酸钠模拟废水进行吸附反应,其中反应时间控制在1、5、10、20、30、60、90、120、240、360、480、600、720min,混合液经过滤分离后,测定上清液中硒浓度。不同反应时间下,硒离子的吸附率如图3所示。由图3可知,本发明的吸附材料对硒离子吸附速度快,在反应1.5h后基本达到吸附平衡。
(2)含硒废水的初始浓度对UiO-66吸附量的影响
以硒计硒酸钠和亚硒酸钠模拟废水的浓度,取8份浓度分别为5mg/L,10mg/L,20mg/L,40mg/L,60mg/L,80mg/L,100mg/L,120mg/L的硒酸钠废水20mL;8份浓度分别为5mg/L,10mg/L,20mg/L,40mg/L,60mg/L,80mg/L,100mg/L,120mg/L的亚硒酸钠废水20mL,装入离心管中,同时分别加入0.01g UiO-66,用氢氧化钠或硝酸调节废水的pH值为6±0.2,在25℃,转速180rpm/min下,吸附时间12h,混合液经过滤分离后,测定上清液中硒浓度。发现随着硒酸钠和亚硒酸钠浓度上升,吸附量也不断增大。其最大吸附量为:UiO-66对于亚硒酸钠和硒酸钠的饱和吸附量分别可达59.9mg/g和37.3mg/g,以硒计。(附图4所示)
(3)UiO-66重复使用次数对含硒废水净化率的影响
各取1份浓度为20mg/L的含硒酸钠、亚硒酸钠废水20mL,分别加入0.01g UiO-66,用氢氧化钠或硝酸调节废水的pH值为6±0.2,在25℃,180rpm/min转速下,吸附时间12h,混合液经离心分离后,测定上清液中硒浓度,分离的UiO-66加入0.1mol/L的NaOH溶液调节溶液的pH值为8.5±0.2进行解吸附,经洗涤后重复使用。发现经过5次循环后,对于废水中硒的吸附量仍保持在初次吸附量的90%以上。(附图5所示)
(4)UiO-66与其他吸附剂吸附硒的对比
从上表中可以看出,UiO-66在投加量低的情况下对硒的两种价态都具有较好的吸附效果,明显优于其他材料。
上述UiO-66材料的制备,不仅限于本实施例中所述的方法,可以市购或者采用其他制备UiO-66金属有机框架材料的方法。
参考文献:
Bleiman,N.,Mishael,Y.G.,2010.Selenium removal from drinking water by adsorption to chitosan-clay composites and oxides:batch and columns tests.Journal of Hazardous Materials 183,590-595.
Das,J.,Patra,B.S.,Baliarsingh,N.,Parida,K.M.,2007.Calcined Mg-Fe-CO3LDH as an adsorbent for the removal of selenite.Journal of Colloid and Interface Science 316,216-223.
Fu,J.,Zhang,X.,Qian,S.,Zhang,L.,2012.Preconcentration and speciation of ultra-trace Se(IV)and Se(VI)in environmental water samples with nano-sized TiO2 colloid and determination by HG-AFS.Talanta 94,167-171.
Fu,Y.,Wang,J.,Liu,Q.,Zeng,H.,2014.Water-dispersible magnetic nanoparticle-graphene oxide composites for selenium removal.Carbon 77,710-721.
Gonzalez,C.M.,Hernandez,J.,Parsons,J.G.,Gardea-Torresdey,J.L.,2010.A study of the removal of selenite and selenate from aqueous solutions using a magnetic iron/manganese oxide nanomaterial and ICP-MS.Microchemical Journal 96,324-329.
Gonzalez,C.M.,Hernandez,J.,Peralta-Videa,J.R.,Botez,C.E.,Parsons,J.G.,Gardea-Torresdey,J.L.,2012.Sorption kinetic study of selenite and selenate onto a high and low pressure aged iron oxide nanomaterial.Journal of Hazardous Materials 211,138-145.
Lounsbury,A.W.,Yamani,J.S.,Johnston,C.P.,Larese-Casanova,P.,Zimmerman,J.B.,2016.The role of counter ions in nano-hematite synthesis:Implications for surface area and selenium adsorption capacity.Journal of Hazardous Materials 310,117-124.
Sun,W.,Pan,W.,Wang,F.,Xu,N.,2015.Removal of Se(IV)and Se(VI)by MFe2O4nanoparticles from aqueous solution.Chemical Engineering Journal 273,353-362.
Szlachta,M.,Chubar,N.,2013.The application of Fe-Mn hydrous oxides based adsorbent for removing selenium species from water.Chemical Engineering Journal 217,159-168.
Wei,X.,Bhojappa,S.,Lin,L.,Viadero Jr,R.C.,2012.Performance of nano-magnetite for removal of selenium from aqueous solutions.Environmental Engineering Science 29,526-532.
Yamani,J.S.,Lounsbury,A.W.,Zimmerman,J.B.,2014.Adsorption of selenite and selenate by nanocrystalline aluminum oxide,neat and impregnated in chitosan beads.Water Research 50,373-381.
Zhang,L.,Liu,N.,Yang,L.,Lin,Q.,2009.Sorption behavior of nano-TiO2for the removal of selenium ions from aqueous solution.Journal of Hazardous Materials 170,1197-1203.
- 还没有人留言评论。精彩留言会获得点赞!