基于数字PCR鉴定纯合型和杂合型转基因玉米双抗12‑5的方法及应用与流程
本发明涉及转基因检测技术领域,尤其是涉及一种基于数字PCR鉴定纯合型和杂合型转基因玉米双抗12-5的方法及应用。
背景技术:
在采用转基因技术进行育种的过程中,首先要将目标基因导入受体植物中,一般来说,植物转化采用的受体品种都不是适宜商业化的品种,而是采用一些容易转化的品种,因此获得转基因植株后需要通过杂交的方法将转基因性状导入适宜商业化生产的品种中。在这一过程中,鉴定植物材料的纯合度是一项非常重要的工作。另外进行转基因生物及产品成分检测的一个重要的物质基础是转基因产品检测标准物质的获取,而原材料纯合度鉴定是制备标准物质的关键环节。目前对转基因植物进行纯合度鉴定通常采用的方法是将转基因植物材料进行自交或者与非转基因植株进行杂交,通过分析后代的性状分离进行鉴定,但是,这种鉴定方法需要花费大量的时间同时工作量也非常的大。
German等建立了实时荧光定量PCR的方法对转基因植物进行纯合度鉴定。实时荧光定量PCR方法有许多优势,比如快速、灵敏,但是在鉴定转基因植物的纯合度方面其精确性一直受到质疑,因为纯合性的鉴定要求能够对转基因的拷贝数达到精确区分2倍的差距的要求。采用实时荧光定量PCR的方法进行纯合度鉴定必须首先要建立标准曲线,从而确保靶标基因和内参基因反应的效率一致或非常接近。为了达到需要的精确度,要筛选优化引物,使其反应效率达到或接近100%,同时要采用高质量的定量PCR预混试剂和高质量的DNA。另外,这种方法需要一个已知纯合度的样品作为校准材料。因此,实时荧光定量PCR法通常是作为其它方法的补充。
数字PCR技术作为第三代PCR,具有不通过建立标准曲线就能够对靶标核酸进行直接定量的性能。目前有两种不同类型的数字PCR技术:微流体数字PCR和微滴数字PCR。在数字PCR中,采用微流体或微滴化方法,将大量稀释后的核酸溶液分散至芯片的微反应器或微滴中。这样经过PCR循环之后,有核酸分子模板的反应器或微滴就会给出荧光信号,没有模板的反应器或微滴就没有荧光信号。根据相对比例和反应器或微滴的体积,就可以推算出原始溶液的核酸浓度。数字PCR具有与实时荧光定量PCR相似的快速、灵敏的优点,同时,它具有对反应抑制物较强的耐受力(Hindson et al.,2013)。两种数字PCR技术均已被用于临床诊断、单细胞基因表达和环境微生物检测等研究中,在转基因成分定量方面也多有报道,Glowacka等近期报道了采用数字PCR技术对转基因烟草进行拷贝数和纯合度分析,结果显示数字PCR技术与Southern杂交法相比具有相同的可靠性同时更加快速。
技术实现要素:
本发明的目的在于提供一种基于数字PCR鉴定纯合型和杂合型转基因玉米双抗12-5的方法,为转基因玉米双抗12-5的杂交育种及标准物质或原材料的鉴定繁殖工作奠定基础,保障材料背景的真实可靠。
为解决上述技术问题,本发明采用如下技术方案:
一种基于数字PCR鉴定纯合型和杂合型转基因玉米双抗12-5的方法,提取待测样品的DNA进行PCR扩增,根据所述PCR扩增的荧光信号值计算所述待测样品中外源基因与内参基因的拷贝数比值,并根据所述拷贝数比值判断所述待测样品为纯合型还是杂合型转基因玉米双抗12-5。
优选地,内参基因的PCR引物序列如下:
adh1-F:5'-CGTCGTTTCCCATCTCTTCCTCC-3'(SEQ ID NO.1)
adh1-R:5'-CCACTCCGAGACCCTCAGTC-3'(SEQ ID NO.2)。
优选地,内参基因的PCR探针序列如下:
adh1-pro:5'-FAM-AATCAGGGCTCATTTTCTCGCTCCTCA-3'-BHQ1(SEQ ID NO.3)。
优选地,外源基因的PCR引物序列如下:
qSK12-5F:5′-GTCGTTTCCCGCCTTCAGTT-3′(SEQ ID NO.4)
qSK12-5R:5′-GGTGCCTGGAAGACAAGTTCTA-3′(SEQ ID NO.5)。
优选地,外源基因的PCR探针序列如下:
qSK12-5P:5′-FAM-AGCTCAACCACATCGCCCGACGC-3'-BHQ1(SEQ ID NO.6)。
优选地,所述内参基因的PCR反应体系以20μL计为:
2×ddPCR Supermix for probe,10μL;引物adh1-F的终浓度为0.9μM;引物adh1-R的终浓度为0.9μM;探针adh1-pro的终浓度为0.25μM;DNA模板,2μL;总反应体系为20μL。
优选地,所述PCR反应条件为:95℃预变性10min;95℃变性30sec,60℃退火及延伸45sec,共40个循环;98℃10min,4℃保存,升降温速度保持在2℃/秒。
优选地,所述外源基因PCR反应体系以20μL计为:
2×ddPCR Supermix for probe,10μL;引物qSK12-5F的终浓度为0.9μM;引物qSK12-5R的终浓度为0.9μM;探针qSK12-5P的终浓度为0.25μM;DNA模板,2μL;总反应体系为20μL。
优选地,所述PCR反应条件为:95℃预变性10min;95℃变性30sec,60℃退火及延伸45sec,共40个循环;98℃10min,4℃保存,升降温速度保持在2℃/秒。
优选地,根据所述拷贝数比值判断所述待测样品为纯合型还是杂合型转基因玉米双抗12-5为通过泊松分布公式计算出所述待测样品中外源基因与内参基因的拷贝数,外源基因拷贝数记为:Ne,内参基因拷贝数记为:Ni;通过Ne/Ni的值来判定样品为纯合型或杂合型,若Ne/Ni的值接近0.5(相对偏差<25%),则样品为杂合型,若Ne/Ni的值接近1.0(相对偏差<25%),则样品为纯合型。
上述方法在转基因玉米双抗12-5的杂交育种及标准物质或原材料的鉴定中的应用。
本发明的有益效果如下:
1、首次提供了利用数字PCR技术来鉴定转基因玉米双抗12-5纯和度的方法;
2、避免了传统的通过分析后代的性状分离进行鉴定纯和型或杂合型转基因玉米双抗12-5耗时长、工作量大的问题;
3、避免了利用实时荧光定量PCR方法鉴定纯和型或杂合型转基因玉米双抗12-5误差大、结果判断困难的问题。
总之,本发明是一种快速、准确和可靠地鉴定纯和型或杂合型转基因玉米双抗12-5绝对定量的方法。
附图说明
图1为杂合型转基因玉米双抗12-5内参基因Adh1数字PCR分析热图;
图2为杂合型转基因玉米双抗12-5转化事件特异性引物数字PCR分析热图;
图3为纯合型转基因玉米双抗12-5内参基因Adh1数字PCR分析热图;
图4为纯合型转基因玉米双抗12-5转化事件特异性数字PCR分析热图。
具体实施方式
下面将结合附图对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
由于数字PCR技术与Southern杂交法相比具有相同的可靠性同时更加快速,发明人通过数字PCR技术,建立一种鉴定纯合型和杂合型转基因玉米双抗12-5的方法,进而为转基因玉米双抗12-5的杂交育种及标准物质或原材料的鉴定繁殖工作奠定基础,保障材料背景的真实可靠。
发明人设计的数字PCR体系以20μL计为:
10μL 2x ddPCR Supermix for probe,2μL基因组DNA,加入引物和探针,使其终浓度达到900nM和250nM。
选用经prEN ISO21570验证的玉米Adh1基因定量检测引物,这一引物扩增的目标片段为134bp,其探针5’端标记荧光基团FAM,3’端标记BHQ1;内参基因的引物及探针的序列如下:
adh1-F:5'-CGTCGTTTCCCATCTCTTCCTCC-3'(SEQ ID NO.1)
adh1-R:5'-CCACTCCGAGACCCTCAGTC-3'(SEQ ID NO.2);
adh1-pro:5'-FAM-AATCAGGGCTCATTTTCTCGCTCCTCA-3'-BHQ1(SEQ ID NO.3);
双抗12-5转化体特异性定量检测引物为国家标准《农业部2259号公告-12-2015》中的引物,扩增片段长度为94bp,引物的5’端标记荧光基团FAM,3’端标记BHQ1;外源基因的引物及探针序列如下:
qSK12-5F:5′-GTCGTTTCCCGCCTTCAGTT-3′(SEQ ID NO.4)
qSK12-5R:5′-GGTGCCTGGAAGACAAGTTCTA-3′(SEQ ID NO.5);
qSK12-5P:5′-FAM-AGCTCAACCACATCGCCCGACGC-3'-BHQ1(SEQ ID NO.6);
发明人设计的PCR反应及反应条件为:
将20μL待测样品的反应体系用通用移液器加入到DG8 cartridge中间一排的8个孔,在DG8 cartridge最底一排8个孔中各加入70μL微滴发生油,在微滴生成仪中自动完成微滴生成。将生成的微滴转移到96孔板中,封上热封膜,放置常规PCR仪中进行PCR。
PCR扩增程序为:95℃预变性10min;95℃变性30sec,60℃退火及延伸45sec,共40个循环;98℃10min,4℃保存,升降温速度保持在2℃/秒。
PCR扩增后的数据分析,判断待测样品为纯合型还是杂合型
将完成PCR的96孔板放入微滴读取仪中,仪器自动完成每一个样本的微滴读取,要求每孔微滴生成数大于10000个才纳入统计分析,含有扩增信号的阳性微滴与未扩增的阴性微滴用荧光阈值来区分,利用QuantaSoft分析各反应孔中外源基因和内参基因的荧光信号值,通过泊松分布公式计算出各反应中外源基因与内参基因的拷贝数,外源基因拷贝数记为:Ne,内参基因拷贝数记为:Ni,通过Ne/Ni的值来判定样品为纯合型或杂合型,若Ne/Ni的值接近0.5(相对偏差<25%),则样品为杂合型,若Ne/Ni的值接近1.0(相对偏差<25%),则样品为纯合型。
实施例1
获得杂合的转基因玉米双抗12-5种子
使用已知为纯合的转基因玉米双抗12-5及其非转基因对照郑单958的种子。种子由浙江大学提供。将纯合的转基因玉米双抗12-5与非转基因对照郑单958种植于试验基地,通过将纯合的转基因玉米双抗12-5与非转基因对照郑单958杂交获得杂合的转基因玉米双抗12-5种子,收获的种子用于后续试验。
实施例2
提取DNA
分别称取200mg四份纯合和实施例1制备的四份杂合转基因玉米双抗12-5的种子粉状样品,按照试剂盒(DNeasy Plant Mini Kit,Qiagen,Hilden,Germany)说明提取DNA。在分光光度计260-280nm处测定所获DNA质量和纯度,并用琼脂糖凝胶电泳确定其完整性。
实施例3
PCR扩增
选用经prEN ISO21570验证的玉米Adh1基因定量检测引物,这一引物扩增的目标片段为134bp,其探针5’端标记荧光基团FAM,3’端标记BHQ1;内参基因的引物及探针序列如下:
adh1-F:5'-CGTCGTTTCCCATCTCTTCCTCC-3'(SEQ ID NO.1)
adh1-R:5'-CCACTCCGAGACCCTCAGTC-3'(SEQ ID NO.2);
adh1-pro:5'-FAM-AATCAGGGCTCATTTTCTCGCTCCTCA-3'-BHQ1(SEQ ID NO.3);
双抗12-5转化体特异性定量检测引物为国家标准《农业部2259号公告-12-2015》中的引物,扩增片段长度为94bp,引物的5’端标记荧光基团FAM,3’端标记BHQ1;外源基因的引物及探针序列如下:
qSK12-5F:5′-GTCGTTTCCCGCCTTCAGTT-3′(SEQ ID NO.4)
qSK12-5R:5′-GGTGCCTGGAAGACAAGTTCTA-3′(SEQ ID NO.5);
qSK12-5P:5′-FAM-AGCTCAACCACATCGCCCGACGC-3'-BHQ1(SEQ ID NO.6);
数字PCR体系:20μL的反应体系包括10μL 2x ddPCR Supermix for probe,2μL基因组DNA,加入引物和探针,使其终浓度达到900nM和250nM;将样品(20μL)反应体系用实验室通用移液器加入到DG8 cartridge中间一排的8个孔,在DG8 cartridge最底一排8个孔中各加入70μL微滴发生油,在微滴生成仪中自动完成微滴生成。将生成的微滴转移到96孔板中,封上热封膜,放置常规PCR仪中进行PCR。
PCR扩增程序为:95℃预变性10min;95℃变性30sec,60℃退火及延伸45sec,共40个循环;98℃10min,4℃保存,升降温速度保持在2℃/秒。
PCR扩增后的数据分析
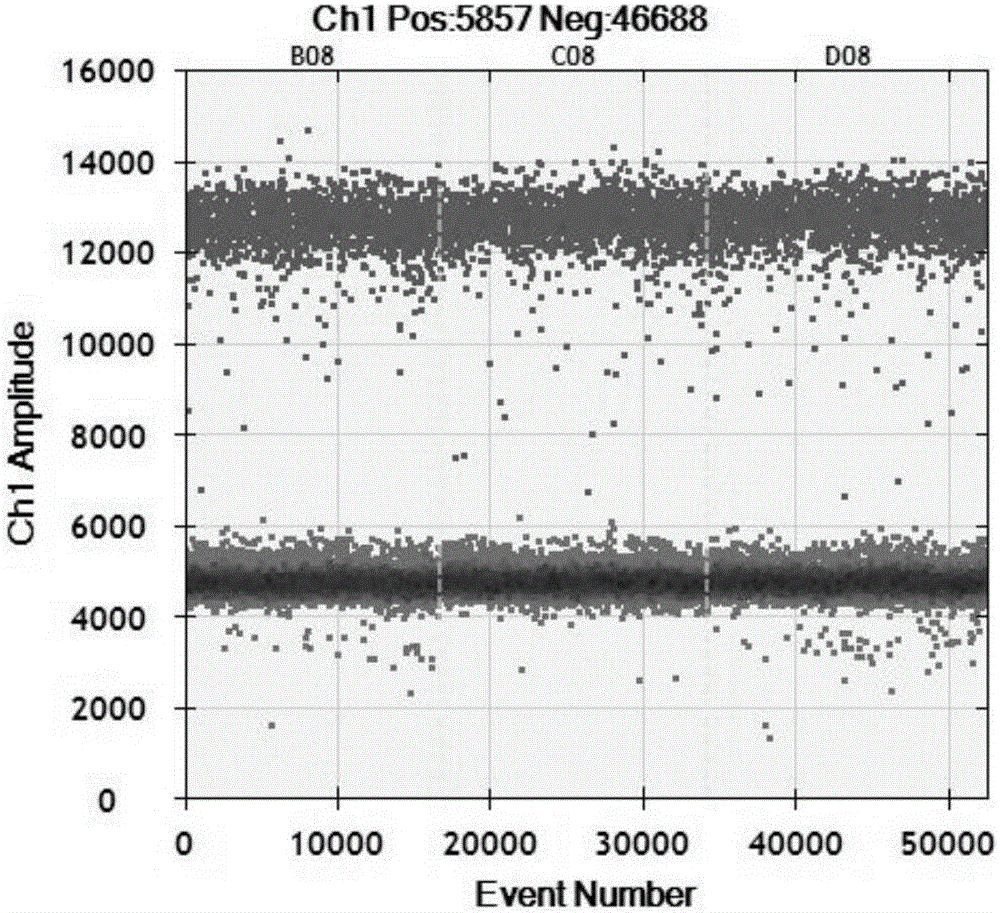
以DNA量为10mg的杂合型转基因玉米双抗12-5为模板,分别采用玉米内标准基因Adh1和双抗12-5转化事件特异性引物和探针建立数字PCR反应体系,图1为杂合型转基因玉米双抗12-5样品的三个重复的内参基因Adh1的数字PCR分析结果热图,三个重复的有效微滴数均在10000以上,能够计算出样品中靶标DNA的拷贝数,图2为对应的样品的三个重复的转化事件特异性序列的数字PCR分析结果热图,三个重复的有效微滴数均在10000以上,能够计算出样品中靶标DNA的拷贝数,如表1所示,杂合样品(杂合1-4)外源基因与内参基因的拷贝数比值接近0.5,计算结果与理论值之间的RSD都小于25%,且PCR结果的重复性很好,因此可以判定样品杂合1-4均为杂合型。
以DNA量为10mg的纯合型转基因玉米双抗12-5为模板,分别采用玉米内标准基因Adh1和双抗12-5转化事件特异性引物和探针建立数字PCR反应体系,图3为纯合型转基因玉米双抗12-5样品的三个重复的内参基因Adh1的数字PCR分析结果热图,三个重复的有效微滴数均在10000以上,能够计算出样品中靶标DNA的拷贝数,图4为对应的样品的三个重复的外源基因的数字PCR分析结果热图,三个重复的有效微滴数均在10000以上,能够计算出样品中靶标DNA的拷贝数,如表1所示,纯合样品(纯合1-4)外源基因与内参基因的拷贝数比值接近1,计算结果与理论值之间的RSD都小于25%,且PCR结果的重复性很好,因此可以判定样品纯合1-4均为纯合型。
表1转基因玉米双抗12-5数字PCR检测纯合度结果
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
<110> 浙江省农业科学院
<120> 基于数字PCR鉴定纯合型和杂合型转基因玉米双抗12-5的方法及应用
<160> 6
<170> PatentIn version 3.5
<210> 1
<211> 23
<212> DNA
<213> 人工序列
<400> 1
cgtcgtttcc catctcttcc tcc 23
<210> 2
<211> 20
<212> DNA
<213> 人工序列
<400> 2
ccactccgag accctcagtc 20
<210> 3
<211> 27
<212> DNA
<213> 人工序列
<400> 3
aatcagggct cattttctcg ctcctca 27
<210> 4
<211> 20
<212> DNA
<213> 人工序列
<400> 4
gtcgtttccc gccttcagtt 20
<210> 5
<211> 22
<212> DNA
<213> 人工序列
<400> 5
ggtgcctgga agacaagttc ta 22
<210> 6
<211> 23
<212> DNA
<213> 人工序列
<400> 6
agctcaacca catcgcccga cgc 23
- 还没有人留言评论。精彩留言会获得点赞!
- 基于环介导等温扩增消光技术的转基因玉米59122检测方法与流程
- 鉴定转基因植物或者转基因玉米双抗12‑5外源基因插入染色体位置的方法及其应用与流程
- CYP78A基因在增加玉米株高和增强植株长势中的应用的制作方法与工艺
- 转基因玉米次生代谢物的HPLC‑MS/MS检测方法与流程
- 一种区分转基因玉米和非转基因玉米的检测方法与流程
- 转基因玉米事件MON87419及其使用方法与流程
- 一种快速获取转基因玉米草甘膦耐受性表型的方法与流程
- 对应于转基因事件MON89034的玉米植物和种子及其检测和使用方法与流程
- 转基因玉米品系VCO‑01981‑5检测方法和试剂与制造工艺
- 一种快速创制转基因玉米双单倍体纯合后代的方法与制造工艺