三环二萜类似物及其制备方法、及其在制备抗前列腺癌药物中的应用与流程
本发明属于医药及其制备和应用的技术领域,具体涉及一种三环二萜类似物及其制备方法、及其在制备抗前列腺癌药物中的应用。
背景技术:
前列腺癌是一种严重威胁中老年男性健康的泌尿系统恶性肿瘤,全世界每年大约有68万男性被诊断为前列腺癌,其中22万死于前列腺癌。在欧洲,男性的前列腺癌发病率已超过肺癌列居第一位;在美国,前列腺癌排在男性癌症死亡率的第二位;在我国,前列腺癌的发病率呈逐年上升的趋势,增长率一度达到10%以上。前列腺癌早期无明显症状,常在体检时发现psa的数值升高,进一步检查后被发现和确诊。前列腺癌早期治疗主要采取局部治疗策略(手术或者局部放疗)(cancer2003,98,1169-1178.);多数患者在诊断时已经处于晚期,此时的主要治疗策略为去势治疗(手术或者药物去势)。晚期前列腺癌患者在经过18—24个月的治疗后,几乎都会发展成为去势抵抗性前列腺癌,临床上表现为对激素疗法和去势疗法的抵抗。基础研究表明,去势抵抗性前列腺癌与雄激素受体密切相关,靶向雄激素受体信号通路的药物是临床上治疗前列腺癌的有效手段。雄激素受体蛋白分为四个功能区(图1),分别为n端结构域(ntd)、dna结合域(dbd)、铰链区(hinge)和配体结合域(lbd)(journalofcarcinogenesis2011,10,1-20.)。目前针对去势抵抗性前列腺癌,临床上广泛使用的一线治疗药物,如阿比特龙(nature2014,510,278-282.)、恩杂鲁胺(mdv3100,drugs2013,73,1723-1732.)都是针对ar的lbd结合域开发的药物,它们能在一定程度上缓解前列腺癌症进展。研究表明大约有25%的患者一开始就对这两种药物耐药;此外随着治疗的进展,最初对这两种药物敏感的患者也会不可避免的均出现耐药现象,形成转移性去势抵抗性前列腺癌,最终导致患者死亡。迄今为止,还没有其它有效的治疗方案。
前列腺癌耐药的原因除了ar过表达和基因扩增外,最重要因素是ar的突变。突变主要包括:a)lbd结合域突变,该突变可导致传统的拮抗剂转变为激活剂,诱导产生去势抵抗性前列腺癌;b)突变产生雄激素受体剪切变异体(androgenreceptorsplicevariants,ar-vs),该突变使得癌细胞对现有的针对lbd结构域的抗前列腺癌药物产生耐药。ar-vs(主要为ar-v7和ar-v567es)是一种截短的ar,这些剪切变异体所编码的蛋白质同ar-fl一样在n-端都具有ntd和dbd结构域,但是在c-端缺少lbd(ar-v7)结构域或缺少完整的lbd结构域(ar-v567es)(图1)。由于ar-vs保留有dbd结构域,且具有持续性激活活性,因此仍能与基因组dna结合,调控下游靶基因的表达,促进前列腺癌的发展。同时,ar-vs缺少完整的lbd结构域,抗雄激素药物无法与之结合,也正因为这样,ar-vs对于传统抗雄激素治疗药物(作用于lbd结构域)表现出耐药性。因此,寻找对表达ar全长或同时表达ar全长(ar-fl)和ar-vs剪切变异体的前列腺癌细胞均有抑制作用的活性化合物,对于克服现有药物的耐药性,治疗去势抵抗性前列腺癌具有重要意义。目前,加拿大essapharmaceuticals研发的epi-001被认为是最具有开发前景的作用于剪切变异体ar-vs的ntd结构域的小分子活性化合物(oncologist2016,21,1427-1435.)。
技术实现要素:
本发明在寻找新型抗前列腺癌药物的研究过程中,首次提出了新的式(i)三环二萜类似物及其制备方法。在寻找新型抗前列腺癌药物的过程中,本发明人在自有化合物库中通过对三种不同类型的前列腺癌细胞株,包括:a)du145(不表达ar,非雄激素依赖);b)表达全长ar的lncap(ar-fl);c)同时表达全长ar和剪切变异体ar-vs的22rv1(ar-fl和ar-vs),进行抗前列腺癌活性筛选,得到对du145抑制活性差,对lncap和22rv1抑制活性好的先导化合物(5)。如果化合物对于du145抑制活性差,而对于lncap和22rv1抑制活性较好,则说明化合物抗前列腺癌活性是与ar受体和剪切变异体ar-vs均相关,这类活性化合物有望克服现有药物的耐药性,发展成为新型的治疗去势抵抗性前列腺癌的药物。本发明以化合物(5)为先导物设计、合成了一系列化合物,这些化合物在细胞水平上抗增殖活性结果如表1所示。
本发明提供的一种三环二萜类似物,其结构如式(i)所示:
其中,r为杂环,包括:五元杂环,c1~c10烷基取代的五元杂环,六元杂环,c1~c10烷基取代的六元杂环,苯并五元杂环,c1~c10烷基取代的苯并五元杂环,苯并六元杂环,c1~c10烷基取代的苯并六元杂环。
优选地,r选自含一个杂原子的五元杂环、c1~c10烷基取代的五元杂环、六元杂环、c1~c10烷基取代的六元杂环、苯并五元杂环、c1~c10烷基取代的苯并五元杂环、苯并六元杂环c1~c10烷基取代的苯并六元杂环;含两个杂原子的五元杂环、c1~c10烷基取代的五元杂环、六元杂环、c1~c10烷基取代的六元杂环、苯并五元杂环、c1~c10烷基取代的苯并五元杂环、苯并六元杂环c1~c10烷基取代的苯并六元杂环;其中,所述杂原子选自n、o、s,所述杂原子可以相同或不同。
进一步优选地,r选自吲唑环,c1~c10烷基取代的吲唑环,苯并噻唑环,c1~c10烷基取代的苯并噻唑环,吲哚环,c1~c10烷基取代的吲哚环,吡啶环,c1~c10烷基取代的吡啶环,苯并咪唑环,c1~c10烷基取代的苯并咪唑环,噻唑环,c1~c10烷基取代的噻唑环。
进一步优选地,r选自:
本发明还提供了一种三环二萜类似物的制备方法,包括以下步骤:
以式(1)为原料,经酯化反应、傅克酰基化反应、卤仿反应、水解反应后,得到如式(4)所示的三环二萜类似物;所述制备方法如路线(i)所示:
具体地,所述方法包括以下步骤(其中(2)和(3)的合成参照europeanjournalofmedicinalchemistry2015,90,10-20.):
(a)酯化反应
在有机溶剂中,在dmap催化下,原料(1)和乙酸酐发生酯化反应生成化合物(2)。
步骤(a)中,所述有机溶剂选自二氯甲烷、无水二氯甲烷之任意的一种;优选地,为无水二氯甲烷。
步骤(a)中,所述催化剂为dmap。
步骤(a)中,所述原料(1)、乙酸酐、dmap的摩尔比为1:(1.5-3):(0.1-0.5);优选地,为1:3:0.2。
步骤(a)中,所述酯化反应的温度为0-40℃;优选地,25℃。
步骤(a)中,所述酯化反应的时间为1-6h;优选地,为4h。
(b)傅克酰基化反应
在有机溶剂中,在三氯化铝(alcl3)催化下,化合物(2)和乙酰氯发生傅克酰基化反应,生成化合物(3)。
步骤(b)中,所述有机溶剂选自二氯甲烷、无水二氯甲烷、四氢呋喃之任意的一种;优选地,为无水二氯甲烷。
步骤(b)中,所述三氯化铝的作用为催化剂,所述乙酰氯为酰基的来源。
步骤(b)中,所述化合物(2)、三氯化铝、乙酰氯的摩尔比为1:1-3:1.5-4.0;优选地,为1:3:3。
步骤(b)中,所述傅克酰基化反应的温度为0-25℃;优选地,为0℃。
步骤(b)中,所述傅克酰基化反应的时间为1-3h;优选地,为2h。
(c)卤仿反应和水解反应
(c-1)卤仿反应
在溶剂中,溴单质和氢氧化钠发生歧化反应,生成次溴酸钠;然后在溶剂中,化合物(3)和次溴酸钠发生卤仿反应,生成中间体。
步骤(c-1)中,歧化反应中,所述溶剂选自水、1,4-二氧六环、二氯甲烷之任意的一种或多种;优选地,为水和1,4-二氧六环的混合溶剂。
步骤(c-1)中,歧化反应中,所述溴单质、氢氧化钠的摩尔比为3-6:1.5-2;优选地,为2:1;进一步优选地,为624:306。
步骤(c-1)中,所述歧化反应的温度为0-25℃;优选地,为0℃。
步骤(c-1)中,所述歧化反应的时间为0.5-2h;优选地,为1h。
步骤(c-1)中,卤仿反应中,所述溶剂选自二氯甲烷、无水二氯甲烷、水、四氢呋喃和1,4-二氧六环之任意的一种或多种;优选地,为水和1,4-二氧六环的混合溶剂。
步骤(c-1)中,卤仿反应中,次溴酸钠使化合物(3)羰基邻位的甲基变为羧基。
步骤(c-1)中,卤仿反应中,所述化合物(3)和次溴酸钠的摩尔比为1-2:8-20;优选地,为1:18。
步骤(c-1)中,所述卤仿反应的温度为0-25℃;优选地,为0℃。
步骤(c-1)中,所述卤仿反应的时间为0.4-1h;优选地,为0.5h。
(c-2)水解反应
在溶剂中,中间体和氢氧化钠发生水解反应,生成化合物(4)。
步骤(c-2)中,所述溶剂选自甲醇、水、乙醇之任意一种或者多种;优选地,甲醇和水的混合溶剂。
步骤(c-2)中,氢氧化钠使中间体含有的酯基水解成羟基和羧酸。
步骤(c-2)中,优选地,所述水解反应所用试剂为naoh固体。
步骤(c-2)中,所述氢氧化钠的用量与化合物(3)的摩尔比为1-6:0.5-2;优选地,为2:1。
步骤(c-2)中,所述水解反应的温度为25-60℃;优选地,为25℃。
步骤(c-2)中,所述水解反应的时间为1-12h;优选地,为6h。
本发明还提出了式(i)所示三环二萜类似物的制备方法,包括以下步骤:以式(4)所示的三环二萜类似物为原料,在dmap、edci、hobt催化下,分别与杂环胺r-nh2进行酰胺化反应,得到式(i)所示的三环二萜类似物。
所述制备方法的反应路线如下:
其中,r为杂环,包括:五元杂环,c1~c10烷基取代的五元杂环,六元杂环,c1~c10烷基取代的六元杂环,苯并五元杂环,c1~c10烷基取代的苯并五元杂环,苯并六元杂环,c1~c10烷基取代的苯并六元杂环。
优选地,r选自含一个杂原子的五元杂环、c1~c10烷基取代的五元杂环、六元杂环、c1~c10烷基取代的六元杂环、苯并五元杂环、c1~c10烷基取代的苯并五元杂环、苯并六元杂环c1~c10烷基取代的苯并六元杂环;含两个杂原子的五元杂环、c1~c10烷基取代的五元杂环、六元杂环、c1~c10烷基取代的六元杂环、苯并五元杂环、c1~c10烷基取代的苯并五元杂环、苯并六元杂环c1~c10烷基取代的苯并六元杂环;其中,所述杂原子选自n、o、s,所述杂原子可以相同或不同。
优选地,r选自吲唑环,c1~c10烷基取代的吲唑环,苯并噻唑环,c1~c10烷基取代的苯并噻唑环,吲哚环,c1~c10烷基取代的吲哚环,吡啶环,c1~c10烷基取代的吡啶环,苯并咪唑环,c1~c10烷基取代的苯并咪唑环,噻唑环,c1~c10烷基取代的噻唑环。
进一步优选地,r选自:
本发明中,优选地,所述杂环胺r-nh2选自:5-氨基吲哚、2-氨基苯并噻唑、2-氨基-4甲基苯并噻唑、6-氨基苯并噻唑、6-氨基吲哚、5-氨基吲哚、6-氨基吲唑、2-氨基苯并咪唑、2-氨基-5甲基噻唑、2-氨基吡啶、2-氨基噻唑、2-氨基-4甲基吡啶、2-肼基-1h-1,3-苯并咪唑。
其中,所述化合物(4)、edci、hobt、dmap:杂环胺的摩尔比为1:(2~6):2:(4~8):(2~6);优选地,为1:2:2:4:3。
其中,所述酰胺化反应的温度为25-50℃;优选地,为25℃。
其中,所述酰胺化反应的时间为6-12h;优选地,为8h。
本发明制备方法中,上述反应通常用薄板层析法跟踪测定反应的进度,反应完毕后采用的后处理方法通常包括浓缩、萃取、柱层析分离等,最终产物以核磁共振谱来验证。
本发明还提供了所述三环二萜类似物在制备全长ar-fl和剪切变异体ar-vs的转录活性的抑制剂中的应用。
本发明还提供了由上述方法制备得到的三环二萜类似物在制备抗前列腺癌药物中的应用。其中,所述三环二萜类似物用于抑制前列腺癌细胞的增殖,克隆形成的数量以及克隆形成的大小;所述前列腺癌细胞是指不表达ar的前列腺癌细胞、表达全长ar-fl的前列腺癌细胞以及同时表达全长ar-fl和剪切变异体ar-vs的前列腺癌细胞;其中,所述前列腺癌细胞包括lncap、22rv1、du145、vcap。
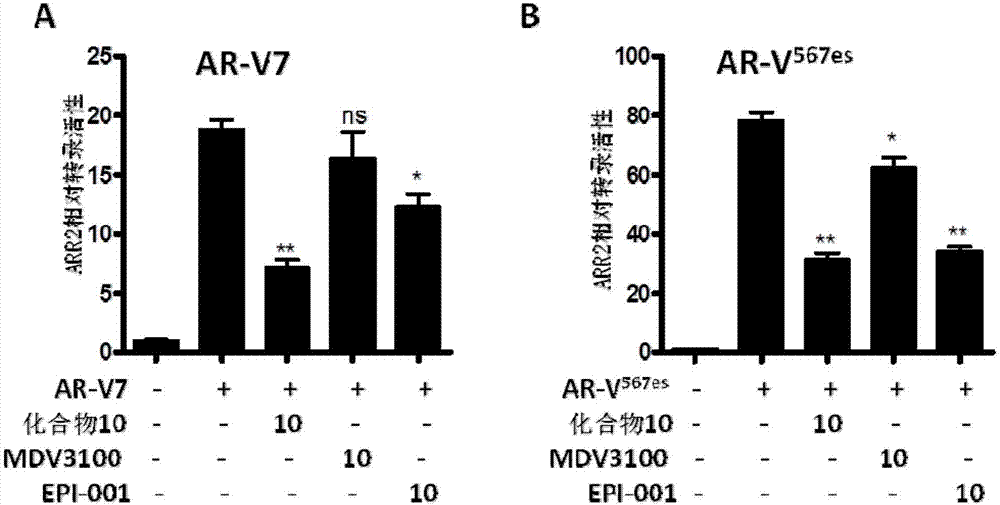
本发明三环二萜类似物在抑制表达ar-fl和ar-vs前列腺癌细胞增殖方面具有显著效果。本发明三环二萜类似物在前列腺癌细胞株lncap(ar-fl)和22rv1(ar-fl&ar-vs)均有抑制活性;luciferase实验(naturecommunications2016,7.)发现对ar-fl和ar-vs(ar-v7和ar-v567es)均有转录抑制活性,其中化合物10活性最好;化合物10能够在较低浓度下抑制前列腺癌细胞的克隆形成。
在具体实施方式中,本发明通过对c环羧基上进行结构改造,增强了三环二萜类似物对前列腺癌细胞株lncap(ar-fl)和22rv1(ar-fl&ar-vs)增殖抑制活性,如表1所示,表1的抗前列腺癌细胞活性测试结果表明,大多数化合物均能较好地抑制前列腺癌细胞增殖,ic50数据表明苯并杂环胺有利于抗前列腺癌增殖活性的提高(例如化合物5、8、9、10、12和17等),并且对前列腺癌细胞株lncap(ar-fl)和22rv1(ar-fl&ar-vs)均有良好的抑制活性。本发明选取ic50较好的化合物5、8、9、10、12和17用luciferase实验做进一步研究,结果如表2、表3和表4所示。表2的实验结果表明,化合物5、8、9、10、12和17对ar-fl有转录抑制活性;表3和表4的实验结果表明,化合物5、8、9、10、12和17对ar-vs(ar-v7和ar-v567es)均有转录抑制活性。根据表1、2、3和4的结果,化合物10对ar-fl、ar-v7、ar-v567es的抑制率分别为42%、64.5%和77.2%,本发明以化合物10作为最优候选化合物。图2的结果表明阴性对照mdv3100对ar-v7和ar-v567es的转录活性几乎没有抑制作用,化合物10抑制剪切变异体ar-v7转录活性的ic50为7.502um,抑制剪切变异体ar-v567es转录活性的ic50为8.813um,与阳性对照epi-001和阴性对照mdv3100相比,抑制活性更好。此外,化合物10在5um时能很好地抑制前列腺癌细胞系lncap(ar-fl)和vcap(ar-fl和ar-vs)的克隆形成,其效果明显优于10um的阳性对照epi-001和阴性对照mdv3100(图3)。因此本发明三环二萜类似物对表达ar全长或同时表达ar全长和ar-vs剪切变异体的前列腺癌细胞均有很好的抑制效果,具有良好的开发前景。
本发明的有益效果在于,本发明将初始原料化合物(1)依次通过酯化、傅克酰基化、卤仿反应、水解反应和酰胺化反应制备得到本发明三环二萜类似物。本发明合成化合物(4)的方法,操作简单、产率高。本发明将自有化合物库中筛选得到的具有抗去势抵抗性前列腺癌活性的三环二萜先导物(5),并在其结构基础上进行修饰,通过化合物(4)与不同的杂环胺酰胺化反应,制备得到一系列结构新颖的目的产物即式(i)三环二萜类似物。本发明制备方法的反应条件温和、所用试剂价格便宜、环境友好、合成路线短、产率高、合成方法简便。制备得到的本发明三环二萜类似物在在细胞水平上的抗前列腺癌效果均有相关实验评估,前列腺癌细胞株lncap(ar-fl)和22rv1(ar-fl&ar-vs)均有抑制活性;luciferase实验(naturecommunications2016,7.)发现所述三环二萜类似物对ar-fl和ar-vs(ar-v7和ar-v567es)均有转录抑制活性,其中化合物(10)活性最好;化合物(10)能够在较低浓度下抑制前列腺癌细胞的克隆形成。
附图说明
图1全长雄激素受体(ar-fl)和剪切变异体(ar-vs)结构图:ar-vs的剪切变异体包括ar-v7和ar-v567es。
图2化合物10抑制剪切变异体ar-vs(包括ar-v7和ar-v567es)的转录活性(16h);阴性对照mdv3100对剪切变异体ar-vs(ar-v7和ar-v567es)的转录活性几乎没有抑制作用,化合物10抑制剪切变异体ar-vs(ar-v7和ar-v567es)的转录活性的ic50分别为7.502um和8.813um,与阳性对照epi-001相比,化合物10抑制前列腺癌细胞系ar-vs的转录活性效果更好。
图3化合物10抑制前列腺癌细胞克隆形成(7天);化合物10在5um时,很好地抑制前列腺癌细胞系lncap(ar-fl)和vcap(ar-vs)的克隆形成,明显优于10um的阳性对照epi-001和阴性对照mdv3100。
具体实施方式
结合以下具体实施例,对本发明作进一步的详细说明,实施本发明的过程、条件、试剂、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。下述实施例中,化合物结构由核磁共振仪测定;试剂主要由上海国药化学试剂公司提供;产品纯化主要通过柱色谱,硅胶(200-300)由青岛海洋化工厂生产。
实施例1:式(4)所示化合物的制备
式(4)所示三环二萜类似物即化合物4的制备:将化合物1(10.0g,36.5mmol)、dmap(558mg,7.3mmol)置于单颈瓶,n2置换,注入60ml无水dcm,慢慢滴加乙酸酐(10.4ml,109.5mmol),滴加完毕后,室温搅拌4h。tlc检测原料反应完全,慢慢滴加30ml水,用dcm(20ml×3)萃取水相,合并有机相,水洗,饱和nacl溶液洗,无水硫酸钠干燥,浓缩,硅胶柱层析(pe:ea=10:1),浓缩得产物2(11.42g白色固体,99.0%)。1hnmr400mhz,cdcl3)δ6.97(d,j=8.4hz,1h),6.77(d,j=2.4hz,1h),6.67(dd,j=8.4,2.8hz,1h),4.56(dd,j=11.2,4.8hz,1h),3.77(s,3h),2.94–2.86(m,1h),2.84–2.73(m,1h),2.27(dt,j=13.2,3.2hz,1h),2.08(s,3h),1.90–1.68(m,4h),1.66–1.58(m,1h),1.40(dd,j=12.0,2.3hz,1h),1.22(s,3h),0.97(s,3h),0.96(s,3h).
将上述所得的化合物2(5.4g,17.06mmol)、alcl3(6.83g,51.2mmol)置于单颈瓶,n2置换,注入40ml无水dcm,溶解完全,0℃下滴加乙酰氯(3.66ml,51.2mmol),搅拌2h。tlc检测原料反应完全,0℃下慢慢滴加20ml冰水,用dcm(20ml×3)萃取水相,合并有机相,水洗,饱和nacl溶液洗,无水硫酸钠干燥,浓缩,硅胶柱层析(pe:ea=10:1),浓缩得产物3(6.01g白色固体,98.1%)。1hnmr(400mhz,cdcl3)δ7.44(s,1h),6.79(s,1h),4.55(dd,j=11.2,4.8hz,1h),3.86(s,3h),2.98–2.87(m,1h),2.84–2.71(m,1h),2.57(s,3h),2.29(dt,j=13.2,3.2hz,1h),2.07(s,3h),1.38(dd,j=12.0,2.4hz,1h),1.23(s,3h),0.97(s,3h),0.96(s,3h).
500ml单颈瓶中加入naoh(12.24g,306mmol),水105ml和1,4-二氧六环68ml,搅拌均匀,0℃下滴加br2(4ml,624mmol),滴加完毕,搅拌1h备用。
将上述反应所得的化合物wy358(3.0g,8.37mmol)置于500ml单颈瓶中,加入1,4-二氧六环84ml和28ml,搅拌均匀,0℃下滴加170ml新制得nabro溶液,1h滴加完毕,立即tlc反应完全,滴加饱和nahso3水溶液至溶液至无色,浓盐酸调节ph为5-6,加入100mldcm,用dcm(60ml×3)萃取水相,合并有机相,水洗,饱和nacl溶液洗,浓缩得粗品3.5g(无需纯化,直接进行下一步)。
将上述3.5g粗品溶于甲醇(40ml)和水(5ml)的混合溶液,加入naoh(1.2g,30mmol),常温搅拌6h,tlc反应完全,用稀hcl调节ph<7,用dcm(40ml×3)萃取水相,合并有机相,水洗,饱和nacl溶液洗,无水硫酸钠干燥,浓缩,硅胶柱层析(dcm:meoh=50:1),得到产物4(2.4g白色固体,两步产率90.2%)。1hnmr(400mhz,dmso)δ12.35(s,1h),7.32(s,1h),6.89(s,1h),4.44(s,1h),3.76(s,3h),3.43(s,2h),3.09(t,j=8.0hz,1h),2.82(dd,j=16.8,6.0hz,1h),2.72–2.63(m,1h),2.30(d,j=13.2hz,1h),1.78(dd,j=12.8,7.2hz,1h),1.65(d,j=10.0hz,2h),1.42-1.33(m,1h),1.12(s,3h),0.97(s,3h),0.78(s,3h).
实施例2:式(5)、(6)、(7)、(8)、(9)、(10)、(11)、(12)、(13)、(14)、(15)、(16)、(17)所示三环二萜类似物的制备
三环二萜类似化合物(5)、(6)、(7)、(8)、(9)、(10)、(11)、(12)、(13)、(14)、(15)、(16)、(17)的通用合成方法:
将化合物(4)(150mg,0.47mmol)、edci(180.2mg,0.94mmol)、hobt(127mg,0.94mmol)、dmap(230mg,1.88mmol)及杂环胺(1.41mmol)置于50ml单颈瓶,n2置换,注入10ml无水dcm或者无水dmf,室温搅拌8h。tlc检测原料反应完全,加10ml水,用稀hcl调节体系ph<7,用dcm(10ml×3)萃取水相,合并有机相,水洗,饱和nacl溶液洗,无水硫酸钠干燥,浓缩,硅胶柱层析(dcm:meoh=60:1),浓缩得相应目标产物。
式(5)所示三环二萜类似物即化合物5,白色固体(90.2%);1hnmr(400mhz,cdcl3)δ9.89(s,1h),8.25(s,1h),8.05–7.9(m,2h),7.49(s,2h),6.88(s,1h),5.57(s,1h),4.03(s,3h),3.67–3.55(m,2h),3.34(dd,j=10.8,4.8hz,1h),3.06-2.98(m,2h),2.96(s,1h),2.88(s,1h),2.31(d,j=12.4hz,1h),1.96–1.91(m,1h),1.88–1.84(m,1h),1.24(s,3h),1.09(s,3h),0.92(s,3h).
式(6)所示三环二萜类似物即化合物6,白色固体(34.5%);1hnmr(400mhz,cdcl3)δ11.21(s,1h),7.99(s,1h),7.82(dd,j=13.2,8.0hz,2h),7.44(t,j=7.2hz,1h),7.30(t,j=7.6hz,1h),6.90(s,1h),4.07(s,3h),3.34-3.31(m,1h),3.03-2.95(m,1h),2.89-2.82(m,1h),2.30(d,j=12.8hz,1h),1.96-1.86(m,2h),1.81-1.70(m,3h),1.65-1.61(m,1h),1.31-1.23(m,1h),1.23(s,3h),1.09(s,3h),0.92(s,3h).
式(7)所示三环二萜类似物即化合物7,白色固体(68.7%);1hnmr(400mhz,cdcl3)δ11.19(s,1h),7.99(s,1h),7.67(d,j=7.6hz,1h),7.25-7.18(m,2h),6.90(s,1h),4.09(s,3h),3.35-3.31(m,1h),3.00-2.97(m,1h),2.89-2.80(m,1h),2.68(s,3h),2.31(d,j=13.2hz,1h),1.96-1.71(m,6h),1.34(d,j=12.4hz,1h),1.24(s,3h),1.09(s,3h),0.92(s,3h).
式(8)所示三环二萜类似物即化合物8,白色固体(72.0%);1hnmr(400mhz,cdcl3)δ10.05(s,1h),8.90(s,1h),8.76(s,1h),8.05(d,j=8.4hz,1h),7.98(s,1h),7.42(d,j=8.8hz,1h),6.88(s,1h),4.04(s,3h),3.38–3.28(m,1h),3.05–2.97(m,1h),2.95–2.80(m,2h),2.30(d,j=12.8hz,1h),1.96–1.90(m,1h),1.87–1.83(m,1h),1.77–1.73(s,2h),1.32(d,j=12.0hz,1h),1.23(s,3h),1.09(s,3h),0.91(s,3h).
式(9)所示三环二萜类似物即化合物9,白色固体,(58.9%);1hnmr(400mhz,dmso)δ11.07(s,1h),9.97(s,1h),8.13(s,1h),7.44(d,j=8.4hz,1h),7.40(s,1h),7.27(s,1h),7.10(d,j=8.4hz,1h),6.97(s,1h),6.36(s,1h),5.33(s,1h),4.50(d,j=5.2hz,1h),3.91(s,3h),3.14-3.09(m,1h),2.93-2.87(m,1h),2.79-2.70(m,1h),2.39-2.35(d,j=12.8hz,1h),1.86-1.81(m,1h),1.71-1.64(m,3h),1.46-1.37(m,1h),1.17(s,3h),1.00(s,3h),0.81(s,3h).
式(10)所示三环二萜类似物即化合物10,白色固体(78.7%);1hnmr(400mhz,dmso)δ11.01(s,1h),9.88(s,1h),8.00(s,1h),7.42(s,1h),7.33(d,j=6.0hz,3h),6.97(s,1h),6.39(s,1h),4.48(d,j=4.8hz,1h),3.91(s,3h),3.14–3.09(m,1h),2.92–2.87(m,1h),2.79–2.70(m,1h),2.37(d,j=12.8hz,1h),1.86–1.79(m,1h),1.70–1.64(m,3h),1.46–1.39(m,1h),1.26–1.20(m,2h),1.17(s,3h),1.00(s,3h),0.81(s,3h).
式(11)所示三环二萜类似物即化合物11,白色固体(45.0%);1hnmr(400mhz,cdcl3)δ10.07(s,1h),8.50(s,1h),7.99(d,j=8.8hz,2h),7.68(d,j=8.4hz,1h),6.94(d,j=8.4hz,1h),6.89(s,1h),4.05(s,3h),3.60(dd,j=13.6,6.4hz,1h),3.34(dd,j=11.2,4.8hz,1h),3.02(dd,j=16.4,5.2hz,1h),2.33(d,j=12.8hz,1h),1.96-1.86(m,2h),1.83–1.74(m,2h),1.47(t,j=6.82h),1.24(s,3h),1.09(s,3h),0.92(s,3h).
式(12)所示三环二萜类似物即化合物12,白色固体,(38.5%);1hnmr(400mhz,cdcl3)δ11.19(s,1h),10.89(s,1h),7.95(s,1h),7.62(d,j=6.8hz,1h),7.2(d,j=6.4hz,1h),7.23(d,j=7.8hz,2h),6.91(s,1h),4.07(s,3h),3.346-3.32(m,1h),3.06-2.86(m,3h),2.32(d,j=12.8hz,1h),1.98-1.93(m,1h),1.90–1.81(m,2h),1.78–1.74(m,1h),1.33(d,j=12.0hz,1h),1.24(s,3h),1.10(s,3h),0.92(s,3h).
式(13)所示三环二萜类似物即化合物13,白色固体(40.0%);1hnmr(400mhz,cdcl3)δ10.98(s,1h),7.96(s,1h),7.11(s,1h),6.86(s,1h),4.02(s,3h),3.33-3.30(m,1h),3.01-2.95(m,1h),2.87-2.78(m,1h),2.41(s,3h),2.30(d,j=13.2hz,1h),1.96-1.86(m,2h),1.85-1.78(m,2h),1.75-1.70(m,1h),1.63-1.60(m,1h),1.22(s,3h),1.08(s,3h),0.90(s,3h).
式(14)所示三环二萜类似物即化合物14,白色固体(46.7%);1hnmr(400mhz,cdcl3)δ10.35(s,1h),8.41(d,j=8.4hz,1h),8.32(d,j=3.2hz,1h),7.94(s,1h),7.74-7.69(m,1h),7.04–7.01(m,1h),6.87(s,1h),4.03(s,3h),3.34-3.28(m,1h),3.02-2.97(m,1h),2.89–2.80(m,1h),2.30(d,j=12.8hz,1h),1.91(d,j=7.6hz,2h),1.79–1.73(m,2h),1.65–1.58(m,2h),1.23(s,3h),1.09(s,3h),0.91(s,3h).
式(15)所示三环二萜类似物即化合物15,白色固体(68.0%);1hnmr(400mhz,cdcl3)δ11.13(s,1h),7.96(s,1h),7.49(d,j=3.6hz,1h),6.99(d,j=3.2hz,1h),6.88(s,1h),4.04(s,3h),3.33(dd,j=11.2,4.8hz,1h),3.00(dd,j=16.8,6.0hz,1h),2.89–2.80(m,1h),2.33-2.28(m,1h),1.96–1.85(m,2h),1.83–1.72(m,2h),1.70–1.61(m,3h),1.23(s,3h),1.09(s,3h),0.91(s,3h).
式(16)所示三环二萜类似物即化合物16,白色固体(76.9%);1hnmr(400mhz,cdcl3)δ10.26(s,1h),8.27(s,1h),8.16(d,j=5.2hz,1h),7.93(s,1h),6.86(d,j=5.6hz,2h),4.00(s,3h),3.32(d,j=8.8hz,1h),3.03–2.97(m,1h),2.89–2.80(m,1h),2.38(s,3h),2.30(d,j=12.8hz,1h),1.96–1.90(m,1h),1.88–1.85(m,1h),1.83–1.78(m,1h),1.76–1.70(m,1h),1.62(m,1h),1.50(s,1h),1.33(dd,j=12.6,2.0hz,1h),1.23(s,3h),1.09(s,3h),0.91(s,3h).
式(17)所示三环二萜类似物即化合物17,白色固体(46.3%);1hnmr(400mhz,dmso)δ6.86(s,1h),6.81(s,1h),4.46(s,1h),3.75(s,3h),3.67(s,1h),3.23(s,2h),3.08-3.02(m,2h),2.82(dd,j=16.8,5.6hz,1h),2.72–2.65(m,3h),2.54(s,1h),2.39(s,3h),2.37(s,3h),2.32(d,j=12.8hz,1h),1.82–1.77(m,1h),1.66(s,2h),1.39(s,1h),1.20(t,j=7.6hz,3h),1.14(s,3h),0.98(s,3h),0.79(s,3h).
实施例3:三环二萜类似物抗前列腺癌细胞增殖测试
采用srb法对3株前列腺癌细胞(du145、lncap、22rv1)进行抑制增殖活性测试。
(1)测试原理
srb(磺酰罗丹明b)是一种粉红色阴离子染料,易溶于水,在酸性条件下可特异性地与细胞内组成蛋白质的碱性氨基酸结合;在515nm波长下产生吸收峰,吸光值与细胞量成良好线性正相关,可用作细胞数的定量检测。
(2)样品测试
(1)待测化合物用dmso溶剂溶解到20mm作为母液保存。(2)肿瘤细胞以适当的密度接种到96孔板上,在细胞培养箱培养24小时后,细胞加入不同浓度梯度的待测化合物处理48小时。其中,药物组分别用不同浓度梯度的本发明中三环二萜衍生物,对照组用相同对应浓度的dmso培养液,并使最终的dmso浓度不超过0.4%。(3)化合物处理细胞48小时后,取出培养板,加入50%tca溶液25μl/孔,4℃固定1小时,用水洗涤5遍,风干。(4)加入0.4%srb溶液50μl/孔,染色10分钟,弃去染色液,1%冰醋酸洗涤5遍,风干。(5)用100μltris-base碱液(10mm)溶解与细胞蛋白结合的srb染料,采用酶标仪在515nm波长下测定吸光值。(6)用graphpad软件计算ic50,实验重复三次,ic50取其平均值。
(3)测试结果
表1为各测试化合物对不同前列腺癌细胞株(du145不表达ar,lncap表达全长ar,22rv1表达全长ar和截短型ar)抑制细胞增殖方面活性数据(ic50)值见表1(48h)。测试结果表明,本发明三环二萜类似物均能较好地抑制前列腺癌细胞增殖,ic50数据表明苯并杂环胺有利于抗前列腺癌增殖活性的提高(例如化合物5、8、9、10、12和17等),本发明一系列式(i)三环二萜类似物对抑制雄激素受体阳性的前列腺癌细胞(lncap、22rv1)增殖均有较好效果。如表1所示,大多数三环二萜类似物均能在较低浓度下抑制雄激素受体阳性的前列腺癌细胞(lncap、22rv1)增殖,尤其是化合物5、8、9、10、12和17的抑制效果最佳。与不表达雄激素受体蛋白的前列腺癌细胞株du145相比,有数量级的差异。
表1三环二萜衍生物对前列腺癌细胞株的抗增殖活性(ic50)
实施例4:三环二萜类似物对ar全长和ar截短体转录活性测试
采用luciferase法对ic50较好的化合物5、8、9、10、12和17对ar全长和ar截短体的转录活性进行测试。
(1)测试原理
对于ar全长转录活性的测试,其原理为:arr2-luci质粒的启动子是能够和ar蛋白结合,并受到ar调控的dna区段。当质粒被转入lncap细胞并作饥饿处理后,10nm的r1881能刺激ar蛋白转录活性,促使arr2-luciferase下游luciferase的表达,并经由dual-luciferasereporterassay检测试剂盒进行检测,读值多少可表征下游基因的表达量。待测化合物和r1881同时处理细胞再测luciferase值,即可检测出待测化合物是否抑制ar转录活性及其抑制强度。
对于ar截短体转录活性的测试,其原理为:在本身不表达ar的pc3细胞中同时转入ar截短体质粒(ar-v7或ar-v567es)和arr2-luciferase。表达出来的ar截短体蛋白能够和arr2-luciferase结合,促使arr2-luciferase下游luciferase的表达,并经由luciferase检测试剂盒进行检测,读值多少可表征下游基因的表达量。质粒转染后同时加以待测化合物处理后的luciferase读值即可反映待测化合物是否抑制ar转录活性及其抑制强度。
(2)样品测试
对于ar全长转录活性的测试,其步骤为:在24孔板中接入适量lncap细胞,细胞贴壁生长24小时后,将arr2-luci质粒和renilla质粒以脂质体转染的方式转染入细胞。6h后将替换培养基,加入含有待测试药物和10nmr1881的去酚红和含5%活性炭过滤血清的培养基。处理16小时后用裂解细胞,按照dual-luciferasereporterassay试剂盒说明,用lumistaroptima化学发光多功能酶标仪测定luciferase和renilla读值,并进行数据换算和分析。
对于ar截短体转录活性的测试,其步骤为:在24孔板中接入适量pc3细胞,细胞贴壁生长24小时后,将ar截短体质粒(ar-v7或ar-v567es)、arr2-luciferase质粒和renilla质粒以脂质体转染的方式转染入细胞。6h后将替换培养基,加入含有待测试药物的去酚红和含5%活性炭过滤血清的培养基。处理16小时后用裂解细胞,按照dual-luciferasereporterassay试剂盒说明,用lumistaroptima化学发光多功能酶标仪测定luciferase和renilla读值,并进行数据换算和分析。
(3)测试结果
ar全长转录活性的测试结果如表2所示。可见本发明所述化合物5、8、9、10、12和17在1um时ar全长转录活性均有明显抑制作用,其中化合物17的抑制率达到40.1%,优于阳性对照epi-001和阴性对照mdv3100。ar-v7转录活性的测试结果如表3所示,可见本发明所述化合物5、8、9、10、12和17在10um时均对表达ar-v7的转录活性有抑制作用,其中化合物10达到64.5%,优于阳性对照epi-001和阴性对照mdv3100。ar-v567es转录活性的测试结果如表4所示。可见本发明所述化合物5、8、9、10、12和17在10um时,对ar-v567es的转录活性有抑制作用,其中化合物10达到77.2%,优于阳性对照epi-001和阴性对照mdv3100。因此,表3和表4的实验结果表明,化合物5、8、9、10、12和17对ar-vs(ar-v7和ar-v567es)均有转录抑制活性。
综上,根据表1、2、3和4的结果,化合物10对ar-fl、ar-v7、ar-v567es的抑制率分别为42%、64.5%和77.2%,本发明以化合物10作为最优候选化合物。
表2.化合物对ar-fl的转录活性抑制(16h)
表3.化合物对ar-v7剪切体的转录活性的抑制(16h)
表4.化合物对ar-v567es剪切体的转录活性的抑制(16h)
实施例5:化合物10抑制ar-v7和ar-v567es的转录活性测试
1、测试原理与样品测试方法同实施例4中ar截短体转录活性的测试的测试原理与样品测试方法。
2、测试结果
结果如图2所示,阴性对照mdv3100对ar-v7和ar-v567es的转录活性几乎没有抑制作用,化合物10分别对ar-v7和ar-v567es均有良好的转录活性抑制效果,半数抑制浓度ic50分别为7.502um和8.813um,在10um时的抑制效果优于同浓度的阳性对照epi-001。
实施例6:化合物10抑制lncap细胞和vcap细胞的克隆形成测试
采用体外克隆形成实验的方法测试化合物10分别对表达ar全长的lncap细胞和表达ar截短体的vcap细胞克隆形成能力的影响。
1、测试原理
细胞克隆形成率即细胞接种存活率,表示接种细胞后贴壁的细胞成活并形成克隆的数量。贴壁后的细胞不一定每个都能增殖和形成克隆,而形成克隆的细胞必为贴壁和有增殖活力的细胞。克隆形成率反映细胞群体依赖性和增殖能力两个重要性状。
2、样品测试
(1)消化处理处于对数生长期的相应细胞,并进行计数,每孔2x103个细胞接种于六孔板中,确保接种的细胞分布均匀。(2)待细胞贴壁后换液,加入含有不同浓度(0,1,2,5,10μm)测试化合物的完全培养基。(3)培养一周后,用吸泵吸掉原来的培养基,磷酸盐缓冲液清洗3次,用多聚甲醛溶液对细胞进行固定处理(20min),然后2‰结晶紫染液将细胞染色5min,最后用缓慢流动的自来水轻轻清洗,以洗掉未结合的结晶紫染液,室温自然干燥。(4)显微镜下拍照,计算细胞克隆形成数量
3、测试结果
实验结果如图3所示,图3表明化合物10能够在体外实验中以剂量依赖性的方式抑制表达ar全长的lncap(ar-fl)细胞和表达ar截短体的vcap(ar-fl和ar-vs)细胞的克隆形成数量和克隆形成大小。在5μm的浓度下,与10μm的阳性对照epi-001和阴性对照mdv3100相比,化合物10明显具有更好的克隆形成抑制能力。
目前,mdv3100和阿比特龙的耐药主要是因为治疗过程中产生了ar-vs剪切变异体的前列腺癌细胞。本发明实验表明,式(i)三环二萜类似物均有抗前列腺癌的活性,特别是化合物10是一种对表达ar全长或同时表达ar全长和ar-vs剪切变异体的前列腺癌细胞均有很好的抑制效果,能克服现有一线药物mdv3100和阿比特龙的耐药性,有望成为治疗去势抵抗性前列腺癌的潜在药物,具有良好的开发前景。
本发明的保护内容不局限于以上实施例,在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。
- 还没有人留言评论。精彩留言会获得点赞!