松材线虫SSR标记引物用于松材线虫检测的用途及松材线虫的PCR检测方法与流程
本发明属于植物病原检测领域,具体涉及一种松材线虫SSR标记引物用于松材线虫检测的用途及检测松材线虫的PCR检测方法。
背景技术:
松材线虫病是由松材线虫(Bursaphelenchus xylophilus)引起的松树毁灭性病害[1]。1934年首次被报道[2],1982年传入中国[3],以其致病能力强、传播途径广、蔓延速度快、防治难度大等特点[4-6],给世界林业带来巨大损失。由于松材线虫病在发病前期不易被发现和识别,并且传染性极强,对松树林区的破坏十分严重,因此尽管相关部门投入大量人力物力进行治理,然而收效甚微,松材线虫的危害仍在快速蔓延。2012年在距离黄山景区不足45公里的地方发现了疫情,松材线虫病已严重威胁到黄山景区内松林的生存。同时,各地病虫害上报情况显示,自松材线虫病1982年传入中国后,各大景区的松树频频陷入危机。因此,目前迫切需要多途径、多方式开展松材线虫的快速检测研究,以做好预防和检疫工作。SSR(Simple Sequence Repeats)标记[又名微卫星DNA(MicrosatelliteDNA)],是近年来发展起来的一种以特异引物PCR为基础的分子标记技术[7],具有多态性高、重复性好、共显性高、易检测、操作简单、无放射、所用时间较短、覆盖面广等优点,在DNA指纹图谱的构建、遗传多样性分析、基因定位、分子标记辅助育种等方面已得到广泛应用[8](Morgante et al.,1993;Milee et al.,2008;罗冉等,2010)。同时,SSR标记还具有物种专化性,是用于植物病原菌鉴定和检测的理想标记。2009年,Taisei等人[9]发表了松材线虫全基因组序列,更为松材线虫SSR标记的开发提供了全新的资源。本发明通过对徐峻荣等人[10]公布的可作为gSSR多态性标记的九对引物进行筛选,选出可对松材线虫DNA样本进行标记检测的引物,以开发更加快速有效的松材线虫分子检测技术与方法。
参考文献
[1]何龙喜,薛旗,吴小芹.松材线虫体内细菌对宿主繁殖和致病力的影响[J].南京林业大学学报(自然科学版),2016(03)
[2]Steiner G,Buhrer EM.Aphelenchoides xylophilus n.sp.a nematode associated with bluestain and other fungi in timber[J].J Agric Res,1934,48:949-951.
[3]Cheng H,Lin M,Li W,Fang Z.The occurrence of a pine wilting disease caused by a nematode found in Nanjing[J].For Pest and Dis,1983,4:1–5.
[4]Ye W,Giblin-Davis RM.Molecular Characterization and Development of Real-Time PCR Assay for Pine-Wood Nematode Bursaphelenchus xylophilus(Nematoda:Parasitaphelenchidae)[J].PLoS ONE,2011,8(11):e78804.doi:10.1371/journal.pone.0078804
[5]JUNG,J.,HAN,H.,RYU,S.H.&KIM,W.Microsatellite variation in the pinewood nematode,Bursaphelenchus xylophilus(Steiner and Bührer)Nickle in South Korea[J].Genes&Genomics,2010,32,147-154.
[6]Tóth.Chemical Research Center,Hungarian Academy of Sciences,Budapest,Hungary Bursaphelenchus xylophilus,the pinewood nematode:its significance and a historical review[J].Acta Biologica Szegediensis,2011,55(2):213-217
[7]罗冉,吴委林,张旸,等.SSR分子标记在作物遗传育种中的应用[J].基因组学与应用生物学,2010,29(01):137-143
[8]黄海燕,杜红岩,乌云塔娜,刘攀峰,等.基于杜仲转录组序列的SSR分子标记的开发[J].林业科学,2013,49(5):176-181
[9]Taisei K,James A C,Jonathan J D,et al.Genomic insights into the origin of parasitism in the emerging plant pathogen Bursaphe-lenchus xylophilus[J].PLo S Pathogens,2011,7(9):1-17.
[10]许峻荣,吴小芹,刘云,等.基于松材线虫全基因组序列的SSR标记开发[J].南京林业大学学报(自然科学版),2014,38(2):36-42
技术实现要素:
本发明的目的包括:
提供一种检测、鉴定或鉴别松材线虫的方法;
提供一种松材线虫SSR标记引物用于松材线虫检测的用途;
提供一种PCR方法,用于检测、鉴定或鉴别松材线虫,等。
具体的,本发明公开了一种松材线虫SSR标记引物用于松材线虫检测的用途,所述SSR标记引物为:
上游引物:5’-TTATCGGGCTCAATCTCGG-3’
下游引物:5’-TAGTGACCCGGGGATCTTC-3’。
同时,本发明公开了一种检测松材线虫的PCR方法,包括以下步骤:
1)提取松材线虫基因组DNA;
2)使用TaqDNA聚合酶对步骤1)所得DNA进行扩增,PCR反应体系组成为:Taq PCR Master Mix 12.5μL,上、下游引物各0.5μL,模板DNA量为50ng,ddH2O补充至25μL;其中,所述上、下游引物为权利要求1所述的引物,上、下游引物量均为10μM;
扩增程序为:94℃预变性3min,94℃变性30s,55℃退火30s,72℃延伸1min,共34个循环;72℃延伸5min;
3)对步骤2)所得扩增产物做电泳检测,通过电泳结果是否含有一条314bp的条带,从而检测、鉴定或鉴别是否含有松材线虫。
优选的,步骤3)所述电泳检测为1.2%琼脂糖凝胶电泳。
进一步的,本发明所述检测松材线虫的PCR方法,还包括以下步骤4):
4)将步骤3)所得314bp条带回收纯化,测序,通过判断测序结果是否与序列表SEQ ID NO.1所示的SSR标记基因序列相同,进一步确认松材线虫的检测、鉴定或鉴别结果。
此外,本发明还公开了一种用于检测松材线虫的试剂盒或检测系统,包括权利要求1所述的引物;
优选的,所述试剂盒或检测体统还包括PCR扩增试剂、电泳试剂和/或序列分析软件。
所述Taq PCR Master Mix,购自上海莱枫生物技术有限公司,含0.1U·μL-1 Taq DNA poly-mersase,0.4nM dNTPs,2×Taq Buffer。
步骤4)所述的条带回收纯化,指经小量PCR产物纯化试剂盒回收,例如可采用购自上海莱枫生物技术有限公司的Sanprep柱式PCR产物纯化试剂盒进行回收纯化,然后送样外检测序。
本发明所述STS标记基因的核苷酸序列如序列表SEQ ID NO.1所示。
本发明选用不同的引物对来对松材线虫基因组DNA进行扩增,并通过凝胶电泳及DNA测序系统对获得的扩增产物进行检验及鉴定。结果显示,在表1所示的九对引物中,第九对引物显示出了稳定、特异的扩增效果,其灵敏度可达0.3pg/ul。经过反复优化,最终确定的PCR检测体系为:25μL总体积中包含TaqDNA聚合酶12.5μL,上、下游引物各0.5μL,模板DNA 0.5μL,双蒸水11μL。PCR反应程序为:94℃预变性3min;94℃变性30s,55℃退火30s,72℃延伸1min,共34个循环;72℃延伸5min。整个分子检测鉴定过程约耗时2h,可以实现松材线虫的快速检测的目标。
目前国内大多数松材线虫分子检测方法费时费力且花费较高,然而检测结果的稳定性以及检测的灵敏度却不尽如人意。随着测序技术的发展和生物基因组计划的实施,许多物种的全基因组测序工作均已开展,2009年松材线虫全基因组序列的公开,为松材线虫SSR标记的开发应用提供了全新的发展机遇。本研究是基于SSR标记,筛选出特异性及灵敏度均较好的引物,建立用此标记检测松树病株中松材线虫的PCR方法,旨在为该致病原的检疫检验和病害诊断提供更好更稳定的检测手段,有望在一定程度上降低松材线虫病对我国林业造成的巨大损失。
有益效果
本发明基于SSR标记,筛选出对松树病株中松材线虫特异性及灵敏度均较好的引物,建立了检测松树病株中松材线虫的PCR方法,可为松材线虫的检疫检验和病害诊断提供更好更稳定的检测手段。对降低松材线虫病对我国林业造成的巨大损失具有积极作用。
附图说明
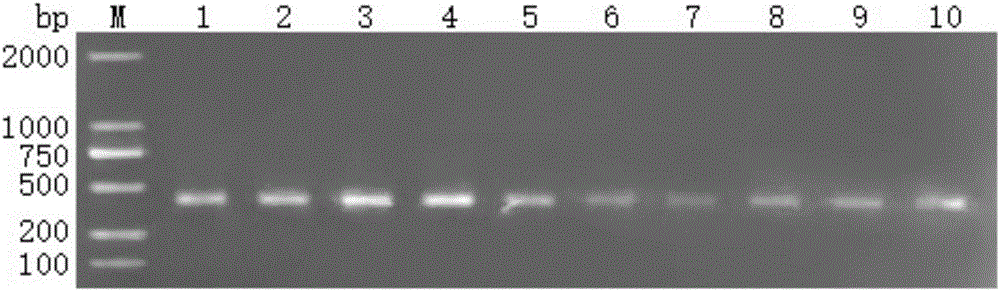
图1:9对引物与松材线虫SSR-PCR反应结果
图2:9号引物与不同地区松材线虫SSR-PCR扩增结果
图3:9号引物分别与松材线虫①、拟松材线虫扩增结果
图4:9号引物与不同浓度松材线虫SSR-PCR反应结果
具体实施方式
1材料与方法
1.1材料
供试线虫a.人工纯化培养的松材线虫(以下用松材线虫①表示),b.从江油市、凉山州、汉源市、名山等10个不同地区枯死松树体内分离的松材线虫(以下用松材线虫②表示),c.纯化培养的拟松材线虫,以上材料均由四川农业大学林学院林木病理实验室提供。
Taq酶Taq酶为具有热稳定性的DNA聚合酶,用于PCR扩增实验,购自成都擎科梓熙生物技术有限公司。
引物由成都擎科梓熙生物技术有限公司合成(见表1)。
表1 PCR引物序列及其扩增程序
Table1 Primer sequence and amplification procedure about PCR
1.2松材线虫的培养和收集
取保存的灰葡萄孢菌(Botrytis cinerea)接种于PDA培养基(1L PDA培养基成分:马铃薯200g,葡萄糖20g,琼脂16g)上。25℃培养5d后,将松材线虫①接种在灰葡萄孢菌上,25℃条件下令其生长繁殖,继续培养15d。随后将培养皿盖上的线虫收集至1.5mL离心管内,使用灭菌水多次清洗,再将其移至离心管中,-80℃保存备用。
1.3松材线虫基因组DNA的提取
采用Biomiga公司(中国)线虫基因组提取试剂盒提取松材线虫DNA。具体操作为:取20μL松材线虫混合液于1.5mL离心管中,加入350μL Buffer MTL和25ul Proteinase K,充分混匀后,50℃温浴30min,直至样品完全溶解。再加入350μL氯仿/异戊醇(24:1)涡旋混匀。10000xg离心2min,小心吸取上清液至一新的1.5mL离心管中。加入1倍体积Buffer MBL和5μL RNase A,最大速度涡旋15s以混匀,70℃温浴10min。再加入1倍体积无水乙醇最大速度涡旋15s以混匀,吸取700μL混合液加入到吸附柱中,10000xg离心1min,倒掉废液,将吸附柱重新插入收集管中。向吸附柱中加入500μL Buffer KB,10000xg离心1min。弃收集管与废液,将吸附柱放入一个新的收集管中,加入650μL DNA Wash Buffer,10000xg离心30s,倒掉废液,将吸附柱重新插入收集管中。13000xg开盖离心2min,彻底去除残留乙醇。最后将DNA吸附柱插入1.5mL离心管,向吸附柱中加入75μL Elution Buffer(65℃预热),室温静置2min,13000xg离心1min洗脱DNA,-20℃下保存备用。
1.4引物的筛选
利用已知的引物扩增供试松材线虫构建基于SSR标记的PCR反应体系。PCR反应体系为:25ul总体积中包含TaqDNA聚合酶12.5μL,上、下游引物各0.5μL,DNA模板0.5μL,双蒸水11μL。PCR反应程序为:94℃预变性3min;94℃变性30s,55℃退火30s,72℃延伸1min,共34个循环;72℃延伸5min。
取PCR扩增产物10μL于1%的琼脂糖凝胶电泳检测,电压为5V/cm,电泳时间为20min。置凝胶于302nm透射紫外灯上观察。若点样孔上方有单一扩增条带出现,则证明该对引物可对松材线虫进行特异性扩增;反之,点样孔上方无扩增条带或多条带杂乱,则该对引物对松材线虫的扩增不具有特异性。
2结果与分析
2.1引物特异性筛选结果
通过以上筛选过程,得到第1、2、3、4、5、6、7、8号引物(表1)扩增结果为杂乱条带,第9号引物(表1)可扩增出特异性条带(引物序号与泳道号一致)(见图1)。
2.2引物特异性检验
选取松材线虫②进行DNA的提取(参见上述步骤1.3)并分别与9号引物构建SSR-PCR反应体系,结果显示9号引物对松材线虫②的基因组DNA均扩增出了一条大小为315bp的特异性条带,(见图2)。同时利用9号引物分别扩增松材线虫①与拟松材线虫(对照组为松材线虫①,1—6号泳道均为拟松材线虫),结果见图3。
2.3引物的灵敏度检验
将松材线虫①的基因组DNA从3ng/μL进行梯度稀释得到7个处理,其浓度分别为30、3、3x10-1、3x10-2、3x10-3、3x10-4、3x10-5ng/μL(依次对应泳道1—7),采用设定好的扩增体系及程序分别扩增和检验,最终确定其最低检测阈值约为0.3pg/μL(见图4)。
序列表
<110> 四川农业大学
<120> 松材线虫SSR标记引物用于松材线虫检测的用途及松材线虫的PCR检测方法
<130> 2017
<160> 19
<170> PatentIn version 3.3
<210> 1
<211> 1
<212> DNA
<213> 松材线虫 (Bursaphelenchus xylophilus)
<400> 1
tgggagactg gccggatcga gccggaaggg ggcgtaagaa tgagaaacaa ggccaataca 60
aacgggctgg gaaacgggca ttcgaggacc ggaccggcgc aaaatccatt ttgtgtcttc 120
cacatgtgtg aaagctactg ctccaagtgc ccacgacgtc gccagccaat ccagccgccc 180
cacaagagag agagagagag agagagagag agggtgagac aaaaagtgtc aatacaggta 240
agtcatttta tataatttca atttgtaagt ctttttgtat aatttctatt tgaagatccc 300
cggggtcaca aaaa 314
<210> 2
<211> 18
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR04399 F
<400> 2
cacctgctgt cagtacac 18
<210> 3
<211> 20
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR04399 R
<400> 3
cagcgagcga tgacaagtca 20
<210> 4
<211> 19
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR04738 F
<400> 4
tacaatgtgc cgcaggatg 19
<210> 5
<211> 20
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR04738 R
<400> 5
cgacatctca ccggtcaacg 20
<210> 6
<211> 19
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR07780 F
<400> 6
atgtcggtgt cacggaaac 19
<210> 7
<211> 19
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR07780 R
<400> 7
ttgtagtccg cgtcggagt 19
<210> 8
<211> 22
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR04959 F
<400> 8
tttagcgtag tccccagagg tg 22
<210> 9
<211> 20
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR04959 R
<400> 9
ccgatgttct ttggctgtgc 20
<210> 10
<211> 18
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR08060 F
<400> 10
aacaacgccg attggtgt 18
<210> 11
<211> 19
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR08060 R
<400> 11
gccattcatt tccagggag 19
<210> 12
<211> 21
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR08026 F
<400> 12
agctgagcag tacttggtag g 21
<210> 13
<211> 22
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR08026 R
<400> 13
gcagtctggt tgcaaagggt gt 22
<210> 14
<211> 24
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR08605 F
<400> 14
ctatcatgcc tagcgtttct attc 24
<210> 15
<211> 18
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR08605 R
<400> 15
caccagctcc aaccacaa 18
<210> 16
<211> 24
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR09083 F
<400> 16
ttcccttgtc cgattgaagt ttcc 24
<210> 17
<211> 24
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR09083 R
<400> 17
tgcttgctag ccatgatttt attg 24
<210> 18
<211> 19
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR09215 F
<400> 18
ttatcgggct caatctcgg 19
<210> 19
<211> 19
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<223> NSSR08605 R
<400> 19
tagtgacccg gggatcttc 19
- 还没有人留言评论。精彩留言会获得点赞!