一种分泌甲氨蝶呤单抗的杂交瘤细胞株及制备方法、应用与流程
本发明属于生物技术领域,尤其涉及一种分泌甲氨蝶呤单抗的杂交瘤细胞株及制备方法、应用。
背景技术:
甲氨蝶呤(mtx)是一种抗恶性肿瘤药、抗风湿药,属于叶酸代谢拮抗剂。作为抗癌剂,它用于治疗白血病和滋养细胞疾病。但是,它有抑制骨髓功能、导致肝肾功能障碍的严重副作用,必须在用药过程中进行多次临床检查,仔细观察患者的状态。通常,在使用mtx后应用四氢叶酸钙(cf)进行解救从而减轻mtx不良反应,但仍然有不同程度的毒性反应,甚至有致死的危险。如何保证临床上既要大剂量治疗肿瘤而又不致产生严重的毒副反应就是监测mtx血药浓度。
mtx测定的方法包括微生物学,荧光分光光度法和分光光度法酶抑制方法以及竞争性蛋白结合测定,放射性和酶免疫测定。在甲氨蝶呤的血药浓度测定方法中,59.09%采用高效液相色谱法,34.09%采用荧光偏振免疫分析法,其它方法仅占6.82%。由于这些方法对于mtx和结构相关分子存在缺乏选择性,目前已经开发了同时测量药物及其代谢物的高效液相色谱(hplc)技术。尽管有这个优点,仍然需要可以在临床实验室中常规进行的mtx高灵敏的免疫测定方法。目前,只有mtx的血药浓度监测才能满足治疗的个体化,增加疗效,减少毒副作用,降低药动学差异,增加患者依从性。将近1/3的医院和研究机构必须寻找新的甲氨蝶呤血药浓度检测方法。而现有的抗体用于测定测试样品中甲氨蝶呤的存在或量的免疫测定时,由于特异性差而检测效果较差,常出现错误的测定结果。
技术实现要素:
针对现有技术中的上述缺陷,本发明的主要目的在于提供一种分泌甲氨蝶呤单抗的杂交瘤细胞株及制备方法、应用,所述杂交瘤细胞株能产生抗甲氨蝶呤单克隆抗体,所述抗体具有高度特异性,用于特异性识别甲氨蝶呤。
为了达到上述目的,本发明采用如下技术方案:一种分泌甲氨蝶呤单抗的杂交瘤细胞株,所述杂交瘤细胞株生物保藏编号为cctccno:c201726。
一种分泌甲氨蝶呤单抗的杂交瘤细胞株的制备方法,所述方法包括如下步骤:
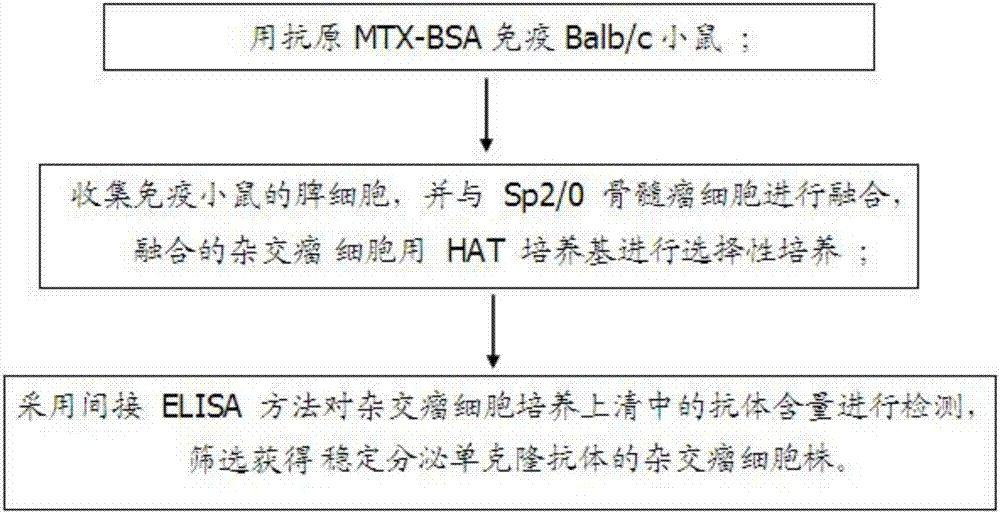
用抗原mtx-bsa(牛血清白蛋白)免疫balb/c小鼠;
收集免疫小鼠的脾细胞,并与sp2/0骨髓瘤细胞进行融合,融合的杂交瘤细胞用hat培养基进行选择性培养;
采用间接竞争elisa方法对杂交瘤细胞培养上清中的抗体含量进行检测,筛选获得稳定分泌单克隆抗体的杂交瘤细胞株。
作为进一步的优选,所述免疫包括:所述小鼠为6-8周龄雌性balb/c小鼠,将纯化的mtx-bsa蛋白与等体积的弗氏完全佐剂充分混合乳化,然后采用弗氏不完全佐剂乳化抗原,充分混合至油包水状态进行皮下多点免疫,2-3次加强免疫。
作为进一步的优选,所述融合包括:无菌条件下取小鼠脾脏制成细胞悬液,在peg1450介导下,融合小鼠骨髓瘤sp2/0细胞与脾细胞,融合后加入dmem培养基终止。
作为进一步的优选,所述小鼠骨髓瘤sp2/0细胞与脾细胞的个数比为1:5。
作为进一步的优选,所述检测包括:液体和半固体融合板检测。
作为进一步的优选,所述液体融合板检测包括:待融合板换液细胞长至中等大小约1万个细胞以上开始检测,在竞争法elisa质控合格后挑选阳性孔作亚克隆。
作为进一步的优选,所述半固体融合板检测包括:常规细胞融合后,用甲基纤维素半固体培养基重悬细胞沉淀,重悬于20ml2%甲基纤维素浓度的半固体培养基,于细胞培养皿中培养;7-10天后观察培养皿中细胞克隆的大小以及数量,在体式显微镜下挑出至20%胎牛血清的ht培养基中培养2-3天后进行效价检测,在竞争法elisa质控合格作亚克隆。
作为进一步的优选,所述甲基纤维素半固体培养基包括:dmem、mem、2%质量百分比的甲基纤维素、胎牛血清、50×hat以及l-谷氨酰胺。
一种分泌甲氨蝶呤单抗的杂交瘤细胞株的应用,所述杂交瘤细胞株用于制备抗甲氨蝶呤单克隆抗体,所述单克隆抗体可用于特异性识别甲氨蝶呤。
作为进一步的优选,所述抗甲氨蝶呤单克隆抗体的制备方法包括如下步骤:将所述杂交瘤细胞注射预先用弗氏不完全佐剂处理过的balb/c小鼠,收集所述小鼠的腹水,所述腹水经过预处理后纯化。
作为进一步的优选,所述纯化包括:选用proteing-琼脂糖亲和层析柱纯化。
本发明的有益效果是:
(1)本发明所述杂交瘤细胞株能产生抗甲氨蝶呤单克隆抗体,所述抗体具有高度特异性,用于特异性识别甲氨蝶呤,且不具有与7-羟基甲氨蝶呤的可检测的交叉反应性。在用于测定测试样品中甲氨蝶呤的存在或量的免疫测定时,避免了出现错误的结果。
(2)本发明制备的杂交瘤细胞株产生的抗甲氨蝶呤单克隆抗体亲和力高,普通单抗只在10的8次方级别,而本发明抗甲氨蝶呤单克隆抗体的抗亲和常数为k=9×109m-1。属高亲和力抗体。
(3)本发明筛选获得稳定分泌单克隆抗体的杂交瘤细胞株时,采用液体和半固体融合板检测两种方法综合起来进行筛选,最大几率的提高了融合克隆量;相比常规的只用一种方法的筛选方式,得到的抗体库的容量更大。
附图说明
图1为本发明实施例分泌甲氨蝶呤单抗的杂交瘤细胞株的制备方法的流程示意图。
具体实施方式
本发明通过提供一种分泌甲氨蝶呤单抗的杂交瘤细胞株及制备方法、应用,克服了现有技术测定测试样品中甲氨蝶呤的存在或量的免疫测定时,由于抗体特异性差而常出现错误测定结果的缺陷。
通常情况下,设计用于测定测试样品中甲氨蝶呤的存在时需要高度特异性的抗体,以避免错误的测定结果,因为这可能导致不适当的剂量变化,又会导致毒性副作用或施用小于最佳的甲氨蝶呤剂量。另外,当用于检测甲氨蝶呤的抗体与其他化合物交叉反应时,也可能发生错误的测定结果。最理想的,用于检测甲氨蝶呤的抗体应当不具有与7-羟基甲氨蝶呤的可检测的交叉反应性。而由本发明实施例杂交瘤细胞株产生的抗甲氨蝶呤单克隆抗体具有高度特异性,用于特异性识别甲氨蝶呤,且不具有与7-羟基甲氨蝶呤的可检测的交叉反应性;在用于测定测试样品中甲氨蝶呤的存在或量的免疫测定时,避免了出现错误的结果。
为了解决上述缺陷,本发明实施例的主要思路是:
本发明实施例分泌甲氨蝶呤单抗的杂交瘤细胞株,所述杂交瘤细胞株生物保藏编号为cctccno:c201726。
保藏单位为:中国典型培养物保藏中心(武汉大学),培养物名称为:杂交瘤细胞株4f2-1a9,保藏编号为:cctccno:c201726,保藏日期为:2017.4.11。
本发明实施例分泌甲氨蝶呤单抗的杂交瘤细胞株的制备方法,所述方法包括如下步骤:
用抗原mtx-bsa(牛血清白蛋白)免疫balb/c小鼠;
收集免疫小鼠的脾细胞,并与sp2/0骨髓瘤细胞进行融合,融合的杂交瘤细胞用hat培养基进行选择性培养;
采用间接竞争elisa方法对杂交瘤细胞培养上清中的抗体含量进行检测,筛选获得稳定分泌单克隆抗体的杂交瘤细胞株。
本发明实施例分泌甲氨蝶呤单抗的杂交瘤细胞株的应用,所述杂交瘤细胞株用于制备抗甲氨蝶呤单克隆抗体,所述单克隆抗体可用于特异性识别甲氨蝶呤。
所述抗甲氨蝶呤单克隆抗体的制备方法包括如下步骤:将所述杂交瘤细胞注射预先用弗氏不完全佐剂处理过的balb/c小鼠,收集所述小鼠的腹水,所述腹水经过预处理后纯化。
为了让本发明之上述和其它目的、特征、和优点能更明显易懂,下文特举数实施例,来说明本发明所述之分泌甲氨蝶呤单抗的杂交瘤细胞株及制备方法、应用。
实施例1
本发明实施例1分泌甲氨蝶呤单抗的杂交瘤细胞株,所述杂交瘤细胞株生物保藏编号为cctccno:c201726。
本发明实施例1分泌甲氨蝶呤单抗的杂交瘤细胞株的制备方法,所述方法包括如下步骤:
1、动物免疫
balb/c小鼠,8周左右成年雌性,抗原与等体积完全佐剂(首免)和不完全佐剂(加强免疫)混合并进行乳化,充分混合至油包水状态进行皮下多点免疫,2-3次加强免疫,每次免疫间隔周期2周,完成3次免疫后眼眶采血检测血清抗体效价,间隔2周,取小鼠血清以间接elisa检测效价。细胞融合前第5天采用相同方法最后免疫。高于>1:10000后1周内进行腹腔冲击,直接将免疫剂量的抗原溶于pbs中,如下表:
2、细胞融合
采用液体和半固体相结合的融合方式,最大机率的提高融合克隆量:末次冲击3天后,摘除眼球处死,并收集阳性对照血,取出脾脏,制备成单细胞悬液,然后取出处于对数期的sp2/0细胞处理后,与脾细胞以一定比例混合(1:5-1:10),50%peg1450作用1min,以基础培养基dmem稀释终止,低速离心后,取一半融合细胞用含20%胎牛血清的hat培养基轻轻悬浮并混匀,按照2×107/板铺至预先准备好的饲养层细胞板里,置于5%co2,37℃下培养。同时另外一半融合细胞用半固体培养基充分混匀后,铺皿,置于5%co2,37度下培养,具体步骤如下:
1)脾细胞:将免疫后的balb/c小鼠在无菌条件下取出其脾脏,并制成单个脾细胞悬液,在制备过程中严格保证无菌。制备脾细胞可选择研磨器+筛网或用无菌注射器吹吸。然后计数。
2)sp2/0准备:sp2/0细胞在融合前4天复苏,并用抗原筛选两次,隔天换液,在融合前一天换成普通培养基dmem、10%小牛血清。
3)饲养层细胞准备:将spf级balb/c小鼠在无菌条件下取出其脾脏,并用含20%胎牛血清的hat培养基制成单个脾细胞悬液,然后根据铺板数量,预先将其铺入到96孔板中。
4)终止液:基础培养基dmem20ml预先放入37℃水浴锅中孵育。
3、细胞株的筛选和克隆
1)融合板检测:
a、液体:待融合板换液细胞长至中等大小约1万个细胞以上开始检测(检测方法参见附表elisa方法)在竞争法elisa质控合格后挑选阳性孔作亚克隆。
b、半固体:常规细胞融合后,用甲基纤维素半固体培养基重悬细胞沉淀,取4g甲基纤维素溶于50ml双蒸水,高压灭菌后于4℃冰箱内磁力搅拌24h。无菌条件下加入2×dmem,配制成dmem-2%甲基纤维素。融合前1d将dmem、mem、2%甲基纤维素、胎牛血清、50×hat、l-谷氨酰胺按所需体积配制成用于重悬融合细胞的半固体培养基,充分混匀,置于4℃冰箱内,使用前充分震荡混匀,恢复室温后使用。将融合后的细胞沉淀,重悬于20ml2%甲基纤维素浓度的半固体培养基,于9cm细胞培养皿在5%co2、37℃、95%湿度细胞培养箱中培养。7-10天后观察培养皿中细胞克隆的大小以及数量,在体式显微镜下挑出至20%胎牛血清的ht培养基中培养2-3天后进行效价检测,检测方法参见附表elisa方法)在竞争法elisa质控合格作亚克隆。
2)亚克隆方法及检测:
挑出融合板中检测阳性值高的孔进行有限稀释,以每板60%的单克隆孔数量计数做亚克隆,每次均挑取竞争结果较好的单克隆孔进行有限稀释,每次亚克隆5-7天即可进行elisa检测,直到最终筛选出能稳定分泌阳性抗体的单克隆细胞株进行扩大培养。
3)细胞株建立:
将亚克隆阶段筛选出的稳定分泌阳性抗体的细胞株,扩大培养于24孔板,扩大后收集上清进行抗原检测,采用elisa梯度稀释及wb验证其稳定性,收集细胞扩大于10cm培养皿中,再次收集上清并检测其中抗体的效价,挑选出较高的1-3株细胞株培养于细胞瓶中,进行冻存。
4)细胞株冻存鉴定
在细胞株冻存完毕后必须复苏同一批次中的一支进行鉴定,鉴定标准:①复苏活细胞数≥100万个细胞/支;②活细胞中有活力细胞≥50万/株;③复苏细胞中不能有除细胞株细胞以外的其它微生物(如:细菌.真菌.支原体等)出现;④复苏细胞生长到一定数目后选出生长好的细胞作单克隆计数铺板,并检测单克隆的分泌抗体能力是否全阳或有抗体分泌;⑤细胞培养上清也需作竞争elisa检测,以确定杂交瘤细胞株的稳定性。结果鉴定得到3株稳定的杂交瘤细胞。其中标品浓度0.5ng/ml时,4f21a9细胞株上清稀释1000倍,竞争结果较好。取该株杂交瘤细胞分泌的单克隆抗体,进行间接竞争elisa实验,测试交叉反应率。该株细胞株的上清的交叉反应也比较好。选取该株进行后续实验。并将该株杂交瘤细胞株送到武汉中国典型培养物保藏中心保藏,保藏日期:2017年4月11日。保藏号为:cctccno:c201726。
实施例2
使用实施例1得到的杂交瘤细胞制备抗甲氨蝶呤单克隆抗体,包括如下步骤:
将实施例1得到的杂交瘤细胞注射预先用弗氏不完全佐剂处理过的balb/c小鼠,收集该小鼠的腹水,收集后的腹水经过预处理后选用proteing-琼脂糖亲和层析柱纯化,具体步骤如下:
1)配制缓冲液:起始缓冲液为ph7.0,20mmol/l磷酸缓冲液;洗脱缓冲液为ph2.70.1mmol/l甘氨酸盐酸。
2)准备收集管:取1.5ml离心管,每支离心管加70μlph9.0,浓度1mol/ltris-hcl。
3)样品准备:经50%sas沉淀得到的样品,置起始缓冲液进行透析过夜,并经0.22m微孔滤膜滤过。
4)纯化过程:用足够的起始缓冲液(8~10ml)平衡proteing-琼脂糖亲和层析柱(hitrapproteing1ml,pharmaciabiotech)。取待纯化的样品(每毫升样品含蛋白10.2~21.1mg)15~25ml上柱,流速为0.5ml/min,然后以同样的流速依次用起始缓冲液7~8ml、洗脱缓冲液6~7ml、起始缓冲液5ml洗涤,每管1ml收集洗脱液。⑤.纯度及活性鉴定纯化的mcab用sds-page鉴定其纯度。
为了得到抗甲氨蝶呤单克隆抗体的效果,对实施例2得到的单克隆抗体进行如下一系列试验予以证明:
试验1:
单抗亲和力常数测定,步骤如下:
①被:按照之前方阵摸索的包被浓度包被96孔板每孔50ul,37℃2小时或4℃过夜;
②封闭:2%bsa或者5%的脱脂牛奶封闭液200ul/孔,37℃1小时或4℃过夜,tbst洗4遍;
③一抗:将纯化后的抗体按一定比例稀释后加入到96孔板中,同时加对应体积的pbs,均50ul/孔,尽量不要打出泡沫,且添加均匀,之后放在96孔微型振荡器上,让液相混合更均匀,37℃温育1小时;
④二抗:一抗孵育后tbst洗4遍,加入酶标二抗,100ul/孔,37℃温育1小时。
⑤显色:二抗孵育后tbst洗4遍,加底物溶液100ul/孔,37℃恒温箱放置5~10min
⑥终止反应、比色:加30ul/孔终止液,颜色变黄并用酶标仪测定450nm的吸光值。
采用beatty所建立的非竞争elisa法采用spss15.0统计软件,以mab浓度为x轴,od值为y轴,经曲线回归分析中的curveestimation过程拟合结合反应曲线模型及其方程。依据曲线模型方程计算od100值,进而得到od50值。再将od50值代入曲线方程,计算相对应的抗体浓度,再结合beatty所推导的公式:k=(n-1)/2(n[ab]’t-[ab]t),计算亲和常数。根据beatty推导的公式,根据幂曲线模型计算的抗氨甲蝶呤单抗亲和常数为k=9×109m-1,属高亲和力抗体。
试验2:交叉反应率测试:
以待测药品叶酸配置标准品曲线,以不同浓度抗原和近似抗原分别做竞争抑制曲线,计算各自的结合率,求出各自在ic50时的浓度,并按下列公式计算交叉反应率。以交叉反应率评价方法的特异性。本发明实施例2制备的单克隆抗体,ic50在1ppb左右,且和叶酸以及7-羟基甲氨蝶呤没有交叉反应。
交叉反应率=ic50(氨甲喋呤)/ic50(叶酸)×100%=0.01%
交叉反应率=ic50(氨甲喋呤)/ic50(7-羟基甲氨蝶呤)×100%=0.05%
试验3:阳性定株杂交瘤细胞的验证
使用伯乐bio-rad的抗体分型试剂盒对抗体进行亚型的分型,结果测得细胞株4f21a9分泌的抗体的亚型为igg1。
上述本申请实施例中的技术方案,至少具有如下的技术效果或优点:
(1)本发明所述杂交瘤细胞株能产生抗甲氨蝶呤单克隆抗体,所述抗体具有高度特异性,用于特异性识别甲氨蝶呤,且不具有与7-羟基甲氨蝶呤的可检测的交叉反应性。在用于测定测试样品中甲氨蝶呤的存在或量的免疫测定时,避免了出现错误的结果。
(2)本发明制备的杂交瘤细胞株产生的抗甲氨蝶呤单克隆抗体亲和力高,普通单抗只在10的8次方级别,而本发明抗甲氨蝶呤单克隆抗体的抗亲和常数为k=9×109m-1。属高亲和力抗体。
(3)本发明筛选获得稳定分泌单克隆抗体的杂交瘤细胞株时,采用液体和半固体融合板检测两种方法综合起来进行筛选,最大几率的提高了融合克隆量;相比常规的只用一种方法的筛选方式,得到的抗体库的容量更大。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 还没有人留言评论。精彩留言会获得点赞!
- 杂交瘤细胞系(My‑C‑cC0C2‑235‑3H8)及其生产抗人心脏肌球蛋白结合蛋白C(C蛋白、MYBPC3、cMyBP‑C或者My‑C)单克隆抗体的应用的制作方法与工艺
- 一种杂交瘤细胞株、其分泌的单克隆抗体及应用的制作方法与工艺
- 杂交瘤细胞株QW8#及其产生的抗Ⅰ型拟除虫菊酯通用单克隆抗体的制作方法与工艺
- 杂交瘤细胞株7G11及其抗体的制作方法与工艺
- 一种杂交瘤细胞株及其产生的狂犬病毒磷蛋白单克隆抗体的制作方法与工艺
- 一种杂交瘤细胞株1A5、分泌的抗舒巴坦单克隆抗体及应用的制作方法与工艺
- 杂交瘤细胞无血清培养液的制作方法与工艺
- 一株降钙素原单克隆抗体杂交瘤细胞株CS12‑1及其应用的制作方法与工艺
- 一株抗甲基汞单克隆抗体杂交瘤细胞株GZ02及其应用的制作方法与工艺
- 一株多效唑单克隆抗体杂交瘤细胞株CS12‑1及其应用的制作方法与工艺
- 杂交瘤细胞系(My‑C‑cC0C2‑259‑1A4)及其生产抗人心脏肌球蛋白结合蛋白C(C蛋白、MYBPC3、cMyBP‑C或者My‑C)单克隆抗体的应用的制作方法与工艺
- 杂交瘤细胞系(My‑C‑cC0C2‑235‑3H8)及其生产抗人心脏肌球蛋白结合蛋白C(C蛋白、MYBPC3、cMyBP‑C或者My‑C)单克隆抗体的应用的制作方法与工艺
- 一种杂交瘤细胞株、其分泌的单克隆抗体及应用的制作方法与工艺
- 杂交瘤细胞株QW8#及其产生的抗Ⅰ型拟除虫菊酯通用单克隆抗体的制作方法与工艺
- 杂交瘤细胞株7G11及其抗体的制作方法与工艺
- 一种杂交瘤细胞株及其产生的狂犬病毒磷蛋白单克隆抗体的制作方法与工艺
- 一种杂交瘤细胞株1A5、分泌的抗舒巴坦单克隆抗体及应用的制作方法与工艺
- 杂交瘤细胞无血清培养液的制作方法与工艺
- 筛选抗微生物剂的方法与流程
- 一株抗甲基汞单克隆抗体杂交瘤细胞株GZ02及其应用的制作方法与工艺