DNA片段与含有该片段的重组载体、构建重组载体的方法及其应用与流程
本发明涉及生物医药领域,具体涉及dna片段与含有该片段的重组载体、构建重组载体的方法及其应用。
背景技术:
急性白血病是一种比较常见的血液系统恶性肿瘤,是人类致死的主要原因之一。近年来,随着联合化疗和造血干细胞移植技术的发展,使得白血病及其它血液系统肿瘤的预后不断改善,然而由于肿瘤的微小残留病变(mrd)不能被彻底清除,疾病复发率及死亡率较高。
研究发现,核酸疫苗能够激发白血病患者特异性免疫应答,清除化疗后残余肿瘤细胞,是有望克服mrd的方法之一。padua等将人类早幼粒细胞白血病的pml-rarα融合基因与破伤风毒素基因的c片段序列融合,证实以融合蛋白为特异性靶点的核酸疫苗可以显著提高患病动物的生存率。mlaa-34基因是与急性单核细胞白血病(aml-m5)发生密切相关的一个新的抗凋亡分子,mlaa-34基因表达下调能显著抑制u937细胞在体外的增值,同时会诱发白血病细胞的凋亡,并与aml-m5的低生存率等不良预后密切相关,是急性白血病的新肿瘤标志物及基因免疫治疗的靶基因。mlaa-34蛋白是胞内蛋白,如何有效递呈mlaa-34蛋白至白血病细胞膜表面从而持续诱导机体产生特异性细胞免疫并成为效应细胞毒性t细胞(ctl)的靶向分子,是疫苗能否发挥抗白血病作用的关键。hsp70与肿瘤的发生、发展、肿瘤免疫和肿瘤的预后等都有密切关系,其具有抗原递呈功能,能将肿瘤细胞内的抗原信息传递至细胞膜上,进而诱导机体产生特异性抗肿瘤免疫应答,且其诱导的免疫应答可不受mhc限制,可以起到很好的抗肿瘤免疫效应,从而起到杀灭肿瘤细胞的作用。
此外,关于核酸疫苗能否整合到宿主基因组上的安全性问题一直备受关注。研究表明,免疫方式对dna疫苗的整合安全性有很大影响,电穿孔免疫方式会导致基因组整合现象,而肌肉注射和基因枪(genegun)免疫方式较为安全,核酸疫苗的质粒dna是以染色体外附加子的形式存在,而不是整合到宿主染色体dna上。
技术实现要素:
本发明的发明目的之一是提供一组dna片段。
本发明的发明目的之二是提供包括上述dna片段的重组载体。
本发明的发明目的之三是提供构建上述重组载体的方法。
本发明的发明目的之四是提供通过上述重组载体进行基因疫苗的制备。
本发明提供的技术方案为:
dna片段,由序列表中的seqidno.1所示的碱基序列组成。
含有外源多核苷酸的重组载体,包含原始载体以及hsp70-mlaa34融合基因;
其中,所述融合基因包含序列表中的seqidno.1所示的碱基序列组成的dna片段。
优选的是,所述原始载体为pires2-egfp质粒。
构建含有外源多核苷酸的重组载体的方法,包括:
步骤一、利用序列表中的seqidno.2和seqidno.3所示的引物序列通过pcr扩增得到含有seqidno.4所示的碱基序列的hsp-70基因;
利用序列表中的seqidno.5和seqidno.6所示的引物序列通过pcr扩增得到含有seqidno.7所示的碱基序列的mlaa-34基因;
步骤二、以hsp-70基因和mlaa-34基因为模板,利用序列表中的seqidno.2和序列表中的seqidno.6所示的引物序列,通过soe-pcr扩增得到序列表中的seqidno.1所示的hsp70-mlaa34融合基因,并且使其含有ecori和bamhi酶切位点;
步骤三、将步骤二所述的hsp70-mlaa34融合基因构建到原始载体上以得到重组载体。
优选的是,所述原始载体为pires2-egfp质粒。
优选的是,包括如权利要求3所述的重组载体以及u937细胞。
优选的是,其转染方法包括如下:
取u937细胞进行培养并收集对数生长期的细胞进行接种,另取两份培养基,在其中一份培养基中加入转染试剂,在另一份中加入含有hsp70-mlaa34融合基因的重组载体,将两份培养基混合均匀,将混合均匀后的转染复合物加入到细胞中,混合均匀,将细胞置于37℃、5%co2的培养箱中培养18~48小时;其中,转染4~6小时后可换新鲜培养基。
优选的是,所述转染细胞进行转染方法包括如下:
步骤a、取u937细胞培养于含10%胎牛血清的rpmi1640培养基中,37℃、5%co2培养,每2~3天换液1次,取对数生长期的细胞进行试验;
步骤b、收集u937细胞并调整细胞浓度至2×105/ml,接种于96孔细胞培养板中,每孔加u937细胞100μl;
步骤c、用50μl的opti-mem培养基稀释0.8μg含有hsp70-mlaa34融合基因重组载体,轻轻吹吸3~5次混匀;
步骤d、轻轻颠倒混匀转染试剂,用50μl的opti-mem培养基稀释2.0μl的lipofectaminetm3000转染试剂,轻轻吹吸3~5次混匀,室温下静置5分钟;
步骤e、混合所述步骤c的含有重组载体的培养和所述步骤d的转染试剂,轻轻吹吸3~5次混匀,室温下静置20分钟,得到转染复合物;
步骤f、将所述转染复合物加入到24孔细胞板中,100μl/孔,前后轻摇细胞板混合均匀;
步骤g、将细胞板置于37℃、5%co2培养箱中培养18~48小时;其中,转染4~6小时后可换新鲜培养基。
使用包括所述的重组载体制备基因疫苗,所述重组载体包含序列表中的seqidno.1所示的碱基序列组成的dna片段。
本发明与现有技术相比较所具有的有益效果:
1、核酸疫苗导入宿主体内后可被抗原提呈细胞或机体组织细胞摄取,在细胞内表达蛋白抗原,刺激机体产生细胞免疫和体液免疫,免疫保护作用好;
2、通过soe-pcr技术在设计引物时,重叠序列可以是基因序列上的任意位点,不需要考虑融合位点及其附近特殊序列,通过特定的重叠互补序列的引物作为桥梁,从而使pcr扩增产物末端形成了相同的重叠链,通过重叠链的延伸将pcr扩增片段拼接起来,从而将两个目的基因融合在一起,相比于限制性内切酶的酶切和连接酶的连接更加简便快捷。
附图说明
图1为soe-pcr法扩增hsp70-mlaa34融合基因经1.0%琼脂糖凝胶电泳鉴定图;其中,1为分子量标记,2为hsp70-mlaa34融合基因,3为hsp70基因,4为mlaa34基因。
图2为pires2-hsp70-mlaa34重组质粒经1.0%琼脂糖凝胶电泳鉴定图;其中,1为分子量标记,2为pires2-hsp70-mlaa34重组质粒,3为双酶切鉴定结果,4为pcr鉴定结果。
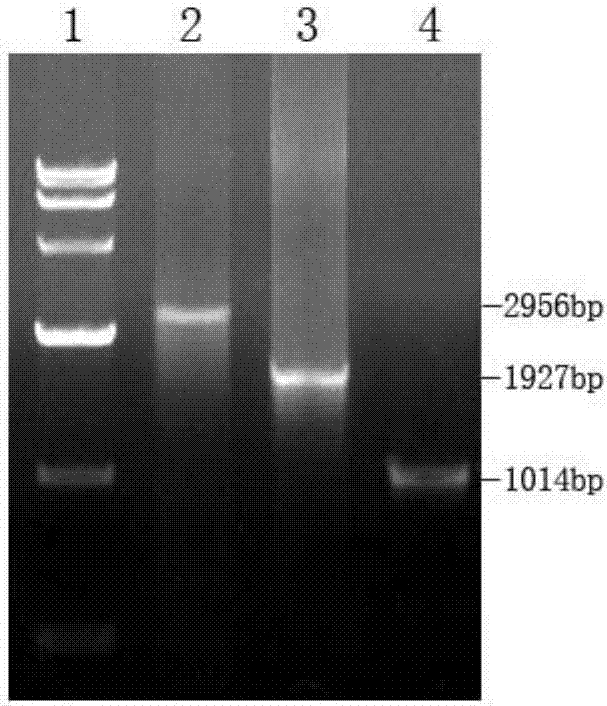
图3为验证基因凝胶电泳图像;其中,1为分子量标记,2为pires2-egfp质粒转染u937细胞,3为pires2-hsp70-mlaa34重组质粒转染u937细胞,4为验证基因转染u937细胞。
图4为目的蛋白在u937细胞内表达检测图。
图5为目的蛋白在u937细胞内表达成像分析图。
具体实施方式
下面结合附图对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
本发明中的“重组载体”是指已连接了基因的表达载体,可交互使用“重组质粒”、“重组载体”和“核酸疫苗”。
实验材料和仪器
1、质粒和细胞
u937细胞购自中科院上海细胞库;pires2-egfp质粒购自addgene公司。
2、动物
balb/c鼠[无特定病原体(spf)级,雌性,6~8周龄]购自北京维通利华实验动物技术有限公司
3、试剂、酶与药品
噻唑蓝(mtt)试剂、限制性内切酶(ecorⅰ/bamhⅰ)购自美国neb公司;总rna提取试剂盒、无内毒素质粒提取试剂盒、逆转录pcr(rt-pcr)试剂盒、t4dna连接酶、胶回收纯化和酶联免疫吸附试验(elisa)等试剂盒购自生工生物工程(上海)股份有限公司;胎牛血清、rpmi1640(高糖)培养基购自美国hyclone公司;无水乙醇、氯仿等常规试剂均为国产分析纯。
实施例
一、基因重组构建pires2-hsp70-mlaa34重组质粒:
1、引物设计:
根据质粒pires2-egfp多克隆位点情况选取ecorⅰ和bamhⅰ酶切位点进行基因克隆,mlaa-34基因(genbank:ay288977.2)扩增片段理论长度为1014bp,hsp70基因(genbank:nm_005345.5)扩增片段理论长度为1927bp,利用序列表中seqidno.3所示的引物和序列表中seqidno.5所示的引物设计重叠序列ggcggcggcggcggc,引物由生工生物工程(上海)股份有限公司合成。
2、重组质粒的构建
步骤一、u937细胞培养于含10%胎牛血清的rpmi1640培养基中,37℃、5%co2,收集u937细胞并调整细胞浓度至2×105/ml,接种于96孔细胞培养板中,每孔加u937细胞100μl作为脾淋巴细胞杀伤活性实验的靶细胞。
步骤二、hsp-70基因扩增以及基因提取
收集培养的u927细胞,trizol法抽提总rna,逆转录合成互补rna(crna),使用下述引物进行pcr扩增得到序列表中seqidno.4所示的碱基序列的dna片段,即为hsp-70基因:
上游端引物:
5′-gcgaattcatgaaaaaaatgcctttgtttagt-3′(序列表中seqidno.2所示的核苷酸序列);
下游端引物:
5′-ggcggcggcggcggctcaaggggccgttttcttcaag-3′(序列表中seqidno.3所示的核苷酸序列);
pcr反应条件:94℃,5min;94℃,30s;55℃,30s;72℃,60s,共30个循环;最后72℃,5min;pcr扩增产物经1.0%琼脂糖凝胶电泳鉴定,用胶回收试剂盒回收纯化pcr产物;
步骤三、mlaa-34基因扩增以及基因提取
收集培养的u927细胞,trizol法抽提总rna,逆转录合成互补rna(crna),使用下述引物进行pcr扩增得到序列表中seqidno.7所示的碱基序列的dna片段,即为mlaa-34基因:
上游端引物:
5′-ggcggcggcggcggcatggccaaagccgcggcgatc-3′(序列表中seqidno.5所示的核苷酸序列);
下游端引物:
5′-cgggatccctaatctacctcctcaatggtg-3′(序列表中seqidno.6所示的核苷酸序列);
pcr反应条件:94℃,5min;94℃,30s;55℃,30s;72℃,60s,共30个循环;最后72℃,5min;pcr扩增产物经1.0%琼脂糖凝胶电泳鉴定,用胶回收试剂盒回收纯化pcr产物。
步骤四、soe-pcr法扩增hsp70-mlaa34融合基因:
将回收纯化的pcr产物,以mlaa-34基因和hsp-70基因为模板,利用下述引物进行soe-pcr扩增得到序列表中seqidno.1所示的碱基序列的dna片段,即为hsp70-mlaa34融合基因:
上游端引物:
5′-gcgaattcatgaaaaaaatgcctttgtttagt-3′(序列表中seqidno.2所示的核苷酸序列);
下游端引物:
5′-cgggatccctaatctacctcctcaatggtg-3′(序列表中seqidno.6所示的核苷酸序列);
soe-pcr反应条件:94℃,5min;94℃,30s;58℃,30s;72℃,60s,共30个循环;最后72℃,5min;soe-pcr扩增产物经1.0%琼脂糖凝胶电泳鉴定,用胶回收试剂盒回收纯化soe-pcr产物,实验结果如图1所示;
步骤五、真核表达载体pires2-hsp70-mlaa34重组质粒的构建:
提取质粒pires2-egfp,与回收的hsp70-mlaa34融合基因片段分别进行ecorⅰ/bamhⅰ双酶切,37℃,1.5h,酶切产物经琼脂糖电泳回收纯化,利用t4dna连接酶将hsp70-mlaa34融合基因亚克隆至pires2-egfp质粒中,16℃连接过夜,构建pires2-hsp70-mlaa34重组质粒;将连接产物转化大肠杆菌(e.coli)dh5α感受态细胞,并在卡那霉素抗性lb培养基上涂板培养;将卡那霉素抗性lb培养基上生长的阳性转化克隆子编号,用接种环挑取克隆子(不要完全挑完)于3ml的lb液体培养基中37℃过夜培养,次日提取pires2-hsp70-mlaa34质粒并进行pcr扩增和酶切鉴定,挑取阳性克隆菌,扩增后提取重组质粒进行pcr及ecorⅰ/bamhⅰ双酶切鉴定,经1.0%琼脂糖电泳鉴定,实验结果如图2所示。
二、细胞水平检测
步骤一、细胞培养
取u937细胞培养于含10%胎牛血清的rpmi1640培养基中,37℃,5%co2培养,每2~3天换液1次,取对数生长期的细胞进行试验。
步骤二、重组载体转染u937细胞
(1)收集u937细胞并调整细胞浓度至2×105/ml,接种于96孔细胞培养板中,每孔加u937细胞100μl作为脾淋巴细胞杀伤活性实验的靶细胞;
(2)用50μl的opti-mem稀释0.8μg重组载体,轻轻吹吸3~5次混匀;
(3)轻轻颠倒混匀转染试剂,用50μl的opti-mem稀释2.0μl的lipofectaminetm3000转染试剂,轻轻吹吸3~5次混匀,室温下静置5min;
(4)混合(2)和(3),轻轻吹吸3~5次混匀,室温下静置20min;
(5)转染复合物加入到24孔细胞板中,100μl/孔,前后轻摇细胞板混合均匀;
(6)将细胞板置于37℃,5%co2培养箱中培养18~48hrs,转染4~6hrs后可换新鲜培养基。
步骤三、目的基因mrna在u937细胞内表达水平检测
分别取转染前和转染两天后的u937细胞1×107,加入1ml的trizol试剂,0.2ml氯仿抽提,吸取上清液后用0.5ml异丙醇沉淀rna,再用75%乙醇洗涤沉淀,自然凉干后用depc水溶解并定量;根据逆转录试剂盒说明书将总mrna反转录为cdna,紫外分光光度计测定其浓度;设计引物为上游引物:5′-ccccatcatcagcggactg-3′(序列表中的seqidno.8所示),下游引物:5′-cttctgttgggggttcttt-3′(序列表中的seqidno.9所示),以cdna为模板进行pcr扩增得到验证基因(序列表中的seqidno.10所示)以确定目的基因在u937细胞内表达,验证基因为目的基因中的一部分,pcr反应体系包括2.5μl10×buffer,2.5μldntps,1.0μgcdna模板,0.1μltaq酶(5u/μl),上下游引物各1μl,加ddh2o至25μl;
pcr反应条件为:94℃预变性4min;94℃,30s;62℃,30s,;72℃,30s;循环30次,再72℃延伸10min,pcr扩增产物以1%琼脂糖电泳,genius凝胶电泳图像分析系统分析鉴定,实验结果如图3所示。
步骤四、目的蛋白在u937细胞内表达水平及蛋白活性检测(western-blot)
转染48h后,收集细胞,加入裂解液150μlripa(1%pmsf),吹打细胞,收集到离心管中,冰浴30min,12000r/min离心10min,提取总蛋白,取上清加入2xsds上样缓冲液,煮沸5min,离心后取上清做sds-page电泳,电转移至pvdf膜上,用mlaa-34单克隆抗体作为一抗,辣根过氧化物酶偶联的羊抗小鼠igg作为二抗,ecl显色后在生物分子成像仪内成像分析,结果如图4、图5所示。
三、整体水平进行检测
步骤一、重组载体免疫balb/c小鼠
质粒dna大量制备和纯化(按试剂盒说明书进行)并用生理盐水调整至1.0g/l;balb/c鼠40只,随机分为4组,每组10只;对照组a组、实验组b、c、d组分别在小鼠两侧股四头肌内肌内注射空质粒pires2、pires2-mlaa34、pires2-hsp70和pires2-mlaa34-hsp70,每只100μg;小鼠每次接种前24h,均用0.25%布比卡因100μl预处理;在0、2、4周进行3次同样剂量免疫。
步骤二、脾淋巴细胞悬液的制备
末次免疫后第7天,处死小鼠,置70%乙醇浸泡3~5min,无菌取脾脏,置于不含胎牛血清的rpmi1640培养基中,剪去脂肪及筋膜组织,于200目不锈钢网筛上研碎,重悬于含5%胎牛血清的hank′s液中,2000r/min离心5min,低渗裂解红细胞,用含10%胎牛血清的rpmi1640培养基清洗3次,并调整浓度为1×107/ml。
步骤三、脾淋巴细胞杀伤活性的检测与结果
取步骤二中制备的脾淋巴细胞悬液,倍比稀释;96孔细胞培养板各反应孔中加脾淋巴细胞100μl,使效靶比分别为50:1、25:1、12.5:1和6.25:1(各设3个复孔),在37℃,5%co2中孵育24h,测定每组小鼠特异性淋巴细胞杀伤活性;反应结束后,每孔加入20μlmtt工作液,37℃反应4h,弃去mtt反应液,每孔加入二甲基亚枫(dmso)200μl,室温振荡10min,酶标仪测定570nm处吸光度值(a570)。脾淋巴细胞杀伤活性(%)=[1-(反应孔a570-效应细胞对照孔a570)/靶细胞对照孔a570]×100%。
将核酸疫苗分组免疫小鼠后,检测致敏脾淋巴细胞对u937细胞的杀伤效率,结果见表1;其中,核酸疫苗d组的杀伤效率明显高于a、b、c组,差异有统计学意义(p<0.01);而a、b、c组杀伤效率比较,差异无统计学意义(p>0.05)。
表1小鼠脾淋巴细胞杀伤活性(
*:p<0.01,与d组比较。
步骤四、细胞因子水平的检测与结果
将步骤二的脾淋巴细胞悬液加入96孔细胞培养板,每孔100μl(各设3个复孔),37℃,5%co2培养72h,以纯化的mlaa-34蛋白(20μg/ml)刺激抗原;以刀豆蛋白a(cona,10μg/ml)为阳性对照,未用抗原刺激孔为阴性对照,培养48h后收集上清,elisa法检测细胞因子,包括白细胞介素(il)-2、il-4和干扰素-γ(ifn-γ)水平(严格按照试剂盒说明书操作)。
脾淋巴细胞悬液经纯化的mlaa-34蛋白刺激后,elisa法检测脾细胞上清液中细胞因子il-2、il-4和ifn-γ水平,结果见表2;其中,核酸疫苗d组的细胞因子il-2、il-4和ifn-γ水平明显高于a、b、c组,差异有统计学意义(p<0.01)。b组和c组上述各细胞因子水平明显高于a组,差异有统计学意义(p<0.01)。b组和c组间上述各细胞因子水平比较,差异无统计学意义(p>0.05)。
表2小鼠脾淋巴悬液细胞因子含量(
*:p<0.01,与a组比较;#:p<0.01,与d组比较。
5、统计学处理
采用spss19.0统计软件进行统计分析,计量资料±s以表示,组间比较采用方差分析,以p<0.05为差异有统计学意义。
四、结果分析
核酸疫苗制作简单、应用安全,是白血病免疫治疗的策略之一。核酸疫苗导入宿主体内后可被抗原提呈细胞或机体组织细胞摄取,在细胞内表达蛋白抗原,刺激机体产生细胞免疫和体液免疫,免疫保护作用好。在构建核酸疫苗时作者使用了soe-pcr技术,将mlaa-34基因和hsp70基因融合在一起,形成mlaa34-hsp70融合基因。mlaa-34基因与急性单核细胞白血病的发生密切相关,其表达下调能显著抑制u937细胞在体外的增殖,同时会诱发白血病细胞的凋亡,是理想的急性白血病免疫治疗的靶基因。hsp70参与肿瘤基因调控及细胞增殖,具有抗原递呈功能,能强烈刺激免疫系统针对肿瘤抗原的免疫反应,进而诱导机体产生特异性抗肿瘤免疫应答,以hsp为基础的肿瘤疫苗是目前肿瘤疫苗研究中的热点。
soe-pcr技术的关键主要在于引物的设计,在设计引物时,重叠序列可以是基因序列上的任意位点,不需要考虑融合位点及其附近特殊序列。通过特定的重叠互补序列的引物作为桥梁,从而使pcr扩增产物末端形成了相同的重叠链,通过重叠链的延伸将pcr扩增片段拼接起来,从而将两个目的基因融合在一起,相比于限制性内切酶的酶切和连接酶的连接更加简便快捷。因此,在融合基因、突变体分子的构建过程中,特别是在人类体细胞敲除、疫苗的研究、多克隆抗体的产生,以及在植物基因工程中具有广泛的应用。本研究设计引物时采用柔性肽基因ggcggcggcggcggc作为重叠序列,融合蛋白mlaa-34和hsp70之间以柔性肽相连接,保证了两个蛋白融合表达且正确折叠,mlaa-34和hsp70皆能发挥其独特功能,从而保证了核酸疫苗的免疫活性。实验表明,核酸疫苗pires2-mlaa34-hsp70免疫balb/c小鼠后,致敏脾淋巴细胞对白血病细胞具有较强的杀伤效率,明显高于其他实验组和对照组,说明核酸疫苗pires2-mlaa34-hsp70能有效地刺激机体产生针对u937细胞的特异性杀伤作用;此外,致敏小鼠脾细胞培养液中细胞因子il-2、il-4和ifn-γ水平明显增高,说明该核酸疫苗能诱发强烈的体液免疫,增强了机体对肿瘤细胞的免疫应答,具有明显的免疫保护作用。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
sequencelisting
<110>吉林医药学院
<120>dna片段与含有该片段的重组载体、构建重组载体的方法及其应用
<130>1
<160>10
<170>patentinversion3.3
<210>1
<211>2994
<212>dna
<213>人工序列
<400>1
gaattcatggccaaagcagcggcgatcggcatcgacctgggcaccacctactcctgcgtg60
ggggtgttccaacacggcaaggtggagatcatcgccaacgaccagggcaaccgcaccacc120
cccagctacgtggccttcacggacaccgagcggctcatcggggatgcggccaagaaccag180
gtggcgctgaacccgcagaacaccgtgtttgacgcgaagcggctgatcggccgcaagttc240
ggcgacccggtggtgcagtcggacatgaagcactggcctttccaggtgatcaacgacgga300
gacaagcccaaggtgcaggtgagctacaagggggagaccaaggcattctaccccgaggag360
atctcgtccatggtgctgaccaagatgaaggagatcgccgaggcgtacctgggctacccg420
gtgaccaacgcggtgatcaccgtgccggcctacttcaacgactcgcagcgccaggccacc480
aaggatgcgggtgtgatcgcggggctcaacgtgctgcggatcatcaacgagcccacggcc540
gccgccatcgcctacggcctggacagaacgggcaagggggagcgcaacgtgctcatcttt600
gacctgggcgggggcaccttcgacgtgtccatcctgacgatcgacgacggcatcttcgag660
gtgaaggccacggccggggacacccacctgggtggggaggactttgacaacaggctggtg720
aaccacttcgtggaggagttcaagagaaaacacaagaaggacatcagccagaacaagcga780
gccgtgaggcggctgcgcaccgcctgcgagagggccaagaggaccctgtcgtccagcacc840
caggccagcctggagatcgactccctgtttgagggcatcgacttctacacgtccatcacc900
agggcgaggttcgaggagctgtgctccgacctgttccgaagcaccctggagcccgtggag960
aaggctctgcgcgacgccaagctggacaaggcccagattcacgacctggtcctggtcggg1020
ggctccacccgcatccccaaggtgcagaagctgctgcaggacttcttcaacgggcgcgac1080
ctgaacaagagcatcaaccccgacgaggctgtggcctacggggcggcggtgcaggcggcc1140
atcctgatgggggacaagtccgagaacgtgcaggacctgctgctgctggacgtggctccc1200
ctgtcgctggggctggagacggccggaggcgtgatgactgccctgatcaagcgcaactcc1260
accatccccaccaagcagacgcagatcttcaccacctactccgacaaccaacccggggtg1320
ctgatccaggtgtacgagggcgagagggccatgacgaaagacaacaatctgttggggcgc1380
ttcgagctgagcggcatccctccggcccccaggggcgtgccccagatcgaggtgaccttc1440
gacatcgatgccaacggcatcctgaacgtcacggccacggacaagagcaccggcaaggcc1500
aacaagatcaccatcaccaacgacaagggccgcctgagcaaggaggagatcgagcgcatg1560
gtgcaggaggcggagaagtacaaagcggaggacgaggtgcagcgcgagagggtgtcagcc1620
aagaacgccctggagtcctacgccttcaacatgaagagcgccgtggaggatgaggggctc1680
aagggcaagatcagcgaggcggacaagaagaaggtgctggacaagtgtcaagaggtcatc1740
tcgtggctggacgccaacaccttggccgagaaggacgagtttgagcacaagaggaaggag1800
ctggagcaggtgtgtaaccccatcatcagcggactgtaccagggtgccggtggtcccggg1860
cctgggggcttcggggctcagggtcccaagggagggtctgggtcaggccccaccattgag1920
gaggtagatgggggcggaggctccggcggcggggggtctgggggcgggggaagcatgaaa1980
aaaatgcctttgtttagtaaatcacacaaaaatccagcagaaattgtgaaaatcctgaaa2040
gacaatttggccattttggaaaagcaagacaaaaagacagacaaggcttcagaagaagtg2100
tctaaatcactgcaagcaatgaaagaaattctgtgtggtacaaacgagaaagaaccccca2160
acagaagcagtggctcagctagcacaagaactctacagcagtggcctgctagtgacactg2220
atagctgacctgcagctgatagactttgagggaaaaaaagatgtgacccagatatttaac2280
aacatcttgagaagacagataggcactcggagtcctactgtggagtatattagtgctcat2340
cctcatatcctgtttatgctcctcaaaggatatgaagccccacagattgccttacgttgt2400
gggattatgctgagagaatgtattcgacatgaaccacttgccaaaatcatcctcttttct2460
aatcaattcagagatttctttaagtacgtggagttgtcaacatttgatattgcttcagat2520
gcctttgctactttcaaggatttactaaccagacataaagtgttggtagcagacttctta2580
gaacaaaattacgacactatttttgaagactatgagaaattgcttcagtctgagaattat2640
gttactaagagacagtctttaaagctgctaggggagctgatcctggaccgtcacaacttt2700
gccatcatgacaaagtatatcagcaagccggagaacctgaaactcatgatgaacctcctt2760
cgggataaaagtcccaacatccagtttgaagcctttcatgtttttaaggtgtttgtggcc2820
agtcctcacaaaacacagcctattgtggagatcctgttaaaaaatcagcccaaactcatt2880
gagtttctgagcagcttccaaaaagaaaggacggatgatgagcagttcgctgacgagaag2940
aactacttgattaaacagatccgagacttgaagaaaacggccccttgaggatcc2994
<210>2
<211>32
<212>dna
<213>人工序列
<220>
<223>人工合成,以用作得到hsp-70基因的编码序列的上游引物
<400>2
gcgaattcatgaaaaaaatgcctttgtttagt32
<210>3
<211>37
<212>dna
<213>人工序列
<220>
<223>人工合成,以用作得到hsp-70基因的编码序列的下游引物
<400>3
ggcggcggcggcggctcaaggggccgttttcttcaag37
<210>4
<211>1938
<212>dna
<213>人工合成
<220>
<223>hsp-70基因的编码序列
<400>4
gaattcatggccaaagcagcggcgatcggcatcgacctgggcaccacctactcctgcgtg60
ggggtgttccaacacggcaaggtggagatcatcgccaacgaccagggcaaccgcaccacc120
cccagctacgtggccttcacggacaccgagcggctcatcggggatgcggccaagaaccag180
gtggcgctgaacccgcagaacaccgtgtttgacgcgaagcggctgatcggccgcaagttc240
ggcgacccggtggtgcagtcggacatgaagcactggcctttccaggtgatcaacgacgga300
gacaagcccaaggtgcaggtgagctacaagggggagaccaaggcattctaccccgaggag360
atctcgtccatggtgctgaccaagatgaaggagatcgccgaggcgtacctgggctacccg420
gtgaccaacgcggtgatcaccgtgccggcctacttcaacgactcgcagcgccaggccacc480
aaggatgcgggtgtgatcgcggggctcaacgtgctgcggatcatcaacgagcccacggcc540
gccgccatcgcctacggcctggacagaacgggcaagggggagcgcaacgtgctcatcttt600
gacctgggcgggggcaccttcgacgtgtccatcctgacgatcgacgacggcatcttcgag660
gtgaaggccacggccggggacacccacctgggtggggaggactttgacaacaggctggtg720
aaccacttcgtggaggagttcaagagaaaacacaagaaggacatcagccagaacaagcga780
gccgtgaggcggctgcgcaccgcctgcgagagggccaagaggaccctgtcgtccagcacc840
caggccagcctggagatcgactccctgtttgagggcatcgacttctacacgtccatcacc900
agggcgaggttcgaggagctgtgctccgacctgttccgaagcaccctggagcccgtggag960
aaggctctgcgcgacgccaagctggacaaggcccagattcacgacctggtcctggtcggg1020
ggctccacccgcatccccaaggtgcagaagctgctgcaggacttcttcaacgggcgcgac1080
ctgaacaagagcatcaaccccgacgaggctgtggcctacggggcggcggtgcaggcggcc1140
atcctgatgggggacaagtccgagaacgtgcaggacctgctgctgctggacgtggctccc1200
ctgtcgctggggctggagacggccggaggcgtgatgactgccctgatcaagcgcaactcc1260
accatccccaccaagcagacgcagatcttcaccacctactccgacaaccaacccggggtg1320
ctgatccaggtgtacgagggcgagagggccatgacgaaagacaacaatctgttggggcgc1380
ttcgagctgagcggcatccctccggcccccaggggcgtgccccagatcgaggtgaccttc1440
gacatcgatgccaacggcatcctgaacgtcacggccacggacaagagcaccggcaaggcc1500
aacaagatcaccatcaccaacgacaagggccgcctgagcaaggaggagatcgagcgcatg1560
gtgcaggaggcggagaagtacaaagcggaggacgaggtgcagcgcgagagggtgtcagcc1620
aagaacgccctggagtcctacgccttcaacatgaagagcgccgtggaggatgaggggctc1680
aagggcaagatcagcgaggcggacaagaagaaggtgctggacaagtgtcaagaggtcatc1740
tcgtggctggacgccaacaccttggccgagaaggacgagtttgagcacaagaggaaggag1800
ctggagcaggtgtgtaaccccatcatcagcggactgtaccagggtgccggtggtcccggg1860
cctgggggcttcggggctcagggtcccaagggagggtctgggtcaggccccaccattgag1920
gaggtagattgaggatcc1938
<210>5
<211>36
<212>dna
<213>人工序列
<220>
<223>人工合成,以用作得到mlaa-34基因的编码序列的上游引物
<400>5
ggcggcggcggcggcatggccaaagccgcggcgatc36
<210>6
<211>30
<212>dna
<213>人工序列
<220>
<223>人工合成,以用作得到mlaa-34基因的编码序列的下游引物
<400>6
cgggatccctaatctacctcctcaatggtg30
<210>7
<211>1026
<212>dna
<213>人工合成
<220>
<223>mlaa-34基因的编码序列
<400>7
gaattcatgaaaaaaatgcctttgtttagtaaatcacacaaaaatccagcagaaattgtg60
aaaatcctgaaagacaatttggccattttggaaaagcaagacaaaaagacagacaaggct120
tcagaagaagtgtctaaatcactgcaagcaatgaaagaaattctgtgtggtacaaacgag180
aaagaacccccaacagaagcagtggctcagctagcacaagaactctacagcagtggcctg240
ctagtgacactgatagctgacctgcagctgatagactttgagggaaaaaaagatgtgacc300
cagatatttaacaacatcttgagaagacagataggcactcggagtcctactgtggagtat360
attagtgctcatcctcatatcctgtttatgctcctcaaaggatatgaagccccacagatt420
gccttacgttgtgggattatgctgagagaatgtattcgacatgaaccacttgccaaaatc480
atcctcttttctaatcaattcagagatttctttaagtacgtggagttgtcaacatttgat540
attgcttcagatgcctttgctactttcaaggatttactaaccagacataaagtgttggta600
gcagacttcttagaacaaaattacgacactatttttgaagactatgagaaattgcttcag660
tctgagaattatgttactaagagacagtctttaaagctgctaggggagctgatcctggac720
cgtcacaactttgccatcatgacaaagtatatcagcaagccggagaacctgaaactcatg780
atgaacctccttcgggataaaagtcccaacatccagtttgaagcctttcatgtttttaag840
gtgtttgtggccagtcctcacaaaacacagcctattgtggagatcctgttaaaaaatcag900
cccaaactcattgagtttctgagcagcttccaaaaagaaaggacggatgatgagcagttc960
gctgacgagaagaactacttgattaaacagatccgagacttgaagaaaacggccccttga1020
ggatcc1026
<210>8
<211>19
<212>dna
<213>人工合成
<220>
<223>人工合成,以用作得到验证基因的编码序列的下游引物
<400>8
ccccatcatcagcggactg19
<210>9
<211>19
<212>dna
<213>人工合成
<220>
<223>人工合成,以用作得到验证基因的编码序列的下游引物
<400>9
cttctgttgggggttcttt19
<210>10
<211>350
<212>dna
<213>人工合成
<220>
<223>验证基因的编码序列
<400>10
ccccatcatcagcggactgtaccagggtgccggtggtcccgggcctgggggcttcggggc60
tcagggtcccaagggagggtctgggtcaggccccaccattgaggaggtagatgggggcgg120
aggctccggcggcggggggtctgggggcgggggaagcatgaaaaaaatgcctttgtttag180
taaatcacacaaaaatccagcagaaattgtgaaaatcctgaaagacaatttggccatttt240
ggaaaagcaagacaaaaagacagacaaggcttcagaagaagtgtctaaatcactgcaagc300
aatgaaagaaattctgtgtggtacaaacgagaaagaacccccaacagaag350
- 还没有人留言评论。精彩留言会获得点赞!