一种ATF1蛋白的磷酸化抗原多肽、应激磷酸化抗体的制备方法及应用与流程
本发明涉及抗体制备
技术领域:
,公开一种可特异性识别人atf1蛋白t184位点的应激磷酸化的兔多克隆抗体的制备方法。
背景技术:
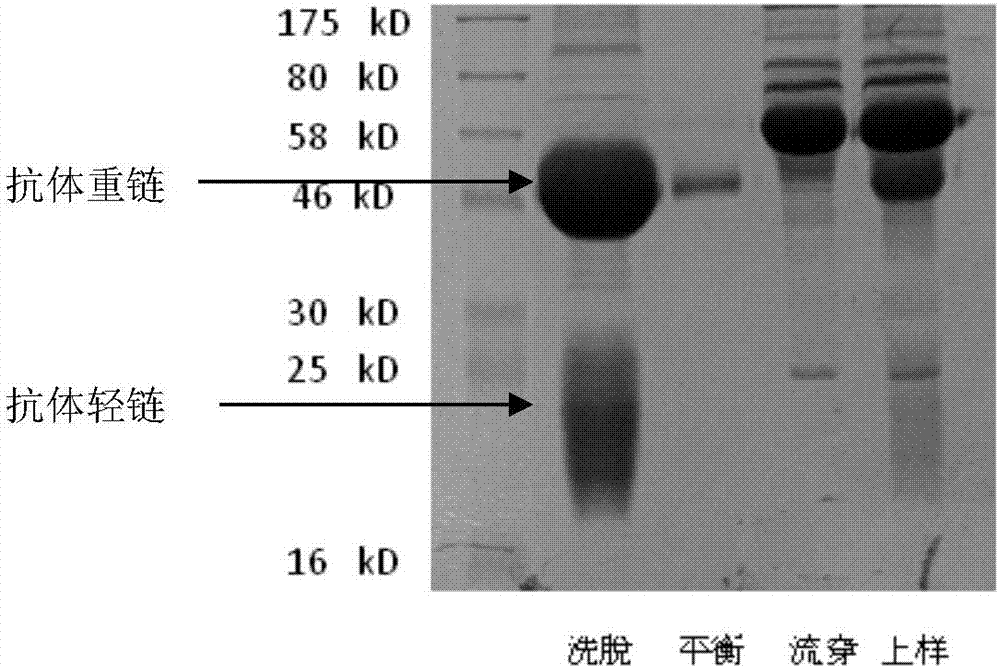
:atf1(cyclicamp-dependenttranscriptionfactoratf-1,或activatingtranscriptionfactor1)基因编码一个转录激活因子,属于atf(activatingtranscriptionfactors)/creb(campresponseelementbindingprotein)亚家族和碱性亮氨酸拉链(bzip)家族蛋白。它调节下游靶基因的表达从而影响细胞生理过程的,涉及细胞生长,生存,和其他细胞活动。该基因与16号染色体上fus基因或22号染色上ewsr1基因易位产生一种新的融合蛋白,该融合蛋白会导致血管瘤样纤维组织细胞瘤和透明细胞肉瘤的发生。此外,atf1作为一个独立分子在一些肿瘤中也发挥一定作用。hsueh和lai等报道atf1在淋巴瘤和活化的淋巴细胞中表达,在细胞生长和分化中发挥积极作用;su等报道atf1在鼻咽癌组织中的表达且与临床分期有关;zheng等报道细胞周期蛋白依赖激酶(cdk)3-介导的atf1磷酸化可增强细胞增殖和转化;jean等报道抗atf1单链抗体能够抑制黑素瘤细胞中cre依赖的启动子活性,并抑制瘤细胞在裸鼠体内的致瘤性和转移潜能;belkhiri等报道t-darpp是darpp-32的删剪转录本,在胃癌中,能上调bcl2的表达,促进肿瘤细胞生长,活化的atf1参与了bcl2的转录上调。总之,atf1对癌症的发展起着重要的作用。蛋白磷酸化是蛋白翻译后修饰的重要机制之一,在细胞对外界信号反应中处于首要位置。转录因子的活性通常受多个磷酸化位点调控,这些位点调节着转录因子的dna结合能力,蛋白稳定性以及与其它转录相关蛋白的相互作用,从而调节其转录活性。通过生物信息学预测,我们发现atf1第184位thr位点为其全新磷酸化位点,我们的前期工作表明,将该位点突变后,atf1的转录调控活性和细胞转化功能明显改变,从而影响肿瘤的发生发展。而本技术则正是研发了此特异识别atf1-t184位点磷酸化的抗体。技术实现要素:本发明公开了一种包含人atf1蛋白t184位点的磷酸化多肽,可特异性识别人肿瘤细胞表达的atf1蛋白t184磷酸化位点的多克隆抗体的制备方法,以及其应用。本发明提供了一种atf1蛋白的磷酸化抗原多肽,其特征在于所述抗原多肽位于t184位点附近的如seqidno:1所示的c端连接一个半胱氨酸的氨基酸序列,且该t184位点的苏氨酸为磷酸化状态。本发明还提供了一种针对人atf1蛋白t184位点的应激磷酸化抗体制备方法,包括(1)对atf1蛋白第184位点附近氨基酸序列进行分析,人工合成权利要求1所述的抗原多肽;(2)将合成的多肽与马来酰亚氨活化的匙孔血载体蛋白klh偶联,将此偶联产物进行脱盐柱纯化后免疫新西兰兔;(3)经过四次免疫的兔血清用elisa法对抗体效价进行检测,效价达理想值后收集免疫兔血清,并用多肽包被的溴化氰活化琼脂糖亲和纯化柱纯化抗体;(4)对纯化后抗体进行elisa、westernbot鉴定,得到针对人atf1蛋白t184位点的应激磷酸化抗体。进一步的,抗体纯化先通过t184位磷酸化多肽包被的溴化氰活化琼脂糖亲和纯化柱,然后通过t184位非磷酸化多肽包被的溴化氰活化琼脂糖亲和纯化柱。进一步的,效价的理想值为1:80000。本发明还提供了一种针对人atf1蛋白t184位点的应激磷酸化抗体的应用,其中所述应用使用上述针对人atf1蛋白t184位点的应激磷酸化抗体制备方法制备得到的多克隆抗体特异性识别癌细胞表达的atf1蛋白pt184位点。其中所述的癌细胞优选为鼻咽癌和胃癌组织细胞。根据前期工作结果,我们预测atf1蛋白第184位苏氨酸(t184)是一个潜在的磷酸化位点,可能与该蛋白的稳定及激活功能相关。本发明选择了atf1蛋白包含第184位苏氨酸位点(t184)的附近15肽作为候选多肽,并用人工方法进行包含pt184的多肽合成及完全抗原制备。应激磷酸化抗体制备方法,包括:对atf1蛋白第184位点附近氨基酸序列的二级结构、免疫原性、亲疏水性、表面可及性等进行分析,确定合适的一段肽序列进行人工合成;将合成的多肽与马来酰亚氨活化的载体mcklh偶联,将此偶联产物进行脱盐柱纯化后免疫新西兰兔;经过四次免疫的兔血清用elisa法对抗体效价进行检测,效价达理想值后收集免疫兔血清,并用多肽包被的溴化氰活化的琼脂糖(cnbr-activatedsepharose)亲和纯化柱纯化抗体;对纯化后抗体进行elisa、westernbot等鉴定。鉴定结果表明该多克隆抗体可特异性识别atf1蛋白pt184位点,可用于检测肿瘤细胞该位点的磷酸化水平,为探索肿瘤细胞增殖及转移机制研究提供一种工具,也为肿瘤诊断提供帮助,并能指导其临床预后判断。其中,化学合成的多肽抗原是小分子,本身很难具有好的抗原性,只能诱导动物产生很弱的免疫反应,因而与载体蛋白交联是很重要的。载体蛋白含有很多抗原决定基,能够刺激t辅助细胞,进而诱导b细胞反应。用于与多肽交联的载体蛋白有多种,其中最普遍使用的载体是匙孔血蓝蛋白(keyholelimpethemacyanin,klh),牛血清白蛋白(bovineserumalbumin,bsa),卵清蛋白(ovalbumin,ova)和牛甲状腺球蛋白(bovinethyroglobulin,thy)。klh具有更高的抗原性,是最为常用的多肽交联载体。bsa也常用来作为多肽载体,但由于bsa经常被用做检测试验的阻断剂而使得该方法生产的抗体在应用上存在着一定的局限性。发明的有益效果本发明采用人工设计和合成含有该磷酸化位点的一段atf1蛋白多肽(pt184),与马来酰胺活化的匙孔血蓝载体蛋白(klh)偶联,经脱盐纯化后免疫新西兰兔,通过四次免疫及elisa效价检测后,采集兔血清,并先通过t184位磷酸化多肽包被的溴化氰活化琼脂糖亲和纯化柱,然后通过t184位非磷酸化多肽包被的溴化氰活化琼脂糖亲和纯化柱(cnbr-activatedsepharose)纯化。经过两次纯化后,通过下述实施例对比发现,吸光度大大提高了,并且抗体的效价达到了1:8万。该多克隆抗体经过elisa、westernblot等鉴定可特异性识别atf1蛋白pt184位点,并且相对于癌旁组织其在鼻咽癌和胃癌组织中高表达,其差异具有统计学意义。本发明的磷酸化多克隆抗体可特异性识别atf1蛋白pt184位点,可用于检测肿瘤细胞该位点的磷酸化水平,为探索肿瘤细胞增殖及转移机制研究提供一种工具,也为肿瘤诊断提供帮助,并能指导其临床预后判断。附图说明图1是采用dnastar软件分析人atf1蛋白特性。框中标注的序列为选定的多肽序列,此多肽序列位于atf1蛋白第184位苏氨酸附近,其抗原性、亲水性及表面可及性较强。图2是抗atf1(pt184)多克隆抗体经肽亲和凝胶柱纯化后sds-page电泳(12%)检测结果。上样为纯化前兔抗血清。图3是本发明中抗atf1(pt184)多克隆抗体的免疫斑点实验鉴定结果。上样为合成的pt184和t184多肽。a图是抗血清检测结果,b图是纯化后抗体检测结果。1是t184多肽,2是pt184多肽。图4是本发明中抗atf1(pt184)多克隆抗体的western-blot鉴定结果。上样为cne1细胞(人鼻咽癌细胞系)裂解液。该细胞分别用pcdna6.0/myc-his-atf1野生型及pcdna6.0/myc-his-atf1(t184a)突变体质粒进行瞬时转染。图5、图6是本发明中抗atf1(pt184)多克隆抗体的免疫组化鉴定结果。所使用的标本为鼻咽癌病理切片和胃癌病理切片,发现磷酸化atf1-t184主要出现于细胞核内,与atf1定位一致。并且在对31个鼻炎癌样本及其癌旁组织,以及122个胃癌样本及其癌旁组织进行统计分析后发现,肿瘤组织与非肿瘤组织之间存在统计学差异。而且在对这122个胃癌做病人做生存分析后可见,高表达atf1-pt184的病人其生存时间远远低于低表达的病人,其结果具有统计学意义。图7是本发明的实施流程。具体实施方式下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明,而不用于限制本发明的范围。在不背离本发明的技术解决方案的前提下,对本发明所作的本领域普通技术人员容易实现的任何改动都将落入本发明的权利要求范围之内。实施例1步骤1:atf1蛋白pt184多肽的设计及合成1.1atf1氨基酸序列根据genbank获得人atf1蛋白氨基酸序列(np_005162)如下:结果:人atf1蛋白含有271个氨基酸。1.2用dnastar软件分析人atf1蛋白特性(表1):表1分析项目(analysis)全蛋白(wholeprotein)分子量(molecularweight)29231.57m.w.长度(length)271等电点(isoelectricpoint)8.37结果:人atf1蛋白分子量为29231.57道尔顿,等电点为8.37,为碱性蛋白。1.3用dnastar软件分析人atf1蛋白免疫原性、亲疏水性及表面可及性(图1):结果:人atf1蛋白第176位至第191位共16个氨基酸抗原性、亲水性及表面可及性较强,且第184位苏氨酸包含其中。1.4atf1合成多肽序列:经过上述分析,选用的多肽序列为mqtyqirttpsatslp(176aa-191aa,seqidno:1)。步骤2:多肽合成及与载体蛋白偶联2.1多肽合成为便于与载体蛋白偶联,合成多肽在c端加入一个半胱氨酸,而且第184位苏氨酸为磷酸化状态:mqtyqirtt(p)psatslpc。同时合成一段含有非磷酸化的第184位苏氨酸多肽序列:mqtyqirttpsatslpc。多肽由上海吉尔生化公司合成。2.2多肽与载体蛋白偶联a.用200μl超纯水稀释一管马来酰亚胺活化的mcklh,使成10mg/ml的溶液。(注:上述溶液呈蓝白色半透明状,不得振荡或加热,否则会导致mcklh沉淀。)b.用相当于步骤1中溶液1.0-2.5倍体积的偶联buffer溶解含巯基的半抗原多肽。将2mg半抗原用200-500μl偶联buffer溶解,加入到mcklh。如果多肽是易溶的,可以以固体加入到mcklh悬液中。(注:如果半抗原不易溶,可以加入dmso增加溶解。dmso在偶联溶解液中浓度低于30%,否则载体蛋白易变性。)c.立即混匀多肽、mcklh,然后在室温反应2h。2.3偶联产物纯化:通过凝胶层析脱盐柱来纯化偶联物如果偶联物在一周以内注射,用pbs纯化。如果偶联物冻存,用纯化缓冲盐纯化,如果在偶联时形成沉淀,离心,收集上清,保留沉淀。仅纯化上清。将纯化的偶联物与沉淀结合。a.溶解一瓶纯化缓冲盐,加入60ml脱气的超纯水。在4度保存。b.拿去脱盐柱的顶和底的盖子,使存储液排出。一脱盐柱可纯化0.5ml样品。c.用3-5倍柱体积(15-25ml)的纯化缓冲液冲洗柱子。d.将0.5ml的多肽载体混合物直接加入柱中心。加入0.5ml的纯化缓冲液,在分离管中收集各峰。e.在280nm下测定吸光度以确定哪部分含有偶联物。在第一个吸收峰检测出的将是半抗原偶联物。混合所有含偶联物的部分f.在含有偶联物的部分出现后,继续向柱内加入缓冲液,收集没有偶联的半抗原。g.将偶联物过滤除菌,无菌保存在-80度。结果:考马斯亮兰法测得偶联后蛋白浓度和含量,每管250μg分装,-80度保存。步骤3:抗atf1多肽兔多克隆抗体制备及纯化:3.1动物免疫每种偶联产物免疫两只新西兰雄兔,体重2-2.5kg。弗式完全佐剂和弗式不完全佐剂购自sigma公司。免疫程序(表3):a.用pbs稀释100μg抗原,至1.25ml,用等体积佐剂混匀,旋涡振荡100分钟,检测乳化结果,取一滴抗原滴于水上,一分钟不溶解扩散。b.免疫前耳静脉取血,4℃静置后取血清,-80℃保存,作阴性对照血清。表33.2抗体效价elisa检测方法:(一)实验试剂a.磷酸盐缓冲液(pbs)(10×浓缩):氯化钠(nacl)50g,氯化钾(kcl)1.25g,磷酸二氢钾(kh2po4)1.25g,磷酸氢二钠(na2hpo4·12h2o)18.1g,加蒸馏水800ml,用1mhcl调ph至7.2,蒸馏水定容至1000ml。b.封闭液:正常牛血清10ml,1×pbs(不含吐温)90ml。c.洗涤缓冲液:吐温-20(tween20)0.2ml,1×pbs1000ml。d.底物显色a液:醋酸钠(ch3coona)13.6g,柠檬酸(c6h8o7·h2o)1.6g,双氧水(h2o230%)0.3ml,蒸馏水加至500ml。e.底物显色b液:乙二胺四乙酸二钠(edta-na2)0.2g,柠檬酸(c6h8o7·h2o)0.95g,甘油(c3h8o3)50ml,四甲基联苯胺(tmb)0.2g,蒸馏水加至500ml。f.终止液(2mh2so4):取浓h2so427.62ml,缓缓加入到473ml的蒸馏水中,混匀即可。g.抗原包被液(0.1m碳酸盐缓冲液)ph9.6:碳酸钠(na2co3)1.59g,碳酸氢钠(nahco3)2.93g,叠氮钠(nan3)0.2g,蒸馏水加至1000ml。h.辣根过氧化物酶标记的羊抗小鼠igg(已商品化)。(二)实验步骤a.抗原包被:纯多肽抗原终浓度一般为1-2μg/ml,用包被液稀释后取100μl加入聚苯乙烯酶联检测板各孔中,4℃过夜后,洗液洗涤3次。建议4℃包被过夜。b.封闭:每孔加200μl或加满封闭液,4℃过夜或37℃两小时后,洗涤3次,拍干。置4℃冰箱保存备用。c.elisa检测(a)加待测样品:兔耳静脉采血后分离血清,用pbs倍比稀释,50-100μl/孔加样到包被好的酶标板中,同时,分别选取免疫前兔血清为阴性对照,37℃孵育30min,洗涤3次,拍干。(b)加二抗:根据酶标二抗的效价选择稀释倍数,100μl/孔,37℃孵育30min,洗涤3次,拍干。(c)显色:加入a、b液各80μl/孔,37℃显色15min。(d)终止:加入终止液80μl/孔。(e)读数:以450nm单波长测定各孔od值,以与阴性对照孔od值的比值(p/n)大于2.5为限,作为判断为阳性或确定效价的临界点兔血清收集:采用颈动脉放血法,非抗凝兔全血收集后在37℃孵育2h,3.3抗体亲和纯化:1)抗体纯化柱制备用合成的含t184位非磷酸化多肽和含t184位磷酸化多肽分别包被cnbr-activatedsepharose,制备两根纯化柱。步骤如下:a.用冰预冷的1mmhcl溶胀1gcnbr-activatedsepharose干粉,用总体积200ml1mmhc洗涤四次,每次50ml。b.将10mg多肽溶解于4ml含0.1mnahco3ph8.3,0.5mnacl包被缓冲液中。c.立即转移溶液到活化的cnbr-activatedsepharose中。上下颠倒混匀室温孵育2小时。d.用0.2m甘氨酸,ph8.0室温封闭偶联琼脂糖胶2小时。e.用0.1m乙酸钠,0.5mnacl,ph4.0溶液和包被缓冲液交替洗涤偶联琼脂糖胶4到5次。2)抗体亲和纯化兔抗血清中抗atf1抗体首先用pt184多肽包被的cnbr-activatedsepharose亲和纯化柱进行纯化。步骤如下:a.2ml兔抗血清用0.01mpbs10倍稀释后,用0.45微米滤膜过滤后上样。b.用洗脱缓冲液(0.1m甘氨酸ph=2.7)洗脱目的蛋白,并加入中和缓冲液(1mtris-hclph=9.0)使抗体中和到中性左右(ph=7.0-8.0),然后将纯化抗体立即用截留分子量为50k的millipore超滤离心管和15ml磷酸盐缓冲液(pbs)进行缓冲液置换并浓缩抗体。c.获得的抗体再次用10倍0.01mpbs稀释后,用t184多肽包被的cnbr-activatedsepharose亲和纯化柱进行再次上样纯化,此次需要收集的是上样流出液,而不是吸附到柱子上的洗脱液,因为针对非磷酸化位点的抗体会吸附到柱子上,而针对磷酸化位点的抗体将自动流出。d.最后用截留分子量为50k的millipore超滤离心管将抗体浓缩并测定抗体浓度。e.将抗体储存于4℃冰箱中备用。最后纯化的抗体经sds-page鉴定。鉴定后抗体1:1比例加入抗体保护液(80%甘油和1%bsa),混匀后保存于-20℃。结果:抗体纯化后经sds-page蛋白电泳鉴定(图2),紫外分光光度计测定抗体浓度为0.56mg/ml。步骤4:抗atf1(pt184)多克隆抗体的鉴定4.1抗atf1(pt184)多克隆抗体的elisa鉴定以合成的atf1蛋白的pt184和t184多肽为检测抗原,分别包被酶标板,以1:2000稀释的未免疫兔血清作为阴性对照,将兔血清及纯化后的抗体倍比稀释,应用elisa方法检测,以与阴性血清的比值大于2.1判断为阳性,以吸光度值大于1计算单抗效价。结果:从效价上分析,免疫动物获得的抗atf1抗血清中针对pt184磷酸化位点的抗体是主要成分,针对非磷酸化位点的t184抗体只占很少一部分;抗体经过pt184和t184多肽包被的亲和纯化柱两次纯化后,基本去除了非磷酸化抗体成分,获得的抗atf1(pt184)抗体的效价达到1:8万,对应吸光度值为1.422,而对照组中同样稀释倍数条件下,针对t184抗原的吸光度值只有0.13(表4)。表4抗atf1(pt184)抗体效价注:第1和第2条酶标板包被的是非磷酸化多肽t184,第3和第4条酶标板包被的是磷酸化多肽pt184。第1和第3条酶标板空中加入的是纯化后抗体倍比稀释液,第2和第4条酶标板空中加入的是纯化前兔抗血清倍比稀释液。ovrflw表示吸光度值过高,超过酶标仪读数范围。4.2抗atf1(pt184)纯化前后免疫斑点检测试剂:tbst缓冲液,nacl87.6g,20mmtris-hcl缓冲液ph7.5100ml,吐温205ml,ddh2o定容至1000ml。称量pt184和t184多肽各1mg并溶解于1ml0.01mpbs缓冲液中,分别取5μlpt184和t184溶解多肽点样到pvdf膜上,用含5%脱脂奶粉的tbst封闭液封闭pvdf膜1h,加入纯化的抗atf1(pt184)多克隆抗体(稀释倍数1:4000),常温下孵育1h后洗膜五次(8min/次),加入irdye700标记的羊抗兔二抗(稀释倍数1:5000),常温下孵育1h后洗膜五次(8min/次),最终结果由odyssey红外荧光扫描成像系统采集数据。结果:本发明中的兔抗atf1(pt184)抗血清和多肽亲和纯化的抗atf1(pt184)多克隆抗体能够监测到pvdf膜上的pt184和t184多肽。抗血清中的多克隆抗体主要识别pt184多肽,只有部分抗体识别t184多肽。纯化后抗体则基本上识别pt184多肽,几乎不能识别t184多肽(图3)。4.3抗atf1(pt184)多克隆抗体的western-blot鉴定构建pcdna6.0/myc-his-atf1野生型及pcdna6.0/myc-his-atf1(t184a)突变表达载体(突变体将184位苏氨酸突变为丙氨酸)。然后将两种表达载体分别瞬时转染鼻咽癌cne1细胞,转染48小时后收集鼻咽癌cne1细胞,细胞用裂解液裂解后进行12%sds-page电泳,电泳后转pvdf膜,经脱脂奶粉封闭后加入纯化的抗atf1(pt184)多克隆抗体(稀释倍数1:4000),常温下孵育1h后洗膜五次(8min/次),加入irdye700标记的羊抗兔二抗(稀释倍数1:5000)常温下孵育1h后洗膜五次(8min/次),最终结果由odyssey红外荧光扫描成像系统采集数据。结果:本发明中的抗atf1(pt184)多克隆抗体可在cne1细胞裂解液中检测到36kd左右的蛋白条带,与atf1蛋白分子量大小相符。野生型质粒转染的细胞表达的atf1蛋白第184位点苏氨酸被明显磷酸化,突变体质粒转染的细胞表达的atf1蛋白也呈现少量磷酸化现象,原因在于cne1细胞本身也有atf1蛋白的本底表达(图4)。4.4抗atf1(pt184)多克隆抗体的免疫组化鉴定1)主要试剂:环保透明剂,无水乙醇,1×pbs,dab染色液(聚合物法)试剂盒,苏木素,中性树胶,edta(1mm,ph8.0)抗原修复液8ml,ddh2o定容至400ml。2)实验步骤a.将病理切片置于60℃烘箱,烤片2h,环保透明剂中浸泡3次,每次10min,依次用100%、95%、80%、70%梯度酒精水化脱苯,每次5min,去离子水中浸泡3min。b.热抗原修复:1×edta抗原修复液加入微波盒中,微波加热至沸腾,将脱蜡水化后的石蜡切片置于耐高温塑料玻片架上,缓慢放入已沸腾的缓冲液中,中档微波处理20min,取出微波盒自然冷却至室温,从缓冲液中取出玻片,先用蒸馏水浸泡两次,之后用pbs浸泡3次,每次3min。c.阻断内源性过氧化物酶的活性:甩掉并擦干组织周围液体(组织切勿干燥),平放于湿盒中,滴加内源性过氧化物酶阻断剂,室温避光孵育15min,用pbs洗3次,每次5min,甩掉并擦干组织周围液体,平放于湿盒。d.一抗孵育:加atf1(pt184)多克隆抗体(1:100用1×pbs稀释)100ul,阴性对照加1×pbs100ul,置于湿盒中,4℃冰箱过夜,37℃复温修复30min,用pbs洗5次,每次5min,甩掉并擦干组织周围液体,平放于湿盒。e.二抗孵育:滴加特异性二抗工作液100ul于组织上,置于湿盒中,室温孵育20min,用pbs洗5次,每次5min,甩掉并擦干组织周围液体。f.滴加预先准备好的显色剂dab工作液100ul,在光镜下控制显色,显色完全后,浸泡入蒸馏水中,终止显色。g.苏木素复染5min,1%盐酸酒精浸泡30-60s分化,自来水冲洗。h.5%氨水浸泡20-30s返蓝,自来水冲洗10min。i.70%、80%、95%、100%梯度酒精脱水干燥,每级3min,置环保透明剂中浸泡3次,每次5min。中性树胶封片,镜下观察结果。结果:图5为鼻咽癌病理切片,图6为胃癌病理切片。如图5a、6a所示,可见本发明中的磷酸化atf1-t184主要出现于细胞核内,与atf1定位一致,为阳性结果;而用pbs代替atf1(pt184)多克隆抗体后检测,可见细胞核内无特异性染色,为阴性结果(图5b、6b)。我们对视野中的阳性细胞进行计数,作为每一个样品的表达值,然后进行统计分析,发现磷酸化atf1-t184在鼻咽癌和胃癌组织中高表达,其差异具有统计学意义(图5c、6c)。图6d为胃癌病人的生存曲线。1为高表达p-atf1-t184,0为低表达p-atf1-t184。发现磷酸化atf1-t184主要出现于细胞核内,与atf1定位一致。并且对122个胃癌样本及其癌旁组织进行统计分析后发现,肿瘤组织与非肿瘤组织之间存在统计学差异。而且在对这122个胃癌做病人做生存分析(表5和图6d)后可见,高表达atf1-pt184的病人其生存时间远远低于低表达的病人,其结果具有统计学意义。表5整体比较卡方dfsiq.logrank(mantel-cox)7.3311.007brelow(generalizedwilcoxon)6.7041.010tarone-ware7.2401.007上表为不同p-atf1-t184细胞核水平下生存分布均匀性检验。本发明的磷酸化多克隆抗体可特异性识别atf1蛋白pt184位点,可用于检测肿瘤细胞该位点的磷酸化水平,为探索肿瘤细胞增殖及转移机制研究提供一种工具,也为肿瘤诊断提供帮助,并能指导其临床预后判断。序列表<110>广东医科大学<120>一种atf1蛋白的磷酸化抗原多肽、应激磷酸化抗体的制备方法及应用<130>px-2017110205<141>2017-11-13<160>0<170>siposequencelisting1.0当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1