一种血液细胞的高效诱导多能干细胞重编程方法与流程
本发明属于细胞领域,具体涉及一种血液细胞的高效诱导多能干细胞重编程方法。
背景技术:
脊椎动物胚胎发育早期囊胚的内细胞团具有多能性,其可以分化为机体除胎盘之外三胚层的所有类型细胞,这些已经终端分化的细胞在体内一般是不会改变命运的。一些研究表明,通过核移植,细胞融合和多能性细胞提取物共培养的方法可以实现终端分化的细胞重新逆分化为多能性的状态,但这些方法依赖于稀缺的卵母细胞或已有的多能干细胞,因此在应用上受到很大的限制。
2006年,日本京都大学yamanaka研究小组利用逆转录病毒载体,将外源性的pou5f1、sox2、c-myc和klf4四种转录因子在小鼠成纤维细胞中过表达,在小鼠胚胎干细胞(embryonicstemcell,esc)的培养条件下获得了fbx15+的多能干细胞系,该细胞系在细胞形态、生长特征、表面标志物、形成畸胎瘤等方面与小鼠esc非常相似,而在基因表达谱、dna甲基化方式及形成嵌合体动物方面却不同于小鼠es细胞,故将其命名为诱导多能干细胞(inducedpluripotentstemcell,ipsc)。
(takahashik1,yamanakas.inductionofpluripotentstemcellsfrommouseembryonicandadultfibroblastculturesbydefinedfactors.cell.2006;126:663-676)
2007年7月,yamanaka研究小组进一步用nanog代替fbx15蛋白进行筛选,得到了nanog+的ipsc,该ipsc不仅在细胞形态、生长特征、标志物表达、移植到小鼠皮下可形成包含3个胚层组织细胞结构的畸胎瘤等方面与小鼠esc非常相似,而且在dna甲基化方式、基因表达谱、染色质状态、形成嵌合体动物等方面也与小鼠esc几乎完全相似。此外,研究还发现重新激活外源致癌基因c-myc是嵌合体动物出现肿瘤形成的原因;而转染的上述4个基因在ipsc中并没有表达,表明这些基因只在诱导过程中起作用,ipsc保持多潜能性状态的原因是内源性转录因子,如nanog等基因的表达。
(okitak1,ichisakat,yamanakas.generationofgermline-competentinducedpluripotentstemcells.nature.2007;448:313-317.)
2007年11月,yamanaka研究组使用了同样的方法获得了人类诱导多能干细胞hipsc,同时,威斯康辛大学thomson研究小组也报道了成功诱导成纤维细胞转化为具有人类胚胎干细胞hesc基本特征的hipsc,所不同的是他们使用慢病毒作为载体,并在14个候选基因中选择出了pou5f1、sox2、nanog、lin28a等4个基因进行转导。
(yu,j.,etal.,inducedpluripotentstemcelllinesderivedfromhumansomaticcells.science.2007;318:1917-1920)
2008年,parkih.,etal.利用来自胎儿、新生儿及成人的皮肤或肺部的原代成纤维细胞,其中包括来自1名健康男性皮肤活检得到的成纤维细胞,采用yamanaka研究小组的策略也获得了相同的结果。他们还发现pou5f1和sox2在hipsc诱导重编程中是必需的,正是这两个转录因子激活、维持了内源多潜能性因子的表达,而klf4和c-myc的作用是改变染色质的结构,从而有利于pou5f1和sox2的结合,以提高诱导的效率。此外,该项研究的重要意义在于将取自皮肤活检的成纤维细胞诱导为hipsc。上述研究表明,从活检人类皮肤组织中提取体细胞后进行诱导以制备患者特异性的干细胞是可行的,因而有望克服细胞移植治疗中存在的免疫排斥反应。
(parkih.,etal.,reprogrammingofhumansomaticcellstopluripotencywithdefinedfactors.nature.2008;451:141-146)
由于向供体细胞转导外源基因使用的病毒/质粒载体会在重编程过程中对其产生一定影响,通过此类方法筛选获得的克隆中存在基因重排、核型异常、表观遗传学异常等现象,甚至具有高危致癌几率。2008年,okita等人通过多次常规质粒转染的方法获得了小鼠ipsc,但操作麻烦、重编程效率低下。同年,stadtfeld等人首次使用由腺病毒载体衍生的复制缺陷型载体生成无整合的ipsc。他们成功地在小鼠肝脏细胞中表达此种载体携带的外源oskm基因,并得到了无外源基因整合的ipsc。但是在重编程小鼠胎儿肝细胞及成体成纤维细胞时,必须在稳定反式表达外源oct4基因的前提下转染携带skm基因的载体,才能得到ipsc。2009年,fusaki团队利用基于仙台病毒(sendaivirus,一个rna病毒)的载体将不同类型的终末分化细胞重编程为hipsc。但这种方法的诱导获得的ipsc内仍然含有此病毒载体,并且在多次传代后仍然可能在细胞内存在,不易删除。在多次传代后筛选到的不含此载体的ipsc克隆由于长时间异位表达myc基因,可能会导致其核型异常。另外zhou等人于2009年以蛋白质oskm与一个精氨酸的细胞膜转导结构域融合,在大肠杆菌中表达并提纯了融合蛋白、将这些融合蛋白转导入含oct4-gfp报告基因的mef中,获得了绿色荧光蛋白阳性的克隆,这种方法避免将外源性基因材料引入重编程细胞中,但最大缺陷在于效率低下,重编程所需时间长,并且需耗费很大精力用以提纯高剂量的融合蛋白。jia等人利用minicircle载体从人类脂肪来源的间充质干细胞获得了非整合ipsc,但需要多次转染,操作比较麻烦,效率提高有限。
(okita,k.,etal.generationofmouseinducedpluripotentstemcellswithoutviralvectors.science2008;322(5903):949-53;
stadtfeld,m.,etal.inducedpluripotentstemcellsgeneratedwithoutviralintegration.science2008;322(5903):945-9;
fusaki,n.,etal.efficientinductionoftransgene-freehumanpluripotentstemcellsusingavectorbasedonsendaivirus,anrnavirusthatdoesnotintegrateintothehostgenome.procjpnacadserbphysbiolsci2009;85(8):348-62.
zhou,h.,etal.generationofinducedpluripotentstemcellsusingrecombinantproteins.cellstemcell2009;4(5):381-4.
jia,f.,etal.anonviralminicirclevectorforderivinghumanipscells.natmethods2010;7(3):197-9.)
2009年,kaji等人利用脂质体包裹携带dna的一种特殊载体系统重编程了小鼠成纤维细胞,在这载体两侧插入了loxp位点,在完成诱导后通过瞬时表达cre重组酶而删除此重编程构件。这一系统的优点在于,在重编程完成后可对外源基因进行删除,其结果可能会提高ipsc的再分化潜能(排除外源基因干扰),更重要的是可以避免重编程因子的激活,从而降低了肿瘤生成的风险。缺点是使用此系统的重编程因子去除效率极低,并且在删除重编程构件后,在cre重组酶切除loxp位点后,细胞内仍残留含loxp位点的载体。基于这些原因,woltjen在内的研究者尝试使用了转座子系统:即同时使用携带目的基因的piggybac转座子及转座子酶对供体细胞进行了重编程,并成功获得了ipsc。转座子系统不仅能精确切除目的基因,并且在切除后无残留,但重编程因子去除效率低下,同时使用转座子酶具有一个表达时间窗口,需要严格控制其表达时间,否则会因为多轮剪切整合导致非保守删除。
(kaji,k.,etal.virus-freeinductionofpluripotencyandsubsequentexcisionofreprogrammingfactors.nature2009;458(7239):771-5;
woltjen,k.,etalpiggybactranspositionreprogramsfibroblaststoinducedpluripotentstemcells.nature.2009;458(7239):766-70.)
2009年,yu等人利用orip/ebna1游离型载体首次获得了无外源基因污染的人类诱导多能干细胞。此方法只需一次转染,操作简单,而且游离型载体在hipsc扩增时会自动的从细胞内去除。但初始的orip/ebna1游离型载体重编程方法效率低下,而且需滋养层细胞,不利于hipsc的规模化制备以及临床级hipsc的制备。
(yu,j.,etal.humaninducedpluripotentstemcellsfreeofvectorandtransgenesequences.science2009;324(5928):797-801;)
如何提高体细胞重编程的效率,一直是该领域科研人员的研究主题之一。提高ipsc细胞产生的效率,使产生的ipsc细胞更加安全有效,是ipsc细胞得以应用亟需解决的问题。
技术实现要素:
为了解决上述问题,本发明的目的是提供一种血液细胞的高效诱导多能干细胞重编程方法,可以高效诱导产生无外源基因成分的多能干细胞。
本发明提供了如下的技术方案:
一种血液细胞的高效诱导多能干细胞重编程方法,包括如下步骤,
s1、从血液标本中抽提单核细胞,通过扩增培养基进行选择性培养,获取红细胞祖细胞;
s2、将含有至少一种潜能性决定因子的游离型载体导入s1中获取的红细胞祖细胞;
s3、将s2中获取的含有游离型载体的红细胞祖细胞经多能干细胞诱导培养基培养,在无饲养层体系中诱导成重编程中间态细胞;
s4、待完全诱导后,更换s3中所述的多能干细胞诱导培养基为多能干细胞培养基维持培养,获得所述的潜能性决定因子表达消失且内源多能性基因pou5f1、nanog、tra-1-60与tra-1-81表达激活的细胞,该细胞即为诱导多能干细胞。
优选的,所述血液标本来源于脊椎动物。
优选的,所述血液标本为人类血细胞。
优选的,所述人类血细胞取自人外周血、新生儿脐带血、人骨髓血中的任意一种。
优选的,所述的游离型载体为含有一个或多个潜能性决定因子的非染色体整合的dna游离型载体。
优选的,所述非染色体整合的dna游离型载体为包含dna复制启动子和作用于上述dna复制启动子的反式作用因子;
所述的dna复制启动子来源于eb病毒、kaposi's肉瘤疱疹病毒、松鼠猴疱疹病毒、马立克式病毒的orip;
所述反式作用因子为一种ebvnuclearantigen1。
优选的,所述潜能性决定因子选自pou5f1、nanog、sox2、lin28a、klf4、mycl、mycn、myc、p53knockdown、mir302/367cluster、esrrb、rex1、gbx2、dlx4、zscan10、zscan4、tbx3、glis1、nr5a1/2、rarg、bmi1、kdm2b、tet1和sv40lt转录因子中的任意一种或者任意多种的组合。
优选的,所述潜能性决定因子选自pou5f1、nanog、sox2、lin28a、klf4、myc和sv40lt转录因子任意一种或者任意多种的组合。
优选的,所述潜能性决定因子来源于脊椎动物。
优选的,所述s1中的扩增培养基、s3中的多能干细胞诱导培养基和s4中的多能干细胞培养基均为化学成分明确的培养基。
本发明还提供了一种通过红细胞祖细胞来源的高效诱导多能干细胞重编程方法获取诱导多能干细胞,该诱导多能干细胞无外源基因成分,适用于细胞再生医疗的临床前研究和临床应用。
本发明的有益效果是为临床前研究与临床应用提供一种安全高效的诱导多能干细胞(ipsc)的方法,该方法是将一组潜能性决定因子导入红细胞祖细胞内并回收多潜能细胞,所述潜能性决定因子承载于一个或多个游离型载体上,本发明所提及的游离型载体不会稳定地整合到靶细胞dna中,并且hipsc中没有残余游离型载体成分。因为反式作用因子在ipsc中不表达,以及细胞分裂期间的不对称分布稀释了游离型载体,所以容易地获得丢失了游离型载体的ipsc。该方法在ipsc制备过程中产生的多潜能细胞可以在衍生期间瞬时表达一个或多个拷贝的所选潜能性决定因子,但本方法通过针对ipsc单克隆进行了筛选,可避免具有整合载体的细胞。此外,ipsc直接来源于人外周血、新生儿脐带血和人骨髓血等,意味着产生多潜能细胞的起始细胞类型是非多潜能细胞或终末分化细胞,样本来源较为便捷,而且相对于皮肤来源的细胞,基因突变积累较少。本方法获得的诱导多能干细胞与人类胚胎干细胞的特征非常相似,表达多潜能细胞特异性标记物,例如,pou5f1、nanog、ssea-3、ssea-4、tra-1-60与tra-1-81。
附图说明
图1是血细胞来源的ipsc重编程方法流程图;
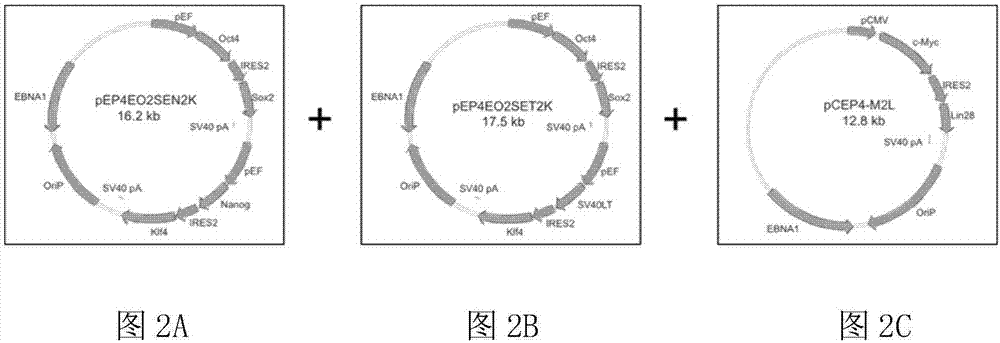
图2a是pep4-e-o2s-e-n2k游离型载体的结构示意图;
图2b是pep4-e-o2s-e-t2k游离型载体的结构示意图;
图2c是pcep4-m-2l游离型载体的结构示意图;
图3a是利用流式细胞术对红细胞祖细胞的鉴定,扩增第10天红细胞祖细胞cd71的表达情况,其中浅灰色线条为抗体阴性对照,黑色线条为红细胞祖细胞中cd71抗体的表达百分比;
图3b是利用流式细胞术对红细胞祖细胞的鉴定,扩增第10天红细胞祖细胞cd235a的表达情况,其中浅灰色线条为抗体阴性对照,黑色线条为红细胞祖细胞中cd235a抗体的表达百分比;
图4是诱导多能干细胞的形态图示,其中,a、b、c、d分别为培养第1、2、3、4天时显微镜下ipsc的形态图,scalebar为200μm;
图5a是利用流式细胞分析诱导多能干细胞(第36代)细胞表面标志物ssea4的检测,其中浅灰色线条为同种抗体阴性对照,黑线为ipsc细胞表面标志物抗体;
图5b是利用流式细胞分析诱导多能干细胞(第36代)细胞表面标志物tra-1-81的检测,其中浅灰色线条为同种抗体阴性对照,黑线为ipsc细胞表面标志物抗体;
图6利用qrt-pcr检测诱导多能干细胞(第14代)多能性基因oct4+/nonog+的表达;
图7是对诱导多能干细胞(第11代)进行染色体核型检测;
图8a是诱导多能干细胞(第11代)在小鼠体内神经组织外胚层形成的畸胎瘤经苏木精-伊红染色处理的结果,成瘤时间为10周;
图8b是诱导多能干细胞(第11代)在小鼠体内软骨组织中胚层形成的畸胎瘤经苏木精-伊红染色处理的结果,成瘤时间为10周;
图8c是诱导多能干细胞(第11代)在小鼠体内肠道组织内胚层形成的畸胎瘤经苏木精-伊红染色处理的结果,成瘤时间为10周。
具体实施方式
本发明通过在游离型载体上引入潜能性决定因子而将红细胞祖细胞重编程为人类诱导多能干细胞,整个操作流程图如附图1所示。所述游离型载体在重编程期间存在但在重编程后的细胞内基本消失。本发明中,“重编程”是指一种遗传过程,其将分化的体细胞转化为去分化细胞,所述去分化细胞比其衍生的细胞具有更高的潜能。
在本发明中,“多潜能细胞”是指表达多潜能细胞特异性标记、具有未分化细胞的细胞形态特征(即紧密集落、高核质比和明显核仁)并且可以分化为所有三个胚层(例如内胚层、中胚层和外胚层)的细胞群体。当引入免疫受损动物如scid小鼠中时,所述多潜能细胞形成通常包含所有三个胚层的细胞或组织特征的畸胎瘤。本领域普通技术人员可以使用本领域常用技术来评定这些特征。多潜能细胞既能够在细胞培养时增殖,也能够分化为显示多潜能特性的各种谱系限制性细胞群体。多潜能细胞比体细胞具有更高潜能。通过本发明重编程方法获得的的产物细胞被称为“诱导多能干细胞”或“ipsc(inducedpluropotentstemcell)”,表示人工地将非多能性细胞(例如红细胞祖细胞)诱导成为多潜能细胞。所述诱导通常是通过强制表达特定基因来实现的。适合本方法的起始细胞来源于血液细胞,例如人外周血、新生儿脐带血和人骨髓血中的红细胞祖细胞,也可以是其他脊椎动物的血液细胞,例如家养动物(如猫、狗等)、家畜(如牛、羊、猪、马等)或实验动物(如猴子、大鼠、小鼠、兔子、豚鼠等)。本发明的重编程方法可根据细胞类型和表达系统而有所不同,本领域普通技术人员了解用于制备具有适合转导率的接受性细胞的示例性条件。
本发明使用的术语“潜能性决定因子”表示能够单独地或与其他因子相组合地将血液细胞诱导成多能干细胞的因子,例如蛋白质、多肽、编码或非编码rna等。
本发明使用的术语“pou5f1”表示八聚体转录因子家族(thefamilyofoctamertranscriptionfactors)的一个成员,其在维持细胞的多能性上起到关键作用。在文献中,pou5f1也曾被称为oct3和oct4。
本发明使用的术语“nanog”属于antp类、nk家族基因,是胚胎干细胞内的一个重要转录因子,它对维持胚胎干细胞多能性起关键性作用,能够独立维持icm和es细胞的多能性。
本发明使用的术语“klf4”表示kruppel样转录因子家族(kruppel-likefamilyoftranscriptionfactors)的一个成员。
本发明使用的术语“sox2”表示sox转录因子家族成员之一。
本发明使用的术语“lin28a”表示rna结合蛋白家族成员之一。
本发明使用的术语“sv40lt”表示猿猴病毒40大t抗原基因(simianviruslargetantigensv40lt),是有效的永生转化基因之一。本身不是潜能决定因子,但其被有利地引入靶细胞,其向细胞提供足以在重编程期间促进细胞存活的条件,同时潜能决定因子被表达。
本发明使用的术语“myc”表示本领域技术人员熟知的一种转录因子,其调控许多基因的表达,募集组蛋白乙酰基转移酶。
本发明的游离型载体为闭合环状dna质粒,可以在单一重编程载体上提供一种或多种潜能性决定因子,可将多种重编程载体引入单个体细胞。一种强力的、构成性转录启动子可以向多种潜能性决定因子提供转录启动控制;所述潜能性决定因子可以受独立强力的、构成性启动子的转录控制;所述的启动子可能是多个拷贝的相同启动子,也可能是不同的启动子。各种异源启动子是本领域已知的,并且可根据诸如潜能决定因子的希望表达水平之类的因素来使用。对转录启动子选择的另一考虑为启动子在靶标体细胞内保持沉默的比率。本方法中的启动子可以是人类ef1α延伸因子启动子。熟练的技术人员将理解,通过单一载体而非通过多种载体引入所有因子对效率更有利,但当总的载体大小增加时,则变得越来越难以引入载体。熟练的技术人员还将了解,因子在载体上的位置能影响其瞬时表达,以及所得重编程效率。这样,申请人在多种载体组合上使用了各种因子组合,若干此类组合在此表明支持重编程。
在引入重编程载体之后并当靶细胞正在被重编程时,载体能存留在靶细胞内,而引入的潜能性决定因子则被转录和翻译。在已重编程为多潜能状态的细胞内,可以有利地下调或终止潜能性决定因子基因的表达。重编程载体与受体细胞的基因组协同地复制,可适度地稳定约2~3周,这比不能复制其dna的游离型载体稳定时间更长。然而,由于载体在细胞分裂时未等分,在缺乏选择性压力时,细胞丢失游离型载体,一旦细胞稳定,则细胞以每代约5-20%的速度继续丢失游离型载体,所以技术人员可以容易地用该方法回收无载体的多潜能细胞。
本发明使用的术语“导入”表示将外源物质(如核酸或蛋白质)引入细胞的过程,例如通过磷酸钙转染、病毒感染、脂质体转染、电穿孔或基因枪等方式进行。
本发明使用的术语“重编程中间态细胞”,即一种处于不完全重编程的细胞状态,是重编程过程中的一种中间态,包括部分多能性基因被激活,在适宜培养条件下可被诱导为多能干细胞。
下面结合具体实施例对本发明做具体说明。
实施例1
游离型载体构建
如图2所示,本实施例构建了三种游离型载体,均是通过聚合酶链式反应(pcr)扩增潜能性决定因子基因中的orf序列,并将该orf序列插入到含有orip/ebna1的哺乳动物表达载体pcep4中构建成游离型载体,三种游离型载体上均包含至少一个内部核糖体进入位点(internalribosomeentrysize,ires),其中第一种游离型载体为pep4-e-o2s-e-n2k,其依次包含第一启动子、pou5f1、ires2、sox2、第二启动子、nanog、ires2和klf4,第二种载体为pep4-e-o2s-e-t2k,其依次包含第三启动子、pou5f1、ires2、sox2、第四启动子、sv40lt、ires2和klf4,第三个载体为pcep4-m-2l,其依次包含第五启动子、myc、ires2和lin28a;上述第一、第二、第三和第四启动子均是延伸因子1α(ef1α)基因启动子,第五启动子是巨细胞病毒(cytomegalovrus,cmv)启动子。“e-o2s”是指一种具有位于oct4和sox2编码区上游且其间有ires2的ef1α启动子的表达序列。同样地,“e-n2k”是指一种具有位于nanog和klf4编码区上游且其间有ires2的ef1α启动子的表达序列;e-t2k是指一种具有位于sv40lt和klf4编码区上游且其间有ires2的ef1α启动子的表达序列;“m-2l”是指一种具有位于myc和lin28a编码区上游且其间有ires2的cmv启动子的表达序列。应当注意的是,本实施例构建了三种类型的游离型载体,但本领域技术人员可根据具体使用情况去构建一种、两种或者三种以上类型的游离型载体。
实施例2
1、红细胞祖细胞的获取
采集至少10μl的血样,转移到淋巴细胞分离管中,离心,取单核细胞层,用dpbs离心洗涤两遍,取样计数,根据计数结果取0.5×106细胞/ml接种于96,48,24,12或6孔板中,加红细胞祖细胞扩增培养基,置于37℃、5%co2培养箱中培养。分别于扩增第4天和第8天每孔补加与起始培养基同样体积的新鲜的扩增培养基。
本实施例的扩增培养基,具体配方为:每升扩增培养基包含its添加剂10ml、glutamax10ml、lipidconcentrate1ml、l-抗坏血酸2-磷酸化半镁盐水合物250μmol、硫酸亚铁3μmol、硝酸铁0.2μmol、硫辛酸1μmol、氢化可的松1μmol、干细胞因子100μg、促红细胞生成素20μg、白细胞介素-35μg、剩余补充imdm基础培养基。
2、红细胞祖细胞的鉴定
培养红细胞祖细胞第10天时,利用流式细胞术检测其表面分子cd71和cd235a的表达情况,分别检测其阳性率和平均荧光强度指标,实验结果如附图3所示,数据显示红细胞祖细胞特异性标志cd71+比例占98.1%,cd235a+比例占76.2%。
实施例3
游离型载体诱导重编程
a、复苏,待实施例2中的红细胞祖细胞长满后,取红细胞祖细胞0.5~4×106,用实施例1构建的pep4-e-o2s-e-n2k、pep4-e-o2s-e-t2k和pcep4-m-2l游离型载体电转染上述红细胞祖细胞,之后接种于诱导多能干细胞培养基和matrigel或玻连蛋白或其它细胞基质包被的六孔板中进行培养,各质粒dna的转染含量分别为pep4-e-o2s-e-n2k:pep4-e-o2s-e-t2k:pcep4-m-2l=1:1:1。
b、48小时后半量更换新鲜的多能干细胞诱导培养基,继续培养至10天,隔天进行换液,即在无饲养层体系上进行重编程。
本实施例的多能干细胞诱导培养基,其组分为:在每升实施例2红细胞祖细胞扩增培养基的基础上添加一种或多种以下小分子:chir990211μmol、a-83-010.5μmol和pd03259010.1μmol。
实施例4
重编程细胞的维持培养
10天后,将诱导多能干细胞更换为多能干细胞培养基,继续培养。重编程15天后,挑取形态类似于人胚胎干细胞的克隆至新的培养皿中进行扩增。经计数每200万个起始红细胞祖细胞中可获得300~350个诱导多能干细胞。
干细胞培养基:本实施例的干细胞培养基选自tesr1和e8培养基中的任意一种。
实施例5:
诱导多能干细胞的鉴定
1.方法
1.1诱导多能干细胞的细胞形态:通过显微镜观察获得的诱导多能干细胞细胞在第1、2、3、4天中形态的变化过程,并对其拍照保存,实验结果如图4所示,显微镜的比例尺(scalebar)为200μm。
1.2诱导多能干细胞的细胞表面标志物的检测:采用培养至第36代的诱导多能干细胞,用accutase收集细胞密度达80-90%的诱导多能干细胞,离心弃上清,重悬后加入ssea4-pe、tra-1-81-pe以及相应isotype,避光孵育,加facsbuffer,重悬离心弃上清,再加入facsbuffer重悬,使用流式细胞仪进行分析,实验结果如附图5所示,其中灰色线条为同种抗体阴性对照,黑线为hipsc细胞表面标志物抗体。
1.3诱导多能干细胞的多能性基因鉴定情况
采用培养至第14代的诱导多能干细胞,分别提取各诱导多能干细胞以及原代间充质干细胞(阴性对照组)的总rna,将总rna反转录为cdna,用多能性基因引物pou5f1(oct4)、nanog进行qpcr,导出数据并分析,实验结果如附图6。
1.4诱导多能干细胞的核型鉴定
采用培养第11代的诱导多能干细胞,待诱导多能干细胞融合度为80%~90%时,加入秋水仙碱处理细胞3小时,后用accutase消化细胞,离心收集细胞,用kcl溶液重悬细胞,加入新鲜配制的固定液(冰乙酸:甲醇=1:3)固定细胞,重复固定1次,离心,用固定液重悬细胞后滴于玻片上,置烘箱烘烤。将玻片置于2.5g/l胰蛋白酶消化液处理10s,giemsa染液染色10min,室温晾干后在显微镜下观察分裂中期相染色体,并用imstar全自动智能染色体核型扫描分析系统对染色体进行分析,实验结果如附图7所示。
1.5体内分化能力鉴定-畸胎瘤:
采用培养第11代的诱导多能干细胞,取生长状态良好的诱导多能干细胞注射到免疫缺陷小鼠后腿肌肉内<scid-berge>,6-10周后后腿肌肉注射部位形成包块,切除小鼠畸胎瘤组织,样本送病理科行苏木精-伊红(he)染色,在光学显微镜下鉴定三个胚层来源的组织细胞并拍照,实验结果如附图8所示。
2.结果:
如图4d所示,诱导多能干细胞克隆挑出来后进行扩增和传代,传代后得到的诱导多能干细胞克隆细胞仍保持高核质比,轮廓清晰、中心紧凑。显微镜(scalebar:200μm)观察获得的诱导多能干细胞在第1、2、3、4天中形态的变化过程,如图4b所示,诱导多能干细胞由梭形转变为圆形,聚集成团,核质比增大,中心部分排列紧密,4天时可见成簇的诱导多能干细胞克隆细胞形成。
如图5所示,诱导多能干细胞(第36代)表达了多能性细胞表面标志物ssea-4、与tra-1-81;如图6所示,诱导多能干细胞(第14代)pcr结果显示其表达细胞多能性相关基因pou5f1、nanog+;如图7所示,该诱导多能干细胞(第11代)可以维持正常的核型。体内分化能力鉴定-畸胎瘤实验形成的肿物,经病理科he染色,如图8所示,在显微镜下可见三胚层组织结构,分别为内胚层的腺体组织,中胚层的软骨组织,外胚层的神经组织。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!