基于代谢组学及转录组学关联分析筛选贝母生物碱合成关键基因的方法与流程
本发明涉及贝母中生物碱合成途径关键基因的筛选,具体的是结合三种贝母的代谢组学分析及生物碱合成途径相关基因的表达量进行关联分析,筛选出贝母中对生物碱含量贡献度较大的生物碱合成途径关键基因。
背景技术:
贝母为百合科多年生草本植物,其鳞茎供药用,广泛分布于地中海、北美和中亚地区。土耳其、巴基斯坦和东南亚等地常用不同品种贝母作为传统草药。我国贝母属植物资源丰富约有近50个种类,19个变种,主要分布于浙江、四川、新疆、甘肃、湖北和安徽等省,贝母属植物的干燥鳞茎是常用的传统中药,主要用于清热润肺,化痰止咳。由于产地、形态及药效不同,常用药用贝母主要有川贝母(Fritillariae cirrhosae bulbus)、浙贝母(Fritillariae thunbergii bulbus)和平贝母(Fritillariae ussuriensis bulbus)三个不同的品种。本研究所用川贝母为产自四川阿坝镇的暗紫贝母(Fritillaria unibracteata)。
贝母属植物中的主要化学成分是生物碱类化合物,多数属于甾体生物碱,其中以异甾生物碱为主,胆甾生物碱次之。甾体类生物碱包括贝母素甲、贝母素乙、贝母辛、湖北甲素、西贝素和蒲贝酮碱等为贝母属主要的生物活性成分。
近年来,针对药用植物次生代谢产物的基因调控已成为分子生物学研究的热点,而甾体生物碱类物质是植物次生代谢产物的重要组成部分,其含量和组成主要取决于生物合成关键基因在细胞中的表达水平。在植物细胞中,甾体生物碱类化合物主要来源于两个前体物质,异戊烯基焦磷酸(IPP)及其异构体二甲基烯丙基焦磷酸(DMAPP)。细胞质中的甲羟戊酸(MVA)途径和质体中的2-C-甲基-D-赤藓糖醇-4-磷酸(MEP)途径都能够产生IPP和DMAPP,且两条途径所产生的IPP可以穿过质体膜互为对方所用。IPP分子和两个DMAPP分子在法尼基焦磷酸合酶(FPS)的作用下生成法尼基焦磷酸(FPP),两个FPP分子在鲨烯合酶(SQS)的作用下以头-头方式还原偶联生成三萜类物质的前体鲨烯。随后,鲨烯在鲨烯环氧酶(SQE)的作用下氧化成2,3-氧化鲨烯,2,3-氧化鲨烯在环阿屯醇酶(CAS)作用下生成环阿屯醇,之后环阿屯醇在一系列酶的催化作用下生成甾体类化合物。有研究表明植物中也可能存在羊毛甾醇合酶(LAS)催化2,3-氧化鲨烯生成羊毛甾醇,羊毛甾醇经过一系列反应得到甾体类化合物。
本发明以探索贝母中差异代谢物含量和生物碱合成相关酶基因表达水平的关联性为出发点,应用超高效液相色谱-三重四级杆质谱联用系统(UPLC-QQQ/MS)对三种贝母中的生物碱含量进行了分析,同时通过高通量测序技术对三种贝母进行转录组学分析找出与生物碱合成途径相关基因的表达情况,然后通过关联性分析构建了贝母差异代谢物-基因表达关系图,对关键基因进行了筛选。在本发明之前,尚未出现涉及基于贝母生物碱含量及其合成途径相关基因表达量对贝母生物碱合成关键基因进行筛选的公开报道。
技术实现要素:
本发明的目的在于构建贝母差异代谢物含量和生物碱合成相关基因表达量的相关性关系,筛选不同贝母中对生物碱合成有重要作用的关键基因。
为了实现上述发明目的,本发明提供的技术方案包括下列步骤:
1)采用超高效液相四级杆飞行时间质谱对三种贝母中生物碱类物质进行定性分析,再用UPLC-QQQ/MS的多反应监测模式对定性得到的生物碱类物质的进行非靶标定量分析。
2)高通量测序分析贝母中生物碱合成途径相关基因的表达量。
3)构建差异代谢物-基因的关系网络,筛选贝母中生物碱合成关键基因。
上述方法中,所述三种贝母为新鲜的浙贝母、平贝母和暗紫贝母。
步骤1)所述分析生物碱类物质非靶标定量分析是采用UPLC-QQQ/MS对不同品种贝母生物碱进行检测,使用内标法通过标准曲线进行定量。分析方法参照Wang等人“Global detection and semi-quantification of Fritillaria alkaloids in Fritillariae Ussuriensis Bulbus by a non-targeted multiple reaction monitoring approach”论文中报道的生物碱定量方法。
步骤2)所述不同品种贝母的转录组学分析是使用测序策略Hiseq-PE150进行高通量测序。具体是分别提取样品RNA,再将RNA反转录合成第一链cDNA,然后利用AMPure XP beads纯化双链cDNA,再进行末端修复、加A尾并连接测序接头。再用AMPure XP beads进行片段大小选择。最后进行PCR扩增,并用AMPure XP beads纯化PCR产物,得到最终的文库。对文库精确定量保证质量,最后上机测序。
步骤3)中所述差异代谢物-基因相关性关系的构建和生物合成关键基因的筛选是通过关联分析将贝母生物碱含量与生物碱合成途径相关基因表达量结合分析得到的。具体的是使用皮尔逊相关系数对生物碱含量及生物碱合成途径相关基因的表达量进行相关分析,变量相关系数高于0.5作为筛选关键合成基因的标准。
本发明基于一年生贝母中生物碱类物质代谢及生物碱合成途径相关基因的表达构建了差异代谢物-基因表达相关性关系,对不同品种贝母中生物碱合成关键基因进行了筛选,为进一步阐明贝母中生物碱类物质合成机制提供了重要信息,同时为通过基因调控等手段提高贝母生物碱含量提供了重要依据。
附图说明
图1为贝母中甾体类生物碱在植物体内的合成途径;
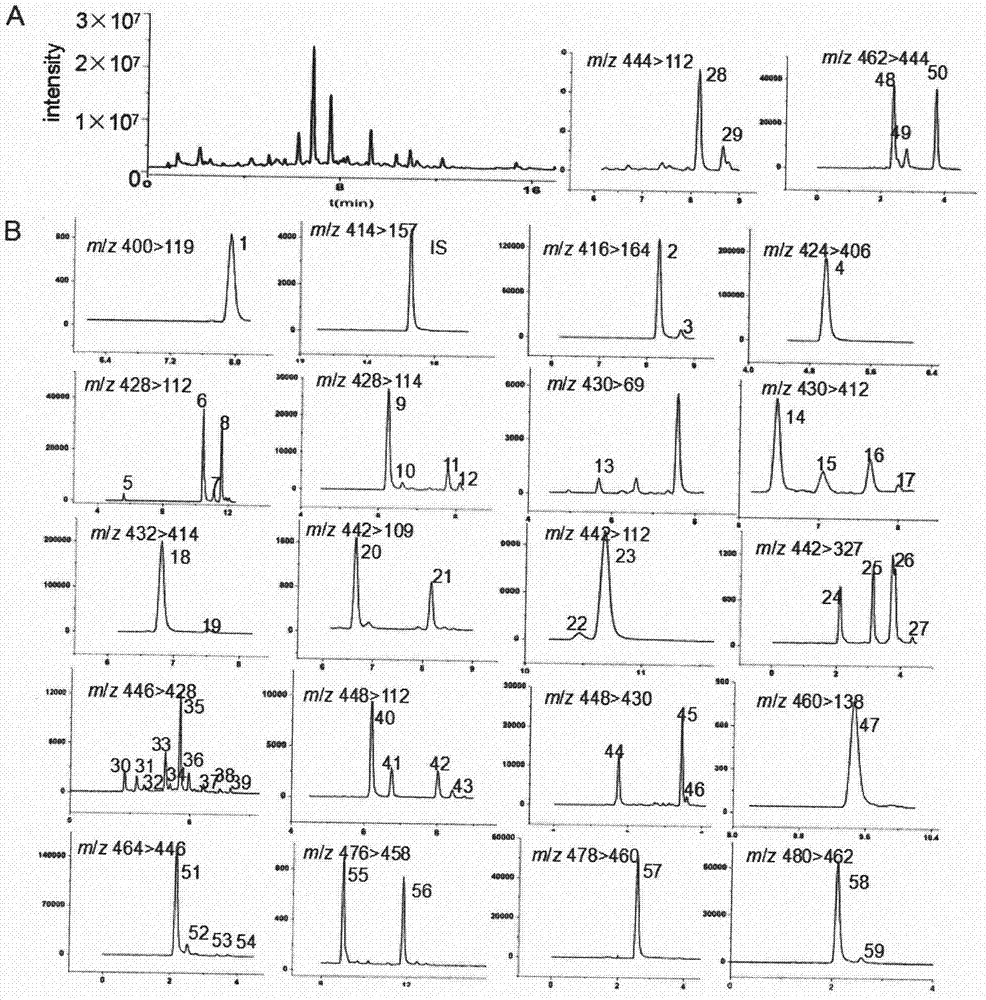
图2为质量控制样本QC的UPLC-QTOF/MS的总离子流图和三种贝母中检测到的生物碱MRM色谱图;
图3为三种贝母代谢组学分析中的PCA图,其中PB表示平贝母,ZB表示浙贝母,AZ表示暗紫贝母;
图4为三种贝母中贝母生物碱合成途径中相关基因的表达量热图,热图颜色越红表示表达量越高,颜色越蓝表示表达量越低;
图5A为贝母中差异代谢物与生物碱合成途径相关基因表达的关联分析热图,红色为正相关,蓝色为负相关,白色为不相关。图5B为相关因子大于0.5的差异代谢物与生物碱合成途径相关酶的网络关系图。FA2,平贝酮;FA9,贝母辛;FA19,贝母素甲;FA20,贝母素乙;FA52,平贝定苷;FA54,平贝碱甲;FA62,平贝碱丙;FA63,平贝碱乙
具体实施方式
下面对本发明的实施例作详细说明,以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试剂如无特殊说明,均为市售购买产品。
实施例1:代谢组学分析
1)材料
所用植物材料分别为收集于浙江金华的浙贝母,吉林磐石的平贝母和四川阿坝镇的暗紫贝母的新鲜鳞茎。采集时间为2017年5月份和6月份,收集到的样品一部分经液氮速冻后冷冻保存于-80℃冰箱,另一部分烘干,保存以做分析使用。
2)样品提取
将各样品研磨成粉末,取干燥粉末500mg,用3mL氨水(25%)碱化1小时,用50mL氯仿:甲醇(4∶1,v/v)混合溶液超声提取1小时。提取液用滤纸过滤,取续滤液10mL于蒸发皿中,水浴蒸干。蒸干后用10mL 0.1M盐酸溶解并过0.22μm有机滤膜备用。将MCX小柱用1mL甲醇,2mL纯水活化后上样,然后以1mL 0.1M盐酸和1mL甲醇除杂,最后用1mL5%二乙胺甲醇溶液洗脱。洗脱液氮吹吹干之后1mL甲醇定容,作为储备溶液。储备溶液稀释10倍,加入内标(澳洲茄胺)使其最终浓度为0.04μg/mL,将该溶液在13000rpm下离心10分钟,取上清放置于进样小瓶。
3)贝母代谢组学分析
参考Wang等人“Global detection and semi-quantification of Fritillaria alkaloids in Fritillariae Ussuriensis Bulbus by a non-targeted multiple reaction monitoring approach”论文中报道的生物碱定量方法,先使用超高效液相色谱-四级杆飞行时间质谱联用技术(UPLC-QTOF/MS)对上述样品提取物生物碱进行定性分析,然后再采用UPLC-QQQ/MS对上述定性得到的生物碱进行定量分析。
UPLC-QTOF/MS对贝母生物碱的定性分析
液相色谱分析采用安捷伦1290液相系统(Agilent,Germany),含在线真空脱气机、高压二元泵、自动进样器、柱温箱。色谱分离采用Waters Acquity UPLC HSS T3 C18柱(2.1×100mm,1.7μm);柱温:30℃;流动相:0.1%甲酸和10mM甲酸铵溶液(A)-乙腈溶液(B);梯度洗脱程序:0~15min,15~45%B;15~17min,45%B;柱后运行时间4min。流速:0.3ml/min,进样体积:5μl。
质谱检测条件为:干燥气体温度,325℃;干燥气流速,5.0L/min;雾化气(nebulizer),45psig;鞘气温度(sheath gas temperature),350℃;鞘气流速,10L/min;毛细管电压,4000V;锥孔电压(skimmer),65V;OCT 1RF Vpp,750V;裂解电压(fragmentor voltage),120V。正离子模式为全程监测模式,一级离子扫描范围设置为m/z 100~1000,二级离子扫描范围设置为m/z 50~1000。样品碰撞能量(collision energy,CE)设定为30,40和50V。
数据采集及处理分别采用Agilent LC-MS-QTOF Mass Hunter Acquisition Software Version.A.01.00(Agilent Technologies)及Mass Hunter Workstation Software Version B.02.00(Agilent Technologies)分析软件。
UPLC-QQQ/MS对检测到的生物碱定量分析
色谱条件同上述UPLC-QTOF/MS所有条件。
质谱检测采用Agilent 6460 QQQ/MS系统(Agilent Corp,USA),电喷雾(ESI)离子源。质谱检测条件为:干燥气体温度,325℃;干燥气流速,5.0L/min;雾化气(nebulizer),45psig;鞘气温度(sheath gas temperature),350℃;鞘气流速,10L/min;毛细管电压,4000V;锥孔电压(skimmer),65V;OCT 1RF Vpp,750V;碎片电压(fragmentor voltage),120V,碰撞电压,45V。正离子模式为全程监测模式,一级离子扫描范围设置为m/z 100~1000,二级离子扫描范围设置为m/z 50~1000。数据采集模式:子离子扫描(product ion scan)、母离子扫描(precursor ion scan)、多反映监测扫描(multi-reactions monitoring,MRM)。
数据采集及处理分别采用Agilent Mass Hunter Acquisition Software Version.A.01.00(Agilent Technologies)及Mass Hunter Workstation Software Version B.02.00(Agilent Technologies)分析软件。
不同品种贝母各取3个不同样品进行测定,每个样品重复进样三次,用内标法通过标准曲线计算贝母中生物碱的含量,结果用SIMCA-P 14.0进行PCA分析。
实施例2转录组学分析
采用RNAprep Pure Plant Kit试剂盒对样本进行总RNA提取,对得到的总RNA进行浓度,完整性和纯度检测,检测合格后,用带有Oligo(dT)的磁珠富集真核生物mRNA,随后加入fragmentation buffer将mRNA打断成短片段,以mRNA为模板,用六碱基随机引物(random hexamers)合成一链cDNA,然后加入缓冲液、NTPs和DNA polymerase I和RNase H合成二链cDNA,随后利用AMPure P beads纯化双链cDNA。纯化的双链cDNA先进行末端修复、加A尾并连接测序接头,再用AMPure XP beads进行片段大小选择。最后进行PCR扩增,并用AMPure XP beads纯化PCR产物,得到最终的文库。
文库构建完成后,先使用Qubit 2.0进行初步定量,稀释文库,随后使用Agilent 2100对文库的插入片段大小进行检测,插入片段符合预期后,使用Q-PCR方法对文库的有效浓度进行准确定量,以保证文库质量。上机测序,测序策略Hiseq-PE150。
由于贝母并未有参考基因组公布,因此本项目采用无参转录组分析策略。
对下机序列Raw data进行质控操作,获得clean data:
(1)当任一测序read中N含量超过该read碱基数的10%时,去除此paired reads;
(2)当任一测序read中含有的低质量(Q<=5)碱基数超过该条read碱基数的50%时,去除此paired reads。
然后对得到的clean data组装,表达定量分析,差异表达分析,功能注释以及GO富集分析。
在注释的基因中找出与生物碱合成途径相关的酶,总结其表达量。
实施例3代谢物-基因关系网络的构建
通过关联分析(correlation analysis)中的皮尔逊相关系数对不同贝母生物碱含量及生物碱合成途径相关基因的表达量进行关联分析,筛选其中对于贝母生物碱合成贡献度较大的基因。用于关键基因筛选的变量相关系数分界值为0.5。
结果与分析
实施例1代谢组学分析
如图2A所示为UPLC-QTOF/MS全扫描得到总离子流图(TIC),共检测得到59个化合物,将化合物分类之后用UPLC-QQQ/MS的MRM模式进行定量,如图2B所示为定量的64个化合物及内标的MRM色谱图。经PCA分析图可以看出,浙贝母、平贝母和暗紫贝母可以很好地区分开,如图4所示。差异性化合物的含量总结如表1所示,一共得到12个差异性化合物,已知成分的化合物有8个。由含量可知,大部分化合物存在于平贝母中,如平贝酮,平贝碱甲等。暗紫贝母中检测到的化合物则相对较少,主要有贝母辛,贝母素甲和贝母素乙,而它们在浙贝母中含量则是最高的。
表1 三种贝母中差异性代谢物的含量(平均值)
实施例2转录组学分析
如图4所示,CAS、SQS、SQE和HMGS等四种基因在贝母中表达量比较高,其余相对较低。在三种贝母的比较中,CAS在浙贝母和平贝中表达量相对较高,比如CAS3和CAS4;SQS在平贝母中表达量最高,如SQS2;SQE则在暗紫贝母和浙贝母中表达量较高,如SQE2。但是相同的基因,不同的拷贝在植物中的表达量也不相同,如SQE3则不同于SQE2,在平贝母中表达量最高;FPS1和FPS2两个基因也呈现出完全相反的分布趋势,表明相同基因不同拷贝在化合物合成中发挥差异化的作用。
实施例3代谢物-基因关系网络的构建
如图5A所示,使用SPSS对生物碱含量及生物碱合成途径相关基因的表达量进行相关分析,得到代谢物与基因表达的相关性分布热图。以相关因子大于0.5为准,筛选得到贡献度大的基因,构建基因与生物碱的网络关系图,如图5B。结果显示,化合物在与基因的相关性上表现出明显的差异,贝母辛,贝母素甲和贝母素乙为一组,其他为一组。由于贝母辛、贝母素甲和贝母素乙为贝母中已知的具有生物活性的化合物,并得到验证。而其他化合物多存在于平贝母中,不具有代表性,所以我们以贝母辛,贝母素甲和贝母素乙为目标,筛选关键性基因。图中可见,LAS1、CAS3、CAS4、SQS3、SQS5和SQE5基因与贝母辛,贝母素甲和贝母素乙相关性较大。所筛选出的对生物碱贝母辛,贝母素甲和贝母素乙合成起重要作用的基因有SQS,LAS,CAS,SQE,。另外与平贝酮等其他差异性生物碱的合成相关的基因有SQS,SQE,CAS。剩余基因为相关性低、不相关或负相关关系。
本研究将甾体类生物碱代谢与其合成途径上相关基因的表达联系起来,构建贝母基因-代谢物关系网络,进而筛选出对贝母生物碱合成贡献度较大的基因,为今后贝母中甾体类生物碱合成机制的阐明及通过基因调控等手段提高贝母生物碱含量有重要借鉴意义。
- 还没有人留言评论。精彩留言会获得点赞!