核酸适配体的筛选方法及特异性结合铜绿假单胞菌的核酸适配体与流程
本发明涉及生物技术领域,尤其涉及核酸适配体的筛选方法及特异性结合铜绿假单胞菌的核酸适配体。
背景技术
核酸适配体(aptamer)是一类通过指数富集配体系统进化技术(systematicevolutionofligandsbyexponentialenrichment),从大容量的核酸文库中筛选获得能与靶分子高特异性,高亲和力结合的单链或序列。然而,用于selex常规程序中的sanger测序由于其低通量性而使得大部分序列未被检测,因此筛选得到的适配体不具有真实代表性。相反,现代高通量测序技术(high-throu-ghputsequencing,hts)能够以千兆字节为单位给出大量的数据,从而保证足够的序列覆盖率,从而能够在任何一轮selex中准确识别pcr产物中最丰富的序列,为适配体的筛选开辟了一条新的途径。但基于全细菌selex(whole-bacteriaselex,wb-selex)的微生物特异性适配体的研究中,几乎没有任何应用hts的报道。
碳点(carbondots,cds)是一种荧光纳米材料,它具有生物相容性高,低毒性,水溶性高,激发光谱宽,量子产率适中,耐光漂白,易于大规模合成,成本低等优点。碳点是一类新的高性能荧光剂,并且能够赋予适体传感器更高的灵敏度。氧化石墨烯(grapheneoxide,go)由于片内能量或电子转移而对许多荧光基团具有优异的荧光猝灭能力,能解决荧光标记的生物传感器背景信号太强的问题。
铜绿假单胞菌是一种革兰氏阴性菌,是一种普遍存在于潮湿环境中的无处不在的机会性病原体是术后伤口感染、褥疮、脓肿、化脓性中耳炎、特别是烧伤后感染的主要病原菌,可导致血行散播,发生菌血症和败血症。世界卫生组织(who)将其定义为饮用水的安全指标。欧共体和食品法典委员会强调,铜绿假单胞菌不能在饮用水中检测到。然而,基于适体传感器的铜绿假单胞菌现场检测技术的发展并没有引起太多研究的关注,导致这一领域存在巨大挑战。因此,对水域内和食品中的铜绿假单胞菌进行监控对于食品安全、环境安全是有重要意义的,临床上对铜绿假单胞菌进行快速诊断更是对患者的诊疗有着重要的意义。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供核酸适配体的筛选方法及特异性结合铜绿假单胞菌的核酸适配体,本发明提供的筛选方法能够快速准确的筛选出高特异性的适配体。
本发明提供的特异性结合铜绿假单胞菌的核酸适配体的筛选方法包括:
构建随机文库,seqidno:3~4所示核苷酸序列的引物对制备次级文库;以大肠杆菌、枯草芽孢杆菌和金黄色葡萄杆菌为反筛选菌株,以铜绿假单胞菌为正筛选菌株,交替进行正筛选、反筛选共计15次;
筛选获得的ssdna文库经测序后,选择丰度较高,而自由能与kd值皆较低者,以恶臭假单胞菌、粪肠球菌、产气荚膜梭状芽胞杆菌为目标,排除特异性较低的适配体,筛选获得特异性结合铜绿假单胞菌的核酸适配体;
所述随机文库由顺序连接的5’端固定区域、随机区域、3’端固定区域组成;所述5’端固定区域的核苷酸序列如seqidno.1所示,所述3’端固定区域的核苷酸序列如seqidno.2所示。
所述随机区域的长度为40bp。
所述随机区域中各位碱基独立的选自a、t、c、g。
本发明中,所述筛选,第1轮为反筛选、第2~8轮为正筛选;第9轮为反筛选;第10~12轮为正筛选;第13~14轮为反筛选;第15轮为正筛选。
各轮筛选条件如表1:
表1各轮筛选条件
本发明中,所述筛选获得的ssdna文库为第9、12、15轮筛选获得的ssdna文库。
本发明中,采用的大肠杆菌为atcc25922,枯草芽孢杆菌为atcc6051和金黄色葡萄球菌为atcc12600。
所述测序采用高通量测序技术,对筛选得到的文库进行全面分析,得到更可靠,更具代表性的适配体。
具体的,使用illuminahiseq3000平台进行测序,产生1gb的数据量。
本发明提供了一种特异性结合铜绿假单胞菌的核酸适配体,其核苷酸序列如seqidno.5所示。
本发明提供的适配体具有良好的亲和力,能够特异性的识别铜绿假单胞菌,能够用于临床分离菌株的鉴定、饮用水安全的监控、饮品安全的监控等多方面的应用,其灵敏度较高,检测阈值可达9cfu/ml。
本发明还提供了一种生物传感器,其由5端修饰氨基的本发明提供的核酸适配体、炭点和氧化石墨烯制得。
本发明提供的生物传感器首先利用碳量子点标记5’端进行氨基修饰的核酸适配体,然后通过加入氧化石墨烯来猝灭碳量子点的荧光。传感器与待测样品孵育,在孵育过程中适配体特异性识别目标菌体,并使适配体上标记的碳量子点恢复荧光。
本发明所述生物传感器的制备方法,包括:
以edc和nhs活化炭点羧基后,与5端修饰氨基的本发明提供的核酸适配体混合孵育制得aptamer-cds;
将所述aptamer-cds与氧化石墨烯混合,孵育制得生物传感器。
所述活化为将炭点溶液与pbs缓冲液混合,然后加入edc和nhs的溶液,25℃超声30min。
所述炭点溶液的浓度为8μg/ml;所述pbs缓冲液的浓度为5mm;所述edc和nhs的溶液中edc的浓度为1mg/μl,nhs的浓度为1mg/μl。
edc和nhs溶液与炭点溶液的体积比为30μl:100μl。
本发明还提供了一种铜绿假单胞菌检测试剂盒,其包括本发明所述的生物传感器或本发明所述制备方法制得的生物传感器。
本发明还提供了一种铜绿假单胞菌的检测方法,将待测样品与本发明所述生物传感器混合,35℃~40℃孵育0.5h~2h,350nm的激发波长下,380~600nm的发射波长范围内记录荧光光谱,根据相对荧光强度判断是否存在铜绿假单胞菌;
所述相对荧光强度=(f450nm-f0450nm)/f0450nm;
其中,f450nm示待测样品的荧光信号输出值,f0450nm示空白对照的荧光信号输出值。
本发明中,所述判断为所述相对荧光强度大于等于零,则样品中含有铜绿假单胞菌。
本发明中,所述待测样品与所述生物传感器的体积比为100:75。
本发明中,所述待测样品为矿泉水,牛奶或可乐。
本发明提供的铜绿假单胞菌适配体的筛选方法,并提供了筛选到的适配体,该适配体具有良好的特异性和灵敏度,以该适配体制备的生物传感器能够实现对铜绿假单胞菌菌的准确检测,检测范围从101cfu/ml到107cfu/ml,检测限低至9cfu/ml,在对饮料中铜绿假单胞菌的污染的检测中表现出良好的检测能力。
附图说明
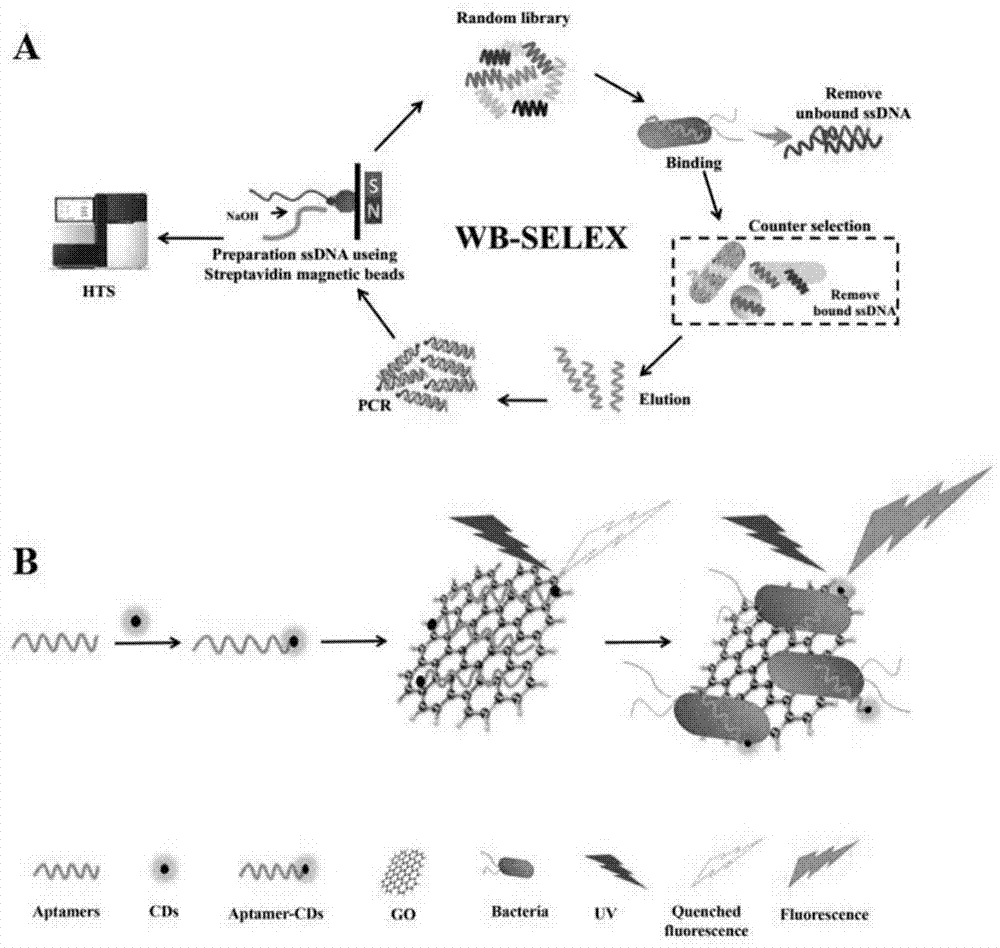
图1示由hts辅助的适配体筛选和鉴定(图1-a)和使用aptamer-cds/go系统对铜绿假单胞菌的检测(图1-b);
图2示a)hrtem表征cecds;b)cecd的紫外可见光谱(曲线a,黑色),pl激发(曲线b,蓝色)和pl发射光谱(曲线c,红色)c)ssdna适体候选物和ssdna-cecd的琼脂糖凝胶电泳;泳道1-5:pa-a1至pa-a5的ssdna适体候选分别;泳道6-10:pa-a1-cecd分别为pa-a5-cecd;m:dl2000dna标记,100bp,250bp,500bp,750bp,1000bp,2000bp,从下到上;d)ssdna-cecd的pl发射峰的红移;
图3a)ssdna-cds/go系统对铜绿假单胞菌的工作原理;b)三种适体候选者ssdna-cd/go系统对包括铜绿假单胞菌的七种细菌的选择性;*(p<0.05),**(p<0.01):两组间差异显着;c)反应体系中go浓度的优化;d)孵化时间的优化;
图4荧光回复率与铜绿假单胞菌浓度之间的线性关系。
具体实施方式
本发明提供了核酸适配体的筛选方法及特异性结合铜绿假单胞菌的核酸适配体,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明采用的试材皆为普通市售品,皆可于市场购得。
下面结合实施例,进一步阐述本发明:
实施例1适配体筛选
1、设计随机文库序列:
5’-tggaccttgcgattgcgattgacagc(40nt)gcagacatgagtct-caggac-3’中间随机区域为40个核苷酸,两端分别为20个核苷酸的固定区域,序列总长为80个核苷酸。
筛选所用的引物序列分别为:
上游引物:tggaccttgcgattgacagc
下游引物1:gtcctgagactcatgtctgc
下游引物2:5’-生物素gtcctgagactcatgtctgc
上述的核酸序列均由上海生工生物有限公司完成
2、采用wb-selex技术筛选铜绿假单胞菌适配体
铜绿假单胞菌核酸适配体的筛选过程如图1-a所示。
1)筛选所用菌株及其培养与收集:
使用铜绿假单胞菌atcc27853进行适配体筛选。使用大肠杆菌atcc25922,枯草芽孢杆菌atcc6051和金黄色葡萄球菌atcc12600进行反选择。恶臭假单胞菌atcc12633,粪肠球菌atcc19433,产气荚膜梭状芽孢杆菌atcc13124以及上述反选择细菌用于评估适配体的特异性。所有需氧菌株在lb培养基(10g/l胰蛋白胨,5g/l酵母提取物,10g/lnacl,ph7.2-7.4)中于37℃生长16小时。将厌氧菌在巯基乙醇酸液体培养基(青岛aikb)和厌氧瓶(bugbox,ruskinn,bridgend,uk)中于37℃培养48h。离心收集细胞,使用前用结合缓冲液(50mmtris-hcl,100mmnacl,5mmkcl,1mmmgcl2,ph7.5)洗涤两次。
2)第一轮筛选过程为负筛选,具体步骤如下:
1将人工合成的的文库1.3nmol溶解于130μl2x结合缓冲液中,95℃加热5min,冰浴10min。
2取大肠杆菌,枯草芽孢杆菌和金黄色葡萄球菌菌液进行离心洗涤,然后用2x结合缓冲液进行重悬,使每一种菌的浓度为1×107cfu/ml。
3将准备好的文库和菌液混合于300μl2x结合缓冲液中,于37℃摇床孵育30min,使文库与细菌充分结合。
4结合结束后,将混合液12000r/min离心10min,取上清作为模板进行pcr扩增并制备次级文库。结合到反筛细菌上的ssdna经离心去除掉。
5扩增体系:上游引物(10μm)和下游引物(10μm)各2.5μl,高保真q5酶0.5μl,,模板2μl,5xbuffer10μl,dntp(10mm)1μl,灭菌去离子水(ddh20)31.5μl。
扩增程序:总循环数为30,预变性温度为98℃,时间持续30s,变性温度为98℃,持续时间为10s,退火温度为66℃,持续时间为30s,延伸温度为72℃,持续时间为20
s。循环结束后,最后的延伸温度为72℃,持续时间为2min。
3)次级文库制备:
1pcr扩增产物利用聚丙烯酞胺凝胶进行电泳,然后使用索莱宝公司的page胶dna回收试剂盒回收正确条带,溶解于100μl磁珠buffer。
2充分震荡重悬磁珠,取50ul到1.5mlep管中。磁性分离1-2min,去掉上清,从磁性分离器上取下ep管。
3加入500ulbuffer1,充分震荡,磁性分离1-2min,去上清。重复一次。
4取pcr扩增后的胶回收产物,用buffer1稀释至500ul,加入磁珠重悬。于室温摇床结合90min。磁性分离1-2min,吸弃上清。
5用500ulbuffer1洗涤磁珠2次。
6加入100ul新配制的naoh,于37℃或者95℃孵育15min。
7磁性分离1-2min,取上清,得到100ulssdna。
8加入10ul左右的1mhcl溶液调节ph至7.5左右。
9用nanodrop2000测定ssdna的含量。
4)其他轮次筛选:
从第二轮开始,进行正常的筛选,与反筛的区别在于当文库与目标菌株结合以后,离心去除未结合的ssdna,用1x结合缓冲液洗涤菌体数次,加入100μlddh2o重悬菌体,95℃加热10min,12000r/min离心10min,取上清液作为模板进行pcr扩增并制备次级文库。筛选总共进行15轮,各轮的筛选条件见表1。
表1各轮筛选条件
a在第一轮反应体系中加入各反选择菌(大肠杆菌atcc25922,枯草芽孢杆菌atcc6051和金黄色葡萄球菌atcc12600)的体积。体积等于50μl,每个反选菌培养物的细胞密度为1×107cfu/ml。
b在其他轮次的反选中,在反应体系中加入每种反选择细菌(大肠杆菌atcc25922,枯草芽孢杆菌atcc6051和金黄色葡萄球菌atcc12600)的体积。体积等于100μl,每个反选菌培养物的细胞密度为1×107cfu/ml。
3、候选适配体的鉴定
hts对第9,12和15轮的ssdna文库进行了测序分析。从上一轮产生的pcr产物中富集2μg的ssdna,由novogeneco.ltd。(beijing,china)使用illuminahiseq3000平台进行测序以产生1gb的数据量。统计每一条序列出现的次数,从而揭示ssdna库内每个序列的丰度。选择丰度排在前五位的ssdna作为适配体候选者。使用dnaman软件分析适体候选者的自由能,并通过mfold程序(http://mfold.rna.albany.edu/?q=mfold)预测适体候选者的二级结构)。
表2.hts法鉴定铜绿假单胞菌适体候选序列、自由能和平衡常数.
使用水热法合成cd。为了制备aptamer-cds纳米缀合物,将100μlcd溶液(8μg/ml)在5mmpbs缓冲液中用30μln-(3-二甲基氨基丙基)-乙基碳化二亚胺盐酸盐(edc)(1mg/μl)和n-羟基琥珀酰亚胺(nhs)(1mg/μl)活化羧基,在25℃下进行超声处理30min。之后,将10μl超声处理过的混合物加入到溶于5mmpbs缓冲液中浓度为3.3μm的90μl修饰氨基的候选适配体中,在25℃孵育2小时。使用hrtem和琼脂糖凝胶电泳,uv-vis扫描和荧光光谱扫描等方法表征合成的cd和aptamer-cd。结果如图2所示。利用合成的aptamer-cecds可以确定候选适配体的kd值。如表1所示。
为了鉴定出最佳的适配体,基于合成的aptamer-cecd建立了aptamer-cecds/go系统。如上所述,本研究采用“开-关”策略用aptamer-cecds/go系统检测铜绿假单胞菌。如图3-a所示,在没有氧化石墨烯(go)的情况下,aptamer-cecd的荧光是明显的(图3-a,曲线a,蓝色)。当它们混合在一起时,通过π-π堆积相互作用将aptamer-cecds吸附到go表面上,并且go通过fret将aptamer-cecds的荧光猝灭。通过这种操作,背景荧光信号减少到最小(图3-a,曲线c,黑色)。将铜绿假单胞菌与aptamer-cds/go系统共同孵育后,aptamer-cds优先与铜绿假单胞菌结合,aptamer-cecds与go之间的π-π堆积作用被中断。通过这种方式,从go表面释放aptamer-cd并恢复荧光(图3-a,曲线b,红色)。因此,铜绿假单胞菌就像一个打开荧光的“开关”。通过读取荧光的恢复,可以识别铜绿假单胞菌的存在。这是saptamer-cds/go系统检测铜绿假单胞菌的工作原理。
经过鉴定,pa-a1对铜绿假单胞菌的结合不受其他菌种的影响,具有良好的特异性,而pa-a2~pa-a5则对其他菌种存在不同程度的结合,特异性较差。
实施例2检测铜绿假单胞菌
1、首先合成aptamer-cd/go生物传感器
使用水热法合成cd,然后将100μlcd溶液(8μg/ml)在5mmpbs缓冲液中用30μln-(3-二甲基氨基丙基)-乙基碳化二亚胺盐酸盐(edc)(1mg/μl)和n-羟基琥珀酰亚胺(nhs)(1mg/μl)活化羧基,在25℃下进行超声处理30min。之后,将10μl超声处理过的混合物加入到溶于5mmpbs缓冲液中浓度为3.3μm的90μl修饰氨基的候选适配体中,在25℃孵育2小时,制得aptamer-cd。将50μlgo(1mg/ml)加入到25μl前述aptamer-cds溶液(100nm)中以猝灭荧光,然后将混合物在37℃孵育1小时,制得aptamer-cd/go生物传感器。
2、铜绿假单胞菌的检测
将100μl铜绿假单胞菌(1×107cfu/ml)加入反应体系并在37℃下孵育1小时。不添加铜绿假单胞菌细胞的反应作为对照。在350nm的激发波长下,在380-600nm的发射波长范围内记录aptamer-cds/go体系的荧光光谱。根据相对荧光强度[(f450nm-f0450nm)/f0450nm]计算荧光信号输出值,其中f450nm和f0450nm分别表示在存在和不存在铜绿假单胞菌的情况下,在350nm激发波长时制备的适体传感器的荧光强度。当(f450nm-f0450nm)/f0450nm≥0则表明存在铜绿假单胞菌。
本方案,使用aptamer-cds/go系统对7种不同细菌进行检测。测试的细菌菌株是铜绿假单胞菌、恶臭假单胞菌,粪肠球菌,产气荚膜梭菌,大肠杆菌,枯草芽孢杆菌和金黄色葡萄球菌。结果表明,该生物传感器对铜绿假单胞菌能够准确识别,而对其他细菌的信号则较差,不产生相对荧光强度的变化,准确度可达100%。
3、灵敏度检测
为了评估aptamer-cds/go系统的灵敏度,按照如上所述的方法进行了针对一系列不同浓度的铜绿假单胞菌的检测,其范围从10cfu/ml至1×107cfu/ml。在优化条件下,测定了不同浓度铜绿假单胞菌存在下所制备的pa-a1-cecds/go体系的荧光恢复率。如图4所示,适体传感器对铜绿假单胞菌检测的浓度范围为10~108cfu/ml,表现出良好的响应性。荧光恢复率与铜绿假单胞菌浓度呈线性相关,标准曲线为(f-f0)/f0=0.0582log[c(cfu/ml)]-0.057,相关系数为0.993(f和f0分别表示在存在和不存在铜绿假单胞菌的情况下生物传感器的荧光强度)。根据该方程,得到的检测限(lod)为9cfu/ml
4、实际样品分析
从超市随机购买矿泉水(雀巢(中国)有限公司),牛奶(伊利有限公司,中国)和可口可乐(可口可乐(中国)有限公司)进行aptamer-cd/go系统对实际样品的应用评估。按照上述方法准备aptamer-cd/go系统。样品被不同浓度的铜绿假单胞菌人为地污染,该浓度从101~103cfu/ml,超出视觉识别范围。受污染的样品也采用相同的程序对aptamer-cd/go系统进行处理。使用灭菌后的蒸馏水作为阴性对照。
从表3的结果可以发现,使用适体传感器系统检测的细菌浓度接近于通过矿物质水和牛奶中的显微计数获得的细胞浓度,表明中性和高蛋白质条件对适体传感器系统的工作没有明显的副作用。但是可口可乐的检测效果受到了很大限制。这可能是由于可口可乐的酸性ph环境,影响了aptamer的正常折叠的正常功能
表3.实际样品中铜绿假单胞菌的检测结果
rsd:relativestandarddeviation(lianetal.,2015).
结果表明,本发明提供的方法可实现对饮品中铜绿假单胞菌的准确检测。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>中国海洋大学;青岛优度生物工程有限公司
<120>核酸适配体的筛选方法及特异性结合铜绿假单胞菌的核酸适配体
<130>mp1804060
<160>5
<170>siposequencelisting1.0
<210>1
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>1
tggaccttgcgattgcgattgacagc26
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
gcagacatgagtctcaggac20
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>3
tggaccttgcgattgacagc20
<210>4
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>4
gtcctgagactcatgtctgc20
<210>5
<211>84
<212>dna
<213>人工序列(artificialsequence)
<400>5
tggaccttgcgattgacagcagacatgagtctcaggacgtgaccgctggaccttgcgatt60
gacagcagacatgagtctcaggac84
- 还没有人留言评论。精彩留言会获得点赞!