G72蛋白及其三种突变体蛋白及其制备、纯化方法和应用与流程
本发明涉及现代分子生物
技术领域:
,具体涉及一种g72蛋白及其三种突变体蛋白及其制备、纯化方法和应用。
背景技术:
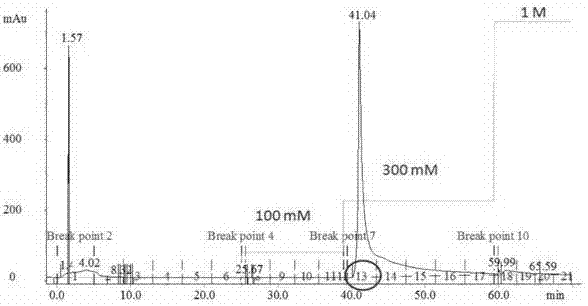
现今社会忙碌的生活步调与莫大的工作压力及家庭压力,造成患有精神疾病的病人日益攀升。部分精神疾病患者会有自杀的倾向,而其中又以精神分裂症所造成的后果最为严重,因此对于精神分裂症的治疗成为各方极欲解决的目标之一。精神分裂症是精神疾病中较为严重的精神障碍症状,受此影响的有约1%的世界人口和占近2.5%的医疗费用。目前至少有11个基因研究报告指出,精神分裂症与g72和dao基因座相邻处具有高度关联性。g72与dao也因此被当作精神分裂症、双相情感疾病及忧郁症的生物标志,用于找寻这些精神疾病与基因型间之关系。g72基因是一个灵长类动物特有的基因,g72蛋白(p:protein;l:largestformofg72)为g72基因的产物之一,由153个氨基酸所组成的胞浆蛋白。此基因座位于人类第13号染色体的长臂上,能与dao产生交互作用,目前发现其为dao的活化蛋白,可以增强dao的催化功能,降低细胞内dserine的浓度。chumakov团队发现一个明显与精神分裂症相关的区域bina,在bina上有两个互补基因,称为g72与g30。此基因只存在于高等灵长类动物,并只表现于脑部及中枢神经系统中,会影响海马回的正常运作。由于d-serine为nmda受器重要的配体之一,其浓度也被报导与精神分裂症相关。所以可能因为它们之间交互作用的影响,使得g72间接调控nmda受体的活性进而诱发疾病产生。g72通常被认为是daao相互作用蛋白,也是n-甲基-d-天门冬氨酸受体激动剂,参与突触可塑性和兴奋毒性。nmda受体的活化时需要有glutamate和d-serine做为共同增效剂结合于nr1上,才能有效的将nmda通道打开,使得钠、钾、钙离子通过[8]。其中以钙离子最重要,因钙离子具有较高的通透性,与许多细胞功能调节有关,因此nmda受体在许多生理及病理的发展过程扮演重要角色。当脑中的nmda受体有损伤时,会使神经元细胞死亡,甚至会发生一些脑部方面的神经退化性疾病,如阿兹海默症、癫痫(epilepsy)、巴金森氏症等。目前精神分裂症仅能仰赖于临床症状诊断,在分子诊断方面,并无可靠的分子生物标记,只能确定它是一个高遗传的复杂性疾病。而最近的研究发现精神分裂患者白血球中g72(又称d-aminoacidoxidaseactivator,daoa)的mrna表达量可能较高(蓝先元教授未发表结果)。目前在基因库里没有g72同源基因的相关数据,但是有越来越多的证据针对g72和dao潜在于重郁症和精神分裂症作用于d-serine神经传导的关联做研究。技术实现要素:为了解决上述的技术问题,本发明提供一种g72蛋白及其三种突变体蛋白及其制备、纯化方法和应用。其目的在于,将得到g72蛋白及其三种突变体蛋白应用于精神分裂症病理的一系列研究中,有助于现代医学对于精神病症的深入研究,开发成治疗精神疾病以及诊断检测精神疾病的试剂,为攻克该系列疾病提供了方法。本发明提供g72蛋白及其三种突变体蛋白,分别为g72-6h、g72r30a-6h、g72r30d-6h、g72r30k-6h,其特征在于,三种突变体蛋白g72r30a-6h、g72r30d-6h、g72r30k-6h的基因为g72基因的arg30分别突变成ala、asp及lys。本发明进一步保护上述g72蛋白及其三种突变体蛋白的制备及纯化方法,包括以下步骤:步骤一、质粒制备:以cdna为模板,加入引物进行pcr,进行30次循环后,以pro-taq将g72基因扩增后,将g72的pcr产物经过酶ndei与xhoi处理后将其接入pet23a(+)质粒中,将g72的基因以ecori和xhoi处理后接入pgex-6p-1质粒内,以定点突变的方法在引物上设计出单点突变,以制备出具体单点突变的pet23a-g72r30k-6h表达质粒,g72r30a-6h和g72r30d-6h的dna片段是以两阶段聚合酶链反应完成;通过琼脂凝胶体电泳分析和dna胶体片段纯化,得到纯化后的pcr产物,以限制酶ndei及xhoi处理纯化过后的g72-6h片段与pet23a(+)载体,使得g72-6h有可与pet23a(+)互补的回文序列,以琼脂胶将载体和g72片段自胶体纯化,以限制酶bamhi及xhoi处理并纯化,加入连接酶及缓冲液于25℃下反应2小时,使g72接合入pet23a(+)载体中,接着转化入大肠杆菌top10f’,于37℃培养至隔日,并以菌落pcr法确认连接成功之后将菌落挑起送测序公司测序,确认序列正确无误后即完成质粒制备,完成质粒制备后即大肠杆菌top10f’大量表达带有his-tag的g72-6h;步骤二、蛋白质的表达:将表达g72-6h的质粒转入大肠杆菌感受态细胞菌株,挑取单一颗菌落培养于lb培养液中,且于培养液中外加氨苄西林和氯霉素,于37℃隔夜培养后,从培养液中取出0.5ml加入5ml新鲜的lb于37℃培养,当菌体浓度达到od600至0.4-0.6时,将温度维持于25℃,外加最终浓度为0.5mm的异丙基硫代半乳糖苷,隔夜培养后,取出1ml菌体于4℃下以离心,去除上清液之后加入适量的pbs,超声破碎仪将细胞壁打破,离心之后分离出可溶物与不可溶物;步骤三、蛋白质的纯化:g72蛋白n端接有gst标签,命名为gst-g72,以谷胱甘肽管柱纯化,将表达gst-g72蛋白的大肠杆菌均匀溶在pbs中,以超声破碎仪将其震破,以4℃,离心20分钟移除细胞碎片,将上清液过滤,以清洗缓冲液i清洗至数值稳定,再以清洗缓冲液ii清洗数次至数值稳定,最后以冲洗缓冲液冲洗出gst-g72蛋白作为本发明进一步的改进,g72蛋白及三种突变体蛋白的引物为:pet23a-g72-6h:g72-f’–ndei:atatcatatgctggaaaagctgatgggg72-r’-xhoi:tatactcgagttcagctttggtagaagpet23a-g72r30a-6h:g72-r30a-f’:ataggttttcaagcgagcattcttctgagcg72-r30a-r’:gctcagaagaatgctcgcttgaaaacctatpet23a-g72r30d-6h:g72-r30d-f’:ataggttttcaagacagcattcttctgagcg72-r30d-r’:gctcagaagaatgctgtcttgaaaacctatpet23a-g72r30k-6h:g72-r30k-f’:ggttttcaaaagagcattcttctgag72-r30k-r’:tcagaagaatgctcttttgaaaacc。作为本发明进一步的改进,过滤器的孔径为0.45μm。作为本发明进一步的改进,冲洗缓冲液由50mmtris-hcl、10mmph为7.4的还原型谷胱甘肽制备而成。作为本发明进一步的改进,清洗缓冲液i为pbs缓冲液内含300mmnacl,所述清洗缓冲液ii为pbs缓冲液内含1mnacl。作为本发明进一步的改进,离心转速为9000-12000rpm。作为本发明进一步的改进,氨苄西林的浓度为50μg/ml,所述氯霉素的浓度为25μg/ml。本发明进一步保护一种将根据上述g72蛋白及其三种突变体蛋白在治疗精神分裂症药物中的应用。本发明进一步保护一种将根据上述g72蛋白及其三种突变体蛋白在诊断检测精神分裂症试剂中的应用。本发明具有如下有益效果:本发明利用分子生物学技术将g72蛋白表达并纯化出来,得到纯度较高的g72蛋白以及其三种突变体蛋白,可将其应用于精神分裂症病理的一系列研究中,有助于现代医学对于精神病症的深入研究,开发成治疗精神疾病以及诊断检测精神疾病的试剂,为攻克该系列疾病提供了方法。附图说明图1为g72蛋白及其突变体蛋白的制备和纯化工艺流程图;图2为g72蛋白质表达质粒的电泳分析,m:dna标准品;pet23a-g72-6h以限制酶ndei和xhoi处理,pgex-6p-1-g72以限制酶bamhi及xhoi处理后并进行电泳分析;图3为g72arg30残基点突变测序图,(a)为pet23a-g72-6h野生型测序结果,(b)为pet23a-g72r30a-6h,经测序之后由agg(arg)突变为gcg(ala),(c)为pet23ag72r30d-6h,由agg(arg)突变为gac(asp),(d)为pet23a-g72r30k-6h突变的测序结果,由agg(arg)突变为aag(lys)。突变的位置如框所示;图4为高表达量菌种的挑选图,m:蛋白标准品。1号到4号为不同菌落所表达的蛋白质,将菌体以sds-page电泳分析,结果显示1号到4号菌落的gst-g72表达量无明显差异;图5以图4的1号到4号菌株表达重组蛋白gst-g72并打破菌体后分离上清液及沉淀物;图6为westernblotting分析图,利用gst抗体侦测,证明gst-g72蛋白,s为可溶蛋白,i为不可溶蛋白;图7为以aktaprime纯化的g72-6h,图中显示g72-6h会在1,3-二氮杂戊环浓度为300mm时被洗脱出来;图8为fractionno.13-19为1,3-二氮杂戊环浓度为300mm时被洗脱而出的g72-6h,分子量为17.9kda;图9为以aktaprime纯化g72r30a-6h,图中显示g72r30a-6h会在1,3-二氮杂戊环浓度为100mm及300mm时被洗脱出来;图10为fractionno.10和no.16为1,3-二氮杂戊环浓度为100mm及300mm时被洗脱而出的g72r30a-6h,分子量为17.9kda;图11为以aktaprime纯化g72r30d-6h,图中显示g72r30d-6h会在1,3-二氮杂戊环浓度为100mm及300mm时被洗脱出来;图12为fractionno.10和16为1,3-二氮杂戊环浓度为100mm及300mm时被洗脱而出的g72r30d-6h,分子量为17.9kda;图13为以aktaprime纯化g72r30k-6h,图中显示g72r30k-6h会在1,3-二氮杂戊环浓度为100mm及300mm时被洗脱出来;图14为fractionno.10和no.16为1,3-二氮杂戊环浓度为100mm及300mm时被洗脱而出的g72r30k-6h,分子量为17.9kda;图15为以还原电泳分析g72-6h、g72r30a-6h、g72r30d-6h及g72r30k-6h蛋白质图,withglutathione表示重新折迭缓冲液中含有谷胱甘肽,withoutglutatgione表示缓冲液中没有加入谷胱甘肽,g72r30a-6h、g72r30d-6h及g72r30k-6h的重新折迭缓冲溶液中不含谷胱甘肽。具体实施方式下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整的描述,显然,所述的实施例只是本发明的部分具有代表性的实施例,而不是全部实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的其他所有实施例都属于本发明的保护范围。实施例1、菌株及质粒表1本研究用菌株及质粒菌株及质粒描述大肠杆菌e.colitop10f用于质粒的制备大肠杆菌e.colibl21(de3)plyss用于蛋白表达pgem-teasy质粒用于t-a克隆pet23a(+)质粒用于蛋白表达pmal-c2g质粒用于蛋白表达pgex-6p-1质粒用于蛋白表达2、引物pet23a-g72-6h:g72-f’–ndei:atatcatatgctggaaaagctgatgggg72-r’-xhoi:tatactcgagttcagctttggtagaagpet23a-g72r30a-6h:g72-r30a-f’:ataggttttcaagcgagcattcttctgagcg72-r30a-r’:gctcagaagaatgctcgcttgaaaacctatpet23a-g72r30d-6h:g72-r30d-f’:ataggttttcaagacagcattcttctgagcg72-r30d-r’:gctcagaagaatgctgtcttgaaaacctatpet23a-g72r30k-6h:g72-r30k-f’:ggttttcaaaagagcattcttctgag72-r30k-r’:tcagaagaatgctcttttgaaaacc。3、主要溶液及培养基的配制(一)质粒提取试剂:(1)溶液ⅰ:50mm葡萄糖,25mmtris-cl(ph8.0),10mmedta(ph8.0);溶液ⅱ:0.2mnaoh,1%sds(临用前配);溶液ⅲ:60ml5m乙酸钾,11.5ml冰乙酸,28.5ml蒸馏水。(2)3m乙酸钠(ph5.2):称取40.8gnaac加入ddw中,使总体积约为60ml,加热至68℃助溶,加冰乙酸调至ph5.2,溶液冷却至室温定容至100ml。1.034×105pa,20min高压灭菌,室温贮存。(3)te缓冲液(ph8.0):10mmtris-cl(ph8.0),1mmedta(ph8.0)。(4)ste溶液:0.1mnacl,10mmtris-cl(ph8.0),1mmedta。(二)琼脂糖凝胶电泳缓冲液(50×tae):tris242g、冰乙酸57.1ml、0.5medta(ph8.0)100ml,加蒸馏水定容至1000ml,室温保存。工作液稀释50倍。(三)lb培养液及培养基:tryptone10g、yeastextract5g、nacl10g,加双蒸水至900ml,用5nnaoh(约200μl)调ph值至7.0~7.2,定容至1l,高压灭菌20~30min,置4℃储存备用。在每升lb液体中加入15g琼脂粉即为固体lb培养基,高压灭菌20~30min,置4℃储存备用。(四)pbs(ph7.4):nacl8g、kcl0.2g、na2hpo41.42g、kh2po40.27g,加去离子水充分溶解,浓盐酸调节ph值为7.4,定容至1l,高温高压20min灭菌,室温保存。(五)蛋白电泳相关试剂蛋白电泳缓冲液1×tris-glycine:tris.hcl25mm,glycine250mm,sds0.1%,ph8.3,固定液:乙醇400ml,冰醋酸100ml,加水至1,000ml,考马斯亮蓝染色液:0.29g考马斯亮蓝g250,加水至250ml,脱色液:乙醇250ml,冰醋酸80ml,加水至1,000ml。(六)westernblot相关试剂转膜缓冲液:glycine2.9g,tris.base5.8g,sds0.27g,加水至1,000ml使用之前新鲜加入20%的甲醇;tbs:tris-hcl50mm(ph7.6),nacl150mm;tbst:tris-hcl50mm(ph7.6),nacl150mm,0.1%tween20;封闭液:5%脱脂奶粉,溶于tbst;碱性磷酸酶底物缓冲液:nacl100mm,mgcl25mm,tris-hcl100mm,ph9.5。(七)蛋白纯化相关试剂ssax蛋白纯化的清洗缓冲液:50mmhepes,ph7.4,1mmedta,50mm1,3-二氮杂戊环ssax蛋白纯化的冲洗缓冲液:50mmhepes,ph7.4,lmmedta,200mm1,3-二氮杂戊环ssax蛋白保存缓冲液:50mmhepes,ph7.4,10%甘油,2mmdtt4、工具酶及抗体限制性内切酶,t4dna连接酶,rnase,primestar⑩hsdnapolymerase,购自宝生物(大连)工程有限公司;溶菌酶购自sigma公司;蛋白酶k及小肠碱性磷酸酶购自neb公司;小鼠抗his-tag单克隆抗体及碱性磷酸酶标记的马抗小鼠igg(h+l)抗体均购自北京中杉金桥生物技术有限公司。5、dna和蛋白分子量标准dnamarker购自宝生物(大连)工程有限公司;1kbplusdnaladder和100bpplusdnaladder购自北京全式金生物技术有限公司。6、试剂盒dna凝胶回收纯化试剂盒和质粒小提试剂盒,购自北京全式金生物技术有限公司;ta克隆试剂盒,购自promega公司。7、制备和纯化方法:步骤一、质粒制备(一)引物设计针对蛋白质表达与纯化部份,设计引物进行质粒置备,具体引物见材料部分。(二)单克隆筛选(a)聚合酶链反应以cdna为模板,并加入上述之引物进行pcr,反应条件分别为变性反应95℃,30秒、退火55℃,30秒、延伸反应72℃,1分钟。进行30次循环后,dao与g72基因可以扩增。以pro-taq将dao与g72基因扩增后,接入pgem-teasy质粒中并确认序列正确。将g72的pcr产物藉由ndei与xhoi经过酶裁切后将其接入pet23a(+)质粒中,以及将g72的基因以ecori和xhoi处理后接入pgex-6p-1质粒内。经转化作用将质粒送入大肠杆菌e.colitop10f’后挑出单一菌落并以pcr确认后再送生物技术公司做测序。另外以定点突变的方法在引物上设计出单点突变,以制备出具体单点突变的pet23a-g72r30k-6h表达质粒。pcr程序:95℃,30秒,55℃,30秒,68℃,7分钟,共30个循环。由pcr获得的突变质粒在特测序列上没有被甲基化,而限制酶dpni能辨识碱基序列5’-gamtc-3’,同时在腺嘌呤时是必须要被甲基化过。因此,pcr反应后所得到的产物以dpni(1unit)处理1小时后,可去除当成模板的质粒dna。将dpni处理过的pcr产物转化入大肠杆菌top10f’之后,挑取菌落并测序,确定突变是否成功。g72r30a-6h和g72r30d-6hdna片段是以两阶段聚合酶链反应完成,首先将pet23a-g72当做模板,增殖pcr片段时加入引物对g72-r30a-f’和g72-r’-xhoi以增殖g72r30a-6h后段序列以及另一引物对g72-r30a-r’和g72-f’-ndei以增殖g72r30a-6h之前段序列;引物对g72-r30d-f’和g72-r’-xhoi以增殖g72r30d-6h后段序列,以及另一引物对g72-r30d-r’和g72-f’-ndei以增殖g72r30d-6h前段序列。分别以pfu聚合酶将g72突变的基因扩增后,以琼脂凝胶体电泳分析,并将目标片段以限制酶切割后取下。分别将g72r30a-6h前后段及g72r30d-6h前后段混合后,加g72-r30a-f’/g72-r30a-r’或是g72-r30d-f’/g72-r30d-r’引物对再做一次pcr,结束后以酶ndei和xhoi处理目标基因与pet23a(+)载体后,并以连接酶将其各自连接,转化入大肠杆菌top10f’后增殖质粒。以pcr扩增的g72片段皆以限制酶ndei及xhoi切割后与pet23a(+)载体接合。dao的基因长度为1,044个碱基对,g72为461个碱基对,pet23a(+)质粒为3,586个碱基对。如图2,第一列所示,g72成功接合pet23a(+)载体,结合完成的质粒大小约为4,630bp及4,047bp,且此基因的c端带有his-tag可供蛋白质纯化使用。为了取得可溶的g72蛋白,因此将g72以限制酶ecori与xhoi处理后接入pgex-6p-1质粒内,并经由琼脂凝胶体电泳分析确认,结合后的质粒大小为5,430bp(图2,第二列)。g72r30a-6h与g72r30d-6hdna片段是依据两阶段聚合酶链反应完成。将dna片段以ndei和xhoi处理后,接合于pet23a(+)载体上并经由dna测序确认突变残基,突变完成的质粒大小为4,047bp。pet23a-g72r30k-6h是以定点诱变的方法制备。pcr反应后所得到的产物以dpni处理可去除模板dna,将dpni处理过的pcr产物转化入大肠杆菌top10f’之后,挑取菌落并确认g72序列,确定突变是否成功。由图3可知,g72的arg30(a,aag)已分别突变成ala(b,gcg)、asp(c,gac)及lys(d,aag)(b)琼脂凝胶体电泳分析配合dna片段大小,依照所需浓度秤取琼脂糖粉加热溶于1×tbebuffer(90mmtris,90mmh3bo3,2mmedtaph8.0)中,插上齿梳,置于室温冷凝,配置成适当浓度的胶体。待胶体凝固之后将齿梳移除,将胶体放置于电泳槽,加入tbebuffer至胶体完全浸泡于buffer中。将欲分析的样品dna与6×dnaloadingdye以5:1混合均匀后注入胶体之沟槽中,并且加入具有特定分子量的标准品。确认电泳方向为负极往正极后,开始进行电泳。电泳分析完成之后将胶体浸泡于etbr(10mg/ml,amresco)染剂中染色15分钟,再将胶体置于uv灯系统下观察并拍照记录,可利用dna标准品来比对样品dna片段之大小。(c)dna胶体片段纯化将pcr产物由dna胶体电泳分析之后,于uv灯系统下观察,将目标片段切下,装在1.5ml微量离心管中,利用胶体纯化试剂盒将dna纯化出来。先加入500μl的dfbuffer并加热至60℃待胶体全部溶解,再将溶解的样品加入df微量管柱中,室温离心10,000rpm,30秒,倒掉管柱下层的废液,加入0.7ml清洗缓冲液(含酒精),室温离心10,000rpm,30秒,重复上述步骤后,再以12,000rpm,离心2分钟,以去除残余酒精。将df微量管柱的下层换成新的微量离心管,加入50μl冲洗缓冲液,置于室温2分钟后,离心12,000rpm,2分钟。离心后于微量离心管中液体即为纯化后的pcr产物。(d)限制酶切反应以上述方法将目标基因自胶体纯化出来后,以ndei及xhoi处理g72片段与pet23a(+),使得g72-6h有可与pet23a(+)互补的回文序列。针对pmal-c2g载体,以琼脂胶将pgex-6p-1载体和g72片段则以限制酶bamhi及xhoi处理并纯化。(e)脱氧核醣核酸连接反应将由限制酶处理过的g72dna片段分别与同样经限制酶处理的pet23a(+)载体混和后加入连接酶及缓冲液于25℃下反应2小时,使dao与g72各自接合入pet23a(+)载体中,接着转化入大肠杆菌top10f’。于37℃培养至隔日,并以菌落pcr法确认连接成功之后将菌落挑起送测序公司测序,确认序列正确无误后即完成质粒制备。完成质粒制备后即可以大肠杆菌top10f’大量表达带有his-tag的g72-6h。(3)纯化质粒将转化后的大肠杆菌利用牙签挑取单一的菌落,放入5ml含有相对应抗生素的lb试管置于37℃培养16~18小时,将菌液以12,000rpm离心,去除上清液,利用质粒小提试剂盒抽取质粒。第一步加入0.2ml的bufferi将沉积的菌体打散,再加入0.2ml的bufferii上下翻转至溶液呈现清澈,最后加入0.2ml的bufferiii后混合均匀,离心12,000rpm,5分钟。离心之后将上清液取出加入微量管柱中,离心12,000rpm,30秒,倒掉微量管柱下的废液。加入0.7ml清洗缓冲液,离心30秒,倒掉微量管柱下的废液,再次加入0.7ml清洗缓冲液,离心30秒,倒掉微量管柱下的废液,再以12,000rpm,离心2分钟以去除残余酒精。将微量管柱的下层换成新的微量离心管,加入100μl冲洗缓冲液,置于室温2分钟后,以12,000rpm离心2分钟。微量离心管中液体即为抽取的质粒。步骤二、蛋白的表达将表达g72-6h的质粒转入e.colibl21(de3)plyss并挑取单一颗菌落培养于lb培养液中,且于培养液中外加氨苄西林(50μg/ml)和氯霉素(25μg/ml)。于37℃隔夜培养后,从培养液中取出0.5ml加入5ml新鲜的lb于37℃培养,当菌体浓度达到预定之od600至0.4-0.6时,将温度维持于25℃,然后再外加最终浓度为0.5mm之iptg(异丙基-β-d硫代半乳糖苷)。于0、1、2、3、4小时及隔夜培养后,取出1ml菌体于4℃下以12,000rpm离心,去除上清液之后加入适量的pbs以超声破碎仪将细胞壁打破,离心之后即可分离出可溶物与不可溶物。分别取适量的可溶物和不可溶物以12%和15%sds-page分析g72-6h,并以westernblotting鉴定。以材料与方法所述方式将pgex-6p-1-g72质粒dna经由转化作用转殖入大肠杆菌bl21(de3)plyss并分别挑取多颗菌落培养于5mllb培养液中含抗生素氨苄西林和氯霉素。gst-g72之分子量为45kda,将菌体以sds-page电泳分析后发现,1号到4号的菌体表达量并无明显差异(图4)。将菌体以超声破碎仪打破,红箭头处显示可能有部分为可溶性蛋白(图5)。由westernblotting分析,利用gst抗体侦测发现,gst-g72具可溶部份可供纯化(图6)。步骤三、蛋白的纯化g72蛋白n端接有gst标签,命名为gst-g72,以谷胱甘肽管柱纯化。将表达gst-g72蛋白的e.coli均匀溶在pbs中,以超声破碎仪将其震破,以4℃,以9,500rpm离心20分钟移除细胞碎片,将上清液通过0.45μm的过滤模。以清洗缓冲液i(pbs缓冲液内含300mmnacl)清洗至数值稳定,再以清洗缓冲液ii(pbs缓冲液内含1mnacl)清洗数次至数值稳定,最后以冲洗缓冲液(50mmtris-hcl,ph7.4,10mmreducedglutathione)冲洗出gst-g72蛋白。以tb(terrificbroth)大量表达出g72-6h及其突变后,将菌体以超声破碎仪打破,将含有包涵体的粗萃取物与蛋白质变性缓冲液混合,将沉淀的包涵体以尿素变性。将变性的蛋白质注入his-tag金属螯合管柱中,经结合缓冲液冲洗之后,以冲洗缓冲液将蛋白冲洗出来。由图7可得知经分液收集器收集后,于第13管样品可以收集到高量的g72-6h,此时的1,3-二氮杂戊环浓度为300mm。以sds-page分析,g72-6h蛋白可得到纯度高于90%的g72-6h蛋白,分子量为17.9kda(图8)。针对g72r30a-6h(图9和图10),g72r30d-6h(图11和图12)及g72r30k-6h(图13和图14),相同的方法可纯化出高纯度g72蛋白,但由于管柱使用次数多时,蛋白与管柱的结合力会变弱,因此,g72点突变蛋白可于1,3-二氮杂戊环100mm时就被冲洗出来。8、蛋白质电泳分析利用还原电泳sds-page分析经由纯化且经过蛋白质重新折迭的g72-6h、g72r30a-6h、g72r30d-6h及g72r30k-6h蛋白质,并侦测目标蛋白质大小。sds为一种界面活性剂,会和蛋白质键结,造成各式非共价键的破坏,而β-巯基乙醇和dtt为还原剂,可将双硫键还原,使其回复为一级结构。因为g72-6h在实验中已经初步得知不管有没有加入谷胱甘肽都不会影响活性,所以在g72r30a-6h、g72r30d-6h及g72r30k-6h的制备上就不加入谷胱甘肽,因此图中所显示的g72突变蛋白都是在重新折迭过程中没有加入谷胱甘肽所得到的蛋白质。因此将重新折迭后的g72-6h蛋白与三种突变蛋白以还原电泳分析,可得知蛋白分子量及纯度。图15可知蛋白的分子量都在17.9kda。本领域的技术人员在不脱离权利要求书确定的本发明的精神和范围的条件下,还可以对以上内容进行各种各样的修改。因此本发明的范围并不仅限于以上的说明,而是由权利要求书的范围来确定的。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1