一种聚乙二醇修饰蛋白的纯化工艺的制作方法
本发明涉及一种聚乙二醇修饰物的纯化新工艺,尤其涉及一种聚乙二醇随机修饰蛋白的纯化新工艺。
背景技术:
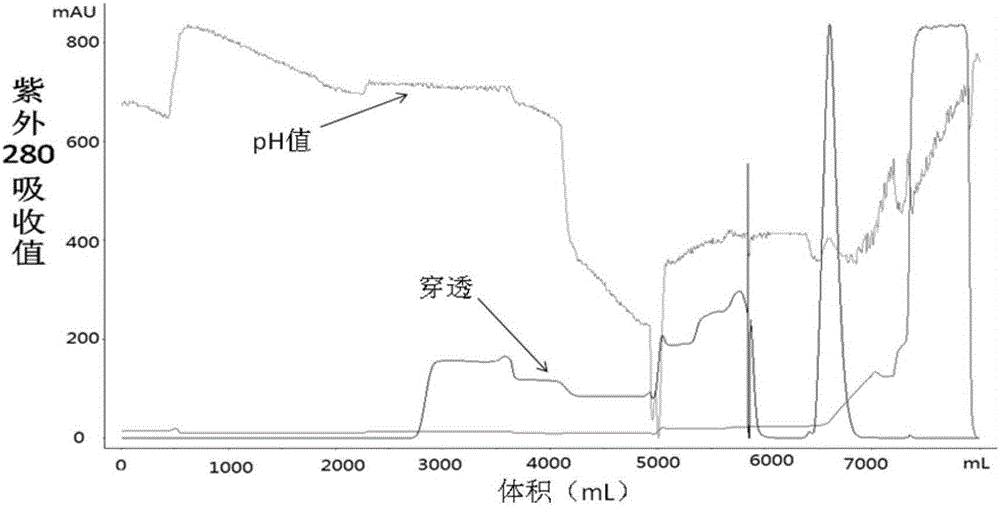
:蛋白质或多肽的聚乙二醇(polyethyleneglycol,PEG)修饰即PEG化(pegylation),是将活化的PEG通过化学方法以共价键偶联到蛋白质或多肽分子上。自1977年Davis首次采用PEG修饰牛血清白蛋白以来,PEG修饰技术迅速发展,并广泛应用于多种蛋白质和多肽的化学修饰,PEG修饰技术也从理论走向实际的药物应用。PEG修饰能赋予蛋白质和多肽类多种优良性能,具体表现为循环半衰期延长、免疫原性降低或消失、毒副作用减少以及物理、化学和生物稳定性增强等,在很大程度上扩宽了蛋白质和多肽的应用范围。其机理可能为:蛋白质PEG修饰后,相对分子质量(Mr)增大,当修饰后的蛋白质的Mr达到或超出肾小球滤过阈值时,蛋白质随血液循环进入肾脏后就可以逃避肾小球的滤过作用;由于PEG的屏蔽效应,使得修饰后的蛋白质或多肽不易受到各种蛋白酶的攻击,降解速率明显降低,稳定性提高,因而可以在血液循环中停留更长的时间;PEG在溶液中呈无规则卷曲,作为一种屏障,能掩盖蛋白质表面的抗原决定簇,使得蛋白质不能与各种细胞表面受体结合,不被机体的免疫系统识别,避免了相应抗体的产生,降低了蛋白质的免疫原性;PEG与蛋白质偶联后能将其优良的理化性质赋予蛋白质,如能改善蛋白质的生物分布和溶解性能。因此,蛋白质和多肽药物的PEG化成为领域研究的热点。目前,已有多种PEG修饰的蛋白质和多肽用于生物医药领域,通过FDA批准进入市场,如PEG修饰的腺苷脱氨酶(PEG-ADA)、天冬酰胺酶(PEG-L-asparaginase)、干扰素α-2b(peginterferonalfa-2b)、干扰素α-2a(peginterferonalfa-2a)、重组人粒细胞集落刺激因子(pegfilgrastim)等。在20种构成蛋白质的常见氨基酸中,只有具有极性的氨基酸残基的侧链基团才能够进行化学修饰。常用的反应氨基酸包括赖氨酸、半胱氨酸、组氨酸、精氨酸、天冬氨酸、谷氨酸、丝氨酸、苏氨酸、酪氨酸,N-端氨基和C-端羧基。这些氨基酸残基上的反应性基团多呈亲核性,其亲核活性通常按下列顺序依次递减:巯基>氨基>羧基(羧酸盐)>羟基。根据化学修饰剂与蛋白质之间反应性质的不同,修饰反应主要分为酰化反应、烷基化反应、氧化还原反应、芳香环取代反应等类型,对蛋白质进行氨基、巯基和羧基等侧链基团进行化学修饰。巯基通 常存在于蛋白质的二硫键和活性位点上,而羧基如果不与蛋白质上的氨基发生分子间或分子内中和反应,也很难活化。因此,蛋白质或多肽分子最容易与修饰剂发生作用的位点是分子表面赖氨酸残基上的氨基。通常,在蛋白质中,氨基含量较高并且通常暴露于溶剂中,可以通过选择不同的修饰剂进行修饰。聚乙二醇修饰中,蛋白质可修饰氨基包含赖氨酸的ε氨基,N末端的α氨基,组氨酸的咪唑基,其中多数蛋白质赖氨酸含量大约是10%左右。并且在降低蛋白药物的免疫原性方面,由于随机修饰能够很好的把蛋白表面的抗原表位进行包裹,具有较好的效果,因此,针对氨基修饰的聚乙二醇修饰剂的研究较早也较为成熟。目前已上市的PEG修饰药物中,绝大部分产品也是随机修饰蛋白表面赖氨酸残基上的氨基的。而这其中,以聚乙二醇-羧酸的活化酯使用最为广泛。这类修饰剂通过和蛋白氨基酸侧链的氨基形成酰胺化和物而偶联到蛋白分子表面。这类修饰剂在和蛋白的反应过程中,由于本身水解会生成大量的酯类化合物。蛋白PEG修饰产物的纯化和分析均较为困难。首先,蛋白经PEG分子修饰后,许多理化性质发生了改变,如等电点、分子质量、溶解度、沉降系数等;其次,由于PEG分子在水溶液中具有伸展的构象,其流体动力学体积远远大于同样分子质量的球状蛋白质,这使得球状蛋白质与PEG的分离非常困难,因此纯化得率较低;第三,由于PEG分子的不均一性,被用来修饰蛋白质的PEG分子,往往存在一定的分子质量分布,如美国UnionCarbide公司提供的mPEG5000的相对分子质量为5000±250,因此,即使包含相同PEG个数的同一种蛋白分子,其相对分子质量也不完全相同。此外,蛋白质表面可修饰的氨基酸位点较多时,PEG分子可以结合在多个不同的氨基酸残基上,从而使PEG修饰蛋白的空间结构进一步复杂化。因此,即使是相同修饰度的蛋白分子之间,也会因修饰位点的不同而呈现多态性(Polydispersity),这种多态性给修饰蛋白的分析和纯化带来了较大困难,这是目前该类产品开发的核心与难点所在。目前常用到的PEG修饰产物的分离纯化工艺主要有以下几类,分别如下:(一)沉淀法蛋白质在一定浓度的盐溶液或有机溶剂中会发生沉淀,而PEG由于其两亲性则继续保持溶解状态,通过简单的离心就能将蛋白质与PEG分离开来。唐微等采用硫酸氨沉淀法可将rIL-2和PEG完全分离开。但这种方法只能用来去除游离PEG,因此具有较大的局限性。需要结合其它的纯化工艺来分离得到目的修饰产物。(二)膜过滤法透析膜或超滤膜上具有一定孔径大小的微孔,若在膜中加入不同分子量的混合物,则小于孔径的分子会透过膜,而大分子则留在原处。与沉淀法相比活性损失小,无需脱盐。但是 其去除PEG的效果和所选择的膜的截留分子量有较大关系,并且如果选择的膜不合适,还会造成目的产物的穿透。因此使用这种方法也需要根据具体的修饰产物及PEG的性质来进行选择。(三)凝胶过滤层析法凝胶过滤层析的分离原理是分离颗粒介质中具有大量孔径均一的网状孔道。分离样品中的小分子物质可以进入颗粒内部,所经历的路程较长,因此流出时间较长,后出峰;大分子物质从颗粒外通过,因此先出峰,据此可以分离不同分子量的物质。PEG修饰蛋白质的分子量大于天然蛋白质,因此出峰较天然蛋白质早,PEG偶联越多,修饰蛋白质出峰越早。McGoff等用GF柱分离PEG修饰SOD,可将未修饰、单点、两点修饰SOD分开。但这种方法的处理量较小,不利于产品的工业化放大。(四)离子交换层析法离子交换层析在分离纯化蛋白质的层析手段中由于处理量大,且分离效果较好而使用最广泛。刘丽军等用CMSepharoseFF分离PEG修饰的rhIFN-2b,洗脱峰依次为未结合的PEG、多点修饰产物、单点修饰产物和未修饰的rhIFN-2b。根据结果分析PEG修饰蛋白质在离子交换层析中主要受PEG屏蔽作用影响,无论是用阴离子还是阳离子交换层析,蛋白上偶联PEG个数越多,结合力越弱,出峰越早;其次受氨基修饰的影响,由于阴离子交换树脂结合的主要是蛋白质的羧基,受氨基修饰影响较小,因而分离效果不如阳离子交换树脂。离子交换层析时缓冲液pH值至少应与蛋白质等电点相差一个单位,修饰样品应用缓冲液或水稀释以降低样品的离子强度。(五)疏水层析和反相色谱法疏水层析和反相层析的原理是分离介质带有疏水侧链,蛋白质在高盐浓度溶液或有机溶剂中变性,暴露出疏水部位,与分离介质结合,降低盐浓度或有机溶剂浓度可将其洗脱下来。PEG具有两亲性但与蛋白质相比疏水性更强,因此PEG修饰蛋白质的疏水性强于天然蛋白,与分离介质的结合力更强,较天然蛋白晚出峰。Katre等采用疏水层析的梯度洗脱法成功将rIL-2与PEG-rIL-2分开。但疏水层析需要使用大量的盐,成本较高。另外疏水层析的处理量较小,不利于工业放大。反相层析由于使用有机溶剂作为流动相,导致蛋白质失活,一般用来分析而不是分离活性蛋白。但是由于大部分PEG与蛋白质和多肽的偶联反应都是随机性亲核反应,其反应后的产物是修饰混合物,因此需要从修饰混合物中将目的修饰产物分离纯化出来,才能够作为药物使用。由于这些修饰混合物除了分子质量和表面电荷存在细小差异外,其他理化性质非常接近,因而给纯化工作带来了困难。此外,当蛋白质或多肽样品中含有PEG时,其会影响蛋白质的 色谱行为,球状蛋白质分子在凝胶过滤色谱中的表观分子质量会减少到原来的一半左右,因而用凝胶过滤色谱纯化PEG修饰产物时分辨率较低,得率也不高。为此,研究建立PEG修饰混合物的分离纯化工艺,具有十分重要的实际意义。技术实现要素:解决的技术问题:本发明主要解决了在PEG修饰产物纯化的过程中,目的产物易穿透,产品收率较低的问题,且目的产物出现降解。经申请人反复验证与分析后,发现导致这一问题产生的关键因素在于:在PEG修饰蛋白样品纯化的步骤中,PEG修饰剂的水解产物(主要是酯类化合物)与离子交换柱的介质相互作用,引起纯化缓冲液体系pH值剧烈波动,先缓慢升高,后迅速下降,然后又快速升高。缓冲体系pH值急剧下降后,样品的带电能力下降,与交换柱介质吸附作用降低,介质的载样量降低,导致目的产物穿透,难以与离子交换柱介质结合而达到分离纯化的作用;缓冲体系pH值快速升高后,PEG修饰蛋白样品的结构发生改变,甚至发生降解,并且较高的pH值可能会降低PEG修饰蛋白样品的生物活性。由此可见,PEG修饰蛋白样品中的残留的PEG修饰剂水解产物对其纯化有巨大的影响,严重降低了PEG修饰蛋白样品的得率及生物活性。因此,本发明首要解决的技术问题就是在对PEG修饰蛋白采用色谱柱纯化之前,尽可能的将PEG修饰剂的水解产物(主要是酯类化合物)去除掉。本发明在对PEG修饰蛋白正式进行纯化之前,采用超滤法去除PEG修饰剂的水解产物及游离PEG的工艺步骤,就很好的解决了这一问题。首先通过超滤的方法可以把修饰混合物中PEG修饰剂水解产生的酯类等小分子去除干净,从而使得后续的色谱纯化(例如:离子交换层析)过程中不会由于PEG修饰剂水解产物造成pH值的波动进而导致目的产物穿透和出现降解的情况发生。本发明旨在提供一种聚乙二醇修饰物的纯化工艺,该工艺简单稳定,成本低,时间短,有利于大规模生产的纯化工艺。本发明中提供的纯化工艺与传统的工艺相比,简化了制备工艺、提高了产物的得率。对于使用随机修饰PEG的蛋白,都适合使用本发明中提供的纯化工艺。技术方案:本发明的第一目的是提供一种聚乙二醇修饰蛋白药物的纯化工艺。该工艺具有步骤简单,目的产物收率高的优点。本发明的纯化工艺,包括采用离子交换层析法的纯化步骤,并且,在说所述纯化步骤之前,还包括去除PEG修饰蛋白修饰反应混合物中的游离PEG及游离PEG水解产物的步骤。优选的,所述PEG水解产物为酯类化合物。优选的,所述去除游离PEG及其水解产物的步骤采用膜过滤法去除。进一步优选的,所述膜过滤法为超滤膜过滤法。优选的,本发明的纯化工艺,包括以下步骤:步骤一,以超滤膜过滤法去除PEG修饰蛋白后的修饰反应混合物中残留的游离PEG及PEG水解产物;步骤二,以离子交换层析法进一步纯化得到PEG修饰蛋白。更优选的,本发明的纯化工艺,具体步骤如下;第一步:以超滤膜过滤法去除游离PEG及其水解产物向PEG修饰蛋白后的反应混合物中加入2-20倍体积的平衡缓冲液进行稀释,用超滤系统进行超滤浓缩。第二步:以离子交换层析法纯化PEG修饰蛋白色谱法条件:阴离子交换柱;平衡缓冲液:10-200mM的Tris-Hcl(pH8.0-9.0);或10-200mM的磷酸缓冲液(pH7.0-8.0);洗脱缓冲液:含0.5-1MNaCl的10-200mM的Tris-HCl(pH8.0-9.0)或含0.5-1MNaCl的10-200mM的磷酸缓冲液(pH7.0-8.0),流速1-5mL/min,检测波长为280nm;上样:将第一步超滤浓缩后的PEG修饰蛋白样品直接上样,流速为1-5mL/min;平衡:平衡缓冲液冲洗1-5个柱体积;收集:洗脱缓冲液梯度洗脱,并收集洗脱峰样品,得到PEG修饰蛋白。优选的,所述PEG修饰蛋白为PEG修饰的门冬酰胺酶或激肽释放酶。优选的,所述PEG修饰蛋白为PEG随机修饰的门冬酰胺酶。有益效果:本发明提供了一种简单稳定,有利于大规模生产的纯化工艺。在本发明中制备工艺与传统的工艺相比,产物得率提高了30%,并有效防止了PEG修饰蛋白的降解及生物活性的丧失。该纯化工艺在保障高纯度及活性的同时,制备方法简单,处理量大,方法重复性高,有利于大规模生产。附图说明图1所示为实施例1中采用一步离子交换层析法纯化PEG修饰门冬酰胺酶的纯化色谱图。由图1可以看出,在上样平衡阶段过程中,pH值变化波动较大,在pH迅速下降阶段,出现了较大的穿透峰。而在后续的洗脱阶段,pH值出现上升。图2所示为实施例1中样品纯化前后HPLC检测结果图由图2可以看出,穿透峰中含有较多的目的产物,纯化得到的修饰产物的峰的右边出现 小尖峰,说明样品出现降解,纯度降低。图3所示为实施例2中采用先超滤后离子交换层析法纯化PEG修饰门冬酰胺酶的纯化色谱图。由图3可以看出,在上样平衡阶段和洗脱阶段中,pH值基本没有变化,并且没有出现穿透峰。图4所示为实施例2中样品纯化前后HPLC检测结果图由图4可以看出,经过两步纯化之后,完全除掉了PEG水解产物、游离PEG等杂质,目的产物的纯度在99%以上,符合要求。图5所示为实施例1,2中纯化后的样品进行HPLC-SEC分析结果图。由图5可以看出,实施例1中纯化得到的修饰产物的峰的右边出现小尖峰,样品发生降解,纯度降低。而实施例2中纯化得到的修饰产物的峰形对称性较好,样品纯度较高。图6所示为实施例1,2中纯化后的样品进行酶活力比较。由图6可以看出,实施例2中纯化得到的修饰产物的比活明显高于实施例1中纯化得到的修饰产物。图7所示为实施例4中采用一步离子交换层析法纯化PEG修饰激肽释放酶的纯化色谱图。由图7可以看出,在整个上样和平衡以及后续的洗脱过程中,pH值也发生了剧烈的波动。pH值先缓慢升高后迅速下降,再迅速上升的不规律变化。而且在上样以及平衡过程中,出现了较大的穿透峰。图8所示为实施例4中样品纯化前后HPLC检测结果图由图8可以看出,穿透峰中含有较多的目的产物。图9所示为实施例5中采用先超滤后离子交换层析法纯化PEG修饰激肽释放酶的纯化色谱图。由图9可以看出,在整个上样和平衡以及后续的洗脱过程中,pH值稳定,没有出现剧烈的波动,而且也没有出现穿透峰。图10所示为实施例5中样品纯化前后HPLC检测结果图由图10可以看出,经过两步纯化之后,完全除掉了PEG水解产物、游离PEG等杂质,目的产物的纯度在99%以上,符合要求。图11所示为实施例4,5中纯化的样品进行HPLC-SEC分析结果图。由图11可以看出,实施例4和实施例5中纯化得到的修饰产物的峰形对称性都较好。具体实施方式定义:本发明使用的缩写含义如下:PEG,聚乙二醇;PEG修饰剂,聚乙二醇修饰剂。聚乙二醇(PEG,HO-(CH2CH2O)n-CH2CH2OH)是一种两端带羟基的线型聚合物,聚乙二醇是经环氧乙烷聚合而成的,由重复的氧乙烯基组成,有分支型,直链型和多臂型。PEG也被称为poly(ethyleneoxide)(PEO),poly(oxy-ethylene)(POE),或者polyoxirane。一般情况下,分子量低于20,000的被称为PEG,分子量更大的被称为PEO。普通的聚乙二醇两端各有一个羟基,若一端以甲基封闭则得到甲氧基聚乙二醇(mPEG),这种衍生物是蛋白质聚乙二醇化技术中最常用到。聚乙二醇修饰剂,则是指带有官能团的聚乙二醇衍生物,是指经过活化的聚乙二醇,目前主要用于蛋白质以及多肽药物修饰,又叫修饰性聚乙二醇,修饰性PEG。M-SPA-5000,M-SPA-10000是分子量分别为5000Da,10000Da的直链聚乙二醇琥珀酰亚胺丙酸酯;M-SC-10K,M-SC-5000,是分子量分别为10KDa和5000Da的直链聚乙二醇琥珀酰亚胺碳酸酯,它们的结构通式为:其中n为0时,mPEG的分子量为10KDa和5000Da时所对应的PEG类型分别是M-SC-10K,M-SC-5000;n为1时,mPEG的分子量为5000Da和10000Da时所对应的PEG类型分别是M-SCM-5000,M-SCM-10000;n为2时,mPEG的分子量为5000Da和10000Da时所对应的PEG类型分别是M-SPA-5000,M-SPA-10000。本申请中所用术语“偶联物”,是指聚乙二醇修饰门冬酰胺酶后得到的修饰产物;聚乙二醇修饰门冬酰胺酶的修饰产物可在本申请中统称为PEG-ASP或PEG修饰ASP的偶联物。聚乙二醇修饰组织激肽释放酶的修饰产物可在本申请中统称为PEG-KLK1或PEG修饰KLK1的偶联物。实施例一、采用一步离子交换层析法纯化PEG修饰门冬酰胺酶的产物1.门冬酰胺酶-PEG偶联物样品制备用20mMpH7.0的磷酸二氢钠-磷酸氢二钠缓冲液(购自国药集团)溶解门冬酰胺酶(购自常州千红生化制药股份有限公司)以配制成为10mg/mL的溶液,用M-SC-5000(购自北京键凯科技有限公司)作为聚乙二醇修饰剂进行修饰,以门冬酰胺酶:聚乙二醇修饰剂为1:20的摩尔比进行反应,在4℃下反应12小时。得修饰反应混合物。2.采用一步离子交换层析法纯化修饰混合物色谱法条件:Q离子交换柱(购自GE公司,HiTrapQHP5mL)。平衡缓冲液:20mM的Tris-Hcl(pH9.0)(试剂购自国药集团)。洗脱缓冲液:含1MNaCl的20mM的Tris-HCl(pH9.0)(试剂购自国药集团)。流速5mL/min,检测波长为280nm。上样:向修饰反应混合物中加入100倍体积超纯水进行稀释,使用0.2M氢氧化钠调pH至9.0。流速为5mL/min平衡:平衡缓冲液液冲洗5个柱体积。收集:洗脱缓冲液梯度洗脱,并收集洗脱峰样品。在进行此纯化过程中,上样还未结束,发现出现了大量穿透峰,经过检测后发现是目的修饰产物,且修饰产物的峰形较差,出现降解峰。分析原因,之所以出现穿透峰是因为pH降低导致,pH降低后,样品的带电能力下降,从而导致PEG-ASP样品不能通过正负电荷的吸附作用结合在介质表面。为了验证是否是由于pH的变化而导致样品的穿透,我们又重复了多次实验。该一步法纯化色谱图如图1所示。由图1可以看出,在整个上样和平衡以及后续的洗脱过程中,pH值呈现先缓慢升高从8.5升至最高9.5后迅速下降,最低降至5.5,再迅速上升的不规律变化。在PH的下降阶段,出现了大量穿透峰,我们收集了穿透峰并进行了HPLC分析,结果如图2所示。图2结果表明穿透峰中的物质主要是目的修饰产物。最终通过计算得出采用一步法纯化的目的产物的总收率仅为53%。这主要是由于穿透峰中含有大量的目的产物所导致的结果。实施例二、采用先超滤后离子交换层析法纯化PEG修饰门冬酰胺酶的产物1.第一步超滤法去除修饰反应混合物中的除游离PEG及其水解产物向修饰反应混合物中(使用的是实施例一中的修饰反应混合物)加入10倍的20mMTris-HCl(pH8.5)进行稀释,PALL超滤系统(膜的截留分子量大小为5000Da)重复进行超滤2-5次。2.第二步离子交换层析法纯化修饰门冬酰胺酶-PEG偶联物色谱法条件:Q离子交换柱(购自GE公司,HiTrapQHP5mL),平衡缓冲液:20mM的Tris-Hcl(pH8.5),(试剂购自国药集团)。洗脱缓冲液:含1MNaCl的20mM的Tris-HCl (pH8.5),(试剂购自国药集团)。流速5mL/min,检测波长为280nm。上样:超滤浓缩的蛋白样品直接上样,流速为5mL/min。平衡:平衡缓冲液液冲洗1-5个柱体积。收集:洗脱缓冲液梯度洗脱,并收集洗脱峰样品。纯化色谱图如图2所示。由图3可以看出,在整个上样和平衡以及后续的洗脱过程中,pH值稳定,没有出现剧烈的波动。样品纯化前后HPLC分析结果如图4所示,纯化后样品的纯度在99%以上。最终通过计算得到目的产物的收率为80%。同时我选择了不同的离子交换介质以及不同的工艺参数和不同截留分子量的超滤膜进行实验,得到了和上述实施例2中相同的结果,具体见表1所示。表1不同纯化工艺参数比较实施例三、两种纯化工艺得到的PEG修饰门冬酰胺酶的目的产物的比较我们对实施例1,2中收集的洗脱峰进行HPLC-SEC分析,色谱柱为TSKG4000PWXL(300×10mmi.d.)分析柱,由含0.1M硫酸钠的0.02M磷酸缓冲液(pH6.0)充分平衡。上样后,以0.6mL/min的流速洗脱,检测波长为280nm,一个样品检测时间为25min。结果见图5所示。由图5可以看出,实施例1中纯化得到的修饰产物的峰的右边出现小尖峰,说明修饰产物发生了降解。而实施例2中纯化得到的修饰产物的峰形对称性较好。同时我们对实施例1,2中收集的洗脱峰酶活力进行比较,结果见图6所示。由图6可以看出,实施例1中纯化得到的修饰产物比活明显低于实施例2中纯化得到的修饰产物。申请人分析,由于实施例1中,在纯化过程中,pH值有较大波动,在洗脱阶段出现了pH值的显著上升,而门冬酰胺酶在碱性条件下不稳定,容易发生降解,因此造成洗脱得到的目的产物发生了一定的降解, 从而使得目的产物的右边出现小尖峰。而在实施例2中的纯化工艺中,由于首先采用超滤的方法去除了PEG修饰剂的水解产物以及游离PEG,因此在后续的离子交换纯化过程中,pH值没有波动,因此在纯化过程中不会对目的产物造成由于pH值的波动而引起的降解和穿透现象。因此综合比较实施例1和2的纯化工艺可以得出,实施例2的纯化工艺具有产物收率高,并且不会引起目的产物的降解等优点。实施例四、采用一步离子交换层析法纯化PEG修饰激肽释放酶的产物为了验证本发明中的纯化工艺是否也适合于其它使用PEG修饰剂对蛋白进行随机修饰的PEG修饰产物的纯化,我们对激肽释放酶(KLK1)进行了PEG修饰,并对修饰产物采用一步离子交换法进行纯化。1、激肽释放酶-PEG偶联物样品制备用100mMpH7.0的磷酸二氢钠-磷酸氢二钠缓冲液(购自国药集团)溶解激肽释放酶(购自常州千红生化制药股份有限公司)以配制成为30mg/mL的溶液,用M-SC-5000(购自北京键凯科技有限公司)作为聚乙二醇修饰剂进行修饰激肽释放酶:聚乙二醇修饰剂为1:80的摩尔质量比进行反应,在30℃下反应12小时2.一步色谱法纯化修饰激肽释放酶-PEG偶联物色谱法条件:DEAE离子交换柱(购自GE公司,HiTrapDEAEFF5mL)。平衡缓冲液:20mM的磷酸缓冲液(pH8.0),(试剂购自国药集团)。洗脱缓冲液:含1MNaCl的20mM的磷酸缓冲液(pH8.0),(试剂购自国药集团)。流速3mL/min,检测波长为280nm。上样:向反应产物中加入10倍体积超纯水进行稀释,使用0.5M氢氧化钠调pH至8.0。流速为5mL/min平衡:平衡缓冲液液冲洗5个柱体积。收集:洗脱缓冲液梯度洗脱,并收集洗脱峰样品。纯化色谱图如图7所示。由图7可以看出,在整个上样和平衡以及后续的洗脱过程中,pH值也发生了剧烈的波动。pH值呈现先缓慢升高后迅速下降,再迅速上升的不规律变化。在pH的下降阶段,由于蛋白电荷数减少,与阴离子交换介质结合力减弱,因此在冲洗的过程中出现了大量穿透峰,我们收集了穿透峰并进行了分析,HPLC检测结果如图8所示,结果表明穿透峰中的物质主要是最终的目的产物。最终通过计算得到目的产物的收率为50%。实施例五采用先超滤后离子交换层析法纯化PEG修饰激肽释放酶的产物1.超滤法去除修饰反应混合物中的除游离PEG及其水解产物向修饰反应混合物中(使用的是实施例四中的修饰反应混合物)加入10倍的20mMTris-HCl(pH8.0)进行稀释,PALL超滤系统重复进行超滤2-5次。2.色谱法纯化修饰激肽释放酶-PEG偶联物色谱法条件:DEAE离子交换柱(购自GE公司,HiTrapDEAEFF5mL)。平衡缓冲液:20mM的磷酸缓冲液(pH8.0)(试剂购自国药集团)。洗脱缓冲液:含1MNaCl的磷酸缓冲液(pH8.0)(试剂购自国药集团)。流速5mL/min,检测波长为280nm。上样:超滤浓缩的蛋白样品直接上样,流速为5mL/min。平衡:平衡缓冲液冲洗1-2个柱体积。收集:洗脱缓冲液梯度洗脱,并收集洗脱峰样品。纯化色谱图如图9所示。由图9可以看出,由于超滤除去大部分PEG水解产物以及PEG,在整个上样和平衡以及后续的洗脱过程中,pH值稳定,没有出现剧烈的波动,因此不会对目的产物造成由于pH值的波动而引起的降解和穿透现象。样品纯化前后HPLC分析结果如图10所示,纯化后样品的纯度在99%以上,最终通过计算得到目的产物的收率为83%。实施例六、两种纯化工艺得到的PEG修饰激肽释放酶的目的产物的比较我们对实施例四,五中收集的洗脱峰进行HPLC-SEC分析,色谱柱为TSKG4000PWXL(300×10mmi.d.)分析柱,由含0.1M硫酸钠的0.02M磷酸缓冲液(pH6.0)充分平衡。上样后,以0.6mL/min的流速洗脱,检测波长为280nm,一个样品检测时间为25min。结果见图11所示。由图11可以看出,虽然实施例四和实施例五中纯化得到的修饰产物的峰形对称性都较好,且修饰产物的纯度相近,但是采用一步离子交换法的目的产物得率仅为50%;采用先超滤后离子交换的两步纯化法,可以有效防止因样品中PEG及其水解产物对离子交换介质的相互作用而导致的介质载样量降低的情况出现,避免了修饰产物难以与纯化介质结合,从而很大程度上提高了纯化效率,使得最终产物的得率提高至83%。实施例七、两种纯化工艺对不同PEG修饰门冬酰胺酶样品的纯化的比较为了验证本发明中的纯化工艺是否也适合于其它不同PEG的活化酯类修饰剂修饰蛋白的纯化,我们分别采用M-SC-10K、M-SPA-5K、M-SPA-10K、M-SCM-5K(均购自北京键凯科技有限公司)的PEG修饰剂对门冬酰胺酶进行了修饰,并分别采用实施例一及实施例二中的制备及纯化方法纯化PEG-ASP。通过分析比较可知,在一步离子交换层析纯化工艺中,在上样、平衡以及后续的洗脱过程中,pH值呈现先缓慢升高后迅速下降,再迅速上升的不规律变化。在pH的下降阶段,出 现了目的产物的穿透峰,并且pH的改变使目的产物发生降解,导致目的产物的纯化得率明显降低。而在先超滤后离子交换层析法纯化工艺中,由于首先采用超滤的方法去除了PEG修饰剂的水解产物以及游离PEG,因此在后续的离子交换纯化过程中,pH值没有波动,因此不会产生由于pH值的波动而引起的目的产物降解和穿透现象。同时通过计算,两种纯化工艺对不同PEG修饰门冬酰胺酶的目的产物的得率如表2所示。从表2中可以看出,一步离子交换层析纯化工艺由于出现了穿透现象,目的产物的得率只有50%左右;而先超滤后离子交换层析法纯化工艺的得率在80%以上。这说明本发明提供的制备及纯化工艺与传统的工艺相比,产物得率能提高28%以上。表2两种纯化工艺对不同PEG修饰门冬酰胺酶的得率的比较目的产物名称一步离子交换层析纯化工艺先超滤后离子交换层析法纯化工艺M-SC-10K-ASP51%85%M-SPA-5K-ASP53%81%M-SPA-10K-ASP55%83%M-SCM-5K-ASP50%84%当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1