制备免疫缺陷的大鼠的方法及其应用与流程
本发明属于生物学领域,更具体地,本发明涉及制备免疫缺陷的大鼠的方法及其应用。
背景技术:
肝脏疾病是威胁人类健康的重要疾病之一,尤其是肝炎病毒引发的肝炎、肝硬化和肝癌以及疟原虫导致的疟疾影响人类健康并造成严重经济负担。肝脏疾病的发病机制及治疗极其复杂,而且人肝细胞体外培养后迅速失去肝特性。因此除了细胞水平,更需要借助动物模型从机体水平进行相关研究。但嗜肝性病原体具有高度的宿主特异性,只能感染人和少数高等灵长类动物(如黑猩猩等)的肝细胞,导致无法在小鼠等传统动物模型中进行相关肝脏疾病研究。通过人肝细胞移植后重构免疫缺陷动物肝脏,可以建立肝脏人源化动物。一种肝脏人源化动物构建方法为:首先从肝脏供体中分离原代肝细胞,然后移植到带有肝损伤的免疫缺陷动物模型(如upa-scid小鼠)中。经过6-8周再殖,人肝细胞重构了小鼠肝脏。根据血清中人血清白蛋白的分泌量,确定整合比例高的人源化小鼠,用于后续药物代谢、安全性和肝炎病毒感染。
肝脏人源化小鼠的肝脏代谢酶和转运体表达和功能已被证实与人类肝脏几乎一致。此前hbv药物非阿尿苷因严重肝毒性导致5人死亡而在临床ii期失败。但在狗、猴、大鼠、小鼠实验中并未发现其有肝脏毒性。当用非阿尿苷处理肝脏人源化小鼠,在低剂量情况下就能导致肝损伤,并能产生病人所有临床症状和病理包括肝功能严重受损、脂肪肝和肝细胞线粒体破坏。因此肝脏人源化动物在临床前进行药物代谢、药物相互作用和安全性评价中具有应用前景。
1990年brinster实验室构建了alb-upa小鼠。这种小鼠出生后会出现严重甚至致死的肠及腹腔出血。joergpetersen实验室将alb-upa小鼠与rag2-/-免疫缺陷小鼠交配获得了upa/rag2-/-小鼠。通过人肝细胞脾脏移植,首次获得再殖比例达(15%)的肝脏人源化小鼠。通过抑制补体反应及选取增殖能力强的人肝细胞,katsutoshiyoshizato实验室在upa/scid小鼠中实现了极高比例(>90%)的人肝细胞再殖。在该高再殖比例肝脏人源化小鼠中,人代谢酶的表达及诱导都和人肝脏非常接近。但是,目前alb-upa小鼠模型存在以下问题:第一,新生小鼠的死亡率很高,子代近半数于产后4天内死于腹腔或内脏出血,移植的窗口期很短(需在出生后2周内移植);第二,存活的小鼠中仅部分是upa基因携带者,而且部分小鼠还存在转基因失活的问题;第三,移植的人肝细胞分泌的补体,对小鼠肾脏功能产生损伤,进一步增加了死亡率。
延胡索酰乙酰乙酸水解酶(fuarylacetoacetatehydrolase,fah)基因剔除小鼠(简称fah-/-小鼠)于1993年建立。fah-/-小鼠因不能进行完全的酪氨酸代谢而在肝脏中积累丁二酰,从而造成肝实质细胞的死亡。在饮用水中添加ntbc饲养的fah-/-小鼠与野生型小鼠表型无明显区别、肝功能正常并可正常发育和繁殖,但在停止喂食ntbc后将在4~6周内因肝功能衰竭而死亡。fah-/-小鼠存在广泛而持续的肝损伤,其肝脏微环境特别适合于移植细胞的增殖,野生性肝细胞(fah基因表达正常)经脾脏移植后几乎可以完全重建fah-/-小鼠的肝脏(90%以上),受体小鼠恢复正常的肝功能。将fah-/-小鼠和rag2-/-il2rg-/-免疫缺陷小鼠杂交后,获得三基因敲除的fah-/-rag2-/-il2rg-/-小鼠(frg小鼠)。frg小鼠缺少成熟的t、b细胞及nk细胞,当移植人肝细胞后,可以获得很高程度(>90%)的人肝细胞再殖。
hiroshisuemizu实验室应用新的可诱导肝损伤小鼠模型—thymidinekinase-nod/scid/il2rg-/-(tk-nog小鼠),可构建高比例(>90%)肝脏人源化小鼠。在nod/scid/il2rg-/-小鼠(nog小鼠)基础上用alb启动子在肝脏中特异表达i型单纯疱疹病毒的胸苷激酶(herpessimplexvirustype1thymidinekinase)。通过给小鼠注射gcv,该化合物对正常细胞无害,但在表达tk基因的小鼠肝细胞中被代谢成有毒产物而造成肝细胞死亡,为移植的人肝细胞提供再殖空间。这种小鼠得益于其免疫缺陷的程度,人肝细胞的平均再殖比例比alb-upa/scid小鼠和frg小鼠高。但这种免疫缺陷小鼠仅能通过人工受精进行繁殖、饲养环境清洁要求极高,难以推广使用。
sulishan实验室建立了肝脏及免疫系统双人源化小鼠模型,在balb/c背景的rag2-/-il2rg-/-小鼠基础上,利用alb启动子在肝脏中特异表达fk506结合蛋白(fkbp)和半胱天冬酶8(caspase8)的融合蛋白。通过注射ap20187诱导fkbp形成二聚体进而激活caspase8,导致小鼠自身肝细胞发生凋亡,与此同时促进人肝细胞的再殖。从流产胎儿胚肝中分离人肝祖细胞和cd34+造血干细胞,将这两组细胞分别注射到出生1-5天经辐射的新生小鼠肝脏,建立了肝脏及免疫系统人源化的小鼠(afc8-huhsc/hep)。该小鼠不仅支持hcv病毒感染,并能产生人t细胞介导的免疫应答。并且,首次发现hcv感染可以在小鼠中诱导肝炎和肝纤维化,同时伴随着星状细胞的活化和人纤维发生相关基因的表达。但考虑到免疫排斥,该模型必须使用流产胎儿的胚肝作为实验材料来获得同一个体来源的肝细胞和造血干细胞,存在伦理问题。另外,相对低的人肝细胞再殖比例(10-30%)和肝祖细胞的相对不成熟性,是该模型的缺陷。
大鼠作为中等大小实验动物比小鼠大了10倍以上,易于手术操作,也可以提供更多的生物材料用于实验分析;大鼠在生理和病理方面与人类更接近,被更广泛地应用于检测药物治疗效果和毒性测试。因此,大鼠成为肝脏人源化动物研究领域的研究热点。如能获得肝脏人源化大鼠,其相对小鼠将更具有应用前景,特别是在药物研发领域。另一方面,虽然肝脏人源化小鼠可作为生物反应器生产人肝细胞,但每只小鼠只能生产出8~15×107肝细胞,数量低。而理论上一只肝脏人源化大鼠可以获得109数量级的人肝细胞,以有效缓解人肝细胞来源匮乏的问题。因此肝脏人源化大鼠相对于小鼠更适合作为人肝细胞的生物反应器。同时目前肝脏人源化小鼠构建的最大成本之一也在于人肝细胞,导致其售价达到每只小鼠3500美元。而由肝脏人源化大鼠提供大量人肝细胞,将极大地降低肝脏人源化动物的构建成本,促进其更广泛的应用。
近年来,rag1/2-/-、il2rg-/-和prkdc-/-il2rg-/-等多种免疫缺陷大鼠被相继报道。但这些免疫缺陷大鼠主要是利用zinc-finger核酸酶、talen等技术构建完成,成本高且手续繁杂,而且它们存在繁殖困难的问题特别是prkdc-/-il2rg-/-大鼠存在早衰现象,导致不利于推广和产业利用。目前利用rag1-/-免疫缺陷大鼠,人原代肝细胞可以在大鼠肝脏中达到10%再殖比例。这说明类似小鼠,肝脏人源化大鼠的构建也是可能的。但该模型主要受限于以下两方面:1)rag1-/-大鼠仍残留t细胞,而且nk细胞相对野生型甚至更多。使用免疫抑制手段能降低免疫排斥,但不能彻底去除,而且费用极高;2)采用注射retrorsine结合肝切的移植模型,手术步骤复杂,而且肝细胞再殖速率相对较慢。特别是雌性动物,即使延长移植后时间至1年,也只能达到40-60%的再殖比例,人肝细胞再殖比例高的肝脏人源化大鼠尚未成功获得。因此肝脏人源化大鼠构建的瓶颈首先是缺少可诱导肝损伤的免疫缺陷大鼠模型,紧接着是缺少人肝细胞移植大鼠的技术体系。
技术实现要素:
本发明的目的在于提供一种fah-/-rag2-/-il2rg-/-大鼠的制备方法和利用fah-/-rag2-/-il2rg-/-大鼠实现人肝细胞体内扩增并构建肝脏人源化大鼠。
在本发明的第一方面,提供一种制备免疫缺陷的大鼠的方法,包括:破坏大鼠重组激活基因2(rag2)和白介素2受体γ(il2rg)基因;从而获得免疫缺陷的大鼠。
在本发明的另一方面,提供一种制备大鼠细胞的方法,包括:破坏大鼠重组激活基因2(rag2)和白介素2受体γ(il2rg)基因;较佳地,所述的细胞为受精卵。
在一个优选例中,所述的方法还包括:破坏大鼠延胡索酰乙酰乙酸水解酶(fah)基因。
在另一优选例中,破坏延胡索酰乙酰乙酸水解酶基因的第2外显子。
在另一优选例中,破坏重组激活基因2的第3外显子。
在另一优选例中,破坏白介素2受体γ基因的第2外显子。
在另一优选例中,利用crispr/cas9基因编辑法进行所述的破坏。
在另一优选例中,利用靶向于延胡索酰乙酰乙酸水解酶基因的第2外显子的sgrna以及cas9mrna来破坏延胡索酰乙酰乙酸水解酶基因的第2外显子;较佳地,所述的sgrna是seqidno:1和seqidno:2所示核苷酸序列的sgrna。
在另一优选例中,利用靶向于重组激活基因2的第3外显子的sgrna以及cas9mrna来破坏重组激活基因2的第3外显子;较佳地,所述的sgrna是seqidno:3和seqidno:4所示核苷酸序列的sgrna。
在另一优选例中,利用靶向于白介素2受体γ基因的第2外显子的sgrna以及cas9mrna来破坏白介素2受体γ基因的第2外显子;较佳地,所述的sgrna是seqidno:5和seqidno:6所示核苷酸序列的sgrna。
在另一优选例中,将所述的sgrna以及cas9mrna或能够形成该sgrna以及cas9mrna的构建物引入到大鼠的受精卵内;使受精卵发育,获得免疫缺陷的大鼠。
在另一优选例中,所述的制备免疫缺陷的大鼠的方法或制备大鼠细胞的方法为“非治疗目的”的方法。
在本发明的另一方面,提供用于制备免疫缺陷的大鼠的sgrna,其靶向于重组激活基因2的第3外显子,其是seqidno:3和seqidno:4所示核苷酸序列的sgrna;和其靶向于白介素2受体γ基因的第2外显子,其是seqidno:5和seqidno:6所示核苷酸序列的sgrna。
在一个优选例中,还包括:靶向于延胡索酰乙酰乙酸水解酶基因的第2外显子的sgrna,其是seqidno:1和seqidno:2所示核苷酸序列的sgrna。
在本发明的另一方面,提供用于制备免疫缺陷的大鼠的试剂盒,其中含有:seqidno:3和seqidno:4所示核苷酸序列的sgrna;和/或
seqidno:5和seqidno:6所示核苷酸序列的sgrna。
在一个优选例中,还含有:seqidno:1和seqidno:2所示核苷酸序列的sgrna。
在另一优选例中,所述的试剂盒中还含有cas9mrna或能形成cas9mrna的构建物。
在本发明的另一方面,提供一种制备大鼠移植模型的方法,包括:
(1)利用前面任一所述的方法制备免疫缺陷的大鼠;
(2)在(1)的免疫缺陷大鼠中,移植异源的细胞,获得大鼠移植模型。
在一个优选例中,所述的异源的细胞包括(但不限于):肝细胞,肿瘤细胞,干细胞(如胚胎干细胞,造血干细胞),ips细胞,血细胞(如红细胞、白细胞)。
在另一优选例中,所述的异源的细胞是人源的,或是哺乳动物(如灵长类动物如猴、猿,啮齿类动物如鼠等)来源的。
在另一优选例中,所述的免疫缺陷的大鼠是重组激活基因2和白介素2受体γ基因缺失的大鼠,将异源的肝细胞,肿瘤细胞,干细胞(如胚胎干细胞,造血干细胞),ips细胞,血细胞(如红细胞、白细胞)移植于该大鼠,从而获得异种移植模型。
在另一优选例中,所述的免疫缺陷的大鼠是延胡索酰乙酰乙酸水解酶基因、重组激活基因2和白介素2受体γ基因缺失的大鼠,将异源的肝细胞,肿瘤细胞,干细胞(如胚胎干细胞,造血干细胞),ips细胞,血细胞(如红细胞、白细胞)移植于该大鼠,从而获得异种移植模型。
在本发明的另一方面,提供前面所述的方法获得的大鼠移植模型的用途,用于:药物代谢及毒理检测;肝脏疾病和肿瘤的研究及药物筛选;或作为生物反应器生产人肝细胞。所述的肝脏疾病例如包括(但不限于):肝炎病毒感染疾病、疟疾。
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
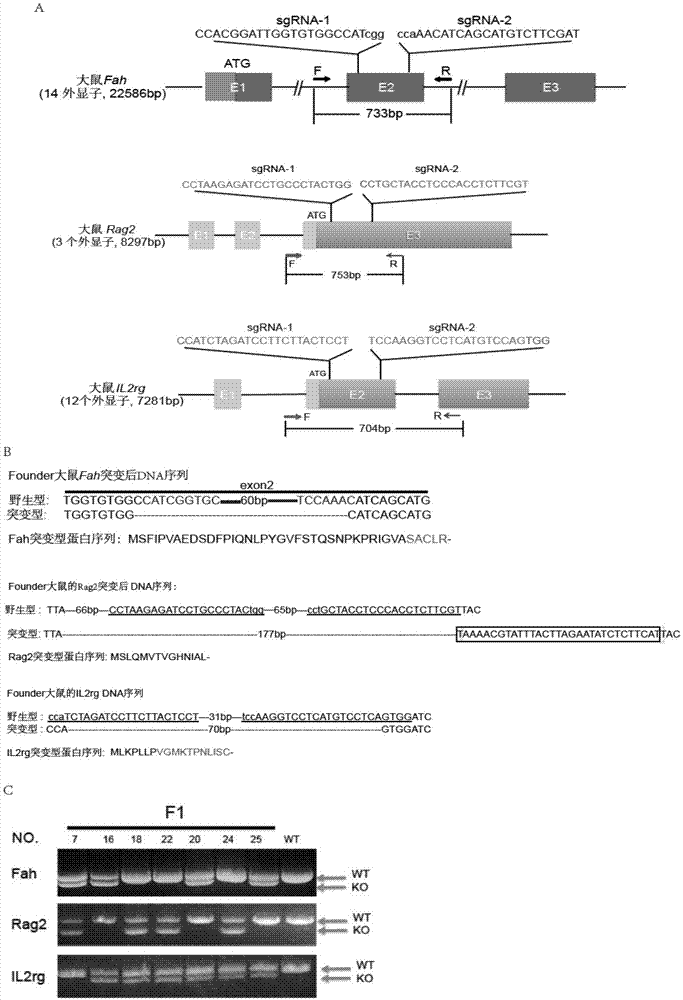
图1、利用crispr系统构建frg大鼠。
a、fah、rag2、il2rg基因示意图。放大部分序列为sgrna靶点。f和r代表用于基因型鉴定的引物。
b、存在突变的founder大鼠fah、rag2、il2rg基因dna测序结果和蛋白序列预测结果。虚线表示缺失的碱基,方框内为增加的碱基。
c、founder大鼠和wt大鼠回交获得的f1大鼠基因鉴定结果。
图2、fah-/-大鼠可作为肝细胞移植模型。
a、4周时fah-/-和wt大鼠的照片。fah+/-大鼠交配获得纯合子。在母鼠怀孕时和小鼠出生后,饮水中都添加ntbc。
b、4周大wt和喂食ntbc的fah-/-大鼠肝脏fah免疫组化染色。
c、6-8周大fah-/-大鼠接受来自于同窝野生型大鼠的肝细胞移植(fah-/-w/htx),移植后立即撤去ntbc水。移植和不移植肝细胞fah-/-大鼠的kaplan-meier存活曲线。
d、移植和不移植肝细胞fah-/-大鼠的体重变化曲线。体重每周称一次,所有值是以第0天的体重为1计算的相对数值。
e、107来自同窝大鼠的野生型肝细胞移植到fah-/-大鼠。肝脏再殖情况在移植后4和8周通过fah免疫组化染色鉴定,并对再殖比例进行定量。
图3、rag2-/-il2rg-/-大鼠胸腺和脾脏发育缺陷。
a、rag2-/-和rag2-/-il2rg-/-大鼠照片和基因型鉴定结果。
b、5周大rag2-/-、il2rg-/-和rag2-/-il2rg-/-大鼠的胸腺。
c、5周大rag2-/-、il2rg-/-和rag2-/-il2rg-/-大鼠的胸腺和脾脏h&e染色结果。
图4、rag2-/-、il2rg-/-和rag2-/-il2rg-/-大鼠免疫球蛋白分泌。
8周大rag2-/-、il2rg-/-和rag2-/-il2rg-/-大鼠血清中免疫球蛋白通过elisa进行定量分析。
图5、rag2-/-il2rg-/-大鼠胸腺和脾脏免疫细胞发育情况
a,b,c、rag2-/-、il2rg-/-和rag2-/-il2rg-/-大鼠的胸腺中cd4+(a)或cd8+(b)单阳性t细胞和cd4+cd8+双阳性t细胞(c)发育情况。
d,e、rag2-/-、il2rg-/-和rag2-/-il2rg-/-大鼠的脾脏中cd3-cd45ra+b细胞、cd3+cd45ra-t细胞(d)和cd161a+nk细胞(e)发育情况。
图6、rag2-/-il2rg-/-大鼠可作为异种移植模型。
a,b,c、5×106snu-398移植到rag2-/-il2rg-/-大鼠的腹股沟形成皮下瘤的形态(a)、大小(b)和h&e染色(c)。
d、5×106人ips细胞移植到rag2-/-il2rg-/-大鼠睾丸包囊形成畸胎瘤的h&e染色。
图7、fah-/-rag2-/-il2rg-/-大鼠可作为高效肝细胞再殖模型。
a、3×106小鼠肝细胞移植frg大鼠。4周及7周时处理大鼠,用fah染色确定肝脏再殖比例。
b、对移植人肝细胞后具有人白蛋白分泌的frg大鼠(frgw/htx)肝脏进行fah免疫组化染色。
c、肝脏连续切片后进行特异识别人白蛋白(alb)和ki67免疫组化染色。
d、肝脏连续切片后进行fah和cyp3a4免疫组化染色。
图8、高比例肝脏人源化frg大鼠具有人类肝脏特异代谢基因表达和结构。
a、移植人肝细胞5个月后,大鼠肝脏进行人特异alb和aat免疫荧光染色。根据染色阳性免疫统计人肝细胞整合比例。
b、肝脏人源化大鼠肝脏切片进行人特异alb、aat、fah、cyp3a4和gs免疫荧光染色。
c、定量pcr检测肝脏人源化小鼠肝脏组织、原代人肝细胞、肝脏人源化大鼠肝脏组织中人肝脏重要代谢酶表达情况。
具体实施方式
本发明人经过深入的研究试验,首次基于crispr/cas9基因编辑技术,通过合理的设计,构建获得fah-/-rag2-/-il2rg-/-免疫缺陷大鼠。并且,本发明人还应用所述的免疫缺陷大鼠进一步建立肝细胞、肿瘤细胞等细胞移植模型。本发明的免疫缺陷大鼠具有良好的应用前景。
如本文所用,所述的“sgrna”即“单独导向rna(single-guiderna,sgrna)”或“单导向rna”,其是基于“目标基因上的靶位点”设计,其包含的序列足以与内切核酸酶cas9协同作用,引导发生cas9介导的靶位点上dna双链断裂。
如本文所用,所述哺乳动物指哺乳纲的动物,包含人、非人灵长类动物(猴、猩猩)、家畜与农畜(例如,猪、绵羊、牛),鼠(小鼠),以及啮齿动物(例如,小鼠、大鼠、兔)等等。
如本文所用,所述的“外源”或“异源”是指来自不同来源的两条或多条核酸或蛋白质序列之间的关系,或来自不同来源的细胞与宿主之间的关系。例如,如果核酸与宿主细胞的组合通常不是天然存在的,则核酸对于该宿主细胞来说是异源的。特定序列对于其所插入的细胞或生物体来说是“异源的”。
如本文所用,术语“引入”或“转化”是指将外源多核苷酸转移进宿主(本发明中为动物或动物细胞)。
如本文所用,所述的“构建物”包括“质粒”。
本发明提供了一种制备免疫缺陷的大鼠的方法,包括:破坏大鼠延胡索酰乙酰乙酸水解酶(fah)基因,重组激活基因2(rag2)和白介素2受体γ(il2rg)基因;从而获得免疫缺陷的大鼠。较佳地,利用crispr/cas9基因编辑法进行所述的破坏。
fah是一个具有419个氨基酸的酶,其基因长度为22586bp,具有14个外显子和13个内含子;其genbank登录号为nm_017181.2。sgrna设计的最优位置应该紧跟着转录起始位点atg后,这样突变后造成翻译提前终止,形成较短的无功能截断蛋白。虽然fah的转录转录起始位点atg在第1个外显子,但本发明人发现其不适于sgrna设计。经过反复研究、分析和试验,本发明人确定以其紧挨着atg的第2外显子的适当位置作为靶向位点,设计2个sgrna。因此,作为本发明的优选方式,所述的sgrna的核苷酸序列如seqidno:1和seqidno:2所示。
rag2是一个具有527个氨基酸的蛋白,其基因长度为8297bp,具有3个外显子和2个内含子;其genbank登录号为nm_001100528.1。本发明人经过反复研究、分析和试验,确定以rag2转录起始位点atg所在的第3外显子的适当位置作为靶向位点,设计2个sgrna。作为本发明的优选方式,所述的sgrna的核苷酸序列如seqidno:3和seqidno:4所示。
il2rg是一个具有368个氨基酸的蛋白,其基因长度为7281bp,具有12个外显子和11个内含子;其genbank登录号为nm_080889.1。本发明人经过反复研究、分析和试验,确定以il2rg转录起始位点atg所在的第2外显子的适当位置作为靶向位点,设计2个sgrna。因此,作为本发明的优选方式,所述的sgrna的核苷酸序列如seqidno:5和seqidno:6所示。
fah基因敲除可以导致大鼠发生可诱导肝脏损伤,rag2基因敲除可以导致大鼠的t、b细胞缺失,il2rg基因敲除可以导致大鼠的nk细胞缺失以及t、b细胞减少。rag2和il2rg各自敲除和共同敲除都可以获得免疫缺陷的大鼠,而rag2和il2rg同时敲除,免疫缺陷最严重,适合人肝细胞移植。
在本发明的指示下,可以采用多种本领域已知的破坏基因的方法来破坏所述的基因。优选地,基于crispr/cas9基因编辑法可以较为方便地制备所述的免疫缺陷大鼠,步骤比制备转基因大鼠更为简单,可操作性好。
合成所述的sgrna可以用本领域常规的技术,之后,可以将之与cas9mrna引入到受动物生殖细胞如受精卵中,cas9mrna在体内翻译出活性的cas9酶,所述的sgrna靶向于基因组中特定的位置,指导将cas9酶的特异性切割,使得基因的特定位置发生缺失、变异。所述的受精卵在发育后,获得免疫缺陷的大鼠。
利用本发明的方法、应用本发明设计选择的sgrna所获得的免疫缺陷的大鼠可以是rag2基因和il2rg缺失的大鼠;还可以是fah、rag2和il2rg基因共同缺失的大鼠。
本发明的方法所获得的免疫缺陷的大鼠,可以应用于制备大鼠移植模型,或应用于扩增异源的细胞(如肝细胞,特别是人肝细胞),或应用于药物研究。
作为一种应用方式,在本发明的免疫缺陷大鼠体内移植异源的细胞,从而制备大鼠移植模型。所述的异源的细胞包括但不限于:非该大鼠来源的肝细胞,肿瘤细胞,干细胞(如胚胎干细胞,造血干细胞),ips细胞,血细胞(红细胞和白细胞)。所述的异源的细胞可以是人源的,或是哺乳动物(如灵长类动物如猴、猿,啮齿类动物如鼠等)来源的。
作为本发明的一种实施方式,获得了fah-/-大鼠,其可作为肝细胞移植并高效重构肝脏的动物模型,将野生型大鼠肝细胞移植该动物模型,可获得很高的肝细胞再殖比例,高于90%。
作为本发明的一种实施方式,所述的免疫缺陷的大鼠是rag2基因和il2rg基因缺失的大鼠(rag2-/-il2rg-/-),将异源的肝细胞,肿瘤细胞,干细胞(如胚胎干细胞,造血干细胞),ips细胞,血细胞(红细胞和白细胞)等移植于该大鼠,可获得异种移植模型。
作为本发明的另一种实施方式,所述的免疫缺陷的大鼠是fah基因、rag2和il2rg基因缺失的大鼠(fah-/-rag2-/-il2rg-/-),将异源的肝细胞,肿瘤细胞,干细胞(如胚胎干细胞,造血干细胞),ips细胞,血细胞(红细胞和白细胞)移植于该大鼠,从而获得异种移植模型。其中人肝细胞在fah-/-rag2-/-il2rg-/-大鼠肝脏中的再殖比例高达65%。
移植了人肝细胞的大鼠,作为生物反应器生产人肝细胞。人肝细胞在大鼠体内生长,从而获得肝脏人源化的动物,应用于科学研究以及临床。
移植了肿瘤细胞的大鼠,肿瘤细胞在大鼠体内生长、形成瘤体,该大鼠可以作为移植瘤模型,应用于科学研究以及药物筛选,药物代谢及毒理检测等。
移植了造血干细胞及血细胞,可以获得血液系统人源化的大鼠,应用于科学研究以及药物筛选等。
与其它动物模型相比,本发明的免疫缺陷大鼠具有可诱导肝损伤特征、肝细胞再殖比例高和免疫缺陷程度高且相对容易饲养的优势。
人肝细胞在离体条件下大量扩增很困难,而在本发明的免疫缺陷大鼠体内则可以大量扩增,而且扩增得到的人肝细胞,不仅代谢酶活性与新鲜分离的人肝细胞一致,还可以移植产生更多的肝脏人源化大鼠。相对于人肝脏分离的肝细胞,这些分离自肝脏人源化大鼠的人肝细胞更易冻存,而且复苏后贴壁效果更好。因此可以利用肝脏人源化大鼠作为生物反应器进行规模化生产人肝细胞,用于高通量药物筛选、毒理分析以及生物人工肝。
本发明还提供了用于制备免疫缺陷大鼠的试剂盒,所述的试剂盒中包含应用于进行crispr/cas9方法操作的sgrna及cas9mrna或能够在体内或体外形成该sgrna及cas9mrna的试剂。
其它常用于进行转基因操作的试剂也可被包含在所述的试剂盒中,以方便本领域技术人员使用,例如显微注射用的试剂等。此外,所述试剂盒中还可包含有指导本领域技术人员操作的使用说明书。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
材料和方法
细胞
大鼠原代肝细胞新鲜分离自野生型sd大鼠,小鼠原代肝细胞分离自野生型c57小鼠,分离后4℃或冰上保存,6小时内移植。冷冻人肝细胞购自上海瑞德肝脏公司。
抗体
rabbitanti-fah(abbomax,1:3000),rabbitanti-ki67(novocastra,1:1000,需抗原修复),goatanti-humanalb(bethyl,1:200),rabbitanti-cyp3a4(santacruz,1:200,需抗原修复),rabbitanti-aat(neomarkers,1:200),mouseanti-gs(bd,1:100)。。
试剂
大鼠免疫球蛋白定量采用ratigg、iga、igmready-set-go!elisakit(ebioscience)。
用于构建克隆dna的kod酶购买自toyobo公司;dna测序由华大基因或者上海英潍捷基公司完成。
肝脏灌流涉及缓冲液:
1)10×ebss缓冲液(不含ca2+和mg2+):65.7gnacl、2.91gna3po4·12h2o、3.9gkcl、9.7gd-葡萄糖溶于1l去离子水中,调ph值至7.4。
2)10×ebss缓冲液(含ca2+和mg2+):1.325gcacl2、2gkcl、0.985gmgso4、34gnacl、11gnahco3、0.78gnah2po4·h2o、5gd-葡萄糖溶于500ml去离子水中,不需要调整ph值。
3)肝灌流溶液i:10ml10×ebss缓冲液(不含ca2+和mg2+)、0.5ml100mmegta中加去离子水至100ml,调ph值至7.4。
4)肝灌流溶液ii:10ml10×ebss缓冲液(含ca2+和mg2+)、1ml1mhepes中加去离子水至100ml,调ph值至7.4。
5)肝灌流缓冲液iii:20ml10×ebss缓冲液(含ca2+和mg2+)、2ml1mhepes、50mgiv型胶原酶中加去离子水至200ml,调ph值至7.4。
实验动物
野生型sd大鼠和野生型c57小鼠,6-8周,购自上海斯莱克公司。
fah-/-、rag2-/-il2rg-/-和fah-/-rag2-/-il2rg-/-(frg)大鼠均为sd背景,其中fah-/-和frg大鼠需要喂食含有5.4mg/lntbc的水。所有动物在spf级动物房培养。动物实验操作严格按照动物平台操作规定及保证动物福利情况下进行。
引物信息
实施例中检测fah、rag2、il2rg基因型所用的引物如表1。
表1
显微注射sgrna和cas9mrna
1)将超排处理的sd母鼠和公鼠交配后获得受精卵,并将其放置在ksom胚胎培养基中。
2)将含有12.5ng/ulsgrna和25ng/ulcas9mrna的te溶液利用显微注射针注射到一细胞期胚胎中。
3)将显微注射后的受精卵移植到假孕母鼠子宫。21天后即可获得基因敲除的新生小鼠。
大鼠原代肝细胞分离
1)将三种灌流液37℃水浴锅中预热。
2)将输液管固定在蠕动泵中,一端置于溶液i液面下,另一端接上针头,打开蠕动泵,调节转速为11,使液体充盈管道。
3)大鼠(5-8周,200g左右)麻醉,腹腔注射6mg/ml苯巴比妥钠(5-10ul/g体重)。
4)大鼠麻醉后将四肢固定在泡沫垫上,泡沫垫下面放置托盘。由腹下部至颈部纵向剪开腹侧皮毛,将皮毛固定于左右两侧。由腹下部横向剪开腹腔壁,沿身体左右两侧向上剪开至颈部下(中间要剪断隔膜和肋骨),将腹腔壁固定于头部右侧,充分暴露心脏和肝脏,用棉棒拨开腹部脂肪和小肠,暴露下腔静脉和肝门静脉。
5)将针头由心窦刺入上腔静脉(注意不要刺破上腔静脉),打开蠕动泵电源,即可见肝脏,下腔静脉和肝门静脉充盈鼓起,剪断肝门静脉,用止血钳夹住下腔静脉,开始灌流。
6)溶液i灌流50~100ml,肝脏不见血色后换溶液ii。溶液ii灌流50~100ml,后换溶液iii(换灌流液时要暂停蠕动泵)。
7)溶液iii灌流400ml,至肝脏组织具有一定流动性,表皮与肝实质脱离时止。
8)关掉蠕动泵,拔出针头,将肝脏剪下,置于10cm皿中,加入10ml溶液iii,用蓝枪头挤压肝脏,将肝细胞挤出,弃掉肝表皮。
9)将肝细胞悬液加入10ml培养基,吹打使细胞散开,转移入离心管中,1000rpm,5min,弃上清。
10)18mlpercol+2ml10×ebss+20mldmem混匀,将沉淀下来的肝细胞悬起,1000rpm,5min,弃上清。
11)用2mlack红细胞裂解液重悬细胞,冰上2-3分钟,然后用10mldmem培养基中和,1000rpm,5min,弃上清。
12)用10mldmem培养基重悬肝细胞,计数及活力。
大鼠原代肝细胞和人原代肝细胞移植
1)大鼠(5-8周,200g左右)麻醉,腹腔注射6mg/ml苯巴比妥(5-10ul/g体重)。
2)大鼠脾脏侧朝上,在肋骨以下1-2cm处剪开表皮和肌肉层。找到附着在脾脏上的褐色脂肪,将其拉出即可牵引出脾脏。将脾脏前端用线轻轻结扎。
3)用胰岛素针取2-10×106大鼠肝细胞或人原代肝细胞(500ul左右),针头插入脾脏,超过结扎位置。注射完成后,停顿30-60秒,然后拔出针头,将线扎紧,防止液体回流。
4)将脾脏放入腹腔,缝合肌肉及表皮,用酒精棉消毒伤口后,放入笼中。
免疫组化
大鼠肝脏用4%pfa固定过夜,脱水包埋,切成3um厚。
1)二甲苯脱蜡3次,每次5分钟。
2)梯度复水:100%乙醇,100%乙醇,90%乙醇,80%乙醇,70%乙醇,50%乙醇,各5分钟。去离子水,浸泡1分钟。
3)抗原修复(此步根据抗体特性可选):ph=6.0的柠檬酸钠抗原修复液95℃加热半小时,然后自然冷却至室温。用去离子水洗15分钟。
4)浸泡在pbs中备用。
5)在样品周围用immunopen画圈,滴一滴3%h2o2,室温15分钟,用于封闭内源的过氧化物酶。
6)pbs洗两次,每次5分钟。
7)用1:20的正常马血清(溶于1%bsa-pbs)封闭,室温孵育20分钟,用pbs洗3次。
8)加一抗,将切片放在湿盒内,封好,4℃过夜。
9)pbs洗三次,每次5分钟。
10)加二抗,室温孵育30分钟。pbs洗三次,每次5分钟。
11)加入abckit中的ab液(a、b液1:100稀释),室温孵育30分钟。pbs洗三次,每次5分钟。
12)dab显色,根据不同抗体调整显色时间。
13)苏木精复染20分钟。自来水冲洗半小时。
14)梯度脱水:50%乙醇,70%乙醇,80%乙醇,90%乙醇,100%乙醇,各2分钟。
15)二甲苯15-30分钟后,中性树脂封片保存。
免疫荧光
1)脱蜡复水步骤同免疫组化步骤中的1-3。
2)在样品周围用immunopen画圈,用1:20的normalhorseserum(溶于
3%bsa-pbs)封闭,室温孵育20分钟,用pbs洗3次。
3)加一抗(溶于3%bsa-pbs),将切片放在湿盒内,封好,4度过夜。
4)pbs洗3次。
5)加对应的荧光二抗(溶于3%bsa-pbs),室温孵育1小时后,pbs洗3次。
6)滴入荧光防淬灭封片剂封片。
免疫球蛋白elisa
采用ratigg、iga、igmready-set-go!elisakit(ebioscience)试剂盒。步骤如下:
1)将捕获抗体用包被缓冲液按照1:250稀释,96孔elisa板每孔加入100ul。将96孔板密封后,4℃孵育过夜。
2)将捕获抗体吸走后加入400ul每孔洗涤缓冲液,浸泡1分钟,然后吸走,洗2次。第二次需将洗涤缓冲液吸干净。
3)加250ul封闭缓冲液,室温孵育2小时。
4)按照步骤2,洗2次。
5)利用assaybuffera将标准品二倍稀释,稀释8个梯度。同样将样品根据标准曲线进行预估稀释倍数,保证最后od450落在标曲范围内。
6)取100ul标准品和样品加入到96孔板,封闭后,室温孵育2小时。
7)按照步骤2,洗4次。
8)每孔加入100ul检测抗体,室温孵育1小时。
9)按照步骤2,洗4次。
10)每孔加入100ul底物溶液,室温孵育15分钟。
11)每孔加入100ul终止溶液,进行a450和a570测量。将a450减去a570即最后用于分析的读值。
免疫细胞分离
对于胸腺:
1)取4-8周内大鼠,打开胸腔,在心脏表面附着着胸腺。如免疫缺陷动物,胸腺不明显,则将心脏表面组织含脂肪都取下来,置于10cm培养皿含有2%fbsdmem。培养皿应放在冰上。
2)用镊子撕扯胸腺,尽量撕成细小碎片。撕扯过程中,细胞会散落在培养基中。
3)细胞悬液用100um滤膜过滤后,计数。
对于脾脏:
1)将大鼠脾脏置于10cm培养皿含有2%fbsdmem。培养皿应放在冰上。
2)将脾脏剪成小块后,用镊子撕扯。
3)细胞悬液用100um滤膜过滤,去掉组织碎片。1000rpm,4℃离心5分钟。
4)加入1mlackbuffer重悬,冰上裂解3分钟后,加入6ml培养基中和。
5)1000rpm,4℃离心5分钟后,用培养基重悬,计数。
对于骨髓:
1)将大鼠后腿长骨剥离,用剪刀去除两端。
2)用1ml注射器吸取2%fbsdmem,注入长骨一段,溶液从另一端流出。
3)收集细胞悬液,100um滤膜过滤,去除组织碎片。1000rpm,4℃离心5分钟。
4)加入1mlackbuffer重悬,冰上裂解3分钟后,加入6ml培养基中和。
5)1000rpm,4℃离心5分钟后,用培养基重悬,计数。
免疫细胞流式分析
1)用50-100ul染色buffer(dmem+0.1%bsa),将5×106细胞重悬。加入直标一抗,每种抗体需要有一个无抗体对照。4℃孵育30-60分钟。
2)加入1ml染色液,洗1次,1000rpm离心5分钟。
3)去上清,重悬于200-300ulpbs中,进行流式细胞检测。以无抗体组作为阴性对照调整电压。
肝癌皮下成瘤实验
1)将snu398细胞系(获自atcc)消化,取5×106细胞直接注射到免疫缺陷大鼠的腹股沟处。
2)三周后处理大鼠,取肿瘤。肿瘤的大小用以下公式计算:肿瘤体积=a×b2/2,a代表最长边,b代表最短边。肿瘤用4%pfa固定包埋后,进行组织学检测。
ipsc畸胎瘤实验
1)将人ipsc消化后,用300ulpbs重悬5×106细胞,注射入免疫缺陷大鼠睾丸。
2)8周后,取大鼠睾丸用4%pfa固定包埋后,进行组织学检测。
he染色
1)脱蜡复水步骤同免疫组化步骤中的1)-4)。
2)苏木精复染20分钟。自来水冲洗半小时。
3)梯度脱水:50%乙醇,70%乙醇,80%乙醇,90%乙醇,100%乙醇,各2分钟。
4)二甲苯15-30分钟后,中性树脂封片保存。
肝脏人源化frg大鼠的基因表达检测
1)获取肝脏人源化小鼠和大鼠肝脏组织和人原代肝细胞,利用trizol(invitrogen)试剂抽提细胞rna。
2)trizol提取的rna取1ug,rneasyffpekit提取rna根据具体数值取1ug或全部,用m-mlv反转录酶(promega)试剂盒获得cdna。
3)采取sybrpremixextaq(takara)试剂盒进行实时定量pcr,利用abisteponeplusreal-timepcrsystem(appliedbiosystems)检测基因表达。引物如表2。
表2
实施例1、利用crispr/cas9建立了fah-/-rag2-/-il2rg-/-大鼠
为产生缺失突变,经过分析比较和反复试验,本发明人在大鼠fah的第二个外显子、rag2的第三个外显子和il2rg的第二个外显子设计了sgrna。具体设计如下(图1a):
针对fah第二个外显子,设计两条sgrna:
sgrna-1:ccacggattggtgtggccatcgg(seqidno:1);
sgrna-2:atcgaagacatgctgatgtttgg(seqidno:2);
针对rag2的第三个外显子,设计两条sgrna:
sgrna-1:cctaagagatcctgccctactgg(seqidno:3);
sgrna-2:acgaagaggtgggaggtagcagg(seqidno:4);
针对il2rg的第二个外显子,设计两条sgrna:
sgrna-1:aggagtaagaaggatctagatgg(seqidno:5);
sgrna-2:tccaaggtcctcatgtccagtgg(seqidno:6)。
将cas9mrna及6条sgrna通过显微注射至sd大鼠的受精卵,然后转移至假孕母鼠子宫。基因组dna提取自新生大鼠鼠尾,并用fah、rag2、il2rg基因两端的一对引物进行pcr扩增(图1a)。通过dna测序,本发明人鉴定获得一只新生鼠同时带有三个基因的突变(图1b)。
本发明人以上述获得的带有三个基因的突变的新生大鼠作为founder大鼠与野生型大鼠进行繁育获得更多f1代大鼠。f1大鼠进行pcr基因型鉴定也发现具有这三个基因的缺失突变,说明这些突变是可稳定遗传的(图1c)。
通过将f1代大鼠进行自交,繁育获得fah-/-、rag2-/-ilrg-/-和fah-/-rag2-/-il2rg-/-(frg)大鼠。
实施例2、fah-/-大鼠可作为肝细胞移植并高效重构肝脏的动物模型
在繁育frg大鼠过程中,首先获得了fah-/-大鼠。fah-/-大鼠在喂食ntbc情况下可以正常生长,且肝脏中完全缺失fah的表达(图2a和b)。当撤去ntbc后,fah-/-大鼠体重持续下降,最终因肝衰竭死亡(图2c和d)。而野生型大鼠肝细胞经脾移植后,fah-/-大鼠体重在下降2周后逐渐恢复,而且60%左右的大鼠能最终存活(图2c和d)。通过fah免疫组化染色,可以发现fah阳性的肝细胞大量再殖,再殖比例>90%,几乎重构了整个大鼠肝脏(图2e)。
上述结果说明,fah-/-大鼠是很好的肝细胞移植模型。
实施例3、rag2-/-il2rg-/-大鼠免疫系统发育严重受损
将f1代自交后,本发明人获得了rag2-/-il2rg-/-大鼠(图3a)。其在spf环境中可以正常生长繁殖,与野生型大鼠没有区别,能存活1.5年以上。胸腺和脾脏是动物体内最重要的两种淋巴器官。通过解剖正处于发育阶段的5周大的大鼠,本发明人发现,野生型大鼠具有明显的胸腺组织,而在rag2-/-、il2rg-/-以及rag2-/-il2rg-/-大鼠中胸腺发育严重不全(图3b)。he染色进一步证实,相对于野生型大鼠胸腺,rag2-/-、il2rg-/-以及rag2-/-il2rg-/-大鼠只有上皮样细胞而没有淋巴细胞(图3c)。脾脏中白髓含有b细胞和t细胞,红髓则含有较多红细胞。he染色显示,rag2-/-大鼠缺失白髓,il2rg-/-大鼠白髓仍有但显著减少,rag2-/-il2rg-/-大鼠则完全缺失白髓(图3c)。同时检测血清中的免疫球蛋白可以发现,il2rg-/-大鼠缺少igg,含有少量的iga,但igm含量比较高。rag2-/-和rag2-/-il2rg-/-大鼠则完全缺失免疫球蛋白(图4)。
为进一步鉴定rag2-/-il2rg-/-大鼠免疫缺陷,本发明人用流式细胞技术分析了胸腺和脾脏中免疫细胞的种群。首先,在胸腺中检测了t细胞的发育情况。相对于野生型大鼠,cd4+和cd8+单阳性t细胞在rag2-/-、il2rg-/-以及rag2-/-il2rg-/-大鼠中完全消失(图5a和b)。cd4+cd8+双阳性t细胞在rag2-/-和rag2-/-il2rg-/-大鼠中几乎消失,而在il2rg-/-大鼠中急剧减少但仍有存留(图5c)。
紧接着,本发明人在脾脏中分析了t、b和nk细胞的发育情况。在rag2-/-大鼠脾脏中cd3-cd45ra+b细胞和cd3+cd45ra-t细胞完全消失,但是cd161a+nk细胞存在并显著增加(图5d和e)。
在il2rg-/-大鼠中cd3-cd45ra+b细胞和cd3+cd45ra-t细胞相对野生型动物都大幅下降,同时cd161a+nk细胞也几乎消失(图5d和e)。这说明il2rg敲除不但影响nk细胞发育,还影响t、b细胞发育。在rag2-/-il2rg-/-大鼠中t、b和nk细胞则几乎完全缺失(图5d和e)。
以上实验结果证明,rag2-/-il2rg-/-大鼠在淋巴器官发育、免疫球蛋白分泌和t、b、nk细胞形成都有极大的缺陷,说明其免疫系统存在严重缺陷。
实施例4、rag2-/-il2rg-/-大鼠可作为异种移植模型
免疫缺陷小鼠被广泛地用于异种移植,特别是人肿瘤细胞、胚胎干细胞、造血干细胞和肝细胞。为在功能水平检测rag2-/-il2rg-/-免疫缺陷程度,本发明人将人肝癌细胞snu-398皮下移植到rag2-/-il2rg-/-大鼠和野生型大鼠。移植3周后,所有动物(n=6)都长出了皮下瘤,但对照组(n=6)没有任何皮下瘤形成(图6a和b)。皮下瘤组织通过组织学分析进行了确认(图6c)。免疫缺陷小鼠还常用于畸胎瘤形成实验,检测ips细胞的全能性。本发明人将人ips细胞移植到rag2-/-il2rg-/-大鼠睾丸包囊,所有动物(n=3)经过2个月都形成畸胎瘤。组织学检测发现,ipsc细胞体内分化成三个胚层,包括管状上皮细胞(内胚层)、神经丛(外胚层)和软骨结构(中胚层)(图6d)。
这些发现说明,rag2-/-il2rg-/-大鼠的免疫系统严重受损,这些动物可以异种移植人类细胞。
实施例5、fah-/-rag2-/-il2rg-/-大鼠用于移植人和小鼠原代肝细胞
通过繁育获得frg大鼠后,本发明人首先移植了3x106小鼠肝细胞,用于检测能否接受异源肝细胞。移植4周及7周时处理大鼠并用fah免疫组化染色显示小鼠肝细胞在frg大鼠肝脏大量再殖,再殖比例达86%(图7a)。说明异源肝细胞也可完全重构frg大鼠肝脏。
本发明人又移植了2x106冻存的人原代肝细胞至frg大鼠。移植1.5个月后,发现血清存在大量人白蛋白分泌(112-560ug/ml)。而移植3个月时,发现人白蛋白分泌量增加到了1.6mg/ml。这显示人肝细胞在frg体内持续增殖。通过fah免疫组化染色可以发现fah阳性的人肝细胞在frg大鼠肝脏中整合(图7b),整合比例高达25%。连续切片样品进行人alb蛋白抗体和ki67染色,发现91%的人肝细胞为ki67阳性(图7c)。这说明整合到大鼠肝脏中的人肝细胞几乎都是处于增殖状态,也就暗示人肝细胞有望完全重构frg肝脏。同时通过连续切片的fah和cyp3a4免疫组化染色发现,整合到frg大鼠肝脏中的人肝细胞人表达cyp3a4,从而显示肝脏人源化动物可应用于研究药物代谢(图7d)。
上述结果说明,fah-/-rag2-/-il2rg-/-大鼠可用作体内扩增人肝细胞并构建肝脏人源化大鼠。
实施例6、高比例肝脏人源化frg大鼠具有人类肝脏特异代谢基因表达和结构
本发明人移植了2×106的冻存人原代肝细胞到frg大鼠,并在移植后5个月获得了高比例肝脏人源化的frg大鼠。通过人特异alb及aat染色,可以发现人肝细胞在frg大鼠肝脏的再殖比例达到了46±15%(图8a)。
人类肝脏代谢酶具有区域表达的特征,如在围中央静脉表达肝脏i相代谢酶、谷氨酰胺合成酶(gs)等,而在围门静脉表达尿素代谢相关酶等。本发明人也在高比例肝脏人源化大鼠肝脏中发现,人肝细胞不仅表达肝脏标志基因alb、aat和fah,还在围中央静脉特异表达cyp3a4和gs(图8b)。
进一步通过人特异qpcr引物检测发现,高比例肝脏人源化大鼠表达肝脏i相代谢酶,包括cyp3a4、cyp2a6、cyp2c9,cyp2e1等,ii相代谢酶如gsta1、ugt2b7等,转运体如slc2a2,slc22a1、slco1b1等(图8c),而且表达量与原代人肝细胞和肝脏人源化小鼠处于可比的水平。
综上所述,高比例肝脏人源化frg大鼠建立起了人类肝脏特异代谢基因表达和结构,可用于肝脏代谢研究和药物研发试验。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>中国科学院上海生命科学研究院
<120>制备免疫缺陷的大鼠的方法及其应用
<130>174728z1
<150>201710458697.0
<151>2017-06-16
<160>42
<170>siposequencelisting1.0
<210>1
<211>23
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(23)
<223>针对fah第二个外显子的sgrna
<400>1
ccacggattggtgtggccatcgg23
<210>2
<211>23
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(23)
<223>针对fah第二个外显子的sgrna
<400>2
atcgaagacatgctgatgtttgg23
<210>3
<211>23
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(23)
<223>针对rag2的第三个外显子的sgrna
<400>3
cctaagagatcctgccctactgg23
<210>4
<211>23
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(23)
<223>针对rag2的第三个外显子的sgrna
<400>4
acgaagaggtgggaggtagcagg23
<210>5
<211>23
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(23)
<223>针对il2rg的第二个外显子的sgrna
<400>5
aggagtaagaaggatctagatgg23
<210>6
<211>23
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(23)
<223>针对il2rg的第二个外显子的sgrna
<400>6
tccaaggtcctcatgtccagtgg23
<210>7
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(21)
<223>引物
<400>7
ctgctgcatttaagctaccac21
<210>8
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(21)
<223>引物
<400>8
catagaagccaggatgagtgt21
<210>9
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(21)
<223>引物
<400>9
ttcccagaaagcaaagcaaag21
<210>10
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(21)
<223>引物
<400>10
gcatgtatgaccgtcctccaa21
<210>11
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(21)
<223>引物
<400>11
aaaggtggttgggaatgaagg21
<210>12
<211>23
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(23)
<223>引物
<400>12
aaggtccatagaagtcagcaaga23
<210>13
<211>18
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(18)
<223>引物
<400>13
gcctttgctcagtatctt18
<210>14
<211>18
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(18)
<223>引物
<400>14
aggtttgggttgtcatct18
<210>15
<211>19
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(19)
<223>引物
<400>15
tatgatgaagcgtttaggc19
<210>16
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(20)
<223>引物
<400>16
cagtaatggacagtttgggt20
<210>17
<211>23
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(23)
<223>引物
<400>17
ttcagcaagaagaacaaggacaa23
<210>18
<211>22
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(22)
<223>引物
<400>18
ggttgaagaagtcctcctaagc22
<210>19
<211>18
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(18)
<223>引物
<400>19
cagcacttcctgaatgag18
<210>20
<211>23
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(23)
<223>引物
<400>20
aggtgactgggaggacttgaggc23
<210>21
<211>19
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(19)
<223>引物
<400>21
atgtctgccctcggagtca19
<210>22
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(20)
<223>引物
<400>22
cgatgatgggaagcgggaaa20
<210>23
<211>19
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(19)
<223>引物
<400>23
cctacggcgtcttctcgac19
<210>24
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(20)
<223>引物
<400>24
ctgcaagaacactctcgcct20
<210>25
<211>17
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(17)
<223>引物
<400>25
ccacctttgacgctggg17
<210>26
<211>23
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(23)
<223>引物
<400>26
cataccaggaaatgagcttgaca23
<210>27
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(20)
<223>引物
<400>27
tcagccctggcccagatccc20
<210>28
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(20)
<400>28
acagctgctcccctggcctt20
<210>29
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(20)
<223>引物
<400>29
gcctgccccatgcagtgacc20
<210>30
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(21)
<223>引物
<400>30
cacagcagccagccaggccat21
<210>31
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(21)
<223>引物
<400>31
agaagcattgacccgatggat21
<210>32
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(21)
<223>引物
<400>32
agcggtctttgagttagagga21
<210>33
<211>19
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(19)
<223>引物
<400>33
ccacgggcaaacactacgg19
<210>34
<211>19
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(19)
<223>引物
<400>34
ggcaggctgctgtcctcat19
<210>35
<211>19
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(19)
<223>引物
<400>35
ctgcccgtatgtccacctg19
<210>36
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(21)
<223>引物
<400>36
agctcctcgacgtagtagaga21
<210>37
<211>22
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(22)
<223>引物
<400>37
gctgctcaactaatcaccatgc22
<210>38
<211>22
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(22)
<223>引物
<400>38
tggtcccaattttgaaaacccc22
<210>39
<211>19
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(19)
<223>引物
<400>39
gaagcggctttggttgtgg19
<210>40
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(21)
<223>引物
<400>40
cgcattgcctttaagactggc21
<210>41
<211>21
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(21)
<223>引物
<400>41
ttggaggtgttttgactgctt21
<210>42
<211>23
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>misc_feature
<222>(1)..(23)
<223>引物
<400>42
acaagtggataaggtcgatgttg23
- 还没有人留言评论。精彩留言会获得点赞!