一种草鱼树突状细胞分离与原代培养的方法与流程
本发明涉及鱼类细胞离体培养技术领域,尤其涉及一种草鱼树突状细胞分离与原代培养的方法。
背景技术:
细胞培养作为细胞生物学乃至生物学研究的重要技术,在生物研究领域中占有重要地位。动物组织(细胞)培养开始于20世纪初,发展至今已成为生物、医学研究及应用广泛采用的技术方法。鱼类细胞培养起步较晚,自20世纪60年代开始。主要用于病毒学,免疫学以及生理和毒理学研究。鱼类树突状细胞的分离培养对鱼类疾病的预防、诊断、治疗具有重要意义。
树突状细胞(dendriticcell,dc)是目前已知的的体内功能最强的抗原呈递细胞(antigenpresentingcell,apc)(steinman,1991),dc是识别内外抗原、调节免疫功能的关键因素,在机体免疫系统中处于中心地位。抗原信息只有通过dc的处理及携带转运从外周传递到淋巴器官如淋巴结、脾脏等免疫细胞富集区才能完成有效递呈而激活免疫反应(andersonkl,2002;beatysr,2007)。被认为是联系固有免疫和获得性免疫的关键。草鱼作为国内产量最大的淡水经济鱼类,开展草鱼树突状细胞相关的研究,对草鱼病害的防治提供了重要的理论基础。
目前对哺乳动物树突状细胞进行分离培养的技术已较为成熟。主要可分为直接培养法,细胞因子诱导法,免疫磁珠法,密度梯度离心法(cavanaghll,2007;cavanaghll,1998;lincl,1998;mckennahj,2001)。
直接培养法是利用dc具有轻度粘附特性,藉此与其他非粘附细胞区别。且dc的粘附为暂时性的,一般在经过分离液处理或培养后就自动从塑料平皿上脱落下来。而单核细胞、巨噬细胞可长时间粘附,借此可分离出dc。bassity等(2012)首次在虹鳟中利用此法分离得到树突状细胞。虽然此法材料来源广,取材方便,实验条件要求不高,但此方法获取的dc数量少,在培养过程中极易造成细胞丢失,目前较少使用此法分离培养dc。细胞因子诱导法时通过ficoll分离液获取外周血单个核细胞(peripheralbloodmononuclearcell,pbmc)后,在培养液中加入适量的粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophagecolonystimulatingfactor,gm-csf)和肿瘤坏死因子-α(tumornecrosisfactor-α,tnf-α)等细胞因子,诱导pbmc分化成为树突状细胞(mckennahj.2001)。此法目前在哺乳动物树突状细胞分离培养中得到了广泛的应用。但此法实验要求高,且后续需要利用抗体进行流式筛选,限制了其在鱼类树突状细胞培养中的应用。免疫磁珠法是近来新兴的一种方法,收集到的单个核细胞用与抗cd19、cd16、cd3单抗相连的磁珠分别去除b细胞、nk细胞和粒细胞,然后加入磁珠交联的羊抗鼠免疫球蛋白g(igg)或特定标记的抗体(用于筛选特定表型的dc)。通过置于磁场中的分离柱,移出磁场后,加压洗脱,即可收集到高纯度的dc(beatysr,2007)。此方法收集到的dc纯度高,表型明确,可立刻用于后续实验。在斑马鱼树突状细胞的分离中得到了应用。但是实验条件要求高,且需要特异性好的单抗用于树突状细胞的筛选。基于目前鱼类抗体数量的稀少,很难将其广泛应用于鱼类树突状细胞的分离培养。密度梯度离心法是通过特定细胞类群密度的不同,通过离心收集不同密度层的细胞,从而分离获取单核细胞,并在直接培养法的基础上,保留2h时贴壁的细胞。从而获得较高纯度的树突状细胞(rasanenl.1988)。此方法过程较简便,无需添加额外的细胞因子,有利于广泛开展树突状细胞相关的研究。
不同动物的生理特性差异显著,其细胞结构、理化特性显著不同,对其分离、培养方法差别也较大,适用于哺乳动物树突状细胞培养的方法对鱼类并不适用。迄今为止,尚未见到草鱼树突状细胞分离培养的方法。
技术实现要素:
本发明的目的在于克服现有技术中的缺陷,提供了一种草鱼树突状细胞分离与原代培养的方法,不仅操作简便,耗时短,成功获得的草鱼树突状细胞,且纯度高可达80%以上。
本发明是这样实现的:
本发明的目的在于提供了一种草鱼树突状细胞分离与原代培养的方法,包括如下步骤:
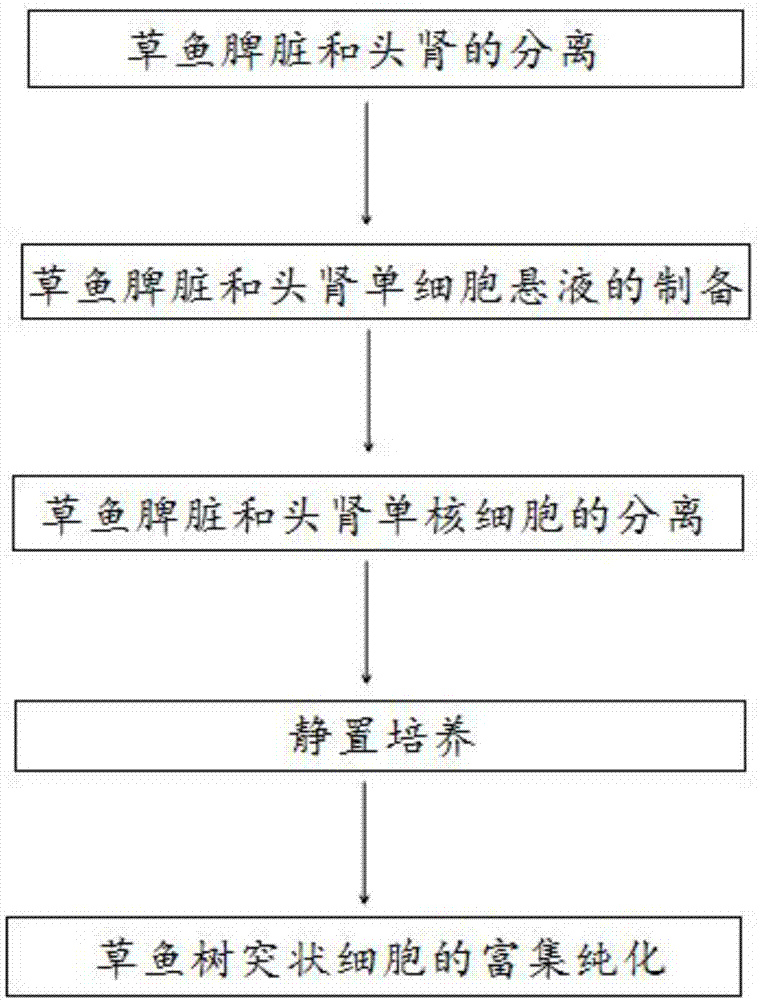
步骤1、草鱼脾脏和头肾的分离:将草鱼麻醉致死,取出脾脏和头肾,去掉粘附的结缔组织和脂肪组织并浸泡;
步骤2、草鱼脾脏和头肾单细胞悬液的制备:连续筛网过滤,获取细胞悬液;
步骤3、草鱼脾脏和头肾单核细胞的分离:ficoll分离,离心后吸取白膜层的细胞并洗涤;
步骤4、静置培养:调整单核细胞浓度,置于培养箱培养;
步骤5、草鱼树突状细胞的富集纯化:培养一段时间后收集悬浮细胞,采用密度梯度离心的方法纯化草鱼树突状细胞。
优选地,所述步骤1中,具体步骤为:使用ms-222将草鱼麻醉致死,体表喷涂75%的酒精并用酒精棉球反复擦拭消毒后转移至无菌超净台中,尾静脉取血;脾脏的分离:使用无菌手术剪沿着鱼体侧线打开腹腔,无菌刀镊取出脾脏,去掉粘附的结缔组织和脂肪组织,置于盛有aim液体的培养皿中浸泡,期间每隔15min更换一次aim液;头肾的分离:无菌手术剪剪下草鱼头部,无菌眼科镊去除膈膜后,取出头肾组织,置于盛有aim液体的培养皿中浸泡,期间每隔15min更换一次aim液。
优选地,所述步骤1中,所述浸泡所用液体为aim液:47.50mll-15培养基、2.50ml双抗、2.5μg/ml两性霉素b和25μg/ml庆大霉素。
优选地,所述步骤2中,将步骤1所得的离体草鱼头肾和脾脏组织用无菌剪刀剪成小块,转移至经过高压灭菌处理的200目不锈钢细胞筛网,使用无菌注射器的塞子的平坦的一端,轻轻按压组织块,使之通过细胞筛。
优选地,所述步骤3中,将上一步收集得到的单细胞悬液调整为108cells/ml,以2:1的体积比,将单细胞悬液轻轻滴加于ficoll分离液上,800g,26℃,离心20min,吸取白膜层的细胞,加入5倍体积的pbs洗涤两次,200g,10min。
优选地,所述步骤4中,将步骤3中收获的单核细胞调整浓度为5ⅹ106cells/ml,置于25cm2培养瓶中,置于28℃二氧化碳生化培养箱静置培养,2h后吸弃悬浮细胞,加入等量新鲜的培养基,每两天更换一半的培养基,更换掉的培养基离心收集细胞,加入等量的新鲜原代培养基重悬后加回原培养瓶。
优选地,所述步骤4中,静置培养所用的细胞原代培养基:42.50mll-15培养基、5mlfbs、2.50ml双抗、2.5μg/ml两性霉素b和25μg/ml庆大霉素。
优选地,所述步骤5中,按照1:1:1的体积比,从下往上分别为1.077g/mlpercoll液,1.048g/mlpercoll液,细胞悬液,三者依次加入到离心管中,800g,26℃,离心30min,吸取两种不同密度percoll液界面层之间的细胞,pbs洗涤2次,200g,10min。
本发明具有的有益效果是:
1、本发明提供的一种草鱼树突状细胞分离与原代培养的方法,可有效制备大量草鱼树突状细胞,而且获得的草鱼树突状细胞纯度高可达80%以上;操作过程简单明了,耗时短。
2、在哺乳动物中,骨髓中细胞种类较单一,在添加生长因子(gm-csf和il-2)条件下,dc前体细胞在7d时大部成熟,具有显著的树突状细胞特征。而外周血获取方便,对供体损伤小。在鱼类中,缺乏骨髓这类组织,若要从外周血中获取足够数量的树突状细胞用于后续的实验研究,对供体损伤较大(需要抽取10ml以上的血液,较难获得),且污染风险较大;迄今为止,尚未见到草鱼树突状细胞分离培养的方法。本发明未选用外周血和骨髓,而是使用草鱼的脾脏和头肾;鱼类脾脏和头肾作为研究较为广泛的免疫器官组织,富含各类免疫相关细胞,使用头肾和脾脏作为分离树突状细胞的来源,大大提升了可供使用的细胞总数,简化了实验步骤,降低了对实验人员实验技能的要求,缩短了实验所需时间,降低了细胞被污染的概率,有利于快速获得大量草鱼树突状细胞;同时,为消除脾脏和头肾中结缔组织和大量血细胞的影响,我们将组织浸泡于aim液前尽可能的剥离附于表面的结缔组织,同时将组织尽可能的剪碎成小块,延长浸泡的时间,使得单细胞悬液通过ficoll液离心时血细胞大部可去除,并通过培养后吸弃悬浮细胞,进一步减少杂细胞的影响。
3、本发明在树突状细胞富集方面,改进了哺乳动物使用1.077g/ml分离液进行富集的方法,增加了1.048g/ml的富集液,通过收集密度在1.048g/ml和1.077g/ml之间的悬浮细胞,提高了树突状细胞的纯度。
附图说明
图1为本发明实施例提供的一种草鱼树突状细胞分离与原代培养的方法的流程图。
图2为本发明实施例提供的一种草鱼树突状细胞分离与原代培养的方法中ficoll分离后获取的单核细胞的(400x)光学显微镜图;
图3为本发明实施例提供的一种草鱼树突状细胞分离与原代培养的方法中培养第3d的单核细胞(400x)光学显微镜图;
图4为本发明实施例提供的一种草鱼树突状细胞分离与原代培养的方法中培养第5d的单核细胞(400x)光学显微镜图;
图5为本发明实施例提供的一种草鱼树突状细胞分离与原代培养的方法中培养第7d的单核细胞(400x)光学显微镜图;
图6为本发明实施例提供的一种草鱼树突状细胞分离与原代培养的方法中吉姆萨染色的草鱼树突状细胞光学显微镜图,其中图a为1000x;图b为630x;
图7为本发明实施例提供的一种草鱼树突状细胞分离与原代培养的方法中使用草鱼树突状细胞流式细胞仪图。
具体实施方式
实施例1
一、准备实验材料
实验所用培养液或培养基组成成分及配比如下
aim液:47.50mll-15培养基、2.50ml双抗、2.5μg/ml两性霉素b和25μg/ml庆大霉素,置于4℃备用;
细胞原代培养基:42.50mll-15培养基、5mlfbs、2.50ml双抗、2.5μg/ml两性霉素b和25μg/ml庆大霉素,置于4℃备用;
二、实验方法
1、草鱼脾脏和头肾的分离:使用过量ms-222将草鱼麻醉致死。体表喷涂75%的酒精并用酒精棉球反复擦拭消毒后转移至无菌超净台中,尾静脉取血。
脾脏的分离:使用无菌手术剪沿着鱼体侧线打开腹腔,无菌刀镊取出脾脏,摘取过程中尽量去掉粘附的结缔组织和脂肪组织。置于盛有aim液体的培养皿中浸泡1h,期间每隔15min更换一次aim液。
头肾的分离:无菌手术剪剪下草鱼头部,无菌眼科镊去除膈膜后,取出头肾组织,置于盛有aim液体的培养皿中浸泡1h,期间每隔15min更换一次aim液。
2、草鱼脾脏和头肾单细胞悬液的制备:将步骤1所得的离体草鱼头肾和脾脏组织用无菌剪刀剪成1cm3的小块。转移至经过高压灭菌处理的200目(0.75um)不锈钢细胞筛网。使用无菌注射器的塞子的平坦的一端,轻轻按压组织块,使之通过细胞筛。
3、草鱼脾脏和头肾单核细胞的分离:将上一步收集得到的单细胞悬液调整为10^8cells/ml,按照说明书的指导,以2:1的体积比,将单细胞悬液轻轻滴加于ficoll分离液上,期间保持界面层的清晰。800xg,26℃,离心20min,吸取白膜层的细胞,加入5倍体积的pbs洗涤两次,200xg,10min。
4、静置培养:将步骤3中收获的单核细胞调整浓度为5ⅹ106cells/ml,置于25cm2培养瓶中,置于28℃二氧化碳生化培养箱静置培养。2h后轻轻晃动培养瓶,吸弃悬浮细胞,加入等量新鲜的培养基。每两天更换一半的培养基。更换掉的培养基离心收集细胞,加入等量的新鲜原代培养基重悬后加回原培养瓶。
5、草鱼树突状细胞的富集纯化:当培养进行到5-7d时,轻轻摇晃培养瓶,收集悬浮细胞,按照1:1:1的体积比,从下往上分别为1.077g/mlpercoll液,1.048g/mlpercoll液,细胞悬液的次序依次加入到15ml离心管中,800xg,26℃,离心30min,吸取两种不同密度percoll液界面层之间的细胞,pbs洗涤2次,200xg,10min。
实验例
将所述实施例所得的草鱼树突状细胞富集纯化后,上流式细胞仪,检测细胞纯度。流式细胞仪中,前向散射光(forwardscatter,fsc)反应的是细胞的大小,侧向散射光(sidescatter,ssc)反应的是细胞的复杂程度,不同类型的细胞的大小及复杂程度差别大,故可以分群。因此这里使用流式细胞仪的fsc和ssc分析富集后树突状细胞的纯度。实验结果如图7所示,整个细胞集中为一群,群外的细胞极少,表明获得的草鱼树突状细胞纯度高,且用流式细胞仪的统计功能进行统计知草鱼树突状细胞的纯度高可达80%以上。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!