植物乳杆菌CQ02-108及其在发酵香肠制备中的应用的制作方法
本发明属于微生物技术领域,具体涉及植物乳杆菌及其在发酵香肠制备中的应用。
背景技术
发酵香肠是指将绞碎的肉和动物脂肪、盐、糖、发酵剂和香辛料等混合后灌进肠衣,在人工或自然控制条件下,经过微生物发酵而制成的发酵肉制品。我国传统的发酵肠不进行人工添加发酵剂的步骤,主要靠原料肉自身的微生物菌群在自然环境下完成发酵成熟,具有独特的风味。因此发酵周期长,并且容易受到气候的限制,产品的安全和品质难以得到保障。
传统发酵香肠的微生物菌群主要由乳酸菌,凝固酶阴性葡萄球菌,酵母和霉菌组成,其中乳酸菌在肉类发酵和保藏中起重要作用,是参与发酵的主要微生物。致病菌是影响发酵香肠安全性的重要原因之一,而乳酸菌能产生乳酸迅速降低产品的ph值,并且部分乳酸菌能产生细菌素,这对致病菌及腐败菌的生长起到了抑制作用。使用产细菌素的乳酸菌作为发酵剂来延长发酵香肠的保质期及保证其安全性已经成为一种趋势。乳酸的产生还会加速亚硝酸盐向一氧化氮肌红蛋白的转化,减少产品中亚硝酸盐的残留量,同时促进了良好色泽的形成。另一方面,乳酸菌能够赋予产品特有的风味和坚实的质地。因此,乳酸菌的筛选研究对发酵肉制品的开发有着十分重要的意义。
此外,在制作发酵香肠时,通常将盐和亚硝酸盐添加到发酵肉制品中从而保证质量,改善风味等。而在香肠的发酵成熟过程中,随着ph的不断降低,水分含量、aw也不断降低,盐浓度则不断升高。因此,筛选一株能够耐受高盐和高酸度,能够产细菌素从而抑制致病菌生长的乳酸菌,并且应用于发酵香肠中,对香肠的加工具有重要的意义。
技术实现要素:
本发明针对以上问题,提供了一株植物乳杆菌及其在发酵香肠中的应用。将从传统自然发酵香肠中筛选出来的能够耐受高盐浓度、高酸度、抑制致病菌生长的植物乳杆菌应用到发酵香肠中,改善香肠的色泽,提高香肠的品质。
本发明的目的是通过以下技术方案实现:
本发明的第一个目的是提供一株植物乳杆菌cq02-108,分类命名为植物乳杆菌lactobacillusplantarum,已于2018年7月17日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmccno.16121。
在本发明的一种实施方式中,所述植物乳杆菌cq02-108产蛋白酶、快速产酸、不产粘、不产气、不产生物胺、不产h2o2、不产h2s、不产色素。
在本发明的一种实施方式中,所述植物乳杆菌cq02-108能够耐受高浓度盐、高酸度。
在本发明的一种实施方式中,所述植物乳杆菌cq02-108能够抑制大肠杆菌、金黄色葡萄球菌的生长。
在本发明的一种实施方式中,所述植物乳杆菌cq02-108能够耐受胆盐和胃液。
本发明的第二个目的是提供一种包含前述植物乳杆菌cq02-108的微生物菌剂。
进一步的,所述微生物菌剂为固态菌剂或液态菌剂。
本发明的第三个目的是提供一种包含前述植物乳杆菌cq02-108的功能发酵剂。
进一步的,所述功能发酵剂为将前述的植物乳杆菌cq02-108在mrs肉汤中37℃培养24h,4℃下6000g离心10min,收集沉淀用无菌水洗涤3次并重悬得到的菌悬液。
本发明的第四个目的是提供前述植物乳杆菌cq02-108或前述的功能发酵剂在制作发酵肉制品中的应用。
进一步的,所述发酵肉制品为发酵香肠。
进一步的,所述应用包括以下步骤:
s1:原料肉中加入调味料和辅料置于4℃腌制;
s2:将前述的功能发酵剂接种到原料肉中混匀,灌制香肠,所述接种量为105-108cfu/g,优选107cfu/g;
s3:发酵:25℃~35℃,rh80%条件下发酵1天;
s4:干燥成熟:15℃,rh75%条件下放置4天;在12℃,rh72%条件下干燥16天至香肠发酵成熟;
进一步的,上述步骤还包括
s5:将香肠进行修剪,真空包装后得到成品。
进一步的,s1中所述原料肉为新鲜猪后腿瘦肉和猪背膘,将其表面的筋膜和大的筋腱等部位剔除后进行漂洗,将肉搅碎后按照猪后腿瘦肉与背膘的比例为8:2进行混合得到;
所述调味料和辅料按照与原料肉的以下质量百分比添加:食盐2%、蔗糖1%、葡萄糖1%、亚硝酸钠0.015%、异抗坏血酸钠0.05%、姜粉0.1%、白胡椒粉0.1%、五香粉0.1%。该调味料和辅料的配比结合本发明植物乳杆菌cq02-108发酵剂的使用,可使发酵香肠具有优异的感官特性。
进一步的,s3中所述发酵温度为30℃。
进一步的,所述功能发酵剂能够抑制大肠杆菌、金黄色葡萄球菌在食品中繁殖,且能够在胆盐、模拟胃液中繁殖。
进一步的,前述植物乳杆菌cq02-108或前述的功能发酵剂在制作发酵肉制品中的应用是利用植物乳杆菌cq02-108耐盐、耐酸、抑菌、快速产酸等特性,改善产品品质。
本发明的有益效果:
(1)本发明的植物乳杆菌不仅满足肉品发酵剂的基本标准之外,还能耐受高浓的盐、耐受高酸度、产细菌素有效抑制致病菌的生长,同时还具有耐胆盐耐胃液的特征,对功能性肉品发酵剂的开发提供一定理论依据。
(2)本发明通过添加植物乳杆菌,在香肠成熟结束时乳酸菌数仍高达107,显著提高发酵香肠中乳酸菌的数量,抑制大肠杆菌和金黄色葡萄球菌的生长。
(3)本发明的植物乳杆菌作为发酵剂制作发酵香肠,有效地改善了发酵香肠的风味和品质。
(4)与传统发酵香肠比,接种本发明的植物乳杆菌cq02-108有效降低香肠在生产过程中的ph,降低了香肠腐败和霉变的风险,提高了产品的安全性。
附图说明
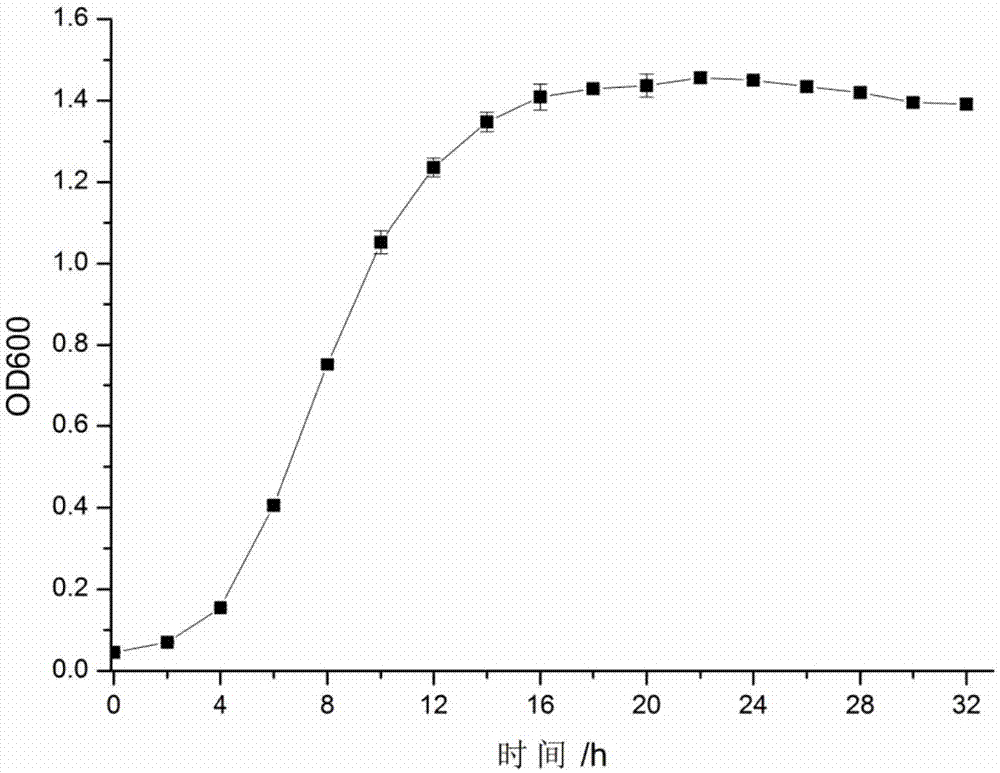
图1是植物乳杆菌cq02-108的生长曲线
图2是植物乳杆菌cq02-108在不同盐浓度下生长情况
图3是植物乳杆菌cq02-108在不同ph度下生长情况
图4是发酵香肠ph变化情况
图5是发酵香肠中乳酸菌数变化情况
图6是发酵香肠中菌落总数变化情况
生物保藏信息说明
一株植物乳杆菌(lactobacillusplantarum)cq02-108,已于2018年7月17日保藏于中国微生物菌种保藏管理委员会普通微生物中心,分类命名为植物乳杆菌lactobacillusplantarum,保藏编号为cgmccno.16121。保藏单位地址:北京市朝阳区北辰西路1号院3号,中国科学院研究所;邮编:100101。
具体实施方式
下面结合具体实施例对本发明做进一步说明:
实施例1:菌株的筛选
筛选方法的具体实施步骤如下:
1、样品采集
原始样品采自重庆市菜市场购买的传统自然发酵香肠。
2、从样品中分离乳酸菌
将25g香肠样品在无菌条件下剪碎,溶于225ml无菌生理盐水混匀,静置数分钟,碎肉完全沉淀后,取上清液按1:10逐步递增稀释,选择合适的稀释度的菌液100ul均匀涂布于添加了碳酸钙的mrs固体培养基,于37℃厌氧培养箱中培养48h。挑取平板上不同形态的、有溶钙圈、且符合乳酸菌菌落形态特征的独立的单个菌落,于mrs培养基上划线,直至获得纯培养物为止。挑取典型菌落进行革兰氏染色和接触酶实验,得到20株革兰氏染色阳性和接触酶阴性的菌株。
3、菌株的初筛
将上述分离的20株菌分别进行产酸、蛋白酶、耐亚硝酸盐、产硫化氢、产生物胺、硝酸还原酶、产气、产粘液、产色素试验,最终得到能够快速产酸、产蛋白酶、耐亚硝酸盐、以及产硫化氢、生物胺、硝酸还原酶、产气、粘液、色素均为阴性的菌株共3株,分别编号为cq02-108、cq02-117、cq02-120。
4、菌株的复筛
将上述所得3株菌进行抑菌试验,采用牛津杯法对菌株的抑菌能力进行测定。指示菌为大肠杆菌及金黄色葡萄球菌。收集乳酸菌稳定期的上清液菌液,上清液再使用0.22μm的微孔滤膜过滤除菌。将活化3代后的指示菌(106cfu/ml)均匀涂布于营养琼脂培养基表面,在培养皿中等距离放置4个无菌牛津杯,每个牛津杯中加入200μl试验菌株上清液,空白对照为液体培养基,4℃扩散6h后于37℃培养48h,观察牛津杯周围抑菌圈情况并对其抑菌圈直径进行测量计算其平均值。最终结果如表1所示,cq02-108相对于cq02-117和cq02-120两株菌抑菌效果最佳,因此最终得到cq02-108。
表1不同菌株的抑菌结果
注:结果表示为平均数±标准差,n=4;同列标注不同小写字母为差异显著(p<0.05)。
5、菌种的鉴定
将筛选出的cq02-108在mrs平板上划线,挑取单菌落利用通用扩增16srrna基因,采用扩增细菌16srrna基因的通用引物:上游引物为27f,下游引物为1492r。pcr条件为:94℃预变性5min;94℃变性1min,55℃退火1min,72℃延伸90s,30个循环;72℃最终延伸10min。
pcr产物经1%琼脂糖凝胶电泳检测后,送生工生物工程(上海)有限公司测序,序列所得结果与ncbi数据库中已知序列进行对比。确定该菌株为植物乳杆菌(lactobacillusplantarum),相似度为100%。该菌已于2018年7月17日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmccno.16121。保藏单位地址:北京市朝阳区北辰西路1号院3号,中国科学院研究所。
实施例2:植物乳杆菌cq02-108耐胆盐试验
将待测菌株的细菌悬浮液调节至109cfu/ml。按照1%(v/v)的比例分别接种到含有0.1%、0.3%胆盐的mrs肉汤中,对照组由不含胆盐的mrs肉汤组成。在37℃下厌氧培养24小时,通过分光光度计以0.5h间隔测量od620。每个菌株的胆盐耐受性基于od620值增加0.3个单位所需的时间。
结果如表2所示,cq02-108在0.1%的胆盐和0.3%的胆盐中od620增加0.3个单位所需的时间均显著低于其余两株菌,表明cq02-108的耐受胆盐能力最强。
表2不同菌株的胆盐耐受结果
注:同列标注不同小写字母表示差异显著(p<0.05),n=3。
实施例3:植物乳杆菌cq02-108耐胃液试验
模拟胃液的制备:将0.35g胃蛋白酶加入到100ml0.2%无菌盐水中,用浓hcl将ph调节至3.0过滤除菌备用。
将待测菌株在37℃在mrs肉汤中培养过夜,然后按照1%的量接种到5ml胃液中并在37℃下孵育3小时。在模拟的胃液中消化后,通过平板计数法测定每种菌株的活菌数(log10cfu/ml),并计算存活率,存活率(%)=3h活菌数/0h活菌数×100%。
结果如表3所示,三株菌都具有良好的胃液耐受性,经过3h的模拟消化,活菌数依然能达到107cfu/ml,其中cq02-108的存活率显著高于其余两株菌,表明cq02-108的耐受胃液的能力最强。
表3不同菌株的胃液耐受情况
注:结果表示为平均数±标准差,n=3;同列标注不同小写字母表示差异显著(p<0.05)。
实施例4:植物乳杆菌cq02-108的耐盐试验
1、植物乳杆菌cq02-108生长曲线的测定
将植物乳杆菌cq02-108接种于mrs液体培养基中,37℃培养48h,每隔2h用分光光度计于波长600nm处测定其吸光值,同时以空白mrs液体培养基作对照。结果如图1所示。
2、耐盐试验:
将植物乳杆菌按2%分别接种到nacl浓度为3%、6%、9%、12%、15%的mrs液体培养基中,37℃下培养24h,用分光光度计测定600nm处吸光值,以空白培养基作为对照,重复6次。
结果如图2所示,发酵香肠中食盐添加量一般为2%~3%,随着水分含量的降低,盐的浓度会不断升高,对盐敏感的乳酸菌的生长会受到抑制。本实验中植物乳杆菌cq02-108在nacl浓度为3%、6%、9%时生长良好,并且在12%、15%的mrs液体培养基中也能生长,本发明的植物乳杆菌cq02-108具有很强的耐盐型,使其在发酵过程中成为优势菌。
实施例5:植物乳杆菌cq02-108的耐酸试验
将植物乳杆菌按2%接种到ph为2.5、3.5、4.5、5.5、6.5的mrs液体培养基中,37℃下培养24h,用分光光度计测定600nm处吸光值,以对应ph的空白培养基作为对照,重复6次。
结果如图3所示,植物乳杆菌cq02-108在不同ph下均能生长,且在ph4.5、5.5、6.5下生长良好。在发酵初期,乳酸菌会迅速产酸,使得产品的ph大幅下降,因此植物乳杆菌能够耐受高酸度使其在发酵过程中成为优势菌。
实施例6:发酵香肠的制备(试验组)
1发酵剂的制备:植物乳杆菌cq02-108在mrs肉汤中37℃培养24h,4℃下6000g离心10min,收集沉淀用无菌水洗涤3次并重悬得到菌悬液待用。所述植物乳杆菌cq02-108(lactobacillusplantarumcq02-108)的保藏编号为cgmccno.16121。
2发酵香肠的制备
2.1选择新鲜猪后腿瘦肉和猪背膘,将其表面的筋膜和大的筋腱等部位剔除后进行漂洗,将肉搅碎后按照猪后腿瘦肉与背膘的比例为8:2进行混合,加入调味料和辅料置于4℃腌制。所述调味料和辅料按肉重添加:食盐2%、蔗糖1%、葡萄糖1%、亚硝酸钠0.015%、异抗坏血酸钠0.05%、姜粉0.1%、白胡椒粉0.1%、五香粉0.1%。
2.2将2.1所述的菌悬液接种到肉中混匀,灌制香肠,所述接种量为107cfu/g。
2.3发酵:30℃,rh80%条件下发酵1天。
2.4干燥成熟:15℃,rh75%条件下放置4天;在12℃,rh72%条件下干燥16天至香肠发酵成熟。
2.5将香肠进行修剪,真空包装后得到成品。
实施例7:发酵香肠的制备(对照组)
(1)选择新鲜猪后腿瘦肉和猪背膘,将其表面的筋膜和大的筋腱等部位剔除后进行漂洗,将肉搅碎后按照猪后腿瘦肉与背膘的比例为8:2进行混合,加入调味料和辅料置于4℃腌制。所述调味料和辅料按肉重添加:食盐2%、蔗糖1%、葡萄糖1%、亚硝酸钠0.015%、异抗坏血酸钠0.05%、姜粉0.1%、白胡椒粉0.1%、五香粉0.1%。
(2)发酵:30℃,rh80%条件下发酵1天。
(3)干燥成熟:15℃,rh75%条件下放置4天;在12℃,rh72%条件下干燥16天至香肠发酵成熟。
(4)将香肠进行修剪,真空包装后得到成品。
实施例8:发酵香肠ph值的测定
将实施例6和实施例7制备的发酵香肠分别在发酵、干燥成熟过程中的第1天、第7天、第14天、第21天测定ph值:将试验组和对照组发酵香肠分别绞碎后,准确称取10.00g样品,加入90ml蒸馏水,均质后过滤,取上清液用ph计测定。
结果如图4所示,在整个发酵周期中,与对照组香肠相比,接种植物乳杆菌cq02-108(lactobacillusplantarumcq02-108)明显降低了香肠的ph值,在发酵第一天即可将ph降至4.62,即本发明的植物乳杆菌cq02-108具有很强的产酸特性,制备的发酵香肠能够抑制有害菌的生长,延长产品的保质期,提高产品的安全性。
实施例9:发酵香肠乳酸菌数的测定
将实施例6和实施例7制备的发酵香肠分别在发酵、干燥成熟过程中的第1天、第7天、第14天、第21天测定乳酸菌数:将试验组和对照组发酵香肠分别在无菌条件下除去香肠肠衣,取25g样品剪碎,加入225ml无菌生理盐水中,均质混匀后梯度稀释,选择合适稀释度的菌液在mrs固体培养基上涂布,37℃培养48h后进行平板计数。
结果如图5所示,发酵第0~1天,试验组和对照组发酵香肠中的乳酸菌活菌数均显著上升,试验组达到9.46(logcfu/g)显著高于对照组的8.67(logcfu/g)。随后均逐渐下降,相同测定天数时,试验组发酵香肠的乳酸菌数均显著高于对照组,至第21天时,试验组香肠的乳酸菌数为7.66(logcfu/g)显著高于对照组的6.67(logcfu/g),此时试验组发酵香肠中植物乳杆菌cq02-108已经成为绝对优势菌群。说明本发明的植物乳杆菌cq02-108能够耐受发酵过程中的高酸度。
实施例10:发酵香肠菌落总数的测定
将实施例6和实施例7制备的发酵香肠分别在发酵、干燥成熟过程中的第1天、第7天、第14天、第21天测定菌落总数:将试验组和对照组发酵香肠分别在无菌条件下除去香肠肠衣,取25g样品剪碎,加入225ml无菌生理盐水中,均质混匀后梯度稀释,选择合适稀释度的菌液在pca固体培养基上涂布,37℃培养48h后进行平板计数。
结果如图6所示,发酵第0~1天,两组香肠中的菌落总数均显著上升,达到9(logcfu/g)以上,随后逐渐下降,从7天开始至21天趋于平稳。21天时,实验组中的菌落总数达到8.09(logcfu/g),低于对照组的菌落总数8.43(logcfu/g),这可能是对照组香肠中除了自身的乳酸菌之外,还有其他的杂菌。这也说明了接种植物乳杆菌cq02-108发酵香肠能更好地抑制其余杂菌的生长,提高产品的安全性。
实施例11:发酵香肠色度的测定
将实施例6和实施例7制备的发酵香肠分别测定色度:将试验组和对照组发酵香肠分别剥去香肠样品肠衣,将肉绞碎混匀,按压成直径2cm,厚度约1cm的薄片,选取6个不同的位置,使用色差仪测定样品的亮度值(l*)、红度值(a*)、黄度值(b*)。结果如表4所示,与对照组香肠相比,添加植物乳杆菌cq02-108可以显著提高发酵香肠的亮度和红度,显著降低香肠的黄度值,有效地改善了香肠的色泽。
表4发酵香肠色差分析
注:结果表示为平均数±标准差,n=6;同列标注不同小写字母表示差异显著(p<0.05)。
实施例12:发酵香肠质构的测定
将实施例6和实施例7制备的发酵香肠分别测定质构:将试验组和对照组发酵香肠分别剥去香肠肠衣,用双面刀将香肠切成高10mm直径约20mm大小,使用t型金属压头,机器参数设定为:感应源1000n,初始力0.3n,压头直径41mm,50%压缩率,测定速度50mm/min两次循环。测定结果取硬度、黏聚性、弹性、咀嚼性4个指标。
结果如表5所示,与空白对照组香肠相比,添加植物乳杆菌cq02-108可以显著提高发酵香肠的硬度、咀嚼性和弹性,赋予香肠更好地质地,提高香肠的品质。
表5发酵香肠质构分析
注:结果表示为平均数±标准差,n=6;同列标注不同小写字母表示差异显著(p<0.05)
实施例13:香肠的感官评定
将实施例6和实施例7制备的发酵香肠分别测定感官:感官评定由12名食品专业人员组成的感官评定小组完成,小组成员按照gb/t22210-2008进行培训,评分标准如表6所示,分别对香肠的颜色、气味、组织状态和滋味四个方面进行评定。结果如表7所示,由表可知,在香肠的颜色、气味、组织状态和滋味四个方面,接种植物乳杆菌组的发酵香肠均显著高于空白对照组的香肠,这表明植物乳杆菌cq02-108可以有效改善发酵香肠的风味和品质。
表6发酵香肠感官评分标准
表7发酵香肠的感官评定
注:结果表示为平均数±标准差;同列标注不同小写字母表示差异显著(p<0.05)。
- 还没有人留言评论。精彩留言会获得点赞!